高效液相色谱法测定盐酸塞利洛尔血浆浓度及人体生物利用度
作者:曲福军 黄 钦 郭晓军 夏 军 徐凯建
单位:(哈尔滨医科大学附属第二医院临床药学药物研究所 哈尔滨150086)
关键词:盐酸塞利洛尔;高效液相色谱法;生物利用度;药物动力学
中国医院药学杂志981112
摘要 目的:研究盐酸塞利洛尔片的相对生物利用度,双单侧T检验、方差分析等方法判断生物等效性。方法:9名健康志愿受试者交叉服用两药厂产的盐酸塞利洛尔片200 mg,以HPLC法测定。结果:药-时曲线符合一级吸收一室模型,其主要药动学参数T1/2K 3.45~3.56 h,Tmax 3.58~3.62 h,Cmax 501.43~531.92 ng.ml-1,AUC 4 508.38~4 605.90 μg.h.L-1。结论:国产药与进口药的药动学参数相似,相对生物利用度98.1%±9.9%。综合分析两制剂生物等效。
, 百拇医药
Determination of plasma concentration and bioavailability of celiprolol by HPLC
Qu Fujun,Huang Qin,Guo Xiaojun,et al
(Clinical Pharmacy and Drug Institute at 2nd Hospital of Harbin Medical University,Harbin 150086)
Aim:To study the relative bioavailability of celiprolol hydrochloride tablets and determine the bioequivalence by double single t test and variance analysis.Method:200 mg celiprolol hydrochloride tablets from two pharmaceutical factories were crossly administrated by 9 healthy volunteeers and determined by HPLC.Results:The drug-time curve was fit to the first order absorption one compartment model.Its main pharmacokinetic parameters were as follows,T1/2k 3.45 h~3.56 h,Tmax 3.58 h~3.62 h,Cmax 501.43 ng.ml-1~531.92 ng.ml-1,AUC 4 508.38 μg.h.l-1~4 605.96 μg.h.l-1.Conclusion:The pharmacokinetic parameters of the domestic drug was similar to those of the imported one.The relative bioavailability was 98.1%±9.9%.The two drugs were bioequivalent by comprehensive analysis.
, 百拇医药
Key words celiprolol hydrochloride,HPLC,bioavailability,pharmacokinetics
盐酸塞利洛尔是一种无内源性拟交感活性及膜稳定作用的新型β1受体阻滞药,国外已在临 床应用于高血压、心绞痛及心律失常的治疗,取得了显著疗效。目前,国内药厂对此药开始研究。我们参考国外文献[1]采用高效液相色谱法对国产盐酸塞利洛尔片的血药浓度及生物利用度进行研究,供临床应用参考。
1 材料与方法
1.1 仪器与药品 Waters 810系统(510高压平流泵,712 WLSP自动进样器,486紫外检测器,Baseline 810色谱处理系统);Waters Nova-pak C18(300×3.9 mm,5 μ)柱;普通离心机;盐酸塞利洛尔片:对照药(下称A药,丹麦RORER产,200 mg/片,批号12527),试验药(下称B药,天津药物研究院产,100 mg/片,批号960829);盐酸塞利洛尔标准品(天津药物研究院提供);乙腈(色谱纯,北京昌化精细化工厂产,批号921210);其它试剂为分析纯,乙醚重蒸两次后使用。
, 百拇医药
1.2 色谱条件 色谱柱:Nova-pak C18(300×3.9 mm,5 μ);柱温:25 ℃±0.2 ℃;流动相:乙腈(55%)∶0.1 mol.L-1磷酸盐缓冲液(pH 4.0)(6%)∶水(39%);流速:1 ml.min-1;检测波长:237 nm;检测灵敏度:0.01 AUFS。
1.3 给药及取样方法 9名健康男性志愿受试者,年龄23±3岁,体重70±5 kg,身高175±5 cm,均体检证明心、肝、肾功能正常。实验采用自身交叉设计,每人分别顿服A药和B药1次,给药量200 mg,两次给药间隔1周。实验前1周受试者禁服一切药物,服药前禁食12 h后于7时空腹用200 ml温开水吞服药物。服后1.5,2.5,3.0,3.5,4.0,5.5,8.0,12.0 h各采静脉血3 ml,肝素抗凝,离心,精取血浆1.0 ml。
1.4 血浆样品处理 取1.0 ml血浆加具塞试管中,再分别加入0.01 mol.L-1磷酸盐缓冲液(pH 6.0)1.0 ml,2 mol.L-1氢氧化钠200 μl,4 ml乙醚提取两次,合并提取液于锥形管中。加0.01 mol.L-1硫酸液200 μl,旋涡振荡90 s,离心弃去有机层,用N2吹去残留乙醚,取水相50 μl进样。
, http://www.100md.com
2 实验结果
2.1 标准曲线制备及色谱条件 准确配制浓度为10,20,50,100,200,500,1 000,2 000 ng.ml-1的血浆对照样品,按血浆样品处理项下提取及色谱分离,以峰面积(A)对浓度(C)线性回归得标准方程:
C=9.90+2.12×10-3A(r=0.995 1,P<0.01)。
故本法在10~2 000 ng.ml-1内线性良好。外标法峰面积定量。据色谱图判断盐酸塞利洛尔的保留时间为3.315 min,此处血中成份无干扰。最低检测浓度10 ng.ml-1,信噪比优于3∶1。
2.2 精密度与回收实验 配制含盐酸塞利洛尔10,20,2 000 ng.ml-1的血浆对照样品,按血浆样品处理项下提取进样。每个浓度分别在1 d内试验5次和5 d内试验5次,得日内RSD分别为3.2%,3.7%,3.3%。日间RSD分别为3.9%,3.1%,3.2%。每个浓度同时做5个平行样得回收率为85.1%,86.1%,80.1%。
, 百拇医药
2.3 受试者血药浓度测定 两药厂制剂交叉给予9名志愿受试者,每人单次口服200 mg药物,按取样方法项下取样,按血浆样品处理方法处理及色谱分析,测得血药浓度值见表1。
表 1 口服200 mg盐酸塞利洛尔片不同时间血药浓度(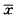 ±s,n=9) 时间
±s,n=9) 时间
h
A药
ng.ml-1
B药
ng.ml-1
1.5
, 百拇医药
140.4±44.9
155.8±44.7
2.5
411.5±166.8
399.1±139.4
3.0
749.2±195.5
784.1±295.6
3.5
972.0±216.6
927.0±216.9
4.0
, 百拇医药
640.8±133.2
571.2±110.1
5.5
403.1±98.9
386.4±62.2
8.0
271.2±52.5
256.5±38.7
12.0
145.3±27.1
142.7±31.6
2.4 药物动力学及生物利用度 各受试者不同时间的血药浓度逐一经MCPKP程序拟合,按梯形面积法[2]求算AUC,9名受试者药动学参数平均值见表2。其药时曲线显示为一室模型。以A药为对照,B药的相对生物利用度为98.1%±9.9%。
, 百拇医药
表 2 口服200 mg盐酸塞利洛尔片后药动学参数(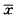 ±s,n=9) 制剂
±s,n=9) 制剂
Ka
h-1
K
h-1
V
L.kg-1
T1/2Ka
h
T1/2K
, 百拇医药
h
Cl
L.h-1.kg-1
Tmax
h
Cmax
ng.ml-1
AUC
μg.h.L-1
F
, 百拇医药
%
A药
1.4±0.7
0.23±0.05
2.9±0.7
0.8±0.4
3.6±0.6
0.7±0.1
3.6±0.5
531.9±78.5
4 605.9±560.9
B药
, http://www.100md.com
1.3±0.8
0.21±0.05
3.2±0.7
0.9±0.5
3.4±0.9
0.7±0.1
3.6±0.4
501.4±64.6
4 508.4±519.3
98.1±9.9
2.5 两制剂生物等效性[3] 将模拟得到的药动学参数分别进行方差分析,结果处理间(A药与B药)、个体间与周期间药动学参数T1/2K、Tmax、Cmax、AUC等均无显著差异(P>0.05)。另将主要药动学参数双单侧T检验及(1~2 α)置信区间分析,结果参数T1/2K、Tmax、Cmax、AUC均T1>1.895(P1<0.05),T2>1.895(P2<0.05),拒绝H0假设,也就是拒绝μT-μR≤Q1或μT~μR≥Q2,说明两制剂生物等效[3]。1~2 α置信区间分析结果为,以上四种参数试验药的均值都在对照药均值的(1~2 α)置信区间范围内,从而更进一步证明两制剂的生物等效性,见表3。表 3 两制剂主要药动学参数双单侧t检验及(1~2 α)置信区间(n=9) 均 值
, http://www.100md.com
T1/2k
h
Tmax
h
Cmax
ng.ml-1
AUC
μg.h.L-1
A药平均值
3.56
3.62
, 百拇医药
531.92
4 605.90
B药平均值
3.45
3.58
501.43
4 508.38
T1
3.85
2.91
2.59
3.73
, 百拇医药 T2
4.01
2.95
4.66
4.62
(1~2 α)
置信区间
3.04~
3.72
3.51~
3.73
477.82~
586.01
, 百拇医药
4 077.88~
5 133.21
3 讨论
3.1 提取方法的选择 本文参考国外文献,用0.1 mol.L-1磷酸盐缓冲液作pH调节液,加碱使血中的盐酸塞利洛尔充分游离成塞利洛尔,用乙醚提取,然后往提取液中加酸使其成盐溶于水相,进样。目的是为了提纯除干扰。在实验过程中试用氯仿、乙酸乙酯代替乙醚提取,结果回收率低或药物吸收峰处有杂质干扰。
3.2 药物动力学特性及生物等效性 实验证明盐酸塞利洛尔体内过程个体差异大。Cmax高者1 432.53 ng.ml-1,低者541.14 ng.ml-1;Tmax高者4.8 h,低者2.8 h;T1/2K高者5.2 h,低者2.4 h。有的受试者出现头痛、头晕、困倦等症状。提示:临床医师应用此药时要注意观察患者服药后表现。9名受试者实验结果表明,天津药物研究院产盐酸塞利洛尔片的相对生物利用度为98.1%±9.9%。模拟得到的药动学参数均进行三因素方差分析,结果显示个体因素间、周期因素间与制剂因素间药动学参数(T1/2k、Tmax、Cmax、AUC等)值无显著变化(P>0.05)。主要药动学参数T1/2K、Tmax、Cmax、AUC双单侧t检验,均为t1>1.895,t2>1.895,所以拒绝H0假设,即接受H1的两制剂的生物等效假设。以上4个参数的平均值均在对照药平均值的1~2 α置信区间内,进一步说明两制剂的生物等效性。综上所述,可以证明天津药物研究院与丹麦RORER产的盐酸塞利洛尔片生物等效。
, 百拇医药
参考文献
1 Buskin JN,Upton RA,Sorgel F,et al.Specific and sensitive assay of celiprolol in blood,plasma and urine using high-performence liquid chromatography.Journal of Chromatography,1982,230:454
2 高清芳主编.现代临床药学.第1版.北京:人民军医出版社,1997:35
3 黄圣凯,韩可勤.生物等效性评价的几种统计方法.中国临床药理学杂志,1993,9(1):43
(1997年9月20日收稿), 百拇医药
单位:(哈尔滨医科大学附属第二医院临床药学药物研究所 哈尔滨150086)
关键词:盐酸塞利洛尔;高效液相色谱法;生物利用度;药物动力学
中国医院药学杂志981112
摘要 目的:研究盐酸塞利洛尔片的相对生物利用度,双单侧T检验、方差分析等方法判断生物等效性。方法:9名健康志愿受试者交叉服用两药厂产的盐酸塞利洛尔片200 mg,以HPLC法测定。结果:药-时曲线符合一级吸收一室模型,其主要药动学参数T1/2K 3.45~3.56 h,Tmax 3.58~3.62 h,Cmax 501.43~531.92 ng.ml-1,AUC 4 508.38~4 605.90 μg.h.L-1。结论:国产药与进口药的药动学参数相似,相对生物利用度98.1%±9.9%。综合分析两制剂生物等效。
, 百拇医药
Determination of plasma concentration and bioavailability of celiprolol by HPLC
Qu Fujun,Huang Qin,Guo Xiaojun,et al
(Clinical Pharmacy and Drug Institute at 2nd Hospital of Harbin Medical University,Harbin 150086)
Aim:To study the relative bioavailability of celiprolol hydrochloride tablets and determine the bioequivalence by double single t test and variance analysis.Method:200 mg celiprolol hydrochloride tablets from two pharmaceutical factories were crossly administrated by 9 healthy volunteeers and determined by HPLC.Results:The drug-time curve was fit to the first order absorption one compartment model.Its main pharmacokinetic parameters were as follows,T1/2k 3.45 h~3.56 h,Tmax 3.58 h~3.62 h,Cmax 501.43 ng.ml-1~531.92 ng.ml-1,AUC 4 508.38 μg.h.l-1~4 605.96 μg.h.l-1.Conclusion:The pharmacokinetic parameters of the domestic drug was similar to those of the imported one.The relative bioavailability was 98.1%±9.9%.The two drugs were bioequivalent by comprehensive analysis.
, 百拇医药
Key words celiprolol hydrochloride,HPLC,bioavailability,pharmacokinetics
盐酸塞利洛尔是一种无内源性拟交感活性及膜稳定作用的新型β1受体阻滞药,国外已在临 床应用于高血压、心绞痛及心律失常的治疗,取得了显著疗效。目前,国内药厂对此药开始研究。我们参考国外文献[1]采用高效液相色谱法对国产盐酸塞利洛尔片的血药浓度及生物利用度进行研究,供临床应用参考。
1 材料与方法
1.1 仪器与药品 Waters 810系统(510高压平流泵,712 WLSP自动进样器,486紫外检测器,Baseline 810色谱处理系统);Waters Nova-pak C18(300×3.9 mm,5 μ)柱;普通离心机;盐酸塞利洛尔片:对照药(下称A药,丹麦RORER产,200 mg/片,批号12527),试验药(下称B药,天津药物研究院产,100 mg/片,批号960829);盐酸塞利洛尔标准品(天津药物研究院提供);乙腈(色谱纯,北京昌化精细化工厂产,批号921210);其它试剂为分析纯,乙醚重蒸两次后使用。
, 百拇医药
1.2 色谱条件 色谱柱:Nova-pak C18(300×3.9 mm,5 μ);柱温:25 ℃±0.2 ℃;流动相:乙腈(55%)∶0.1 mol.L-1磷酸盐缓冲液(pH 4.0)(6%)∶水(39%);流速:1 ml.min-1;检测波长:237 nm;检测灵敏度:0.01 AUFS。
1.3 给药及取样方法 9名健康男性志愿受试者,年龄23±3岁,体重70±5 kg,身高175±5 cm,均体检证明心、肝、肾功能正常。实验采用自身交叉设计,每人分别顿服A药和B药1次,给药量200 mg,两次给药间隔1周。实验前1周受试者禁服一切药物,服药前禁食12 h后于7时空腹用200 ml温开水吞服药物。服后1.5,2.5,3.0,3.5,4.0,5.5,8.0,12.0 h各采静脉血3 ml,肝素抗凝,离心,精取血浆1.0 ml。
1.4 血浆样品处理 取1.0 ml血浆加具塞试管中,再分别加入0.01 mol.L-1磷酸盐缓冲液(pH 6.0)1.0 ml,2 mol.L-1氢氧化钠200 μl,4 ml乙醚提取两次,合并提取液于锥形管中。加0.01 mol.L-1硫酸液200 μl,旋涡振荡90 s,离心弃去有机层,用N2吹去残留乙醚,取水相50 μl进样。
, http://www.100md.com
2 实验结果
2.1 标准曲线制备及色谱条件 准确配制浓度为10,20,50,100,200,500,1 000,2 000 ng.ml-1的血浆对照样品,按血浆样品处理项下提取及色谱分离,以峰面积(A)对浓度(C)线性回归得标准方程:
C=9.90+2.12×10-3A(r=0.995 1,P<0.01)。
故本法在10~2 000 ng.ml-1内线性良好。外标法峰面积定量。据色谱图判断盐酸塞利洛尔的保留时间为3.315 min,此处血中成份无干扰。最低检测浓度10 ng.ml-1,信噪比优于3∶1。
2.2 精密度与回收实验 配制含盐酸塞利洛尔10,20,2 000 ng.ml-1的血浆对照样品,按血浆样品处理项下提取进样。每个浓度分别在1 d内试验5次和5 d内试验5次,得日内RSD分别为3.2%,3.7%,3.3%。日间RSD分别为3.9%,3.1%,3.2%。每个浓度同时做5个平行样得回收率为85.1%,86.1%,80.1%。
, 百拇医药
2.3 受试者血药浓度测定 两药厂制剂交叉给予9名志愿受试者,每人单次口服200 mg药物,按取样方法项下取样,按血浆样品处理方法处理及色谱分析,测得血药浓度值见表1。
表 1 口服200 mg盐酸塞利洛尔片不同时间血药浓度(
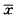 ±s,n=9) 时间
±s,n=9) 时间h
A药
ng.ml-1
B药
ng.ml-1
1.5
, 百拇医药
140.4±44.9
155.8±44.7
2.5
411.5±166.8
399.1±139.4
3.0
749.2±195.5
784.1±295.6
3.5
972.0±216.6
927.0±216.9
4.0
, 百拇医药
640.8±133.2
571.2±110.1
5.5
403.1±98.9
386.4±62.2
8.0
271.2±52.5
256.5±38.7
12.0
145.3±27.1
142.7±31.6
2.4 药物动力学及生物利用度 各受试者不同时间的血药浓度逐一经MCPKP程序拟合,按梯形面积法[2]求算AUC,9名受试者药动学参数平均值见表2。其药时曲线显示为一室模型。以A药为对照,B药的相对生物利用度为98.1%±9.9%。
, 百拇医药
表 2 口服200 mg盐酸塞利洛尔片后药动学参数(
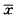 ±s,n=9) 制剂
±s,n=9) 制剂Ka
h-1
K
h-1
V
L.kg-1
T1/2Ka
h
T1/2K
, 百拇医药
h
Cl
L.h-1.kg-1
Tmax
h
Cmax
ng.ml-1
AUC
μg.h.L-1
F
, 百拇医药
%
A药
1.4±0.7
0.23±0.05
2.9±0.7
0.8±0.4
3.6±0.6
0.7±0.1
3.6±0.5
531.9±78.5
4 605.9±560.9
B药
, http://www.100md.com
1.3±0.8
0.21±0.05
3.2±0.7
0.9±0.5
3.4±0.9
0.7±0.1
3.6±0.4
501.4±64.6
4 508.4±519.3
98.1±9.9
2.5 两制剂生物等效性[3] 将模拟得到的药动学参数分别进行方差分析,结果处理间(A药与B药)、个体间与周期间药动学参数T1/2K、Tmax、Cmax、AUC等均无显著差异(P>0.05)。另将主要药动学参数双单侧T检验及(1~2 α)置信区间分析,结果参数T1/2K、Tmax、Cmax、AUC均T1>1.895(P1<0.05),T2>1.895(P2<0.05),拒绝H0假设,也就是拒绝μT-μR≤Q1或μT~μR≥Q2,说明两制剂生物等效[3]。1~2 α置信区间分析结果为,以上四种参数试验药的均值都在对照药均值的(1~2 α)置信区间范围内,从而更进一步证明两制剂的生物等效性,见表3。表 3 两制剂主要药动学参数双单侧t检验及(1~2 α)置信区间(n=9) 均 值
, http://www.100md.com
T1/2k
h
Tmax
h
Cmax
ng.ml-1
AUC
μg.h.L-1
A药平均值
3.56
3.62
, 百拇医药
531.92
4 605.90
B药平均值
3.45
3.58
501.43
4 508.38
T1
3.85
2.91
2.59
3.73
, 百拇医药 T2
4.01
2.95
4.66
4.62
(1~2 α)
置信区间
3.04~
3.72
3.51~
3.73
477.82~
586.01
, 百拇医药
4 077.88~
5 133.21
3 讨论
3.1 提取方法的选择 本文参考国外文献,用0.1 mol.L-1磷酸盐缓冲液作pH调节液,加碱使血中的盐酸塞利洛尔充分游离成塞利洛尔,用乙醚提取,然后往提取液中加酸使其成盐溶于水相,进样。目的是为了提纯除干扰。在实验过程中试用氯仿、乙酸乙酯代替乙醚提取,结果回收率低或药物吸收峰处有杂质干扰。
3.2 药物动力学特性及生物等效性 实验证明盐酸塞利洛尔体内过程个体差异大。Cmax高者1 432.53 ng.ml-1,低者541.14 ng.ml-1;Tmax高者4.8 h,低者2.8 h;T1/2K高者5.2 h,低者2.4 h。有的受试者出现头痛、头晕、困倦等症状。提示:临床医师应用此药时要注意观察患者服药后表现。9名受试者实验结果表明,天津药物研究院产盐酸塞利洛尔片的相对生物利用度为98.1%±9.9%。模拟得到的药动学参数均进行三因素方差分析,结果显示个体因素间、周期因素间与制剂因素间药动学参数(T1/2k、Tmax、Cmax、AUC等)值无显著变化(P>0.05)。主要药动学参数T1/2K、Tmax、Cmax、AUC双单侧t检验,均为t1>1.895,t2>1.895,所以拒绝H0假设,即接受H1的两制剂的生物等效假设。以上4个参数的平均值均在对照药平均值的1~2 α置信区间内,进一步说明两制剂的生物等效性。综上所述,可以证明天津药物研究院与丹麦RORER产的盐酸塞利洛尔片生物等效。
, 百拇医药
参考文献
1 Buskin JN,Upton RA,Sorgel F,et al.Specific and sensitive assay of celiprolol in blood,plasma and urine using high-performence liquid chromatography.Journal of Chromatography,1982,230:454
2 高清芳主编.现代临床药学.第1版.北京:人民军医出版社,1997:35
3 黄圣凯,韩可勤.生物等效性评价的几种统计方法.中国临床药理学杂志,1993,9(1):43
(1997年9月20日收稿), 百拇医药