类异戊二烯通路与药物靶点
作者:杜俊蓉
单位:华西医科大学药学院 成都610041
关键词:
华西药学杂志990412 近年来,生物科学的理论与研究成果越加快速地渗透到新药研究的领域中,尤其随着对细胞信号转导系统认识的日益深入,为新药的设计提供了不少新的思路和分子靶点,其中与类异戊二烯(isoprenoid)通路相关的药物靶点及创新药物的研究非常活跃,取得了初步成效。
1 类异戊二烯通路及其生物学意义
类异戊二烯系指由焦磷酸异戊烯酯(isopenteny pyrophosphate)形成的一类化合物。它们亦是胆固醇生物合成的中间产物。由于胆固醇具有重要的生理与病理学意义,早期有关类异戊二烯代谢的研究主要侧重于胆固醇这一主要终末产物。
, http://www.100md.com
众所周知,哺乳动物体内胆固醇主要由自身合成,其反应过程复杂,在近30步酶促反应中,3-羟-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-meth-ylglutaryl CoA reductase,HMG-CoA还原酶)是肝细胞合成胆固醇的限速酶,能催化HMG-CoA还原成甲羟戊酸(mevalonate,MVA,系类异戊二烯的前体),这是内源性胆固醇合成的关键性一步。若抑制HMG-CoA还原酶可明显降低体内胆固醇水平。
80年代初期,人们发现启动细胞周期进入S期需要胆固醇合成的中间产物介入。进一步的研究发现,这可能是因为类异戊二烯代谢物——焦磷酸法呢酯(farnesyl pyrophosphate,FPP)参与Ras蛋白的翻译后修饰。在胞浆中合成的未成熟Ras蛋白,其碳端的四个氨基酸残基(具有CAAX盒特征,其中C为半胱氨酸,A为亮氨酸、缬氨酸等脂肪族氨基酸,X一般为蛋氨酸或丝氨酸)需经三或四步连续的翻译后修饰反应才能转化为成熟的功能蛋白。这些修饰反应包括:(1)法呢基化:由法呢基转移酶(farnesyltransferase,FTase)识别Ras蛋白碳端CAAX盒,将FPP上15碳的类异戊二烯-法呢基转到半胱氨酸(C)的疏基上;(2)蛋白水解:由一种蛋白酶水解切除碳端的AAX三肽;(3)甲基化:由一种蛋白甲基转移酶催化,在新的碳端——半胱氨酸的羧基上甲基化;(4)软脂酰化:某些Ras蛋白在离法呢基化半胱氨酸上游不远处的另一个半胱氨酸位点(如H-Ras蛋白中的第184位氨基酸)经软脂酰蛋白转移酶催化发生软脂酰化[1]。上述脂化修饰可极大地提高Ras蛋白与细胞膜的亲和力,是其正确的膜定位、进而与底物和调节分子相互作用、正常转导细胞跨膜信号的前提[2]。因此干扰Ras蛋白的法呢基化或翻译后修饰的其它环节,理论上应影响Ras蛋白介导的细胞信号转导通路,从而改变细胞生物学行为。
, 百拇医药
2 Ras蛋白与细胞信号转导通路
ras基因是80年代初发现的第一个癌基因,在哺乳动物的基因组中已发现三种类型,H-ras、K-ras与N-ras。其表达产物P21 Ras蛋白由188或189个氨基酸组成,是具有内源性GTP酶活性的G蛋白(鸟苷酸结合蛋白),在胞浆中经翻译后修饰,转运到细胞膜内侧,发挥信号蛋白作用[3-4]。在调节细胞增殖分化的行为中,其信号转导过程为:当生长因子等丝裂素与具有酪氨酸蛋白酶活性受体的胞外配体结合区结合后,导致受体在膜上形成二聚体,胞质内激酶活性区发生自身磷酸化,产生构象变化,再与效应分子——生长因子受体结合蛋白2(growth factor receptor binding protein 2,GrB2)的SH2区结合,经相邻的SH3区使SOS(Son of sevenless)效应蛋白磷酸化,从而激活位于细胞膜内侧上的Ras蛋白,由Ras-GDP转化为Ras-GTP活化型,后者介导丝裂素活化蛋白(mitogen-activated protein,MAP)激酶通路的磷酸化级联反应,最后激活核内的多种转录因子(如:c-jun与c-fos),导致细胞增殖或分化(图1)[5]。当Ras蛋白发生突变时,由于不能水解GTP,始终保持活性构象Ras-GTP,致使Ras通路一直处于激活状态,引起细胞生长增殖失控。临床研究证实:40%的肿瘤中有Ras蛋白突变,在胰腺癌中突变率高达80~90%,结肠癌与甲状腺癌中50%[4]。显然,Ras蛋白的细胞信号转导异常直接影响细胞的增殖状态。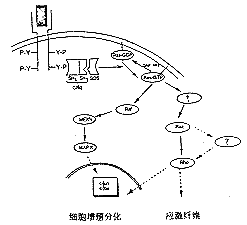
, http://www.100md.com
3 类异戊二烯通路中的药物靶点及相关药物
3.1 HMG-CoA还原酶及其抑制剂
HMG-CoA还原酶是机体组织合成胆固醇的限速酶,抑制该酶的活性能有效地降低内源性胆固醇的合成,并代偿性促进肝脏等细胞LDL受体的合成,增加对血浆LDL的摄取,致使血浆总胆固醇及LDL胆固醇降低;又由于肝细胞胆固醇的减少,VLDL的合成及释放亦减少,因此HMG-CoA还原酶是调脂药理想的作用靶点。
以HMG-CoA还原酶为靶点,已研制出强效的降血脂药——他汀类药物(statins),这些药物均是HMG-CoA还原酶抑制剂,其抑制常数在1.2×10-10~2.3×10-9M之间,能明显降低高胆固醇血症,不良反应少。目前主要用于临床各类高胆固醇血症的治疗。
令人惊奇的是,进一步临床观察发现洛伐他汀还可抑制血管成形术(PTCA)后冠状动脉再狭窄。由于再狭窄的主要病理变化特征是血管壁中膜平滑肌细胞的过度增生并向内膜迁移,他汀药物抑制再狭窄机制目前尚不清楚。可能的解释是:药物通过抑制HMG-CoA还原酶,耗竭类异戊二烯通路中的甲羟戊酸及下游的FPP,干扰Ras蛋白的法呢基化及其膜定位,阻滞Ras的信号转导通路从而抑制细胞增殖。支持这一观点的证据是:他汀药物确实可以完全阻断血小板衍生生长因子(Platelet-derived growth factor,PDGF)诱导的人动脉平滑肌细胞中Ras蛋白的翻译后修饰[7],但尚需进一步确证该作用是否干扰了Ras蛋白信号转导功能,以阐明他汀类药物防治血管增殖性疾病的作用机制。
, 百拇医药
3.2 FTase及其抑制剂
在类异戊二烯通路中,他汀类药物通过耗竭MVA抑制FPP合成,从理论上讲可干扰Ras蛋白的法呢基化而影响其功能。但MVA的耗竭也必然导致下游胆固醇生物合成中其他多种重要的生物活性物质的合成减少(见图1),从而影响细胞多种生物学行为。由48kDa与46kDa两个亚单位组成的FTase可催化碳端为CAAX盒特征的蛋白质法呢基化,这是Ras蛋白翻译后修饰的第一步,也是其活性所需要的。因此,抑制FTase是阻滞Ras蛋白功能的更佳靶点。目前FTase抑制剂主要包括天然产物及人工设计合成两大类[7]。
3.2.1 天然产物来源的FTase抑制剂 利用FTase模型直接筛选天然产物已发现了若干抑制剂,包括肽类似物pepticinnamins,FPP竞争性抑制剂Chaetomellic acid A与B actinoplanic acid[8]、manumycin(VCF1-C)。虽然它们均是强效的体外FTase抑制剂,IC50在0.06~5.0 μmol之间,但细胞活性甚小,这可能与其不能进入细胞有关。这类天然来源的抑制剂主要为人工设计抑制剂提供模板。
, http://www.100md.com
3.2.2 人工合成FTase抑制剂 该类抑制剂根据作用机制又可分为肽类似物、FPP类似物和双底物类似物三种。以Ras蛋白碳端CAAX为模板设计合成了大量的肽类似物,其中L-739,749与BZA-5B不仅是强效FTase抑制剂(IC50分别为240 nmol与0.85 nmol),而且具有明显细胞活性。BZA-5B可逆转Ras转化细胞的表型,亦可抑制动脉平滑肌细胞的增殖(抑制率达62%)[9];L-739,749能明显抑制H-ras与N-ras转化细胞在裸鼠中的生长,抑制率分别为66%与51%,且未见毒性反应。另一类似物L-744,832具有抗小鼠乳腺肿瘤与淋巴肿瘤的作用[10];以FPP法呢基为模板设计合成的FPP类似物中,α-羟基法呢基膦酸与TR006可抑制ras转化细胞中Ras蛋白的法呢基化与细胞的生长[11,12],TR006亦可明显抑制人动脉平滑肌细胞增殖,且无细胞毒性反应[13]。这类化合物的主要问题是细胞膜通透性差,为克服这一缺陷,Overhand等人将FPP衍生物转化为新戊酰氧甲基(pivaloyloxomethyl)衍生物,以降低化合物极性,增加跨膜转运,结果能明显增强效应[13];模拟FPP与CAAX两部分合成的该类制剂BMS-186511是选择性FTase抑制剂,100 μmol可完全阻断H-ras与K-ras转化细胞中Ras蛋白的法呢基化[14]。近几年来已有大量的各类FTase抑制剂问世,其中有的已是具有细胞与整体活性的强效抑制剂。有关FTase抑制剂抗肿瘤或防治其它增殖性疾病(如:动脉粥样硬化与再狭窄)的研究正方兴未艾,目前随着临床试验的展开,其临床疗效与安全性的评价已成为关注的焦点。
, http://www.100md.com
4 其他
双膦酸盐类是重要的抗骨质疏松药,它们通过诱导破骨细胞的凋亡而抑制骨吸收,但其确切的分子靶点一直不明了。
新近文献报道,含氮双膦酸盐类药物(如ibandronate与alendronate)及HMG-CoA还原酶抑制剂均可诱导鼠破骨细胞凋亡,而MVA、FPP与GGPP(geranylgeranyl pyrophosphate,焦磷酸 牛儿酯)却能拮抗其作用,从而提示:双膦酸盐类的分子靶点可能位于类异戊二烯通路中,通过阻滞某一环节而减少FPP/GGPP合成,抑制蛋白质(包括Ras蛋白)的法呢基或 牛儿基化,干扰这些信号蛋白在骨细胞凋亡中的信号通路,发挥抗骨质疏松作用[15]。
参考文献
1 Leonard MD. Ras Farnesyltransferase:A New Therapeutic Target. J Med Chem 1997;40∶2972
, 百拇医药
2 Zhang FL,Casey PJ. Protein Prenylation:molecular mechanism and functional consequences. Annu Rev Biochem 1996;65∶241
3 Burgering BM, Bos JL. Regulation of Ras-mediated signalling:more than one way to skin a cat. Trends Biochem Sci 1995;20∶18
4 Denhardt DT. Signal-transducing protein phosphorylation cascades mediated by Ras/Rho proteins in the mammalian cell: the potential for multiplex signalling. Biochem J 1996;318∶729
, 百拇医药
5 Spaargaren M, Bischoff JR, McCormick F. Signal transduction by Ras-like GTPase: a potential target for anticancer drugs.Gene Expression 1995;4∶345
6 Kiares H, Spandidos DA. Mutation of Ras gene in human tumors. Int J Oncol 1995;7∶413
7 Negre-Aminou P, van Vliet AK, van Erck M,et al.Inhibition of proliferation of human smooth muscle cells by various HMG-CoA reductase inhibitors; comparison with other human cell types. Biochim Biophys Acta 1997;1345∶259
, 百拇医药
8 Singh SB, Liesch JM, Lingham RB, et al.A macrocyclic polycarboxylic acid which is a potent inhibitor of Ras farnesyl-protein transferas. J Am Chem Soc 1994;116∶11606
9 Raiteri M, Arnaboldi L, McGeady P,et al.Pharmacological control of the mevalonate pathway:effect on arterial smooth muscle cell proliferation. J Pharmacol Exp Ther 1997;281∶114
10 Mangues R, Corral T, Kohl NE, et al.Antitumor effect of a farnesyl protein transferase inhibitor in mammary and lymphoid tumors overexpressing N-ras in transgenic mice. Cancer Res 1998;58∶1253
, 百拇医药
11 Cohen LH, Valentijn AR, Roodenburg L, et al. Different analogues of FPP inhibit squalene synthase and protein:farnesyltransferase to different extents. Biochem Pharmacol 1995;49∶839
12 Gibbs JB, Pompliano DL, Mosser SD,et al.Selective inhibition of farnesyl-protein transferase blocks ras processing in vivo. J Biol Chem 1993;268∶7617
13 Cohen LH, Piterman E, van Leeuwen RE,et al.Inhibition of human smooth muscle cell proliferation in culture by farnesyl pyrophosphate analogues, inhibitors of in vitro protein:farnesyl pyrophosphate. Biochem Pharmacol 1999;57∶365
, 百拇医药
14 Manne V, Yan N, Carboni JM, et al.Bisubstrate inhibitors of farnesyltransferase:a novel class of specific inhibitors of ras transformed cells. Oncogene 1995;10∶1763
15 Luckman SP, Hughes DE, Coxon FP,et al.Nitrogen-containing bisphosphonates inhibit the mevalonate pathway and prevent post-translation prenylation of GTP-binding proteins, including Ras. J Bone Miner Res 1998;13∶581, 百拇医药
单位:华西医科大学药学院 成都610041
关键词:
华西药学杂志990412 近年来,生物科学的理论与研究成果越加快速地渗透到新药研究的领域中,尤其随着对细胞信号转导系统认识的日益深入,为新药的设计提供了不少新的思路和分子靶点,其中与类异戊二烯(isoprenoid)通路相关的药物靶点及创新药物的研究非常活跃,取得了初步成效。
1 类异戊二烯通路及其生物学意义
类异戊二烯系指由焦磷酸异戊烯酯(isopenteny pyrophosphate)形成的一类化合物。它们亦是胆固醇生物合成的中间产物。由于胆固醇具有重要的生理与病理学意义,早期有关类异戊二烯代谢的研究主要侧重于胆固醇这一主要终末产物。
, http://www.100md.com
众所周知,哺乳动物体内胆固醇主要由自身合成,其反应过程复杂,在近30步酶促反应中,3-羟-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-meth-ylglutaryl CoA reductase,HMG-CoA还原酶)是肝细胞合成胆固醇的限速酶,能催化HMG-CoA还原成甲羟戊酸(mevalonate,MVA,系类异戊二烯的前体),这是内源性胆固醇合成的关键性一步。若抑制HMG-CoA还原酶可明显降低体内胆固醇水平。
80年代初期,人们发现启动细胞周期进入S期需要胆固醇合成的中间产物介入。进一步的研究发现,这可能是因为类异戊二烯代谢物——焦磷酸法呢酯(farnesyl pyrophosphate,FPP)参与Ras蛋白的翻译后修饰。在胞浆中合成的未成熟Ras蛋白,其碳端的四个氨基酸残基(具有CAAX盒特征,其中C为半胱氨酸,A为亮氨酸、缬氨酸等脂肪族氨基酸,X一般为蛋氨酸或丝氨酸)需经三或四步连续的翻译后修饰反应才能转化为成熟的功能蛋白。这些修饰反应包括:(1)法呢基化:由法呢基转移酶(farnesyltransferase,FTase)识别Ras蛋白碳端CAAX盒,将FPP上15碳的类异戊二烯-法呢基转到半胱氨酸(C)的疏基上;(2)蛋白水解:由一种蛋白酶水解切除碳端的AAX三肽;(3)甲基化:由一种蛋白甲基转移酶催化,在新的碳端——半胱氨酸的羧基上甲基化;(4)软脂酰化:某些Ras蛋白在离法呢基化半胱氨酸上游不远处的另一个半胱氨酸位点(如H-Ras蛋白中的第184位氨基酸)经软脂酰蛋白转移酶催化发生软脂酰化[1]。上述脂化修饰可极大地提高Ras蛋白与细胞膜的亲和力,是其正确的膜定位、进而与底物和调节分子相互作用、正常转导细胞跨膜信号的前提[2]。因此干扰Ras蛋白的法呢基化或翻译后修饰的其它环节,理论上应影响Ras蛋白介导的细胞信号转导通路,从而改变细胞生物学行为。
, 百拇医药
2 Ras蛋白与细胞信号转导通路
ras基因是80年代初发现的第一个癌基因,在哺乳动物的基因组中已发现三种类型,H-ras、K-ras与N-ras。其表达产物P21 Ras蛋白由188或189个氨基酸组成,是具有内源性GTP酶活性的G蛋白(鸟苷酸结合蛋白),在胞浆中经翻译后修饰,转运到细胞膜内侧,发挥信号蛋白作用[3-4]。在调节细胞增殖分化的行为中,其信号转导过程为:当生长因子等丝裂素与具有酪氨酸蛋白酶活性受体的胞外配体结合区结合后,导致受体在膜上形成二聚体,胞质内激酶活性区发生自身磷酸化,产生构象变化,再与效应分子——生长因子受体结合蛋白2(growth factor receptor binding protein 2,GrB2)的SH2区结合,经相邻的SH3区使SOS(Son of sevenless)效应蛋白磷酸化,从而激活位于细胞膜内侧上的Ras蛋白,由Ras-GDP转化为Ras-GTP活化型,后者介导丝裂素活化蛋白(mitogen-activated protein,MAP)激酶通路的磷酸化级联反应,最后激活核内的多种转录因子(如:c-jun与c-fos),导致细胞增殖或分化(图1)[5]。当Ras蛋白发生突变时,由于不能水解GTP,始终保持活性构象Ras-GTP,致使Ras通路一直处于激活状态,引起细胞生长增殖失控。临床研究证实:40%的肿瘤中有Ras蛋白突变,在胰腺癌中突变率高达80~90%,结肠癌与甲状腺癌中50%[4]。显然,Ras蛋白的细胞信号转导异常直接影响细胞的增殖状态。

, http://www.100md.com
3 类异戊二烯通路中的药物靶点及相关药物
3.1 HMG-CoA还原酶及其抑制剂
HMG-CoA还原酶是机体组织合成胆固醇的限速酶,抑制该酶的活性能有效地降低内源性胆固醇的合成,并代偿性促进肝脏等细胞LDL受体的合成,增加对血浆LDL的摄取,致使血浆总胆固醇及LDL胆固醇降低;又由于肝细胞胆固醇的减少,VLDL的合成及释放亦减少,因此HMG-CoA还原酶是调脂药理想的作用靶点。
以HMG-CoA还原酶为靶点,已研制出强效的降血脂药——他汀类药物(statins),这些药物均是HMG-CoA还原酶抑制剂,其抑制常数在1.2×10-10~2.3×10-9M之间,能明显降低高胆固醇血症,不良反应少。目前主要用于临床各类高胆固醇血症的治疗。
令人惊奇的是,进一步临床观察发现洛伐他汀还可抑制血管成形术(PTCA)后冠状动脉再狭窄。由于再狭窄的主要病理变化特征是血管壁中膜平滑肌细胞的过度增生并向内膜迁移,他汀药物抑制再狭窄机制目前尚不清楚。可能的解释是:药物通过抑制HMG-CoA还原酶,耗竭类异戊二烯通路中的甲羟戊酸及下游的FPP,干扰Ras蛋白的法呢基化及其膜定位,阻滞Ras的信号转导通路从而抑制细胞增殖。支持这一观点的证据是:他汀药物确实可以完全阻断血小板衍生生长因子(Platelet-derived growth factor,PDGF)诱导的人动脉平滑肌细胞中Ras蛋白的翻译后修饰[7],但尚需进一步确证该作用是否干扰了Ras蛋白信号转导功能,以阐明他汀类药物防治血管增殖性疾病的作用机制。
, 百拇医药
3.2 FTase及其抑制剂
在类异戊二烯通路中,他汀类药物通过耗竭MVA抑制FPP合成,从理论上讲可干扰Ras蛋白的法呢基化而影响其功能。但MVA的耗竭也必然导致下游胆固醇生物合成中其他多种重要的生物活性物质的合成减少(见图1),从而影响细胞多种生物学行为。由48kDa与46kDa两个亚单位组成的FTase可催化碳端为CAAX盒特征的蛋白质法呢基化,这是Ras蛋白翻译后修饰的第一步,也是其活性所需要的。因此,抑制FTase是阻滞Ras蛋白功能的更佳靶点。目前FTase抑制剂主要包括天然产物及人工设计合成两大类[7]。
3.2.1 天然产物来源的FTase抑制剂 利用FTase模型直接筛选天然产物已发现了若干抑制剂,包括肽类似物pepticinnamins,FPP竞争性抑制剂Chaetomellic acid A与B actinoplanic acid[8]、manumycin(VCF1-C)。虽然它们均是强效的体外FTase抑制剂,IC50在0.06~5.0 μmol之间,但细胞活性甚小,这可能与其不能进入细胞有关。这类天然来源的抑制剂主要为人工设计抑制剂提供模板。
, http://www.100md.com
3.2.2 人工合成FTase抑制剂 该类抑制剂根据作用机制又可分为肽类似物、FPP类似物和双底物类似物三种。以Ras蛋白碳端CAAX为模板设计合成了大量的肽类似物,其中L-739,749与BZA-5B不仅是强效FTase抑制剂(IC50分别为240 nmol与0.85 nmol),而且具有明显细胞活性。BZA-5B可逆转Ras转化细胞的表型,亦可抑制动脉平滑肌细胞的增殖(抑制率达62%)[9];L-739,749能明显抑制H-ras与N-ras转化细胞在裸鼠中的生长,抑制率分别为66%与51%,且未见毒性反应。另一类似物L-744,832具有抗小鼠乳腺肿瘤与淋巴肿瘤的作用[10];以FPP法呢基为模板设计合成的FPP类似物中,α-羟基法呢基膦酸与TR006可抑制ras转化细胞中Ras蛋白的法呢基化与细胞的生长[11,12],TR006亦可明显抑制人动脉平滑肌细胞增殖,且无细胞毒性反应[13]。这类化合物的主要问题是细胞膜通透性差,为克服这一缺陷,Overhand等人将FPP衍生物转化为新戊酰氧甲基(pivaloyloxomethyl)衍生物,以降低化合物极性,增加跨膜转运,结果能明显增强效应[13];模拟FPP与CAAX两部分合成的该类制剂BMS-186511是选择性FTase抑制剂,100 μmol可完全阻断H-ras与K-ras转化细胞中Ras蛋白的法呢基化[14]。近几年来已有大量的各类FTase抑制剂问世,其中有的已是具有细胞与整体活性的强效抑制剂。有关FTase抑制剂抗肿瘤或防治其它增殖性疾病(如:动脉粥样硬化与再狭窄)的研究正方兴未艾,目前随着临床试验的展开,其临床疗效与安全性的评价已成为关注的焦点。
, http://www.100md.com
4 其他
双膦酸盐类是重要的抗骨质疏松药,它们通过诱导破骨细胞的凋亡而抑制骨吸收,但其确切的分子靶点一直不明了。
新近文献报道,含氮双膦酸盐类药物(如ibandronate与alendronate)及HMG-CoA还原酶抑制剂均可诱导鼠破骨细胞凋亡,而MVA、FPP与GGPP(geranylgeranyl pyrophosphate,焦磷酸 牛儿酯)却能拮抗其作用,从而提示:双膦酸盐类的分子靶点可能位于类异戊二烯通路中,通过阻滞某一环节而减少FPP/GGPP合成,抑制蛋白质(包括Ras蛋白)的法呢基或 牛儿基化,干扰这些信号蛋白在骨细胞凋亡中的信号通路,发挥抗骨质疏松作用[15]。
参考文献
1 Leonard MD. Ras Farnesyltransferase:A New Therapeutic Target. J Med Chem 1997;40∶2972
, 百拇医药
2 Zhang FL,Casey PJ. Protein Prenylation:molecular mechanism and functional consequences. Annu Rev Biochem 1996;65∶241
3 Burgering BM, Bos JL. Regulation of Ras-mediated signalling:more than one way to skin a cat. Trends Biochem Sci 1995;20∶18
4 Denhardt DT. Signal-transducing protein phosphorylation cascades mediated by Ras/Rho proteins in the mammalian cell: the potential for multiplex signalling. Biochem J 1996;318∶729
, 百拇医药
5 Spaargaren M, Bischoff JR, McCormick F. Signal transduction by Ras-like GTPase: a potential target for anticancer drugs.Gene Expression 1995;4∶345
6 Kiares H, Spandidos DA. Mutation of Ras gene in human tumors. Int J Oncol 1995;7∶413
7 Negre-Aminou P, van Vliet AK, van Erck M,et al.Inhibition of proliferation of human smooth muscle cells by various HMG-CoA reductase inhibitors; comparison with other human cell types. Biochim Biophys Acta 1997;1345∶259
, 百拇医药
8 Singh SB, Liesch JM, Lingham RB, et al.A macrocyclic polycarboxylic acid which is a potent inhibitor of Ras farnesyl-protein transferas. J Am Chem Soc 1994;116∶11606
9 Raiteri M, Arnaboldi L, McGeady P,et al.Pharmacological control of the mevalonate pathway:effect on arterial smooth muscle cell proliferation. J Pharmacol Exp Ther 1997;281∶114
10 Mangues R, Corral T, Kohl NE, et al.Antitumor effect of a farnesyl protein transferase inhibitor in mammary and lymphoid tumors overexpressing N-ras in transgenic mice. Cancer Res 1998;58∶1253
, 百拇医药
11 Cohen LH, Valentijn AR, Roodenburg L, et al. Different analogues of FPP inhibit squalene synthase and protein:farnesyltransferase to different extents. Biochem Pharmacol 1995;49∶839
12 Gibbs JB, Pompliano DL, Mosser SD,et al.Selective inhibition of farnesyl-protein transferase blocks ras processing in vivo. J Biol Chem 1993;268∶7617
13 Cohen LH, Piterman E, van Leeuwen RE,et al.Inhibition of human smooth muscle cell proliferation in culture by farnesyl pyrophosphate analogues, inhibitors of in vitro protein:farnesyl pyrophosphate. Biochem Pharmacol 1999;57∶365
, 百拇医药
14 Manne V, Yan N, Carboni JM, et al.Bisubstrate inhibitors of farnesyltransferase:a novel class of specific inhibitors of ras transformed cells. Oncogene 1995;10∶1763
15 Luckman SP, Hughes DE, Coxon FP,et al.Nitrogen-containing bisphosphonates inhibit the mevalonate pathway and prevent post-translation prenylation of GTP-binding proteins, including Ras. J Bone Miner Res 1998;13∶581, 百拇医药