新型降血糖药瑞格列奈
作者:许青
单位:上海医科大学 附属中山医院 药剂科,上海 200032
关键词:瑞格列奈;非胰岛素依赖型糖尿病;降糖素类
中国新药与临床杂志000625[摘要] 瑞格列奈是第一个用于治疗糖尿病的苯甲酸衍生物,能有效地刺激胰岛素的分泌,降低空腹和餐后血糖水平。起效迅速,T(1)/(2)短,给药灵活,不良反应少。本文对其药理作用、药物动力学和临床应用等方面作一综述。
[中图分类号] R977.15;R587.1
[文献标识码] A
[文章编号] 1007-7669(2000)06-0502-02
, 百拇医药 瑞格列奈(repaglinide)是一种新型的胰岛素促分泌剂,被称为“膳食葡萄糖调节剂”,用于饮食治疗和运动作为单一疗法时的辅助用药,以降低2型糖尿病病人与饮食有关的血糖浓度。瑞格列奈是氨基乙酰基苯甲酸衍生物,其化学式为(S)-(+)-2-乙氧基-4-[2-(3-甲基-1-[2-(1-哌啶基)-苯基]-丁基)氨基-2-乙酰基]苯甲酸,分子结构式为: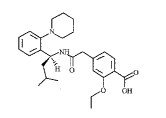
图1 瑞格列奈结构式
药理学 瑞格列奈与磺酰脲类[1-3]有相似的作用机制。通过阻断胰腺β细胞上的对ATP敏感的钾通道,引起钙通道开放,Ca2+内流,使胞浆内Ca2+浓度升高,从而刺激胰岛素的分泌[4]。与磺酰脲类不同的是,瑞格列奈在胰腺β细胞上另有其具有高亲合力的结合位点。
, 百拇医药
药物动力学 瑞格列奈的Cmax为30 mg.L-1,Tmax为0.8 h;AUC为37 mg.h.L-1,绝对生物利用度为63%。瑞格列奈在肝脏代谢,其代谢产物无降血糖活性,主要通过胆汁排泄,T(1)/(2)β为0.87 h,多次给药也不引起药物蓄积[5-7] 。
慢性肝病病人的瑞格列奈的血清总浓度和游离瑞格列奈浓度均明显高于健康者,而两者瑞格列奈的血浆蛋白结合率相似,约为97 %。与健康受试者的对照试验表明,慢性肝病病人瑞格列奈血浓度的增高和延长不会增加低血糖反应的发生率[8]。
肾功能不良病人的瑞格列奈的AUC,Cmax显著增加,Tmax无明显变化。其低血糖及其他相关不良反应的发生率与健康人没有明显区别[9]。因此肾功能不良病人应用瑞格列奈的首次剂量无需调整,但之后增加剂量必须小心谨慎。
, 百拇医药
临床应用 一项为期18 wk的随机、双盲、安慰剂对照试验(包括6 wk的剂量调节期和随后12 wk的维持剂量期)的结果显示[10]:在12 wk的维持剂量期间,瑞格列奈组病人的平均糖基化血红蛋白(HbA1c)值从8.5 %下降至7.8 %,而安慰剂组病人的平均HbA1c值从8.1 %上升至9.3 %(P<0.01)。与安慰剂组相比,瑞格列奈组平均空腹和餐后血糖浓度均明显下降(P<0.01),空腹和餐后胰岛素和C肽浓度则有明显上升(P<0.05)。
与格列本脲的临床对比试验表明在餐前每日2~3次口服瑞格列奈0.5~4 mg与每日服用格列本脲2.5~15 mg的疗效相当[11]。
与二甲双胍对照试验的结果显示,瑞格列奈或二甲双胍单药治疗的效果没有明显差别,HbA1c值分别下降了0.4 %和0.3 %。2药联合应用,HbA1c值下降了(1.4±0.2) %,从8.3 %下降至6.9 %(P=0.0016),空腹血糖下降了2.2 mmol.L-1(P=0.0003)。瑞格列奈无论单用和(或)与二甲双胍合用,空腹胰岛素水平分别提高了4.04 mU.L-1和4.23 mU.L-1(P<0.02)[12]。
, 百拇医药
剂量与用法 对以前未服用过口服降血糖药的病人,起始剂量为每餐前服用(瑞格列奈)0.5 mg;对已经使用口服降血糖药的病人,可以在每餐前服用瑞格列奈1~2 mg。最大剂量为4 mg,qid,均餐前给药。
药物相互作用 体外试验表明瑞格列奈的代谢会被抗真菌药(酮康唑或咪康唑)和抗菌药(红霉素等)抑制。细胞色素P-450酶系统3A4的诱导剂,包括曲格列酮、利福平、巴比妥类、卡马西平等可能加速瑞格列奈的代谢。在健康志愿者中进行的药物相互作用研究表明瑞格列奈对地高辛、茶碱和华法林的药物动力学参数没有临床意义上的影响。与西咪替丁合用时,瑞格列奈的吸收和代谢没有明显的改变。某些药物包括非甾类抗炎药和其他高蛋白结合率的药物:水杨酸盐、磺胺药、氯霉素、香豆素类、丙磺舒、单胺氧化酶抑制剂和肾上腺素β受体阻滞剂等会加强口服降血糖药的降血糖作用。另一些可使血糖升高的药则可能导致对血糖失去控制。这些药物包括噻嗪类和其他利尿药、皮质激素、酚噻嗪、甲状腺药物、雌激素、口服避孕药、苯妥英、烟酸、拟交感神经药、钙通道阻滞剂和异烟肼。
, http://www.100md.com
不良反应 瑞格列奈常见的不良反应包括低血糖反应、头痛和腹泻等,大多轻微而短暂。只有极少的与血糖水平改变有关的暂时性视力障碍的报道。胃肠道不良反应包括呕吐、腹泻和便秘等的发生率和严重性与其他口服胰岛素促分泌剂没有差别。一项与格列本脲、格列齐特的对照研究表明,三者呕吐的发生率分别为3 %,2 %, 1 %,腹泻的发生率分别为5 %,4 %,6 %,便秘的发生率为3 %,2 %,3 %。
[参考文献]
[1] 俞茂华.口服降糖药物治疗糖尿病的现状及其进展[J].新药与临床,1997,16:94-96.
[2] 荣 文,蔡凌霜,郭世彪,窦文东.格列本脲合用阿司匹林及小檗碱治疗非胰岛素依赖型糖尿病[J]. 新药与临床,1997,16:109-110.
[3] 徐世淞.口服抗糖尿病药的临床评价[J].中国新药与临床杂志,1998,17:385-386.
, http://www.100md.com
[4] Gromada J, Dissing S, Kofod H, Frokjaer-Jenen J. Effects of the hypoglycaemic drugs repaglinide and glibenclamide on ATP-sensitive potassium-channels and cytosolic calcium levels in TC3 cells and rat pancreatic beta cells[J]. Diabetologia, 1995, 38:1025-1032.
[5] Hatorp V, Nielsen KK, Rathgen K. Bioavailability of repaglinide after administration as either 2 mg tablet or 2 mg iv infusion[J]. J Clin Pharmacol, 1997, 37:874.
, 百拇医药 [6] Lardinois CK. Type 2 diabetes: Glycemic targets and oral therapies for older patients[J]. Geriatrics, 1998, 53:22-39.
[7] Schwartz SL, Strange P. Repaglinide does not accumulate in patients with type 2 diabetes[J]. Diabetes, 1998, 47 Suppl 1:A357.
[8] Hatorp V, Haug-pihale G. A comparison of the pharmacokinetics of repaglinide in healthy subjects with that in subjects with chronic liver disease[J]. Diabetes, 1998, 47 Suppl 1:A356.
, 百拇医药
[9] Marbury TC, Hatorp V. Pharmacokinetics of repaglinide after single and multiple doses in patients with renal impairment compared with normal healthy volunteers[J]. Diabetes, 1998, 47 Suppl 1: A357.
[10] Goldberg RB, Einhorn D, Lucas CP, et al. A randomized placebo-controlled trial of repaglinide in the treatment of type 2 diabetes[J]. Diabetes Care, 1998, 21:1897-1903.
[11] Balfour JA, Faulds D. Repaglinide[J]. Drugs-Aging, 1998, 13:173-180.
[12] Moses R, Slobodniuk R, Boyages S, et al. Effect of repaglinide addition to metformin monotherapy on glycemic control in patients with type 2 diabetes[J]. Diabetes Care, 1999, 22:119-124.
[收稿日期] 1999-06-04 [接受日期] 1999-09-17, 百拇医药
单位:上海医科大学 附属中山医院 药剂科,上海 200032
关键词:瑞格列奈;非胰岛素依赖型糖尿病;降糖素类
中国新药与临床杂志000625[摘要] 瑞格列奈是第一个用于治疗糖尿病的苯甲酸衍生物,能有效地刺激胰岛素的分泌,降低空腹和餐后血糖水平。起效迅速,T(1)/(2)短,给药灵活,不良反应少。本文对其药理作用、药物动力学和临床应用等方面作一综述。
[中图分类号] R977.15;R587.1
[文献标识码] A
[文章编号] 1007-7669(2000)06-0502-02
, 百拇医药 瑞格列奈(repaglinide)是一种新型的胰岛素促分泌剂,被称为“膳食葡萄糖调节剂”,用于饮食治疗和运动作为单一疗法时的辅助用药,以降低2型糖尿病病人与饮食有关的血糖浓度。瑞格列奈是氨基乙酰基苯甲酸衍生物,其化学式为(S)-(+)-2-乙氧基-4-[2-(3-甲基-1-[2-(1-哌啶基)-苯基]-丁基)氨基-2-乙酰基]苯甲酸,分子结构式为:

图1 瑞格列奈结构式
药理学 瑞格列奈与磺酰脲类[1-3]有相似的作用机制。通过阻断胰腺β细胞上的对ATP敏感的钾通道,引起钙通道开放,Ca2+内流,使胞浆内Ca2+浓度升高,从而刺激胰岛素的分泌[4]。与磺酰脲类不同的是,瑞格列奈在胰腺β细胞上另有其具有高亲合力的结合位点。
, 百拇医药
药物动力学 瑞格列奈的Cmax为30 mg.L-1,Tmax为0.8 h;AUC为37 mg.h.L-1,绝对生物利用度为63%。瑞格列奈在肝脏代谢,其代谢产物无降血糖活性,主要通过胆汁排泄,T(1)/(2)β为0.87 h,多次给药也不引起药物蓄积[5-7] 。
慢性肝病病人的瑞格列奈的血清总浓度和游离瑞格列奈浓度均明显高于健康者,而两者瑞格列奈的血浆蛋白结合率相似,约为97 %。与健康受试者的对照试验表明,慢性肝病病人瑞格列奈血浓度的增高和延长不会增加低血糖反应的发生率[8]。
肾功能不良病人的瑞格列奈的AUC,Cmax显著增加,Tmax无明显变化。其低血糖及其他相关不良反应的发生率与健康人没有明显区别[9]。因此肾功能不良病人应用瑞格列奈的首次剂量无需调整,但之后增加剂量必须小心谨慎。
, 百拇医药
临床应用 一项为期18 wk的随机、双盲、安慰剂对照试验(包括6 wk的剂量调节期和随后12 wk的维持剂量期)的结果显示[10]:在12 wk的维持剂量期间,瑞格列奈组病人的平均糖基化血红蛋白(HbA1c)值从8.5 %下降至7.8 %,而安慰剂组病人的平均HbA1c值从8.1 %上升至9.3 %(P<0.01)。与安慰剂组相比,瑞格列奈组平均空腹和餐后血糖浓度均明显下降(P<0.01),空腹和餐后胰岛素和C肽浓度则有明显上升(P<0.05)。
与格列本脲的临床对比试验表明在餐前每日2~3次口服瑞格列奈0.5~4 mg与每日服用格列本脲2.5~15 mg的疗效相当[11]。
与二甲双胍对照试验的结果显示,瑞格列奈或二甲双胍单药治疗的效果没有明显差别,HbA1c值分别下降了0.4 %和0.3 %。2药联合应用,HbA1c值下降了(1.4±0.2) %,从8.3 %下降至6.9 %(P=0.0016),空腹血糖下降了2.2 mmol.L-1(P=0.0003)。瑞格列奈无论单用和(或)与二甲双胍合用,空腹胰岛素水平分别提高了4.04 mU.L-1和4.23 mU.L-1(P<0.02)[12]。
, 百拇医药
剂量与用法 对以前未服用过口服降血糖药的病人,起始剂量为每餐前服用(瑞格列奈)0.5 mg;对已经使用口服降血糖药的病人,可以在每餐前服用瑞格列奈1~2 mg。最大剂量为4 mg,qid,均餐前给药。
药物相互作用 体外试验表明瑞格列奈的代谢会被抗真菌药(酮康唑或咪康唑)和抗菌药(红霉素等)抑制。细胞色素P-450酶系统3A4的诱导剂,包括曲格列酮、利福平、巴比妥类、卡马西平等可能加速瑞格列奈的代谢。在健康志愿者中进行的药物相互作用研究表明瑞格列奈对地高辛、茶碱和华法林的药物动力学参数没有临床意义上的影响。与西咪替丁合用时,瑞格列奈的吸收和代谢没有明显的改变。某些药物包括非甾类抗炎药和其他高蛋白结合率的药物:水杨酸盐、磺胺药、氯霉素、香豆素类、丙磺舒、单胺氧化酶抑制剂和肾上腺素β受体阻滞剂等会加强口服降血糖药的降血糖作用。另一些可使血糖升高的药则可能导致对血糖失去控制。这些药物包括噻嗪类和其他利尿药、皮质激素、酚噻嗪、甲状腺药物、雌激素、口服避孕药、苯妥英、烟酸、拟交感神经药、钙通道阻滞剂和异烟肼。
, http://www.100md.com
不良反应 瑞格列奈常见的不良反应包括低血糖反应、头痛和腹泻等,大多轻微而短暂。只有极少的与血糖水平改变有关的暂时性视力障碍的报道。胃肠道不良反应包括呕吐、腹泻和便秘等的发生率和严重性与其他口服胰岛素促分泌剂没有差别。一项与格列本脲、格列齐特的对照研究表明,三者呕吐的发生率分别为3 %,2 %, 1 %,腹泻的发生率分别为5 %,4 %,6 %,便秘的发生率为3 %,2 %,3 %。
[参考文献]
[1] 俞茂华.口服降糖药物治疗糖尿病的现状及其进展[J].新药与临床,1997,16:94-96.
[2] 荣 文,蔡凌霜,郭世彪,窦文东.格列本脲合用阿司匹林及小檗碱治疗非胰岛素依赖型糖尿病[J]. 新药与临床,1997,16:109-110.
[3] 徐世淞.口服抗糖尿病药的临床评价[J].中国新药与临床杂志,1998,17:385-386.
, http://www.100md.com
[4] Gromada J, Dissing S, Kofod H, Frokjaer-Jenen J. Effects of the hypoglycaemic drugs repaglinide and glibenclamide on ATP-sensitive potassium-channels and cytosolic calcium levels in TC3 cells and rat pancreatic beta cells[J]. Diabetologia, 1995, 38:1025-1032.
[5] Hatorp V, Nielsen KK, Rathgen K. Bioavailability of repaglinide after administration as either 2 mg tablet or 2 mg iv infusion[J]. J Clin Pharmacol, 1997, 37:874.
, 百拇医药 [6] Lardinois CK. Type 2 diabetes: Glycemic targets and oral therapies for older patients[J]. Geriatrics, 1998, 53:22-39.
[7] Schwartz SL, Strange P. Repaglinide does not accumulate in patients with type 2 diabetes[J]. Diabetes, 1998, 47 Suppl 1:A357.
[8] Hatorp V, Haug-pihale G. A comparison of the pharmacokinetics of repaglinide in healthy subjects with that in subjects with chronic liver disease[J]. Diabetes, 1998, 47 Suppl 1:A356.
, 百拇医药
[9] Marbury TC, Hatorp V. Pharmacokinetics of repaglinide after single and multiple doses in patients with renal impairment compared with normal healthy volunteers[J]. Diabetes, 1998, 47 Suppl 1: A357.
[10] Goldberg RB, Einhorn D, Lucas CP, et al. A randomized placebo-controlled trial of repaglinide in the treatment of type 2 diabetes[J]. Diabetes Care, 1998, 21:1897-1903.
[11] Balfour JA, Faulds D. Repaglinide[J]. Drugs-Aging, 1998, 13:173-180.
[12] Moses R, Slobodniuk R, Boyages S, et al. Effect of repaglinide addition to metformin monotherapy on glycemic control in patients with type 2 diabetes[J]. Diabetes Care, 1999, 22:119-124.
[收稿日期] 1999-06-04 [接受日期] 1999-09-17, 百拇医药