苦参素对成纤维细胞增殖、形态学及转化生长因子β1的影响
作者:朱梁 宋健 张兴荣 沈建伟 张贤康
单位:长征医院 消化科,上海 200003
关键词:苦参素;成纤维细胞;转化生长因子β;广豆根
中国新药与临床杂志000610 [摘要] 目的:研究苦参素对成纤维细胞增殖、形态学及转化生长因子β1(TGF-β1)表达的影响,阐明其抗肝纤维化的作用机制。方法:用甲基噻唑基四唑MTT(methyl thiazolyl tetrazolium)比色法、HE染色及免疫细胞化学技术分别检测小鼠皮肤成纤维细胞(NIH3T3)增殖、形态学及TGF-β1的表达。结果:苦参素能明显抑制成纤维细胞增殖及TGF-β1的表达,并呈剂量依赖性。结论:苦参素可通过抑制成纤维细胞增殖及TGF-β1的表达而起到抗肝纤维化作用。
, 百拇医药
[中图分类号] R963
[文献标识码] B
[文章编号] 1007-7669(2000)06-0461-03
Affect of kwoninone on fibroblastic proliferation, morphology and expression of TGF-β1
ZHU Liang SONG Jian ZHANG Xing-Rong SHEN Jian-Wei ZHANG Xian-Kang
(Department of gastroenterology, Shanghai Changzheng Hospital, SHANGHAI 200003, China)
, http://www.100md.com
[ABSTRACT] AIM:To study the affect of kwoninone on fibroblastic proliferation, morphology and expression of transforming growth factor-beta (TGF-β1) and elucidate its mechanism in fibrosis. METHODS: The proliferation, morphology and expression of TGF-β1 of fibroblast was measured by MTT bioassay, HE dyeing and immunocytochemistry. RESULTS: The kwoninone has an could significantly inhibit fibroblastic proliferation, growth and expression of TGF-β1 in concentration-dependent manner. CONCLUSION: The kwoninone anti-hepatic fibrosis effect through inhibiting fibroblastic proliferation, growth, and expression of TGF-β1.
, http://www.100md.com
[KEY WORDS] kwoninone; fibroblasts; transforming growth factor beta; sophora subprastrata
苦参素(kwoninone),是从中药广豆根(Sophora Subpsostarata)中分离所得生物碱类,具有抗炎、抗菌、抗病毒、抑制免疫、抗肿瘤等生物学作用[1]。近来有研究报道,用它治疗慢性肝炎,可有效的降低ALT、改善临床症状、并使乙型肝炎及丙型肝炎病毒标志物转阴、减轻炎性细胞浸润及肝细胞坏死,另具有防治肝纤维化作用[2-4]。本研究以小鼠皮肤成纤维母细胞(NIH3T3)为靶细胞,从细胞及细胞因子水平研究苦参素对成纤维细胞增殖、生长及转化生长因子β1(TGF-β1)表达的影响,以期从细胞及细胞因子水平阐述苦参素抗肝纤维化作用机制,为临床用于肝纤维化的防治提供更多的理论基础。
, 百拇医药 材料与仪器 靶细胞:NIH3T3细胞株(购于中国科学院上海细胞所)。苦参素注射液(2 mL:200 mg,批号980215,上海第一生化药业公司),RPMI1640培养基、小牛血清、胰酶、甲基噻唑基四唑(MTT,华舜生物试剂公司),二甲基亚砜(DMSO),苏木精染液,伊红染液;TGF-β1免疫组织化学染色试剂盒,DAB显色试剂盒。B5060EX二氧化碳培养箱(德国Heraeus公司产品),37XAZ倒置生物显微镜(上海光学仪器厂),Olympus光学显微镜,DG-3022型酶联免疫检测仪(南京华东电子管厂),YS-875A净化工作台。
方法
1 MTT法检测不同浓度的苦参素对NIH3T3细胞增殖的影响 用0.25%胰蛋白酶消化单层培养NIH3T3细胞,用含10%的小牛血清RPMI1640培养液稀释为单个细胞悬液(5×107个.L-1),接种于96孔培养板,每孔100 μL,同时每孔加入经培养液倍比稀释的苦参素100 μL,至苦参素终浓度分别为31.3,62.5,125,250,500,1000 mg.L-1,每种浓度设3个复孔;并设对照孔3个,不加苦参素,而加入等量的培养液;另设空白对照孔3个,不加细胞,其他条件与前相同。同时,在相同条件下用同样方法再接种另2块96孔培养板。将培养板移入CO2孵箱中,培养48 h后,每孔加入MTT溶液(5 g.L-1,PBS)20 μL,37 ℃继续孵育4 h,终止培养,吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解,在酶联免疫检测仪上,选择490 nm波长,以空白对照孔调零,检测各孔光吸收值,将所得结果进行统计学分析。
, 百拇医药
2 苦参素对成纤维细胞形态学及TGF-β1的影响 制细胞爬片:将生长良好的NIH3T3细胞用0.25%胰酶消化,制成细胞悬液,调整细胞密度为1×108个.L-1,接种于含盖玻片的2块培养皿中,其中一块加入苦参素使终浓度为500 mg.L-1,另一块加入等量的培养液,放入CO2孵箱培养2~3 d,待细胞基本长成单层,取出盖玻片,95%乙醇固定。HE染色;TGF-β1免疫细胞化学染色:将经苦参素处理和未处理的细胞爬片各一块,滴加适当稀释的一抗(小鼠TGF-β1单抗),37 ℃孵育1.5 h,0.01 mol.L-1的PBS洗2 min,2次;滴加山羊抗小鼠IgG,37 ℃孵育15 min,0.01 mol.L-1的PBS洗2 min,2次;滴加试剂APA-兔抗山羊IgG,37 ℃,20 min, 0.01 mol.L-1PBS洗5 min,4次。DAB显色:使用DAB显色试剂盒,取1 mL蒸馏水,加试剂盒中A,B,C试剂各1滴,混匀后加至切片,室温显色,镜下控制反应时间,蒸馏水洗涤。苏木素轻度复染,脱水、透明、封片,显微镜观察,照相保留结果。
, http://www.100md.com
3 统计学方法 t检验,P<0.05为有显著意义。
结果
1 苦参素对NIH3T3细胞增殖的影响 不同浓度的苦参素作用于NIH3T3细胞48 h后,平均每孔的吸光度如表1所示,当苦参素浓度达到62.5 mg.L-1时,NIH3T3细胞增殖活性受到明显抑制(P<0.05),并呈剂量依赖性。
表1 MTT法检测苦参素对NIH3T3细胞增殖
的影响(n=9,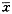 ±s) 组别
±s) 组别
浓度/mg.L-1
吸收度(OD)
, 百拇医药
对照
0
0.447±0.013
1
31.3
0.431±0.020a
2
62.5
0.338±0.014b
3
125
0.272±0.016c
, 百拇医药
4
250
0.221±0.019ce
5
500
0.199±0.021c
6
1000
0.179±0.020ce
各组与对照组比较经t检验:aP>0.05,bP<0.05,cP<0.01;4,6与2组间比较经t检验:eP<0.05。2 苦参素对NIH3T3细胞形态学的影响 对照组细胞胞体较大,胞浆丰富,胞突多,呈多角型,胞核大,处于核分裂期细胞多。苦参素处理组NIH3T3细胞胞体较小,胞突少,多呈梭型或圆形,胞核较小,处于核分裂期细胞较少。如图1所示:
, 百拇医药
3 苦参素对成纤维细胞TGF-β1表达的影响 经TGF-β1免疫细胞化学法染色,在显微镜下可以观察到,苦参素处理组成纤维细胞胞浆内棕黄色颗粒弱、量少,呈弱阳性;而正常对照组成纤维细胞胞浆内呈强阳性,这说明苦参素能抑制成纤维细胞TGF-β1的表达。结果如图2所示:
讨论 肝纤维化发生的主要机制是肝细胞外基质(ECM)的过度增多和异常沉积,这一过程是不断变化的,重要的是肝脏多种细胞(如贮脂细胞)产生细胞外基质,而后者又反过来影响细胞的发生、分化、增殖、粘附和表型的表达,这种相互作用又是由多种细胞因子介导的。近年研究表明,贮脂细胞是肝纤维化细胞外基质的主要来源细胞[5],在肝损伤时,贮脂细胞能合成除V型胶原外的几乎所有的ECM成分,肝细胞坏死的刺激能激活贮脂细胞并使之增殖,贮脂细胞增殖后表型发生改变,显著的表型变化使之转变为肌纤维母细胞(myofibroblasts)和成纤维细胞,后者是产生ECM的主要细胞,对肝纤维化的形成起主要作用[6]。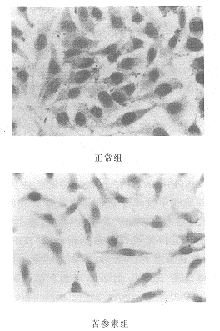
, 百拇医药
图1 苦参素(500 mg.L-1)对NIH3T3细胞形态学的影响(HE染色,×400)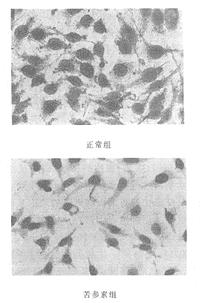
图2 TGF-β1免疫细胞化学染色显微照片(×400)
近年研究也表明TGF-β1是促进肝纤维化形成的一重要细胞因子,肝纤维化时,门脉周围细胞、导管周围细胞、肝小叶中央静脉周围细胞与肝包膜间质细胞等部位TGF-β1mRNA转录明显增加[7]。TGF-β1的突出作用是促进胶原与基质的形成,同时抑制其降解。它还能促进贮脂细胞向肌成纤维细胞样细胞的转化,促进肝细胞的增殖;还可增加纤连蛋白(FN)及蛋白多糖(PG)的合成,并促进FN和胶原在细胞外基质中的沉积;此外TGF-β1还通过抑制胶原酶和蛋白酶的产生,以及促进组织抑制因子(如金属蛋白酶,α2巨球蛋白等前纤维蛋白溶酶抑制物)的分泌,来减少胶原的降解[8]。有研究表明肝纤维化时,肝脏间质细胞如贮脂细胞、内皮细胞、库普弗细胞(昔名枯否氏细胞)等通过自分泌或旁分泌TGF-β,调节贮脂细胞及肝细胞等合成细胞外基质,促进肝纤维化形成[9,10]。
, 百拇医药
本实验以肝纤维化研究常用的模型细胞NIH3T3(小鼠皮肤成纤维母细胞)为靶细胞,研究苦参素对成纤维细胞增殖、形态学及TGF-β1表达的影响,结果发现苦参素能抑制NIH3T3成纤维母细胞的增殖,并且呈剂量依赖性,同时受抑制的NIH3T3细胞胞体较小,处于核分裂期细胞较少;NIH3T3细胞表达TGF-β1减少。提示苦参素可通过抑制肝纤维化时细胞外基质的主要来源细胞(成纤维细胞)的增殖、生长及TGF-β1的表达,而起到抗肝纤维化作用。它也有可能阻止肝纤维化时贮脂细胞的活化和增殖,这仍需进一步的研究证实,以阐明苦参素抗肝纤维化的机制。
[基金项目] 国家自然科学基金资助项目(19872074)
[参考文献]([REFERENCES]
[1] 李 丹(Li D),王平全(Wang PQ),张楠森(Zhang NS).苦参碱类生物碱的研究进展及临床应用[J].中草药(Chin Trad Herb Drugs),1996,27:308-311.
, 百拇医药
[2] 蔡 雄(Cai X),王国俊(Wang GJ),瞿 瑶(Qu Y),樊成辉(Fan CH),张瑞祺(Zhang RQ),徐文胜(Xu WS).苦参素注射液治疗慢性乙型肝炎临床疗效分析[J]. 第二军医大学学报(Acad J Second Mil Med Univ),1997,18:47-49.
[3] 李继强(Li JQ), 李超群(Li CQ),曾民德(Zeng MD),等(et al).氧化苦参碱治疗慢性丙型病毒性肝炎的初步研究[J]. 中国中西医结合杂志(Chin J Integrated Tradit Chin West Med),1998,18:227-229.
[4] 陈伟忠(Chen WZ),张俊平(Zhang JP),许 青(Xu Q),等(et al).苦参碱对大鼠实验性肝纤维化的影响[J]. 第二军医大学学报(Acad J Second Mil Med Univ),1996,17:424-426.
, http://www.100md.com
[5] 高春芳(Gao CF),孔宪涛(Kong XT).肝贮脂细胞与肝纤维化[J]. 临床肝胆病杂志(Chin J Clin Hepatol),1994,10:125-128.
[6] Bissell DM. Lipocyte activation and hepatic fibrosis[J]. Gastroenterol,1992,102:1803-1805.
[7] Krull NB, Zimmermann T, Gressner AM. Spatial and temporal patterns of gene expression for the proteoglycans biglycan and decorin and for transforming growth factor-β1 revealted by in situ hybridization during experimentally induced liver fibrosis in the rat[J]. Hepatology,1993,18:581-589.
, http://www.100md.com
[8] Bedossa P, Paradis V. Transforming growth factor-β(TGF-β):A key-role in liver fibrogenesis[J]. Hepatol,1995,22 Suppl 2:37-42.
[9] Friedman SL. The cellular basis of hepatic fibrosis[J]. N Engl J Med,1993,328:1828-1835.
[10] Biagini G, Ballardini G. Liver fibrosis and extracellular matrix[J]. J Hepatol,1989,8:115-119.
[收稿日期] 1999-07-07 [接受日期] 1999-11-01, http://www.100md.com
单位:长征医院 消化科,上海 200003
关键词:苦参素;成纤维细胞;转化生长因子β;广豆根
中国新药与临床杂志000610 [摘要] 目的:研究苦参素对成纤维细胞增殖、形态学及转化生长因子β1(TGF-β1)表达的影响,阐明其抗肝纤维化的作用机制。方法:用甲基噻唑基四唑MTT(methyl thiazolyl tetrazolium)比色法、HE染色及免疫细胞化学技术分别检测小鼠皮肤成纤维细胞(NIH3T3)增殖、形态学及TGF-β1的表达。结果:苦参素能明显抑制成纤维细胞增殖及TGF-β1的表达,并呈剂量依赖性。结论:苦参素可通过抑制成纤维细胞增殖及TGF-β1的表达而起到抗肝纤维化作用。
, 百拇医药
[中图分类号] R963
[文献标识码] B
[文章编号] 1007-7669(2000)06-0461-03
Affect of kwoninone on fibroblastic proliferation, morphology and expression of TGF-β1
ZHU Liang SONG Jian ZHANG Xing-Rong SHEN Jian-Wei ZHANG Xian-Kang
(Department of gastroenterology, Shanghai Changzheng Hospital, SHANGHAI 200003, China)
, http://www.100md.com
[ABSTRACT] AIM:To study the affect of kwoninone on fibroblastic proliferation, morphology and expression of transforming growth factor-beta (TGF-β1) and elucidate its mechanism in fibrosis. METHODS: The proliferation, morphology and expression of TGF-β1 of fibroblast was measured by MTT bioassay, HE dyeing and immunocytochemistry. RESULTS: The kwoninone has an could significantly inhibit fibroblastic proliferation, growth and expression of TGF-β1 in concentration-dependent manner. CONCLUSION: The kwoninone anti-hepatic fibrosis effect through inhibiting fibroblastic proliferation, growth, and expression of TGF-β1.
, http://www.100md.com
[KEY WORDS] kwoninone; fibroblasts; transforming growth factor beta; sophora subprastrata
苦参素(kwoninone),是从中药广豆根(Sophora Subpsostarata)中分离所得生物碱类,具有抗炎、抗菌、抗病毒、抑制免疫、抗肿瘤等生物学作用[1]。近来有研究报道,用它治疗慢性肝炎,可有效的降低ALT、改善临床症状、并使乙型肝炎及丙型肝炎病毒标志物转阴、减轻炎性细胞浸润及肝细胞坏死,另具有防治肝纤维化作用[2-4]。本研究以小鼠皮肤成纤维母细胞(NIH3T3)为靶细胞,从细胞及细胞因子水平研究苦参素对成纤维细胞增殖、生长及转化生长因子β1(TGF-β1)表达的影响,以期从细胞及细胞因子水平阐述苦参素抗肝纤维化作用机制,为临床用于肝纤维化的防治提供更多的理论基础。
, 百拇医药 材料与仪器 靶细胞:NIH3T3细胞株(购于中国科学院上海细胞所)。苦参素注射液(2 mL:200 mg,批号980215,上海第一生化药业公司),RPMI1640培养基、小牛血清、胰酶、甲基噻唑基四唑(MTT,华舜生物试剂公司),二甲基亚砜(DMSO),苏木精染液,伊红染液;TGF-β1免疫组织化学染色试剂盒,DAB显色试剂盒。B5060EX二氧化碳培养箱(德国Heraeus公司产品),37XAZ倒置生物显微镜(上海光学仪器厂),Olympus光学显微镜,DG-3022型酶联免疫检测仪(南京华东电子管厂),YS-875A净化工作台。
方法
1 MTT法检测不同浓度的苦参素对NIH3T3细胞增殖的影响 用0.25%胰蛋白酶消化单层培养NIH3T3细胞,用含10%的小牛血清RPMI1640培养液稀释为单个细胞悬液(5×107个.L-1),接种于96孔培养板,每孔100 μL,同时每孔加入经培养液倍比稀释的苦参素100 μL,至苦参素终浓度分别为31.3,62.5,125,250,500,1000 mg.L-1,每种浓度设3个复孔;并设对照孔3个,不加苦参素,而加入等量的培养液;另设空白对照孔3个,不加细胞,其他条件与前相同。同时,在相同条件下用同样方法再接种另2块96孔培养板。将培养板移入CO2孵箱中,培养48 h后,每孔加入MTT溶液(5 g.L-1,PBS)20 μL,37 ℃继续孵育4 h,终止培养,吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解,在酶联免疫检测仪上,选择490 nm波长,以空白对照孔调零,检测各孔光吸收值,将所得结果进行统计学分析。
, 百拇医药
2 苦参素对成纤维细胞形态学及TGF-β1的影响 制细胞爬片:将生长良好的NIH3T3细胞用0.25%胰酶消化,制成细胞悬液,调整细胞密度为1×108个.L-1,接种于含盖玻片的2块培养皿中,其中一块加入苦参素使终浓度为500 mg.L-1,另一块加入等量的培养液,放入CO2孵箱培养2~3 d,待细胞基本长成单层,取出盖玻片,95%乙醇固定。HE染色;TGF-β1免疫细胞化学染色:将经苦参素处理和未处理的细胞爬片各一块,滴加适当稀释的一抗(小鼠TGF-β1单抗),37 ℃孵育1.5 h,0.01 mol.L-1的PBS洗2 min,2次;滴加山羊抗小鼠IgG,37 ℃孵育15 min,0.01 mol.L-1的PBS洗2 min,2次;滴加试剂APA-兔抗山羊IgG,37 ℃,20 min, 0.01 mol.L-1PBS洗5 min,4次。DAB显色:使用DAB显色试剂盒,取1 mL蒸馏水,加试剂盒中A,B,C试剂各1滴,混匀后加至切片,室温显色,镜下控制反应时间,蒸馏水洗涤。苏木素轻度复染,脱水、透明、封片,显微镜观察,照相保留结果。
, http://www.100md.com
3 统计学方法 t检验,P<0.05为有显著意义。
结果
1 苦参素对NIH3T3细胞增殖的影响 不同浓度的苦参素作用于NIH3T3细胞48 h后,平均每孔的吸光度如表1所示,当苦参素浓度达到62.5 mg.L-1时,NIH3T3细胞增殖活性受到明显抑制(P<0.05),并呈剂量依赖性。
表1 MTT法检测苦参素对NIH3T3细胞增殖
的影响(n=9,
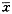 ±s) 组别
±s) 组别浓度/mg.L-1
吸收度(OD)
, 百拇医药
对照
0
0.447±0.013
1
31.3
0.431±0.020a
2
62.5
0.338±0.014b
3
125
0.272±0.016c
, 百拇医药
4
250
0.221±0.019ce
5
500
0.199±0.021c
6
1000
0.179±0.020ce
各组与对照组比较经t检验:aP>0.05,bP<0.05,cP<0.01;4,6与2组间比较经t检验:eP<0.05。2 苦参素对NIH3T3细胞形态学的影响 对照组细胞胞体较大,胞浆丰富,胞突多,呈多角型,胞核大,处于核分裂期细胞多。苦参素处理组NIH3T3细胞胞体较小,胞突少,多呈梭型或圆形,胞核较小,处于核分裂期细胞较少。如图1所示:
, 百拇医药
3 苦参素对成纤维细胞TGF-β1表达的影响 经TGF-β1免疫细胞化学法染色,在显微镜下可以观察到,苦参素处理组成纤维细胞胞浆内棕黄色颗粒弱、量少,呈弱阳性;而正常对照组成纤维细胞胞浆内呈强阳性,这说明苦参素能抑制成纤维细胞TGF-β1的表达。结果如图2所示:
讨论 肝纤维化发生的主要机制是肝细胞外基质(ECM)的过度增多和异常沉积,这一过程是不断变化的,重要的是肝脏多种细胞(如贮脂细胞)产生细胞外基质,而后者又反过来影响细胞的发生、分化、增殖、粘附和表型的表达,这种相互作用又是由多种细胞因子介导的。近年研究表明,贮脂细胞是肝纤维化细胞外基质的主要来源细胞[5],在肝损伤时,贮脂细胞能合成除V型胶原外的几乎所有的ECM成分,肝细胞坏死的刺激能激活贮脂细胞并使之增殖,贮脂细胞增殖后表型发生改变,显著的表型变化使之转变为肌纤维母细胞(myofibroblasts)和成纤维细胞,后者是产生ECM的主要细胞,对肝纤维化的形成起主要作用[6]。

, 百拇医药
图1 苦参素(500 mg.L-1)对NIH3T3细胞形态学的影响(HE染色,×400)

图2 TGF-β1免疫细胞化学染色显微照片(×400)
近年研究也表明TGF-β1是促进肝纤维化形成的一重要细胞因子,肝纤维化时,门脉周围细胞、导管周围细胞、肝小叶中央静脉周围细胞与肝包膜间质细胞等部位TGF-β1mRNA转录明显增加[7]。TGF-β1的突出作用是促进胶原与基质的形成,同时抑制其降解。它还能促进贮脂细胞向肌成纤维细胞样细胞的转化,促进肝细胞的增殖;还可增加纤连蛋白(FN)及蛋白多糖(PG)的合成,并促进FN和胶原在细胞外基质中的沉积;此外TGF-β1还通过抑制胶原酶和蛋白酶的产生,以及促进组织抑制因子(如金属蛋白酶,α2巨球蛋白等前纤维蛋白溶酶抑制物)的分泌,来减少胶原的降解[8]。有研究表明肝纤维化时,肝脏间质细胞如贮脂细胞、内皮细胞、库普弗细胞(昔名枯否氏细胞)等通过自分泌或旁分泌TGF-β,调节贮脂细胞及肝细胞等合成细胞外基质,促进肝纤维化形成[9,10]。
, 百拇医药
本实验以肝纤维化研究常用的模型细胞NIH3T3(小鼠皮肤成纤维母细胞)为靶细胞,研究苦参素对成纤维细胞增殖、形态学及TGF-β1表达的影响,结果发现苦参素能抑制NIH3T3成纤维母细胞的增殖,并且呈剂量依赖性,同时受抑制的NIH3T3细胞胞体较小,处于核分裂期细胞较少;NIH3T3细胞表达TGF-β1减少。提示苦参素可通过抑制肝纤维化时细胞外基质的主要来源细胞(成纤维细胞)的增殖、生长及TGF-β1的表达,而起到抗肝纤维化作用。它也有可能阻止肝纤维化时贮脂细胞的活化和增殖,这仍需进一步的研究证实,以阐明苦参素抗肝纤维化的机制。
[基金项目] 国家自然科学基金资助项目(19872074)
[参考文献]([REFERENCES]
[1] 李 丹(Li D),王平全(Wang PQ),张楠森(Zhang NS).苦参碱类生物碱的研究进展及临床应用[J].中草药(Chin Trad Herb Drugs),1996,27:308-311.
, 百拇医药
[2] 蔡 雄(Cai X),王国俊(Wang GJ),瞿 瑶(Qu Y),樊成辉(Fan CH),张瑞祺(Zhang RQ),徐文胜(Xu WS).苦参素注射液治疗慢性乙型肝炎临床疗效分析[J]. 第二军医大学学报(Acad J Second Mil Med Univ),1997,18:47-49.
[3] 李继强(Li JQ), 李超群(Li CQ),曾民德(Zeng MD),等(et al).氧化苦参碱治疗慢性丙型病毒性肝炎的初步研究[J]. 中国中西医结合杂志(Chin J Integrated Tradit Chin West Med),1998,18:227-229.
[4] 陈伟忠(Chen WZ),张俊平(Zhang JP),许 青(Xu Q),等(et al).苦参碱对大鼠实验性肝纤维化的影响[J]. 第二军医大学学报(Acad J Second Mil Med Univ),1996,17:424-426.
, http://www.100md.com
[5] 高春芳(Gao CF),孔宪涛(Kong XT).肝贮脂细胞与肝纤维化[J]. 临床肝胆病杂志(Chin J Clin Hepatol),1994,10:125-128.
[6] Bissell DM. Lipocyte activation and hepatic fibrosis[J]. Gastroenterol,1992,102:1803-1805.
[7] Krull NB, Zimmermann T, Gressner AM. Spatial and temporal patterns of gene expression for the proteoglycans biglycan and decorin and for transforming growth factor-β1 revealted by in situ hybridization during experimentally induced liver fibrosis in the rat[J]. Hepatology,1993,18:581-589.
, http://www.100md.com
[8] Bedossa P, Paradis V. Transforming growth factor-β(TGF-β):A key-role in liver fibrogenesis[J]. Hepatol,1995,22 Suppl 2:37-42.
[9] Friedman SL. The cellular basis of hepatic fibrosis[J]. N Engl J Med,1993,328:1828-1835.
[10] Biagini G, Ballardini G. Liver fibrosis and extracellular matrix[J]. J Hepatol,1989,8:115-119.
[收稿日期] 1999-07-07 [接受日期] 1999-11-01, http://www.100md.com
参见:首页 > 中医药 > 中药专业 > 中草药汇编 > 中药大典 > 根类 > 广豆根