口服外源SOD的完整生物大分子吸收的研究
作者:贺华君 施惠娟 袁勤生
单位:华东理工大学生物化学研究所,上海200237
关键词:SOD;口服;吸收;Western-blotting
药物生物技术990308
摘 要 分别用Cu2+,降解成多肽的无活性的SOD和完整SOD对ICR小鼠灌胃,发现Cu2+不引起血液中红细胞SOD的活性变化,而降解后的无活性的SOD却能使红细胞中SOD活性升高,可见降解后的SOD片段可能诱导了内源SOD的生成,口服完整的SOD也能使其活性升高,通过Western-blotting分析,找到了完整的SOD分子经胃肠道吸收、穿过了红细胞膜,进入了红细胞内的证据。
Studies on Oral Delivery of Exogenous Bovine
, http://www.100md.com
Cu.Zn-SOD Absorption by Rat Erythrocytes
He Huajun, Shi Huijuan , Yuan Qinsheng
(Institute of Biochemistry, East China University of Science
& Technology, Shanghai 200237)
Abstract Oral delivery of Cu2+,degraded inactivated SOD and native SOD to rats respectively. It is found that only oral administrated of Cu2+ can not change the activity of the extract of erythrocyte. However, the degraded and native SOD both increased intracellular erythrocyte SOD activity. By western-blotting analys is, further verified the complete native SOD absorption by rat erythrocyte . The possible mechanism is also discussed.
, http://www.100md.com
Key Words SOD ,Oral delivery ,Absorption ,Western-blotting
自从1969年McCord和Fridovich[1]首次发表从牛血红细胞中发现超氧化物歧化酶(Superoxidedismutase,SOD,EC1.15.1.1)活力以来,以研究氧代谢、自由基学说的分子生物学方面的一系列富有创造性的工作广泛地开展。由于SOD对维持生物体内的超氧阴离子自由基产生和消除的动态平衡的作用,目前临床应用主要集中在抗辐射、抗肿瘤、抗衰老和自身免疫性疾病上,它的应用范围也正不断扩大[2]。
SOD作为药用酶,临床应用多为胃肠道外注射。虽然一系列的实验表明了SOD的有效性及持久性[3,4],但口服后血红细胞SOD的升高是由于通过降解的多肽诱导内源SOD的生成还是具活性肽段的吸收,或者完整的外源SOD吸收?本文分别用Cu2+、降解成多肽的无活性的SOD和完整SOD对ICR小鼠灌胃后研究其在血红细胞中的吸收,并探讨了其可能的机制。
, http://www.100md.com
1 材料与方法
1.1 实验材料
牛血Cu.Zn-SOD(300万U/g),上海宝安生物技术公司;ICR小鼠,中科院上海实验动物中心;丙烯酰铵(Acr),N,N’-亚甲双丙烯酰铵(Bis)等均为电泳纯,购自上海生化所西巴斯生物公司;AP标羊抗小鼠IgG及NBT/BCIP试剂盒,华美生物工程公司;其余为进口或国产分析纯。
1.2 实验方法
1.2.1 小鼠灌胃及取血样[5] 取22(2gICR小鼠,禁食24h,每只灌胃0.2ml,内含目标物溶于NaHCO3溶液(1.5g/100ml,pH8.2),而Cu2+溶于PBS缓冲液(NaCl8g,KH2PO40.24g,Na2HPO41.44g,KCl0.2g,1000ml,pH7.4);对照组灌胃相应的0.2ml缓冲液;每组5只。于灌胃后一定时间眼眶放血,取血0.8ml,肝素抗凝,加预冷的PBS缓冲液,3500r/min,15min;然后PBS缓冲液洗3次,每次1500r/min,5min。取血红细胞0.3ml,加入等量去离子水溶血,然后乙醇、氯仿沉淀,取上清测SOD活力及进行SDS-PAGE。
, 百拇医药
1.2.2 SOD活力测定 用改进的邻苯三酚法[6]。
1.2.3 SDS-PAGE 按浓缩胶5%,分离胶15%进行,操作见文献[7]。
1.2.4 小鼠抗单亚基SOD血清的制备 取一定量SOD,于变性缓冲液中(50mmol/LpH6.8Tris-HCl,2%SDS,100mmol/L二硫苏糖醇,20%甘油),混匀,沸水浴3~5min,4℃对PBS缓冲液透析过夜,得到变性的单亚基SOD。常规免疫小鼠,共4次,用免疫双扩散实验测得其对变性单亚基SOD的效价为1∶32,分装于-20℃,保存备用。
1.2.5 变性SOD的制备 取单亚基SOD10mg,在人工胃液(50mg胃蛋白酶,pH1.5~2的稀HCl5ml)中降解2~4h,用1mol/LNaOH调pH至7.4终止反应。
, 百拇医药 1.2.6 Western-blotting[7] SDS-PAGE后,电转移至硝酸纤维素膜,脱脂奶粉封闭液(5%脱脂奶粉,0.02%Tween20,溶于PBS缓冲液)封闭1~2h,一抗用1∶100稀释的小鼠抗血清,PBS洗3×10min,再用TNB缓冲液(50mmol/LTris-HCl,150mmol/LNaCl,pH7.5)洗,二抗用AP标的羊抗小鼠IgG(5%脱脂奶粉,0.02%Tween20,溶于TNB缓冲液)。TNB缓冲液洗3×10min,NBT/BCIP显色至适度。
2 结 果
2.1 Cu2+灌胃对血红细胞SOD活性的影响
用含Cu2+,0.1~10(mol/L的PBS缓冲液0.2ml对ICR小鼠灌胃,取血红细胞上清测SOD活力,未见其活力的显著变化(数据略)。
, 百拇医药
2.2 降解的SOD对血红细胞SOD活性的影响
降解的SOD经测活证实无SOD活性,而且15%的SDS-PAGE凝胶已显示不出降解SOD片段的大小,可见SOD被降解成小分子的肽段。按每只0.5mg灌胃,以时间对SOD活力变化的百分数作图,结果见图1。从图1可知,降解的无活性SOD可引起细胞内SOD活力升高,至7h达到121.4%。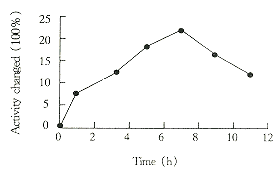
Fig 1 Oral administration of degraded SOD on
the SOD activity of erythrocytes
2.3 灌胃完整SOD对血红细胞SOD活性的影响
分别用每只0.5mg,2mg,5mg和50mg的量对小鼠灌胃,测其SOD的活力,了解其对血红细胞的活力影响,以时间对SOD活力变化的百分数作图见图2。
, http://www.100md.com
Fig 2 Oral administration of native SOD on the activity of erythrocytes
从图2可以看出,口服完整SOD能使血红细胞中的SOD活力升高。且随时间变化渐渐升高,然后达到一高峰,再慢慢恢复到原水平。而且随SOD剂量的不同其达活力最高峰的时间和变化程度略有不同。
2.4 SDS-PAGE及Western-blotting分析
图3是血红细胞SOD提取物的SDS-PAGE,可以看到在Mr16000附近有一清晰的条带,为SOD带。Cu.Zn-SOD分子由两条相同亚基组成,牛血SOD的Mr约为32000,在变性条件下两个亚基会分开,所以SDS-PAGE上可见其Mr为16000。从对照来看,其内源SOD带亦存在。因为内源小鼠SOD和外源牛的SOD的Mr相差不多,所以从SDS-PAGE上显示不出差别。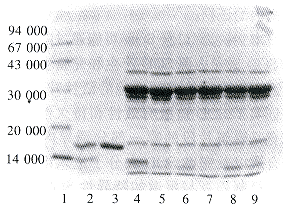
, 百拇医药
1.Protein marker(Mr) 2.Partial degraded SOD
3.Standard SOD sample 4-9.Oral delivery 5mg SOD after 1,3,5,7 and 9h,respectively
Fig 3 SDS-PAGE of samples of erythrocytes after oral delivery of SOD
图4为Western-blotting的图谱,图4A为标准品、标准品加入小鼠血红细胞样及小鼠血红细胞样。可见小鼠免疫得到的抗血清与内源的SOD的反应检测不到。而牛血SOD与其发生免疫反应,产生清晰的条带。图4B为灌胃每只50mg血红细胞样的Western-blotting的分析图谱,在5h,7h处可见与标准SOD相符的条带,可见与标准SOD具有相同的免疫原性,证实了完整的外源SOD进入血红细胞。
, http://www.100md.com
A:1.standard SOD sample
2.Standard SOD plus control extracts
3.2×dilute to line 2 4.10×dilute to line 2
5.20×dilute to line 2 6~7.Control
B:1.Blank 2.Standard SOD
3~7.Oral delivery 20mg,1,3,5,7and 9h,r espectively
8.Control 9.Protein marker(Mr)
, http://www.100md.com
Fig 4 Western-blotting of samples of erythrocytes
3 讨论
SOD是生物大分子,Mr为32000,虽然实验表明其免疫原性很低,但有报道[8]多次注射仍有抗体的产生,所以口服不仅是一条方便而简单的途径,而且可以避免免疫反应
的产生。但是作为有活性的酶,能否被吸收进入血液循环?本室曾[5]研究了SOD在口服吸收过程中对胃、肠道内胃酸及蛋白水解酶失活的耐受力,及小鼠SOD口服后血细胞中SOD的活力变化情况。结果表明:在一定时间内,SOD对模拟胃酸及蛋白水解酶作用的残存活力均超过80%,口服10~100U/g体重小鼠SOD后,12h内血红细胞中SOD活性均呈峰型增加,峰值变化为44%~100%;吸收的动力学曲线符合Michaelis-Menten方程。此外,牛主动脉内皮细胞培养试验表明:细胞对荧光标记SOD有透过作用。黄维华等[9]以放射性标记的125I-SOD和酶活性两方面证实:口服SOD后,提高了红细胞内SOD的活力,并探讨了其可能的作用机制。Regnault等[10]研究了口服0.5~20mgSOD/kg鼠SOD和脂质体包裹的SOD以及在脂质体中含N-脂酰鞘氨醇包裹的SOD,其生物利用度分别为14%、22%和51%。
, 百拇医药
口服吸收试验一般用放射性标记或荧光标记,事实上,如果在SOD胃肠道降解成小分子进入血液循环后,其放射性强度和荧光仍然在血液中可检测出来;另一方面,SOD降解的某一小肽段能穿过细胞膜,也许仍具有SOD的部分活性,因此活性检测不具有专一性。而且据报道[11],一般细胞和非分化细胞中存在脱辅基SOD(Apo-SODpool),在人的淋巴细胞中脱辅基SOD占总SOD的35%左右,因此降解的Cu2+、Zn2+若穿过细胞膜,仍会引起SOD活性的提高,但本实验表明在直接灌胃Cu2+没有引起血红细胞SOD的活性显著变化。可能是因为Cu2+为抗重金属系统所吸收。所以找到直接的证据对阐明SOD生物大分子的吸收和作用机制具有重要的意义
另一方面,SOD作为外源生物大分子,在血液中的半衰期很短,但有试验证明[2],注射酶与药物动力学的快速清除不同的是,其作用可持续几周甚至几个月。Edeas等[12]用免疫细胞化学方法检测与不同量的外源SOD孵育的外周血淋巴细胞中的Mn和Cu,ZnSOD,证实SOD穿过了细胞膜,且24h后总的SOD活力提高。
, http://www.100md.com
本研究发现,口服降解的无活性SOD能使红细胞中SOD活性升高,可见降解后的SOD片段可能诱导了内源SOD的生成;这进一步证实了文献[9]的推论。Emerit等[3]用流动细胞仪和共聚焦激光光谱,可见荧光标记的SOD快速吸附到单细胞、淋巴细胞表面,缓慢地被吞入细胞内。而本文通过Western-blotting分析,找到了完整的SOD分子经胃肠道吸收,穿过了红细胞膜,进入了红细胞内的证据。
本文认为:口服SOD可能通过降解的外源SOD诱导内源SOD产生和完整生物大分子进入等途径使血红细胞的活性升高,进一步证实了SOD口服有效性和持久性。但是究竟是降解片段的哪一部分诱导内源SOD的合成以及完整SOD大分子进入细胞膜的这种机制是否与报道的特异性SOD受体有关[13]等,都还有待进一步的研究;另外,口服吸收的生物利用度也有待通过添加佐剂、降低肠胃道消化酶的影响等方法来提高。
参考文献
, http://www.100md.com
1 Mccord J M,Fridoch I.Superoxide dismutase.An enzymic function f or erythrocuprein (hemocuprein).J Biol Chem,1969,244(22) ∶6049
2 Folhe L.Superoxide dismutase for therapeutic use: clinical experience, dead ends and hopes.Mol Cell Biochem,1988,84∶123
3 Emerit I,Garban F,Vassy J,et al. Superoxide-mediated clastogenesis an d ant iclastogenic effects of exogenous superoxide dismutase,Prot Natl Acad Sci USA, 1996,93∶12799
, 百拇医药
4 袁勤生. 我国SOD应用研究热点和问题.中国医药工业杂志,1994,25(5)∶227
5 袁勤生,崔玉敏,张炳然.口服SOD的稳定性及吸收途径研究.药物生物技术,1994,1(1):24.
6 谢卫华,姚菊芳,袁勤生.连苯三酚自氧化法测定超氧化物歧化酶活性的改进.医 药工业,1988,19(5)∶217
7 萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T著.分子克隆实验指南.金冬 雁,黎孟枫译.第2版.北京∶科学出版社,1992.880
8 Adachi T,Usami Y,Kishi T,et al.An enzyme immunoassay for cuprozinc superoxide dismutase using monoclonal antibodies. Application for pharmacokinetic study. J Immun Meth,1988,109∶93
, 百拇医药
9 黄维华,卢政,袁勤生.超氧化物歧化酶在胃肠道内的稳定性与口服吸收研究.中 国医药工业杂志,1995,26(11):502
10 Regnault C,Soursac M. Pharmacokinetics of superoxide dismutase in rat s after oral administration.Biopharm Drug Dispos,1996,17(2) ∶165
11 Petrovic N,Comi A,Ettinget M J. Identification of an Apo-superoxide dismutase (Cu,Zn)pool in human lymphoblasts, J Biol Chem,1996,271(45)∶28331
12 Edeas M A,Peltier E,Claise C,et al. Immunocytochemical study of u p take c arrier-free copper-zinc superoxide dismutase by peripheral blood lymphocytes.Cell Mol Biol(Paris),1996,42(8)∶1173.
13 Mondola P,Santillo M,Santangelo F,et al. The calf superoxide dism utase re ceptor of rat hepatocytes.Comp Biochem Physiol, B:Biochem Mol Biol,1994,108B(3)∶309
收稿日期:1999-03-11, http://www.100md.com
单位:华东理工大学生物化学研究所,上海200237
关键词:SOD;口服;吸收;Western-blotting
药物生物技术990308
摘 要 分别用Cu2+,降解成多肽的无活性的SOD和完整SOD对ICR小鼠灌胃,发现Cu2+不引起血液中红细胞SOD的活性变化,而降解后的无活性的SOD却能使红细胞中SOD活性升高,可见降解后的SOD片段可能诱导了内源SOD的生成,口服完整的SOD也能使其活性升高,通过Western-blotting分析,找到了完整的SOD分子经胃肠道吸收、穿过了红细胞膜,进入了红细胞内的证据。
Studies on Oral Delivery of Exogenous Bovine
, http://www.100md.com
Cu.Zn-SOD Absorption by Rat Erythrocytes
He Huajun, Shi Huijuan , Yuan Qinsheng
(Institute of Biochemistry, East China University of Science
& Technology, Shanghai 200237)
Abstract Oral delivery of Cu2+,degraded inactivated SOD and native SOD to rats respectively. It is found that only oral administrated of Cu2+ can not change the activity of the extract of erythrocyte. However, the degraded and native SOD both increased intracellular erythrocyte SOD activity. By western-blotting analys is, further verified the complete native SOD absorption by rat erythrocyte . The possible mechanism is also discussed.
, http://www.100md.com
Key Words SOD ,Oral delivery ,Absorption ,Western-blotting
自从1969年McCord和Fridovich[1]首次发表从牛血红细胞中发现超氧化物歧化酶(Superoxidedismutase,SOD,EC1.15.1.1)活力以来,以研究氧代谢、自由基学说的分子生物学方面的一系列富有创造性的工作广泛地开展。由于SOD对维持生物体内的超氧阴离子自由基产生和消除的动态平衡的作用,目前临床应用主要集中在抗辐射、抗肿瘤、抗衰老和自身免疫性疾病上,它的应用范围也正不断扩大[2]。
SOD作为药用酶,临床应用多为胃肠道外注射。虽然一系列的实验表明了SOD的有效性及持久性[3,4],但口服后血红细胞SOD的升高是由于通过降解的多肽诱导内源SOD的生成还是具活性肽段的吸收,或者完整的外源SOD吸收?本文分别用Cu2+、降解成多肽的无活性的SOD和完整SOD对ICR小鼠灌胃后研究其在血红细胞中的吸收,并探讨了其可能的机制。
, http://www.100md.com
1 材料与方法
1.1 实验材料
牛血Cu.Zn-SOD(300万U/g),上海宝安生物技术公司;ICR小鼠,中科院上海实验动物中心;丙烯酰铵(Acr),N,N’-亚甲双丙烯酰铵(Bis)等均为电泳纯,购自上海生化所西巴斯生物公司;AP标羊抗小鼠IgG及NBT/BCIP试剂盒,华美生物工程公司;其余为进口或国产分析纯。
1.2 实验方法
1.2.1 小鼠灌胃及取血样[5] 取22(2gICR小鼠,禁食24h,每只灌胃0.2ml,内含目标物溶于NaHCO3溶液(1.5g/100ml,pH8.2),而Cu2+溶于PBS缓冲液(NaCl8g,KH2PO40.24g,Na2HPO41.44g,KCl0.2g,1000ml,pH7.4);对照组灌胃相应的0.2ml缓冲液;每组5只。于灌胃后一定时间眼眶放血,取血0.8ml,肝素抗凝,加预冷的PBS缓冲液,3500r/min,15min;然后PBS缓冲液洗3次,每次1500r/min,5min。取血红细胞0.3ml,加入等量去离子水溶血,然后乙醇、氯仿沉淀,取上清测SOD活力及进行SDS-PAGE。
, 百拇医药
1.2.2 SOD活力测定 用改进的邻苯三酚法[6]。
1.2.3 SDS-PAGE 按浓缩胶5%,分离胶15%进行,操作见文献[7]。
1.2.4 小鼠抗单亚基SOD血清的制备 取一定量SOD,于变性缓冲液中(50mmol/LpH6.8Tris-HCl,2%SDS,100mmol/L二硫苏糖醇,20%甘油),混匀,沸水浴3~5min,4℃对PBS缓冲液透析过夜,得到变性的单亚基SOD。常规免疫小鼠,共4次,用免疫双扩散实验测得其对变性单亚基SOD的效价为1∶32,分装于-20℃,保存备用。
1.2.5 变性SOD的制备 取单亚基SOD10mg,在人工胃液(50mg胃蛋白酶,pH1.5~2的稀HCl5ml)中降解2~4h,用1mol/LNaOH调pH至7.4终止反应。
, 百拇医药 1.2.6 Western-blotting[7] SDS-PAGE后,电转移至硝酸纤维素膜,脱脂奶粉封闭液(5%脱脂奶粉,0.02%Tween20,溶于PBS缓冲液)封闭1~2h,一抗用1∶100稀释的小鼠抗血清,PBS洗3×10min,再用TNB缓冲液(50mmol/LTris-HCl,150mmol/LNaCl,pH7.5)洗,二抗用AP标的羊抗小鼠IgG(5%脱脂奶粉,0.02%Tween20,溶于TNB缓冲液)。TNB缓冲液洗3×10min,NBT/BCIP显色至适度。
2 结 果
2.1 Cu2+灌胃对血红细胞SOD活性的影响
用含Cu2+,0.1~10(mol/L的PBS缓冲液0.2ml对ICR小鼠灌胃,取血红细胞上清测SOD活力,未见其活力的显著变化(数据略)。
, 百拇医药
2.2 降解的SOD对血红细胞SOD活性的影响
降解的SOD经测活证实无SOD活性,而且15%的SDS-PAGE凝胶已显示不出降解SOD片段的大小,可见SOD被降解成小分子的肽段。按每只0.5mg灌胃,以时间对SOD活力变化的百分数作图,结果见图1。从图1可知,降解的无活性SOD可引起细胞内SOD活力升高,至7h达到121.4%。

Fig 1 Oral administration of degraded SOD on
the SOD activity of erythrocytes
2.3 灌胃完整SOD对血红细胞SOD活性的影响
分别用每只0.5mg,2mg,5mg和50mg的量对小鼠灌胃,测其SOD的活力,了解其对血红细胞的活力影响,以时间对SOD活力变化的百分数作图见图2。

, http://www.100md.com
Fig 2 Oral administration of native SOD on the activity of erythrocytes
从图2可以看出,口服完整SOD能使血红细胞中的SOD活力升高。且随时间变化渐渐升高,然后达到一高峰,再慢慢恢复到原水平。而且随SOD剂量的不同其达活力最高峰的时间和变化程度略有不同。
2.4 SDS-PAGE及Western-blotting分析
图3是血红细胞SOD提取物的SDS-PAGE,可以看到在Mr16000附近有一清晰的条带,为SOD带。Cu.Zn-SOD分子由两条相同亚基组成,牛血SOD的Mr约为32000,在变性条件下两个亚基会分开,所以SDS-PAGE上可见其Mr为16000。从对照来看,其内源SOD带亦存在。因为内源小鼠SOD和外源牛的SOD的Mr相差不多,所以从SDS-PAGE上显示不出差别。

, 百拇医药
1.Protein marker(Mr) 2.Partial degraded SOD
3.Standard SOD sample 4-9.Oral delivery 5mg SOD after 1,3,5,7 and 9h,respectively
Fig 3 SDS-PAGE of samples of erythrocytes after oral delivery of SOD
图4为Western-blotting的图谱,图4A为标准品、标准品加入小鼠血红细胞样及小鼠血红细胞样。可见小鼠免疫得到的抗血清与内源的SOD的反应检测不到。而牛血SOD与其发生免疫反应,产生清晰的条带。图4B为灌胃每只50mg血红细胞样的Western-blotting的分析图谱,在5h,7h处可见与标准SOD相符的条带,可见与标准SOD具有相同的免疫原性,证实了完整的外源SOD进入血红细胞。

, http://www.100md.com
A:1.standard SOD sample
2.Standard SOD plus control extracts
3.2×dilute to line 2 4.10×dilute to line 2
5.20×dilute to line 2 6~7.Control

B:1.Blank 2.Standard SOD
3~7.Oral delivery 20mg,1,3,5,7and 9h,r espectively
8.Control 9.Protein marker(Mr)
, http://www.100md.com
Fig 4 Western-blotting of samples of erythrocytes
3 讨论
SOD是生物大分子,Mr为32000,虽然实验表明其免疫原性很低,但有报道[8]多次注射仍有抗体的产生,所以口服不仅是一条方便而简单的途径,而且可以避免免疫反应
的产生。但是作为有活性的酶,能否被吸收进入血液循环?本室曾[5]研究了SOD在口服吸收过程中对胃、肠道内胃酸及蛋白水解酶失活的耐受力,及小鼠SOD口服后血细胞中SOD的活力变化情况。结果表明:在一定时间内,SOD对模拟胃酸及蛋白水解酶作用的残存活力均超过80%,口服10~100U/g体重小鼠SOD后,12h内血红细胞中SOD活性均呈峰型增加,峰值变化为44%~100%;吸收的动力学曲线符合Michaelis-Menten方程。此外,牛主动脉内皮细胞培养试验表明:细胞对荧光标记SOD有透过作用。黄维华等[9]以放射性标记的125I-SOD和酶活性两方面证实:口服SOD后,提高了红细胞内SOD的活力,并探讨了其可能的作用机制。Regnault等[10]研究了口服0.5~20mgSOD/kg鼠SOD和脂质体包裹的SOD以及在脂质体中含N-脂酰鞘氨醇包裹的SOD,其生物利用度分别为14%、22%和51%。
, 百拇医药
口服吸收试验一般用放射性标记或荧光标记,事实上,如果在SOD胃肠道降解成小分子进入血液循环后,其放射性强度和荧光仍然在血液中可检测出来;另一方面,SOD降解的某一小肽段能穿过细胞膜,也许仍具有SOD的部分活性,因此活性检测不具有专一性。而且据报道[11],一般细胞和非分化细胞中存在脱辅基SOD(Apo-SODpool),在人的淋巴细胞中脱辅基SOD占总SOD的35%左右,因此降解的Cu2+、Zn2+若穿过细胞膜,仍会引起SOD活性的提高,但本实验表明在直接灌胃Cu2+没有引起血红细胞SOD的活性显著变化。可能是因为Cu2+为抗重金属系统所吸收。所以找到直接的证据对阐明SOD生物大分子的吸收和作用机制具有重要的意义
另一方面,SOD作为外源生物大分子,在血液中的半衰期很短,但有试验证明[2],注射酶与药物动力学的快速清除不同的是,其作用可持续几周甚至几个月。Edeas等[12]用免疫细胞化学方法检测与不同量的外源SOD孵育的外周血淋巴细胞中的Mn和Cu,ZnSOD,证实SOD穿过了细胞膜,且24h后总的SOD活力提高。
, http://www.100md.com
本研究发现,口服降解的无活性SOD能使红细胞中SOD活性升高,可见降解后的SOD片段可能诱导了内源SOD的生成;这进一步证实了文献[9]的推论。Emerit等[3]用流动细胞仪和共聚焦激光光谱,可见荧光标记的SOD快速吸附到单细胞、淋巴细胞表面,缓慢地被吞入细胞内。而本文通过Western-blotting分析,找到了完整的SOD分子经胃肠道吸收,穿过了红细胞膜,进入了红细胞内的证据。
本文认为:口服SOD可能通过降解的外源SOD诱导内源SOD产生和完整生物大分子进入等途径使血红细胞的活性升高,进一步证实了SOD口服有效性和持久性。但是究竟是降解片段的哪一部分诱导内源SOD的合成以及完整SOD大分子进入细胞膜的这种机制是否与报道的特异性SOD受体有关[13]等,都还有待进一步的研究;另外,口服吸收的生物利用度也有待通过添加佐剂、降低肠胃道消化酶的影响等方法来提高。
参考文献
, http://www.100md.com
1 Mccord J M,Fridoch I.Superoxide dismutase.An enzymic function f or erythrocuprein (hemocuprein).J Biol Chem,1969,244(22) ∶6049
2 Folhe L.Superoxide dismutase for therapeutic use: clinical experience, dead ends and hopes.Mol Cell Biochem,1988,84∶123
3 Emerit I,Garban F,Vassy J,et al. Superoxide-mediated clastogenesis an d ant iclastogenic effects of exogenous superoxide dismutase,Prot Natl Acad Sci USA, 1996,93∶12799
, 百拇医药
4 袁勤生. 我国SOD应用研究热点和问题.中国医药工业杂志,1994,25(5)∶227
5 袁勤生,崔玉敏,张炳然.口服SOD的稳定性及吸收途径研究.药物生物技术,1994,1(1):24.
6 谢卫华,姚菊芳,袁勤生.连苯三酚自氧化法测定超氧化物歧化酶活性的改进.医 药工业,1988,19(5)∶217
7 萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T著.分子克隆实验指南.金冬 雁,黎孟枫译.第2版.北京∶科学出版社,1992.880
8 Adachi T,Usami Y,Kishi T,et al.An enzyme immunoassay for cuprozinc superoxide dismutase using monoclonal antibodies. Application for pharmacokinetic study. J Immun Meth,1988,109∶93
, 百拇医药
9 黄维华,卢政,袁勤生.超氧化物歧化酶在胃肠道内的稳定性与口服吸收研究.中 国医药工业杂志,1995,26(11):502
10 Regnault C,Soursac M. Pharmacokinetics of superoxide dismutase in rat s after oral administration.Biopharm Drug Dispos,1996,17(2) ∶165
11 Petrovic N,Comi A,Ettinget M J. Identification of an Apo-superoxide dismutase (Cu,Zn)pool in human lymphoblasts, J Biol Chem,1996,271(45)∶28331
12 Edeas M A,Peltier E,Claise C,et al. Immunocytochemical study of u p take c arrier-free copper-zinc superoxide dismutase by peripheral blood lymphocytes.Cell Mol Biol(Paris),1996,42(8)∶1173.
13 Mondola P,Santillo M,Santangelo F,et al. The calf superoxide dism utase re ceptor of rat hepatocytes.Comp Biochem Physiol, B:Biochem Mol Biol,1994,108B(3)∶309
收稿日期:1999-03-11, http://www.100md.com