少孢根霉发酵生产超氧化物歧化酶初探
作者:张羽航 江汉湖 董明盛 姚汝华
单位:张羽航 姚汝华(华南理工大学食品与生物工程学院,广州510641);江汉湖 董明盛(南京农业大学食品科技学院,南京210095)
关键词:超氧化物歧化酶;少孢根霉;酶制备;发酵
摘 要 对少孢根霉RT
摘 要 对少孢根霉RT-3(Rhizopus oligosporus saito RT-3)固体发酵向胞外分泌超氧化物歧化酶的条件进行了研究。酶液的制备采用pH8.2,50mmol/L的磷酸缓冲液,离心取上清液。RT-3发酵42h后酶活达到最大(142U/ml)。适宜的接种量为0.5%~1%。添加10%的水有利于产酶。培养温度宜采用变温方式,即在37℃下培养24h,之后28℃培养18h。
Preliminary Study on Production of Superoxide
, 百拇医药
Dismutase by Rhizopus Oligosporus
Zhang Yuhang, Jiang Hanhu1,Dong Mingsheng1,Yao Ruhua
(College of Food & Biotechnology,South China University of Technology,Guangzhou 510641;1College of Food Science & Technology,Nan jing Agricultura l University,Nanjing 210095)
Abstract SOD crude extract was prepared from solid fermenti ng culture of Rhizo pus oligosporus RT-3 by adopting phosphate buffer (pH8.2,50mmol/L) at 42th hour of fermentation enzyme activity reached maximum of 142U/ml. Optimal inoculum size and water added in culture were 0.5%~1% and 10% respectively. It was found that culturing at 37℃ for 24 hours followed by temperature shift to 28℃ for 18h ours was effective for SOD production.
, 百拇医药
Key Words Superoxide dismutase, Rhizopus oligosporus, Fermen tation, Enzyme preparation
超氧化物歧化酶(Superoxide Dismutase 简称SOD)是一种广泛存在于生物体内的含铜,锌或锰和铁的金属酶,它催化超氧阴离子自由基(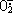 )转变为H2O2和O2的歧化反应,从而 消除体内多余的
)转变为H2O2和O2的歧化反应,从而 消除体内多余的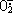 ,解除
,解除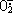 对生物性的毒性。目前有关SOD的国内外报道都是胞内酶,发酵生产该酶需破碎胞壁,工作难度大且繁琐[1,2]。我们发现从少孢根霉RT-3(Rhizopus oligosporus saito RT-3)固体发酵培养物可以直接抽提得到SOD。为了能够简便大量生产,我们初步研究了RT-3的固体发酵特性。
对生物性的毒性。目前有关SOD的国内外报道都是胞内酶,发酵生产该酶需破碎胞壁,工作难度大且繁琐[1,2]。我们发现从少孢根霉RT-3(Rhizopus oligosporus saito RT-3)固体发酵培养物可以直接抽提得到SOD。为了能够简便大量生产,我们初步研究了RT-3的固体发酵特性。
, 百拇医药
1 材 料
1.1 实验菌株
少孢根霉RT-3(Rhizopus oligosporus Saito RT-3)由南京农业大学食品微生物组筛 选并通过鉴定。
1.2 培养基
1.2.1 斜面培养基 PDA培养基。
1.2.2 液体培养基 豆芽1000g加入1000ml水煮沸30min,纱布过滤。滤汁加入葡萄糖3%,(NH4)2SO40.4%,MgSO4.7H2O0.25%和KH2PO40.1%。溶解并补水至1000ml,用乳酸调pH5~5.5,分装,0.1MPa灭菌30min。
, http://www.100md.com
1.2.3 固体发酵培养基 精选大豆,浸泡16~18h,去皮,煮沸30min,沥尽水,按湿重1%添加乳酸。
2 方 法
2.1 培养方法
经液体培养基培养获得的少孢根霉RT-3菌丝,捣碎后与赋形剂混匀。在固体发酵培养基中接种发酵剂,然后35℃培养[3]。
2.2 SOD粗酶液的制备[4,5]
2.2.1 静置时间的确定 取培养物按每g加5ml50mmol/L(pH8.3)的磷酸缓冲液,于食品加工机搅打10s,分成4份,分别静置1,12h和4℃振荡1,112h,12000r/min离心15min,取上清液测定SOD活性。上述步骤均于4℃下进行。
, 百拇医药
2.2.2 搅打时间的确定 取培养物按每g加5ml50mmol/L(pH8.3)的磷酸缓冲液,于食品加工机搅打10,30,40,60s,静量1h,于12000r/min离心15min,取上清液测定SOD活力。上述步骤均于4℃下进行。
2.3 发酵过程的动力学分析
2.3.1 菌丝体生物量的评估 采用Kronenberg等的方法,于培养物发酵的不同时间分别取样用肉质检测仪检测培养物的质地[6,7]。
2.3.2 pH 于培养物发酵的不同时间分别取样15g,加入30ml去离子水,搅拌1min,测量pH,测量值代表大豆表面的pH[6]。
2.3.3 品温 不同时间测量培养物表面的温度
2.4 酶活测定
, 百拇医药
采用微量邻苯三酚自氧化法[8]。
3 结 果
3.1 SOD粗酶液的制备
3.1.1 不同抽提方法和时间对酶活力的影响 实验中采用静置浸泡1h、12h和振荡浸泡1h、12h四种抽提方式。从结果发现不同抽提方式和时间对酶活力的影响不大。考虑到简化实验过程,采用直接将打浆液离心,取上清液测酶活。
3.1.2 搅打时间的确定 实验结果显示在搅打时间达到40s后酶活力达到相对恒定的值。继续延长搅打时间对酶活没有大的提高。
3.2 发酵过程动力学分析
3.2.1 菌丝体生物量的评估 由图1可见肉质仪切断束缚大豆的菌丝所需的力量在第36h达到最高。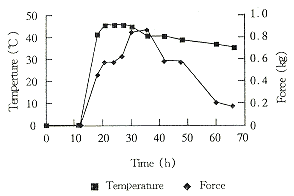
, 百拇医药
Fig 1 Change of force and temperature during fermentation
3.2.2固体发酵进程 固体发酵过程中,SOD酶活、pH和品温变化见图1与图2。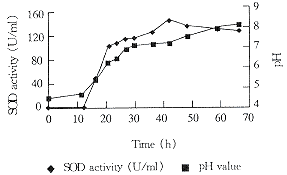
Fig 2 Change of pH and SOD activity during fermentation
结果表明:发酵前27h,品温迅速上升至最高温度45℃,直至第42h还在40℃。与此同时,酶活迅速上升达到142U/ml。在这段时间内,菌丝生长迅速。菌丝体生长检测说明此时菌丝体处于旺盛生长状态。发酵后期(42h以后)培养物的品温下降,菌丝体生长衰退,并且菌丝体的自溶也已出现。同时培养物中SOD酶活已迅速下降。
, 百拇医药
在整个发酵期间pH值逐渐上升,这一点与该菌株在液体发酵时的pH值变化不同。
3.3 发酵因素研究
3.3.1 接种量对产酶的影响 以0.5%~2%的比例接种发酵剂,其对酶活性的影响见表1。
Tab 1 Effect of different inoculum size on SOD activity
Inoculum size(%)
0.5
1
2
Enzyme activity(U/ml)
, 百拇医药
142.55
130.94
110.59
从表1可知,接种量从0.5%~2%对产酶稍有差异。接种量大,可以缩短菌体生长延滞期。接种量1%时在第18h就可见到菌丝体生长,而接种量0.5%要在24~26h才能观察到。但是接种量大,也会带来曲温上升快和衰退早等负作用,不利于产酶。综合考虑可以采用0.5%~1%的接种量。
3.3.2 加水量对产酶的影响 不论是孢子萌发,还是菌丝生长,酶的形成都需适当水分。考虑到大豆煮后晾干本身就有较高的含水量,所以加水量为10%,20%,30%。Tab 2 Effect of different addition of water on SOD activity
Water added(%)
, 百拇医药
0
10
20
30
Enzyme activity
(U/ml)
130.94
165.12
119.33
0
由表中结果可知添加10%的水有利于产酶,20%的加水量对产酶有抑制作用,而30%的加水量使菌体无法良好生长。加水量低,发酵中温度上升会使培养基表面干化,发酵不彻底,致使产酶量降低。加水量过多,温度过高,空中水蒸汽分压过大,氧气分压过低,使氧浓度降低,也不利于SOD的形成[9]。
, http://www.100md.com
3.3.3 温度对产酶的影响 采用37℃恒温培养及变温培养,结果见表3。Tab 3 Effect of temperature on SOD activity
Temperature
Enzyme activity(U/ml)
37℃
135.45
Temperature shift 1
170.28
Temperature shift 2
131.58
Temperature shift 1 (culture at 37℃ in first12h,then 28℃) Temperature shift 2 (culture at 37℃ in first 24h,then28℃)
, http://www.100md.com
从表3可知,变温2酶活高于37℃恒温培养和变温1。温度的变化和菌体形成孢子有密切的关系。37℃培养72h菌丝体已自溶,但绝无孢子形成,但如在第12h转至28℃,培养物有大量孢子生成,培养物纵切面呈黑色,打浆液亦为黑色。在第24h转至28℃培养,只在培养物的外缘有黑色孢子形成。培养物打浆液与37℃培养物打浆液并无明显差异。综合考虑生理和实际发酵情况,采用变温2较适宜。
4 讨 论
4.1 酶液制备
在酶液制备中采用食品加工机搅打培养物的原因有两个:1)粉碎培养物,增大培养物与缓冲液接触的面积,加快酶抽提速度;2)食品加工机不可能象组织捣碎机那样破碎细胞。限于食品加工机的性质,在搅拌时间达到40s后它已不可能再进一步粉碎培养物,可以大致限定我们研究的SOD是菌体分泌的SOD,所以酶活趋于稳定。
结合培养物打浆后的液体状态和酶活测定方法要求,我们确定抽提液与培养物的比例为5∶1。主要原因是当抽提液与培养物为2∶1时,浆液太稠不利于离心。抽提液与培养物按10∶1打浆时,酶液较稀不利于酶活测定且所需缓冲液体积太大。
, 百拇医药
4.2 酶的生产
RT-3固体发酵生产SOD主要包括两个方面:1)酶的形成;2)酶的分泌。现阶段我们的研究结果显示培养方式的改变是促使RT-3分泌SOD的主要原因。培养基质和培养条件的改变主要影响了酶的形成。大豆固体培养基在这两个方面是否起了某种特殊的作用尚不清楚。王程等研究了米曲霉生产脱氨酶过程中的超微结构动态,认为菌体在产酶过程中发生了分生孢子的脱落和线粒体的空化两个现象[10]。归根到底RT-3在大豆固体培养基上发生的变化与其自身的结构和生理有关。
4.3 温度对发酵的影响
温度对培养物酶活力的影响主要是菌丝体生长和孢子形成与SOD酶活性增加的生理生化调节程序存在着密切的内在联系。少孢根霉RT-3菌丝生长的适宜温度范围为37~42℃,而当温度降至30℃以下时,有大量孢子形成。在前24h采用37℃培养,菌丝快速生长,同时大量形成SOD。24h后转入28℃培养,孢子开始形成,再次刺激SOD的生成。
, 百拇医药
据此我们认为RT-3合成SOD在其生理上有两个阶段。第一个阶段是在菌丝体迅速生长期,由于其旺盛的生理活动,包括呼吸强度等大大增强,相应SOD酶活也大大提高[11]。第二个阶段是在孢子形成阶段,这一强烈的生命代谢活动需要机体保持旺盛的活力,SOD活性的增加有利于这一代谢活动进行。这一现象王玉万等也曾观察到[12]。
由此可见,本课题的深入研究不但将进一步促进微生物发酵生产SOD产业的发展,而且将为SOD合成的调节机制等方面提供新的资料和研究思路。
参考文献
1 冯清平,张晓君.酵母SOD高产工程菌培养优化条件研究.微生物学报,1995,35(4)∶280
2 TaniguchiM,Hoshino K, Itoh T. Production of Superoxide Dismutase from Strept ococcus lactis using a bioreactor with a micro filtration module. Biotechnology and Bioengineering,1992,39(8)∶ 886
, 百拇医药
3 江汉湖,董明盛. 高温型丹贝生产菌RT-3的分离筛选和鉴定. 南京农业大学学 报, 1992,15(3)∶97
4 曾浩洋,董启功. 以Rhizopus thailandensis发酵脱脂黄豆粉之酵素活性及生化组成变 化探讨(二). 中国农业化学会志,1985,23(3~4)∶300
5 孔显良,王俊英,姜丽萍. 食品用α-淀粉酶的制备. 微生物学通报,1992, 19(5)∶265
6 Ariefin R, Apostolopoulos C, Graffham A,Assessment of hyphal binding in temp he. Journal of Applied Microbiology,1994,18∶32
7 Kronenberg H I,Hang Y D. A puncture testing method for monitoring solid sub strate fermentation. Journal of Food Science,1993,50∶539
, 百拇医药
8 邓碧玉,袁勤生,李文杰. 改良的微量连苯三酚自氧化法测定超氧化物歧化酶活性的方法 . 生物化学与生物物理进展,1991,18(2)∶163
9 李永泉,赵小立,贺筱蓉等. 复合水解酶黑曲霉固体发酵工艺研究. 真菌学报 ,1995,14(3)∶226
10 王程,严自正. 米曲霉在产脱氨酶过程中的超微结构动态分析. 微生物学 通报,1985,4∶191
11 陈明杰,潘迎捷,江昭月,等. 香菇的子实体中超氧化物歧化酶的活性变化 初探. 食用菌,1989,6∶12
12 王玉万,柏玉萍,王云,等. 滑菇子实体阶段胞外CMC酶和HC酶酶活性增加. 微生物学通报,1992,19(1)∶7
收稿日期:1998-06-29, 百拇医药
单位:张羽航 姚汝华(华南理工大学食品与生物工程学院,广州510641);江汉湖 董明盛(南京农业大学食品科技学院,南京210095)
关键词:超氧化物歧化酶;少孢根霉;酶制备;发酵
摘 要 对少孢根霉RT
摘 要 对少孢根霉RT-3(Rhizopus oligosporus saito RT-3)固体发酵向胞外分泌超氧化物歧化酶的条件进行了研究。酶液的制备采用pH8.2,50mmol/L的磷酸缓冲液,离心取上清液。RT-3发酵42h后酶活达到最大(142U/ml)。适宜的接种量为0.5%~1%。添加10%的水有利于产酶。培养温度宜采用变温方式,即在37℃下培养24h,之后28℃培养18h。
Preliminary Study on Production of Superoxide
, 百拇医药
Dismutase by Rhizopus Oligosporus
Zhang Yuhang, Jiang Hanhu1,Dong Mingsheng1,Yao Ruhua
(College of Food & Biotechnology,South China University of Technology,Guangzhou 510641;1College of Food Science & Technology,Nan jing Agricultura l University,Nanjing 210095)
Abstract SOD crude extract was prepared from solid fermenti ng culture of Rhizo pus oligosporus RT-3 by adopting phosphate buffer (pH8.2,50mmol/L) at 42th hour of fermentation enzyme activity reached maximum of 142U/ml. Optimal inoculum size and water added in culture were 0.5%~1% and 10% respectively. It was found that culturing at 37℃ for 24 hours followed by temperature shift to 28℃ for 18h ours was effective for SOD production.
, 百拇医药
Key Words Superoxide dismutase, Rhizopus oligosporus, Fermen tation, Enzyme preparation
超氧化物歧化酶(Superoxide Dismutase 简称SOD)是一种广泛存在于生物体内的含铜,锌或锰和铁的金属酶,它催化超氧阴离子自由基(
, 百拇医药
1 材 料
1.1 实验菌株
少孢根霉RT-3(Rhizopus oligosporus Saito RT-3)由南京农业大学食品微生物组筛 选并通过鉴定。
1.2 培养基
1.2.1 斜面培养基 PDA培养基。
1.2.2 液体培养基 豆芽1000g加入1000ml水煮沸30min,纱布过滤。滤汁加入葡萄糖3%,(NH4)2SO40.4%,MgSO4.7H2O0.25%和KH2PO40.1%。溶解并补水至1000ml,用乳酸调pH5~5.5,分装,0.1MPa灭菌30min。
, http://www.100md.com
1.2.3 固体发酵培养基 精选大豆,浸泡16~18h,去皮,煮沸30min,沥尽水,按湿重1%添加乳酸。
2 方 法
2.1 培养方法
经液体培养基培养获得的少孢根霉RT-3菌丝,捣碎后与赋形剂混匀。在固体发酵培养基中接种发酵剂,然后35℃培养[3]。
2.2 SOD粗酶液的制备[4,5]
2.2.1 静置时间的确定 取培养物按每g加5ml50mmol/L(pH8.3)的磷酸缓冲液,于食品加工机搅打10s,分成4份,分别静置1,12h和4℃振荡1,112h,12000r/min离心15min,取上清液测定SOD活性。上述步骤均于4℃下进行。
, 百拇医药
2.2.2 搅打时间的确定 取培养物按每g加5ml50mmol/L(pH8.3)的磷酸缓冲液,于食品加工机搅打10,30,40,60s,静量1h,于12000r/min离心15min,取上清液测定SOD活力。上述步骤均于4℃下进行。
2.3 发酵过程的动力学分析
2.3.1 菌丝体生物量的评估 采用Kronenberg等的方法,于培养物发酵的不同时间分别取样用肉质检测仪检测培养物的质地[6,7]。
2.3.2 pH 于培养物发酵的不同时间分别取样15g,加入30ml去离子水,搅拌1min,测量pH,测量值代表大豆表面的pH[6]。
2.3.3 品温 不同时间测量培养物表面的温度
2.4 酶活测定
, 百拇医药
采用微量邻苯三酚自氧化法[8]。
3 结 果
3.1 SOD粗酶液的制备
3.1.1 不同抽提方法和时间对酶活力的影响 实验中采用静置浸泡1h、12h和振荡浸泡1h、12h四种抽提方式。从结果发现不同抽提方式和时间对酶活力的影响不大。考虑到简化实验过程,采用直接将打浆液离心,取上清液测酶活。
3.1.2 搅打时间的确定 实验结果显示在搅打时间达到40s后酶活力达到相对恒定的值。继续延长搅打时间对酶活没有大的提高。
3.2 发酵过程动力学分析
3.2.1 菌丝体生物量的评估 由图1可见肉质仪切断束缚大豆的菌丝所需的力量在第36h达到最高。

, 百拇医药
Fig 1 Change of force and temperature during fermentation
3.2.2固体发酵进程 固体发酵过程中,SOD酶活、pH和品温变化见图1与图2。

Fig 2 Change of pH and SOD activity during fermentation
结果表明:发酵前27h,品温迅速上升至最高温度45℃,直至第42h还在40℃。与此同时,酶活迅速上升达到142U/ml。在这段时间内,菌丝生长迅速。菌丝体生长检测说明此时菌丝体处于旺盛生长状态。发酵后期(42h以后)培养物的品温下降,菌丝体生长衰退,并且菌丝体的自溶也已出现。同时培养物中SOD酶活已迅速下降。
, 百拇医药
在整个发酵期间pH值逐渐上升,这一点与该菌株在液体发酵时的pH值变化不同。
3.3 发酵因素研究
3.3.1 接种量对产酶的影响 以0.5%~2%的比例接种发酵剂,其对酶活性的影响见表1。
Tab 1 Effect of different inoculum size on SOD activity
Inoculum size(%)
0.5
1
2
Enzyme activity(U/ml)
, 百拇医药
142.55
130.94
110.59
从表1可知,接种量从0.5%~2%对产酶稍有差异。接种量大,可以缩短菌体生长延滞期。接种量1%时在第18h就可见到菌丝体生长,而接种量0.5%要在24~26h才能观察到。但是接种量大,也会带来曲温上升快和衰退早等负作用,不利于产酶。综合考虑可以采用0.5%~1%的接种量。
3.3.2 加水量对产酶的影响 不论是孢子萌发,还是菌丝生长,酶的形成都需适当水分。考虑到大豆煮后晾干本身就有较高的含水量,所以加水量为10%,20%,30%。Tab 2 Effect of different addition of water on SOD activity
Water added(%)
, 百拇医药
0
10
20
30
Enzyme activity
(U/ml)
130.94
165.12
119.33
0
由表中结果可知添加10%的水有利于产酶,20%的加水量对产酶有抑制作用,而30%的加水量使菌体无法良好生长。加水量低,发酵中温度上升会使培养基表面干化,发酵不彻底,致使产酶量降低。加水量过多,温度过高,空中水蒸汽分压过大,氧气分压过低,使氧浓度降低,也不利于SOD的形成[9]。
, http://www.100md.com
3.3.3 温度对产酶的影响 采用37℃恒温培养及变温培养,结果见表3。Tab 3 Effect of temperature on SOD activity
Temperature
Enzyme activity(U/ml)
37℃
135.45
Temperature shift 1
170.28
Temperature shift 2
131.58
Temperature shift 1 (culture at 37℃ in first12h,then 28℃) Temperature shift 2 (culture at 37℃ in first 24h,then28℃)
, http://www.100md.com
从表3可知,变温2酶活高于37℃恒温培养和变温1。温度的变化和菌体形成孢子有密切的关系。37℃培养72h菌丝体已自溶,但绝无孢子形成,但如在第12h转至28℃,培养物有大量孢子生成,培养物纵切面呈黑色,打浆液亦为黑色。在第24h转至28℃培养,只在培养物的外缘有黑色孢子形成。培养物打浆液与37℃培养物打浆液并无明显差异。综合考虑生理和实际发酵情况,采用变温2较适宜。
4 讨 论
4.1 酶液制备
在酶液制备中采用食品加工机搅打培养物的原因有两个:1)粉碎培养物,增大培养物与缓冲液接触的面积,加快酶抽提速度;2)食品加工机不可能象组织捣碎机那样破碎细胞。限于食品加工机的性质,在搅拌时间达到40s后它已不可能再进一步粉碎培养物,可以大致限定我们研究的SOD是菌体分泌的SOD,所以酶活趋于稳定。
结合培养物打浆后的液体状态和酶活测定方法要求,我们确定抽提液与培养物的比例为5∶1。主要原因是当抽提液与培养物为2∶1时,浆液太稠不利于离心。抽提液与培养物按10∶1打浆时,酶液较稀不利于酶活测定且所需缓冲液体积太大。
, 百拇医药
4.2 酶的生产
RT-3固体发酵生产SOD主要包括两个方面:1)酶的形成;2)酶的分泌。现阶段我们的研究结果显示培养方式的改变是促使RT-3分泌SOD的主要原因。培养基质和培养条件的改变主要影响了酶的形成。大豆固体培养基在这两个方面是否起了某种特殊的作用尚不清楚。王程等研究了米曲霉生产脱氨酶过程中的超微结构动态,认为菌体在产酶过程中发生了分生孢子的脱落和线粒体的空化两个现象[10]。归根到底RT-3在大豆固体培养基上发生的变化与其自身的结构和生理有关。
4.3 温度对发酵的影响
温度对培养物酶活力的影响主要是菌丝体生长和孢子形成与SOD酶活性增加的生理生化调节程序存在着密切的内在联系。少孢根霉RT-3菌丝生长的适宜温度范围为37~42℃,而当温度降至30℃以下时,有大量孢子形成。在前24h采用37℃培养,菌丝快速生长,同时大量形成SOD。24h后转入28℃培养,孢子开始形成,再次刺激SOD的生成。
, 百拇医药
据此我们认为RT-3合成SOD在其生理上有两个阶段。第一个阶段是在菌丝体迅速生长期,由于其旺盛的生理活动,包括呼吸强度等大大增强,相应SOD酶活也大大提高[11]。第二个阶段是在孢子形成阶段,这一强烈的生命代谢活动需要机体保持旺盛的活力,SOD活性的增加有利于这一代谢活动进行。这一现象王玉万等也曾观察到[12]。
由此可见,本课题的深入研究不但将进一步促进微生物发酵生产SOD产业的发展,而且将为SOD合成的调节机制等方面提供新的资料和研究思路。
参考文献
1 冯清平,张晓君.酵母SOD高产工程菌培养优化条件研究.微生物学报,1995,35(4)∶280
2 TaniguchiM,Hoshino K, Itoh T. Production of Superoxide Dismutase from Strept ococcus lactis using a bioreactor with a micro filtration module. Biotechnology and Bioengineering,1992,39(8)∶ 886
, 百拇医药
3 江汉湖,董明盛. 高温型丹贝生产菌RT-3的分离筛选和鉴定. 南京农业大学学 报, 1992,15(3)∶97
4 曾浩洋,董启功. 以Rhizopus thailandensis发酵脱脂黄豆粉之酵素活性及生化组成变 化探讨(二). 中国农业化学会志,1985,23(3~4)∶300
5 孔显良,王俊英,姜丽萍. 食品用α-淀粉酶的制备. 微生物学通报,1992, 19(5)∶265
6 Ariefin R, Apostolopoulos C, Graffham A,Assessment of hyphal binding in temp he. Journal of Applied Microbiology,1994,18∶32
7 Kronenberg H I,Hang Y D. A puncture testing method for monitoring solid sub strate fermentation. Journal of Food Science,1993,50∶539
, 百拇医药
8 邓碧玉,袁勤生,李文杰. 改良的微量连苯三酚自氧化法测定超氧化物歧化酶活性的方法 . 生物化学与生物物理进展,1991,18(2)∶163
9 李永泉,赵小立,贺筱蓉等. 复合水解酶黑曲霉固体发酵工艺研究. 真菌学报 ,1995,14(3)∶226
10 王程,严自正. 米曲霉在产脱氨酶过程中的超微结构动态分析. 微生物学 通报,1985,4∶191
11 陈明杰,潘迎捷,江昭月,等. 香菇的子实体中超氧化物歧化酶的活性变化 初探. 食用菌,1989,6∶12
12 王玉万,柏玉萍,王云,等. 滑菇子实体阶段胞外CMC酶和HC酶酶活性增加. 微生物学通报,1992,19(1)∶7
收稿日期:1998-06-29, 百拇医药