肺水的热-染料稀释法测量
作者:闫天生 温光楠
单位:
关键词:
北京生物医学工程990214 肺水肿是各种严重创伤、休克、败血症以及胰腺炎等内、外科疾病时常见的临床综合症,也是成人呼吸窘迫综合征(ARDS)发生时的主要病理生理过程[1]。肺水肿出现时必然会有血管外肺水(EVLW,extravascular lung water)的增多,对血管外肺水质和量的改变进行动态观察和定量检测,成为肺水肿基础与临床研究的热点[2]。热-染料稀释方法用来测量心输出量,已在临床上应用多年。将两种指示剂联合使用来测量血管外肺水是国外近年兴起的一种新技术,本文结合我们的研究工作[3],对热-染料稀释法测量血管外肺水的概况及进展做一介绍。
0 历史回顾
, http://www.100md.com
1954年,Chinard和Enn首次创立了可测量活体动物及人血管外肺水的双指示剂稀释技术[4]。将两种同位素指示剂同时注入右心房,一种为小分子的能自由通过血管壁运动的“可弥散”指示剂,如氚水。另一种为大分子的被限制于肺血管中运动的“不可弥散”指示剂,如51Cr-RBC或125I-Hb。依据两种指示剂通过肺循环的平均通过时间差及即刻的心输出量,计算出血管外肺水量。这一方法创立的重要意义在于,人们从此可以定量地观察活体的血管外肺水,也使肺水肿的研究进入了定量研究的新阶段。这一方法在理论上是科学的和合理的,但是,在实际操作上还存在着一些难以克服的缺点。比如,采用这一方法时,测量结果要依靠抽取血样后在同位素闪烁计数仪计数,然后通过手工进行曲线拟合和计算。因此计算复杂,耗时长,难以反映出即刻的肺水。当测量结果得出时,血管外肺水的状态可能早已发生了改变。由于同位素具有放射性,对人体有害。测量需要多次重复进行,而且测量操作较为复杂,每次测量均要使受试者失血。这些难以解决问题的长期存在,限制了同位素双指示剂稀释技术的发展和临床应用[5]。
, 百拇医药
此后,Fegler为测量血流量,建立了热稀释技术,这一技术今天已经发展成为心输出量测量的主要方法。Gee由此受到启发,他在反复试验的基础上,采用热(冰水)和心脏绿(ICG)染料作为双指示剂,测量血管外肺水获得成功[6]。此后,Lewis将这一方法与计算机联机,使数据采集、计算处理等复杂的工作变得简捷、迅速,并成功地用于ICU病房的床旁检测[7]。这些里程碑式的工作,揭开了双指示剂稀释技术测量肺水新的一页。
1 技术原理
热-染料双指示剂稀释技术是基于上述的同位素双指示剂方法建立和发展起来的,两者的基本原理相同。当可弥散与不可弥散两种指示剂被同时注入后,其中一种被限制于血管内空间,另一种能够弥散出血管。从弥散指示剂的分布容量中减去不弥散指示剂的分布容量,就可以得到血管外容量(V)。如果给一密闭的管道系统以恒定的流量(Qt)灌注,那么通过在P1点注射一团指示剂,经过C(t)时间后,在指示剂将通过该系统时,由P2点测量其浓度,就可以把这一系统中P1和P2两点之间的容量计算出来。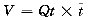
, 百拇医药
(1)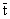 :指示剂平均通过时间
:指示剂平均通过时间
Qt可以从所注入指示剂的量(m)与从浓度稀释曲线获得的平均浓度的关系式中求出: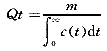
(2)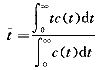
(3)
假定肺是由血管内和血管外空间组成,它们之间被一层半透膜分开。当可弥散及不可弥散指示剂注入上腔静脉或右心房后,它们经过右心时被均匀地混合,并以流量Qt被带入肺循环。可弥散指示剂分布到肺血管内、外空间,而不可弥散指示剂被限制于肺血管内空间。通过分析两种指示剂的浓度时间曲线,就可获得全肺弥散容量(VD)和肺血管内容量(VI):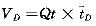
, 百拇医药
(4)
而: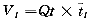
(5)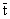 D:可弥散指示剂平均通过时间;
D:可弥散指示剂平均通过时间;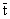 I:不可弥散指示剂平均通过时间。
I:不可弥散指示剂平均通过时间。
因此,血管外空间(VE)应等于: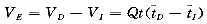
(6)
VE的大小主要取决于可弥散指示剂的容量,如果可弥散指示剂均匀地在血管外肺水空间中分布,那么此时VE就近似等于血管外肺水[8,9],参见图1。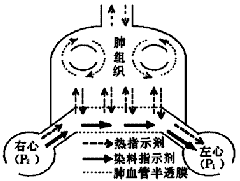
, http://www.100md.com
图1 双指示剂稀释技术原理图
2 测量装置及方法
采用热-ICG染料双指示剂稀释法测量血管外肺水,其测量装置一般由以下几部分组成[10]:(1)导管:上腔静脉或右心导管用于注射双指示剂;置于腹主动脉的肺水导管,用于测定热指示剂的温度变化,以及获取染料指示剂信号。(2)换能部分:将温度信号及染料信号转换为电信号,由热敏电阻和光敏二极管来完成。(3)装有注射器的抽血及回输血泵。(4)记录仪:描记双指示剂稀释曲线。(5)计算机分析系统:将测量所得的电信号放大及A/D转换,对结果进行计算、储存、显示或打印。图2为作者建立的血管外肺水微机测量系统。
图2 血管外肺水微机测量系统框图
热-染料双指示剂稀释法测量血管外肺水的主要过程如下[11]:将Swan-Ganz导管(5F或7F)从颈静脉或股静脉插入到右心房附近,肺水导管经股动脉插入到腹主动脉。肺水导管具有双腔结构,其中一腔用于抽取及回送血样,以测定染料稀释度,也可以联于测压装置。导管尖端装有热敏电阻。ICG染料被溶解在5~10ml的生理盐水中,混匀后浸入冰水里约20分钟,达到0℃左右,使之含有热和染料双指示剂信号。开始测量时,经右心导管快速注入指示剂。同时,血管外肺水微机测量系统接收到启动信号后,自动拾取双指示剂浓度变化信号,开始采集测量数据,进行实时处理,包括计算、显示、贮存及打印结果,台式平衡记录仪描记双指示剂稀释曲线,以上工作在1~3min内完成。测量结束后迅速回输抽出的血液。连续测量3~4次为一组,取均值,相邻两次的测量时间间隔约3~5min。
, http://www.100md.com
3 评价与展望
利用热作为可弥散指示剂具有许多优点,热在水中的弥散系数是5.9×10-3ft2/hr,而小分子物质如氚水则是5~10×10-5ft2/hr。前者的弥散率或交换速度高出后者100倍以上。因此在指示剂通过肺循环的短暂时间里,热指示剂可以更为迅速、充分地分布于全肺,与血管外肺组织进行能量交换与混合。利用热敏电阻可以方便、准确、迅速地测出热信号的变化。ICG进入血中后,能迅速地和血浆蛋白相结合,形成大分子物质。其透光稳定,最大吸收光谱为780~805nm,入血后5min约97%经过肝脏代谢排出。在血中无累积、无毒、无皮肤色染,因此,可在同一病人多次重复应用[6]。
Lewis给正常受检者测量,测得血管外肺水值是5.5~6.2ml/kg[7]。Chu等对患有ARDS及经X光检查证实有严重肺水肿者,测得的血管外肺水值为15.8±4.6ml/每公斤体重[1]。
, 百拇医药
Blomquist指出热-染料双指示剂稀释技术可以准确、敏感、特异地对血管外肺水进行定量测量,具有重复性好,可联机等优点。它提供了一个准确的用于评价肺毛细血管液体运动的技术,若把血管外肺水的变化和肺毛细血管静水压的变化结合起来研究,则可以评价肺毛细血管的通透性[12]。这种方法的可重复性也相当好,重复测量的变异系数一般是4.5%~8.2%,作者的结果为5.67%。使用这种方法对各种类型肺水肿时肺水的测量也都非常准确,在动物实验及部分临床濒死病人中,活体测得的血管外肺水值和Pearce法测得的肺水值之间,有着相当好的一致性[5]。Boldt观察了各种类型的肺损伤对热-染料双指示剂稀释法测量肺水的影响,指出这种方法可以对正常肺、压力性肺水肿和通透性肺水肿时的肺水,进行近于100%的检测[13]。Maron认为敏感性是81%~88%,特异性是97%,可以反映出肺间质的水量,肺水每公斤体重增加2.04ml就可用此法检出,因此,利用这一方法能够早期发现间质性肺水肿[14]。利用血管外肺水微机测量系统和Swan-Ganz心导管,在每次测量时,除了可迅速得到血管外肺水的结果外,还可以得到心输出量、全肺热容量、肺血量,以及血液动力学的多项重要参数和指标[15]。国外已有肺水计算机商品出售,并已开始投入临床应用。
, http://www.100md.com
随着现代医学的发展,肺水肿检测手段不断增多,但是能够准确、特异地对血管外肺水进行测量,而且操作简单、使用灵活方便、可用于床旁的方法,尚首推热-染料双指示剂稀释方法。由于每次测量都需要经皮置入导管,所以热-染料双指示剂稀释技术的一个明显的缺点是具有微创伤。随着Sheldinger技术与导管技术的普及与发展,这些微创伤已经不成为严重的问题。这一方法的另外一些有待解决的问题是可弥散指示剂的丢失,不同心输出量和肺灌流状态对其测量准确性的影响等[11]。尽管如此,在其他方法尚不能区分活体血管内、外肺水的情况下,热-染料双指示剂稀释技术作为一个能够准确、敏感、特异地对血管外肺水做定量分析,提供关于活体肺液体运动的信息,从而早期检测肺水肿的方法,在基础研究与临床肺水肿病人的救治中,仍然有着重要的不可替代的使用价值。
作者简介:闫天生:首都医科大学北京同仁医院胸心外科副教授,副主任医师,医学博士,硕士研究生导师。
作者单位:闫天生 首都医科大学 北京同仁医院胸心外科(北京 100730)
, http://www.100md.com
温光楠 西安第四军医大学病理生理教研室(西安 710032)
参考文献
1 Chu RY,Sidhu N,Carlile PJr.Blood volume distribution in lung injury.Nucl Med Biol,1993,20:167
2 Frostell C,Blomqvist H,Wickerts CJ,et al.Lung fluid balance evaluated by the rate of change of extravascular lung water content.Acta Anaesthesiol Scand,1990,34:362
3 闫天生,温光楠,徐世序.血管外肺水微机测量系统.北京生物医学工程,1994,13(1):16
, 百拇医药
4 Chinard FP,Enns T.Transcapillary pulmonary exchange of water in the dog.Amer J Physiol,1954,178:197
5 Byrne K,Surgerman HJ.Experimental and clinical assessment of lung injury by measurement of extravascular lung water and transcapillary protein flux in ARDS:a review of current techniques.J Surg Res,1988,44:185
6 Allison RC,Carlile PV,Gray BA.Thermaldiution measurement of lung water.Clin Chest Med,1985,6:439
, 百拇医药
7 Lewis FR.Elings VI.The measurement of extravascular lung water by thermal-green dye indicator dilution.Ann NY Acas Sci,1982,384:394
8 Bock J,Hoeft A,Korb H,et al.Determination of central blood volume and extravascular lung water. Thorac Cardiovasc Surg,1987,35:53
9 Clough AV,Cui D,Linehan JH,et al.Model-free numerical deconvoluting of recirculation indicator concentration curves.J Appl Physiol,1993,74:1444
, 百拇医药
10 Segawa T,Arakawa M,Kambara K,et al.Correction for apparent prolongation of mean trsansit time resulting from response time in a thermodilution system.IEEE Trans Biomed Eng,1993,40:1
11 Fernandez ME,Vazquez MG,Cardenas A,et al.Ventilation with positive end-expiratory pressure reduces extravascular lung water and increases lymphatic flow in hydrostatic pulmonary edema.Crit Care Med,1996,24:1562
12 Blomquist H,Wickerts CT,Rosblad PG.Effect of plural fluid and positive end-expirator pressure on the measurement of extravascular lung water by the double-indicator dilution technique.Acta Anaesthesiol Scand,1991,35:578
, http://www.100md.com
13 Boldt J,Zickmann B,Dapper F,et al.Does the technique of cardiopulmonary bypass affect lung water content? Eur J Cardiothorac Surg,1991,5:22
14 Maron MB,Holcomb PH,Daeson CA,et al.Edema development and recovery in neurogenic pulmonary edema.J Appl Phsiol,1994,77:1155
15 Kambara K,Jerome EH,Serikov VB,et al.Reliability of extravascular thermal volume measurements by thermal conductivity technique in sheep.J Appl Physiol,1992,73:1449
(1998-07-20收稿), 百拇医药
单位:
关键词:
北京生物医学工程990214 肺水肿是各种严重创伤、休克、败血症以及胰腺炎等内、外科疾病时常见的临床综合症,也是成人呼吸窘迫综合征(ARDS)发生时的主要病理生理过程[1]。肺水肿出现时必然会有血管外肺水(EVLW,extravascular lung water)的增多,对血管外肺水质和量的改变进行动态观察和定量检测,成为肺水肿基础与临床研究的热点[2]。热-染料稀释方法用来测量心输出量,已在临床上应用多年。将两种指示剂联合使用来测量血管外肺水是国外近年兴起的一种新技术,本文结合我们的研究工作[3],对热-染料稀释法测量血管外肺水的概况及进展做一介绍。
0 历史回顾
, http://www.100md.com
1954年,Chinard和Enn首次创立了可测量活体动物及人血管外肺水的双指示剂稀释技术[4]。将两种同位素指示剂同时注入右心房,一种为小分子的能自由通过血管壁运动的“可弥散”指示剂,如氚水。另一种为大分子的被限制于肺血管中运动的“不可弥散”指示剂,如51Cr-RBC或125I-Hb。依据两种指示剂通过肺循环的平均通过时间差及即刻的心输出量,计算出血管外肺水量。这一方法创立的重要意义在于,人们从此可以定量地观察活体的血管外肺水,也使肺水肿的研究进入了定量研究的新阶段。这一方法在理论上是科学的和合理的,但是,在实际操作上还存在着一些难以克服的缺点。比如,采用这一方法时,测量结果要依靠抽取血样后在同位素闪烁计数仪计数,然后通过手工进行曲线拟合和计算。因此计算复杂,耗时长,难以反映出即刻的肺水。当测量结果得出时,血管外肺水的状态可能早已发生了改变。由于同位素具有放射性,对人体有害。测量需要多次重复进行,而且测量操作较为复杂,每次测量均要使受试者失血。这些难以解决问题的长期存在,限制了同位素双指示剂稀释技术的发展和临床应用[5]。
, 百拇医药
此后,Fegler为测量血流量,建立了热稀释技术,这一技术今天已经发展成为心输出量测量的主要方法。Gee由此受到启发,他在反复试验的基础上,采用热(冰水)和心脏绿(ICG)染料作为双指示剂,测量血管外肺水获得成功[6]。此后,Lewis将这一方法与计算机联机,使数据采集、计算处理等复杂的工作变得简捷、迅速,并成功地用于ICU病房的床旁检测[7]。这些里程碑式的工作,揭开了双指示剂稀释技术测量肺水新的一页。
1 技术原理
热-染料双指示剂稀释技术是基于上述的同位素双指示剂方法建立和发展起来的,两者的基本原理相同。当可弥散与不可弥散两种指示剂被同时注入后,其中一种被限制于血管内空间,另一种能够弥散出血管。从弥散指示剂的分布容量中减去不弥散指示剂的分布容量,就可以得到血管外容量(V)。如果给一密闭的管道系统以恒定的流量(Qt)灌注,那么通过在P1点注射一团指示剂,经过C(t)时间后,在指示剂将通过该系统时,由P2点测量其浓度,就可以把这一系统中P1和P2两点之间的容量计算出来。
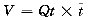
, 百拇医药
(1)
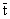 :指示剂平均通过时间
:指示剂平均通过时间Qt可以从所注入指示剂的量(m)与从浓度稀释曲线获得的平均浓度的关系式中求出:
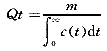
(2)
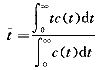
(3)
假定肺是由血管内和血管外空间组成,它们之间被一层半透膜分开。当可弥散及不可弥散指示剂注入上腔静脉或右心房后,它们经过右心时被均匀地混合,并以流量Qt被带入肺循环。可弥散指示剂分布到肺血管内、外空间,而不可弥散指示剂被限制于肺血管内空间。通过分析两种指示剂的浓度时间曲线,就可获得全肺弥散容量(VD)和肺血管内容量(VI):
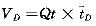
, 百拇医药
(4)
而:
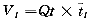
(5)
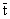 D:可弥散指示剂平均通过时间;
D:可弥散指示剂平均通过时间;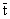 I:不可弥散指示剂平均通过时间。
I:不可弥散指示剂平均通过时间。因此,血管外空间(VE)应等于:
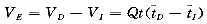
(6)
VE的大小主要取决于可弥散指示剂的容量,如果可弥散指示剂均匀地在血管外肺水空间中分布,那么此时VE就近似等于血管外肺水[8,9],参见图1。

, http://www.100md.com
图1 双指示剂稀释技术原理图
2 测量装置及方法
采用热-ICG染料双指示剂稀释法测量血管外肺水,其测量装置一般由以下几部分组成[10]:(1)导管:上腔静脉或右心导管用于注射双指示剂;置于腹主动脉的肺水导管,用于测定热指示剂的温度变化,以及获取染料指示剂信号。(2)换能部分:将温度信号及染料信号转换为电信号,由热敏电阻和光敏二极管来完成。(3)装有注射器的抽血及回输血泵。(4)记录仪:描记双指示剂稀释曲线。(5)计算机分析系统:将测量所得的电信号放大及A/D转换,对结果进行计算、储存、显示或打印。图2为作者建立的血管外肺水微机测量系统。

图2 血管外肺水微机测量系统框图
热-染料双指示剂稀释法测量血管外肺水的主要过程如下[11]:将Swan-Ganz导管(5F或7F)从颈静脉或股静脉插入到右心房附近,肺水导管经股动脉插入到腹主动脉。肺水导管具有双腔结构,其中一腔用于抽取及回送血样,以测定染料稀释度,也可以联于测压装置。导管尖端装有热敏电阻。ICG染料被溶解在5~10ml的生理盐水中,混匀后浸入冰水里约20分钟,达到0℃左右,使之含有热和染料双指示剂信号。开始测量时,经右心导管快速注入指示剂。同时,血管外肺水微机测量系统接收到启动信号后,自动拾取双指示剂浓度变化信号,开始采集测量数据,进行实时处理,包括计算、显示、贮存及打印结果,台式平衡记录仪描记双指示剂稀释曲线,以上工作在1~3min内完成。测量结束后迅速回输抽出的血液。连续测量3~4次为一组,取均值,相邻两次的测量时间间隔约3~5min。
, http://www.100md.com
3 评价与展望
利用热作为可弥散指示剂具有许多优点,热在水中的弥散系数是5.9×10-3ft2/hr,而小分子物质如氚水则是5~10×10-5ft2/hr。前者的弥散率或交换速度高出后者100倍以上。因此在指示剂通过肺循环的短暂时间里,热指示剂可以更为迅速、充分地分布于全肺,与血管外肺组织进行能量交换与混合。利用热敏电阻可以方便、准确、迅速地测出热信号的变化。ICG进入血中后,能迅速地和血浆蛋白相结合,形成大分子物质。其透光稳定,最大吸收光谱为780~805nm,入血后5min约97%经过肝脏代谢排出。在血中无累积、无毒、无皮肤色染,因此,可在同一病人多次重复应用[6]。
Lewis给正常受检者测量,测得血管外肺水值是5.5~6.2ml/kg[7]。Chu等对患有ARDS及经X光检查证实有严重肺水肿者,测得的血管外肺水值为15.8±4.6ml/每公斤体重[1]。
, 百拇医药
Blomquist指出热-染料双指示剂稀释技术可以准确、敏感、特异地对血管外肺水进行定量测量,具有重复性好,可联机等优点。它提供了一个准确的用于评价肺毛细血管液体运动的技术,若把血管外肺水的变化和肺毛细血管静水压的变化结合起来研究,则可以评价肺毛细血管的通透性[12]。这种方法的可重复性也相当好,重复测量的变异系数一般是4.5%~8.2%,作者的结果为5.67%。使用这种方法对各种类型肺水肿时肺水的测量也都非常准确,在动物实验及部分临床濒死病人中,活体测得的血管外肺水值和Pearce法测得的肺水值之间,有着相当好的一致性[5]。Boldt观察了各种类型的肺损伤对热-染料双指示剂稀释法测量肺水的影响,指出这种方法可以对正常肺、压力性肺水肿和通透性肺水肿时的肺水,进行近于100%的检测[13]。Maron认为敏感性是81%~88%,特异性是97%,可以反映出肺间质的水量,肺水每公斤体重增加2.04ml就可用此法检出,因此,利用这一方法能够早期发现间质性肺水肿[14]。利用血管外肺水微机测量系统和Swan-Ganz心导管,在每次测量时,除了可迅速得到血管外肺水的结果外,还可以得到心输出量、全肺热容量、肺血量,以及血液动力学的多项重要参数和指标[15]。国外已有肺水计算机商品出售,并已开始投入临床应用。
, http://www.100md.com
随着现代医学的发展,肺水肿检测手段不断增多,但是能够准确、特异地对血管外肺水进行测量,而且操作简单、使用灵活方便、可用于床旁的方法,尚首推热-染料双指示剂稀释方法。由于每次测量都需要经皮置入导管,所以热-染料双指示剂稀释技术的一个明显的缺点是具有微创伤。随着Sheldinger技术与导管技术的普及与发展,这些微创伤已经不成为严重的问题。这一方法的另外一些有待解决的问题是可弥散指示剂的丢失,不同心输出量和肺灌流状态对其测量准确性的影响等[11]。尽管如此,在其他方法尚不能区分活体血管内、外肺水的情况下,热-染料双指示剂稀释技术作为一个能够准确、敏感、特异地对血管外肺水做定量分析,提供关于活体肺液体运动的信息,从而早期检测肺水肿的方法,在基础研究与临床肺水肿病人的救治中,仍然有着重要的不可替代的使用价值。
作者简介:闫天生:首都医科大学北京同仁医院胸心外科副教授,副主任医师,医学博士,硕士研究生导师。
作者单位:闫天生 首都医科大学 北京同仁医院胸心外科(北京 100730)
, http://www.100md.com
温光楠 西安第四军医大学病理生理教研室(西安 710032)
参考文献
1 Chu RY,Sidhu N,Carlile PJr.Blood volume distribution in lung injury.Nucl Med Biol,1993,20:167
2 Frostell C,Blomqvist H,Wickerts CJ,et al.Lung fluid balance evaluated by the rate of change of extravascular lung water content.Acta Anaesthesiol Scand,1990,34:362
3 闫天生,温光楠,徐世序.血管外肺水微机测量系统.北京生物医学工程,1994,13(1):16
, 百拇医药
4 Chinard FP,Enns T.Transcapillary pulmonary exchange of water in the dog.Amer J Physiol,1954,178:197
5 Byrne K,Surgerman HJ.Experimental and clinical assessment of lung injury by measurement of extravascular lung water and transcapillary protein flux in ARDS:a review of current techniques.J Surg Res,1988,44:185
6 Allison RC,Carlile PV,Gray BA.Thermaldiution measurement of lung water.Clin Chest Med,1985,6:439
, 百拇医药
7 Lewis FR.Elings VI.The measurement of extravascular lung water by thermal-green dye indicator dilution.Ann NY Acas Sci,1982,384:394
8 Bock J,Hoeft A,Korb H,et al.Determination of central blood volume and extravascular lung water. Thorac Cardiovasc Surg,1987,35:53
9 Clough AV,Cui D,Linehan JH,et al.Model-free numerical deconvoluting of recirculation indicator concentration curves.J Appl Physiol,1993,74:1444
, 百拇医药
10 Segawa T,Arakawa M,Kambara K,et al.Correction for apparent prolongation of mean trsansit time resulting from response time in a thermodilution system.IEEE Trans Biomed Eng,1993,40:1
11 Fernandez ME,Vazquez MG,Cardenas A,et al.Ventilation with positive end-expiratory pressure reduces extravascular lung water and increases lymphatic flow in hydrostatic pulmonary edema.Crit Care Med,1996,24:1562
12 Blomquist H,Wickerts CT,Rosblad PG.Effect of plural fluid and positive end-expirator pressure on the measurement of extravascular lung water by the double-indicator dilution technique.Acta Anaesthesiol Scand,1991,35:578
, http://www.100md.com
13 Boldt J,Zickmann B,Dapper F,et al.Does the technique of cardiopulmonary bypass affect lung water content? Eur J Cardiothorac Surg,1991,5:22
14 Maron MB,Holcomb PH,Daeson CA,et al.Edema development and recovery in neurogenic pulmonary edema.J Appl Phsiol,1994,77:1155
15 Kambara K,Jerome EH,Serikov VB,et al.Reliability of extravascular thermal volume measurements by thermal conductivity technique in sheep.J Appl Physiol,1992,73:1449
(1998-07-20收稿), 百拇医药