供者抗原经门静脉输注诱导特异性免疫耐受的研究①
作者:王佳 卢一平 杨宇如 唐孝达②
单位:王佳 卢一平 杨宇如 唐孝达② (华西医科大学附属第一医院泌尿科,成都610041)
关键词:输血;脾细胞;骨髓细胞;门静脉;免疫耐受
中国免疫学杂志/990516 摘 要 目的:探讨供者特异性抗原在诱导免疫耐受中的作用和地位。方法:采用大鼠异位(颈部)心脏移植模型,通过门静脉途径输注不同类型供者特异性抗原。结果:发现供者特异性输血(DST)、供者特异性脾细胞(DSSL)和供者特异性骨髓细胞(DSBM)能诱导受体对供体移植物产生免疫耐受。结论:这类免疫耐受的产生可能与肝脏特殊免疫功能有关;Kupffer细胞可能在其中起重要作用。但门静脉耐受对外周血CD8+细胞的影响不明显。
中国图书分类号 R69
, http://www.100md.com
Study of the donor-specific antigens induce tolerance by portal vein in fusion
WANG Jia, LU Yi-Ping, YANG Yu-Ru et al.
The First Hospital of West China Medical University, Chengdu 610041
Abstract Objective:To find whether the donor specific antigens can induce immunological tolerance. Methods:A rat model of cervical heterotopic cardiac transplantation was established and the different donor antigens were infused through the portal vein. Results:DST,DSSL and DSBM can induce the specific tolerance by the way of portal vein infusion. Conclusion:The immunological tolerance correlated with the special immunological function of the liver. Kupffer's cells may play an important role in inducing allograft tolerance.
, http://www.100md.com
Key words Whole blood Splenocyte Bone marrow Portal vein Tolerance
肝脏和门静脉独特的解剖学位置和结构决定了肝脏具有特殊的免疫功能。近年来,门静脉耐受的研究主要集中在器官移植的运用方面,但关于门静脉耐受的机制仍然不清楚。本文将重点探讨肝脏作为特殊免疫器官在耐受诱导的形成和维持中所发挥的作用和可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康纯系雄性大鼠,供体Wistar,受体SD(华西医科大学实验动物中心,持一级动物生产许可证),体重200~250 g。
1.1.2 实验材料 CsA(Sandoz,瑞士),口服水剂;RPMI 1640(Gibco,美国),Ficoll(pH 7.2,上海试剂二厂);丝裂霉素C 50 mg/ml(Kyoima Hakko CO.Lt,日本);3H-TDR1 mCi/ml(上海原子能研究所);单克隆抗体CD8+(羊抗鼠Sigma,美国)。
, http://www.100md.com
1.2 方法
1.2.1 心脏移植模型 采用颈部异位移植,即供心无名动脉和肺主动脉分别与受体右颈内动脉和右颈外静脉行端端吻合。通过触诊和移植心心电图记录移植物存活和排斥反应发生时间。
1.2.2 刺激抗原的制备
1.2.2.1 全血的制备 无菌取血,各供体开腹经腔静脉采血2 ml,肝素化备用。同时回输生理盐水5 ml。
1.2.2.2 脾细胞悬液制备 无菌取脾。60目不锈钢网碾磨过滤,离心悬液(1 000 r/min),加红细胞溶解液,Hank's液清洗2次。RPMI 1640调整细胞浓度为1×108 ml-1。台盼蓝拒染法判断细胞活性大于90%。
1.2.2.3 骨髓细胞悬液制备 无菌切取供体髂骨和股骨,Hank's平衡液冲洗骨髓腔,离心(1 000 r/min),调整细胞浓度为1×108 ml-1。
, 百拇医药
1.2.2.4 外周血淋巴细胞分离 鼠尾静脉采血1 ml,PBS等倍稀释,加入2 ml Ficoll液面上,离心30 min(1 700 r/min),取淋巴细胞层,PBS洗涤2次。
1.2.3 结果检测
1.2.3.1 混合淋巴细胞反应(MLR) 培养液采用RPMI 1640加10%人体白蛋白。培养瓶加入供受体脾细胞悬液各1 ml(1×108 ml-1),细胞培养液5 ml,适量双抗(青、链霉素)。置于5%CO2孵箱37℃培养6 d,终止培养前12 h,按1×106单个核细胞加1 μCi3H-TDR。由液体闪烁计数仪测定cpm(脉冲数/分)值。
1.2.3.2 外周血T细胞亚群的检测 羊抗鼠CD8+单抗按1∶100效价每份标本加10 μl混合,37℃水浴30 min,加补体20 μl,台盼蓝染色后,计数200个以上淋巴细胞,计算CD8+淋巴细胞亚群的阳性细胞百分率。
, http://www.100md.com
1.2.3.3 移植心T细胞亚群检测 取排斥心脏标本,液氮保存,冰冻切片,丙酮固定10 min,0.3%H2O2甲醇溶液充分水洗30 min,2%血清覆盖组织,置37℃烘箱10 min,直接滴加CD8+抗体(1∶100效价)于组织上。再次孵育30 min,滴加ABC复合物,再经DAB-H2O2显色后裱片。
1.2.3.4 移植心排斥后标本 作病理检查。
1.3 实验分组 采用麻醉下开腹,将不同供者抗原一次性分别注入配对受者门静脉,注射总量为1 ml,细胞悬液浓度为1×108 ml-1共分3个实验组和1个对照组,各组样本量5只。对照组输注等量RPMI 1640液,其余3个实验组抗原种类分别为DST、DSSL和DSBM。环孢素A(CsA)剂量各组均为5 mg/(kg.d),管喂,术前6 d至术后28 d。
, http://www.100md.com
2 结果
2.1 移植物存活时间和混合淋巴细胞反应 见表1、表2。
表1 移植物存活时间
Tab.1 Time of the grafts survival Group
Antigens
Surviral time(day)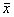 ±s
±s
1
CsA
8,13,17,11,14
12.6±3.4
, http://www.100md.com
2
DST+CsA
38,45,30,25,38
35.2±7.8
3
DSST+CsA
55,50,49,48,60
52.4±5.0
4
DSBM+CsA
80,87,76,60,66
73.8±10.8
, 百拇医药
Note:n=5,P<0.004表2 混合淋巴细胞反应(MLR)
Tab.2 The outcome of 4 group mix lymphocyte reaction (MLR) Antigens
n
Time of postoperation
MLR (cpm)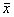 ±s
±s
CsA
5
7
9 955,12 310,12 531,9 086
, http://www.100md.com
10 971±1 714
DST+CsA
5
7
9 901,8 714,7 210,7 140,8 039
8 201±1 150
4
21
6 609,6 147,6 540,7 101
6 599±392
DSSL+CsA
, 百拇医药 5
7
8 890,8 901,8 357,8 151,7 454
8 351±600
5
21
4 103,5 008,4 980,5 014,3 940
4 609±540
DSBM+CsA
5
7
7 405,8 151,8 357,7 494,7 005
, 百拇医药
7 682±558
5
21
4 196,3 725,2 866,2 913,3 210
3 382±569
Note:P<0.023
2.2 术后7 d外周血T细胞亚群(CD8+) 检测移植后7 d对照组和实验组T细胞亚群(CD8+)的变化,发现实验组与CsA对照组间存在明显统计学差异(P<0.001),而各实验组间的变化无统计学意义(P>0.163)。
2.3 组织病理学检查 CsA对照组在光镜下大量单核细胞浸润,组织充血水肿,心肌细胞有局灶性变性坏死,呈急性排斥反应表现。实验组则组织病理改变相对较轻,但仍有局灶性炎性细胞浸润。
, 百拇医药
3 讨论
门静脉耐受的概念早在1973年就已提出,继而Qian又证明门静脉注射异基因脾细胞可以诱导供体特异性耐受[1,2]。对于这类耐受的解释目前尚不清楚。Desquenne-Clark等认为是依靠建立一个长期、稳定的嵌合状态[3]。我们采用DST、DSSL、DSBM经门静脉输注,其平均移植物存活时间分别为35.2±7.8 d,52.4±5.0 d和73.8±10.8 d,明显高于对照组。并且以骨髓组诱导效果最好(P<0.004)。这可能是刺激抗原在肝脏内“滞留”,被肝内的某种特殊细胞摄取并处理,将其免疫原性转变为耐受原性形式而在耐受的诱导中发挥作用。Callery研究了肝Kupffer细胞封闭对经门静脉途径单核细胞输注诱导耐受的影响,认为Kupffer细胞对肝脏内刺激抗原的聚积具有特殊效应[4]。因此我们认为肝脏内发生的同种异体刺激抗原的积聚是门静脉耐受中最基本的步骤。这种抗原积聚越多,Kupffer细胞发挥的捕获效应(Trap effection)就越大。这也可解释本实验中输注DSSL、DSBM诱导免疫耐受的强度比DST高,它可使受者的MLR呈特异性下降,这主要是因为T细胞耐受的结果。这种强度的差别也显示出各实验组MLR下降的差异性(P<0.023)。这种受抗原影响的T细胞耐受的强弱,将直接关系到受体对移植物耐受的产生与维持。
, 百拇医药
门静脉耐受对T细胞亚群CD8+的影响还不十分清楚。结果分析,实验组除与CsA对照组存在差异外(P<0.001),其余组间并未显示出统计学差异(P>0.163)。当然,一方面影响T细胞亚群因素较多,难以反映客观情况,此外,随着对T细胞亚群在移植免疫中的功能研究的深入,发现在T细胞亚群如CD4+、CD8+中还存在一些亚类,这些高度分化的细胞群体通过不同的作用机制参与免疫应答[5,6]。如I型CD8+细胞可以抑制TH2 CD4+细胞的免疫应答。Ⅱ型CD8+细胞可以抑制TH1CD4+细胞的免疫反应。但这种抑制产生的确切机制以及是否具有规律性还需进一步深入研究。
总之,肝脏作为特殊免疫器官在免疫耐受中的作用和机制尚不清楚,特别是Kupffer细胞的闭封效应,肝脏的微环境在门静脉耐受形成和维持中所发生的变化和相关机制等问题,还有待于深入研究。
, 百拇医药
①本课题为国家博士点基金资助(C1025)
②上海市第一人民医院泌尿科,上海200085
作者简介:王 佳,男,35岁,讲师,在站博士后,主要从事肾移植和免疫耐受的研究;
指导教师,唐孝达,男,63岁,教授,博士生导师,主要从事器官移植及免疫耐受和临床泌尿系统疾病的研究
4 参考文献
[1] Triger D R M H, Cyhamon R, Wright J et al. Studies on hepatic uptake of antigen comparison of inferior vena cave and protal vein routes of immunization. Immunology, 1973;25:941
, 百拇医药
[2] Qian J H, Hashimoto T, Fujiwara H et al. Studies on the iuduction of tolerance to alloantigens. J Immunology, 1985;134:3656
[3] Desquenne-Clark L, Kimura H, Laji L. Comparsion of the abilities of MHC-compatible bone marrow cells and lymph nobe cells to induce tolerance of skin allografts in rats. Transplantation, 1993;56:390
[4] Callery M P, Mangino M J, Fly M W et al. A biologic basis for limited kupffer cell reactivity to portal derived endotoxin. Surgery, 1991;110:221
[5] 张凤蕴.血中的淋巴细胞亚群是淋巴系统的诊断指标吗?国外医学*免疫学分册,1991;14(6):321
[6] 张凤蕴.免疫调节:CD8+的新功能.国外医学.免疫学分册,1995;18(3):153
〔收稿1997-11-21 修回1998-05-19〕, http://www.100md.com
单位:王佳 卢一平 杨宇如 唐孝达② (华西医科大学附属第一医院泌尿科,成都610041)
关键词:输血;脾细胞;骨髓细胞;门静脉;免疫耐受
中国免疫学杂志/990516 摘 要 目的:探讨供者特异性抗原在诱导免疫耐受中的作用和地位。方法:采用大鼠异位(颈部)心脏移植模型,通过门静脉途径输注不同类型供者特异性抗原。结果:发现供者特异性输血(DST)、供者特异性脾细胞(DSSL)和供者特异性骨髓细胞(DSBM)能诱导受体对供体移植物产生免疫耐受。结论:这类免疫耐受的产生可能与肝脏特殊免疫功能有关;Kupffer细胞可能在其中起重要作用。但门静脉耐受对外周血CD8+细胞的影响不明显。
中国图书分类号 R69
, http://www.100md.com
Study of the donor-specific antigens induce tolerance by portal vein in fusion
WANG Jia, LU Yi-Ping, YANG Yu-Ru et al.
The First Hospital of West China Medical University, Chengdu 610041
Abstract Objective:To find whether the donor specific antigens can induce immunological tolerance. Methods:A rat model of cervical heterotopic cardiac transplantation was established and the different donor antigens were infused through the portal vein. Results:DST,DSSL and DSBM can induce the specific tolerance by the way of portal vein infusion. Conclusion:The immunological tolerance correlated with the special immunological function of the liver. Kupffer's cells may play an important role in inducing allograft tolerance.
, http://www.100md.com
Key words Whole blood Splenocyte Bone marrow Portal vein Tolerance
肝脏和门静脉独特的解剖学位置和结构决定了肝脏具有特殊的免疫功能。近年来,门静脉耐受的研究主要集中在器官移植的运用方面,但关于门静脉耐受的机制仍然不清楚。本文将重点探讨肝脏作为特殊免疫器官在耐受诱导的形成和维持中所发挥的作用和可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康纯系雄性大鼠,供体Wistar,受体SD(华西医科大学实验动物中心,持一级动物生产许可证),体重200~250 g。
1.1.2 实验材料 CsA(Sandoz,瑞士),口服水剂;RPMI 1640(Gibco,美国),Ficoll(pH 7.2,上海试剂二厂);丝裂霉素C 50 mg/ml(Kyoima Hakko CO.Lt,日本);3H-TDR1 mCi/ml(上海原子能研究所);单克隆抗体CD8+(羊抗鼠Sigma,美国)。
, http://www.100md.com
1.2 方法
1.2.1 心脏移植模型 采用颈部异位移植,即供心无名动脉和肺主动脉分别与受体右颈内动脉和右颈外静脉行端端吻合。通过触诊和移植心心电图记录移植物存活和排斥反应发生时间。
1.2.2 刺激抗原的制备
1.2.2.1 全血的制备 无菌取血,各供体开腹经腔静脉采血2 ml,肝素化备用。同时回输生理盐水5 ml。
1.2.2.2 脾细胞悬液制备 无菌取脾。60目不锈钢网碾磨过滤,离心悬液(1 000 r/min),加红细胞溶解液,Hank's液清洗2次。RPMI 1640调整细胞浓度为1×108 ml-1。台盼蓝拒染法判断细胞活性大于90%。
1.2.2.3 骨髓细胞悬液制备 无菌切取供体髂骨和股骨,Hank's平衡液冲洗骨髓腔,离心(1 000 r/min),调整细胞浓度为1×108 ml-1。
, 百拇医药
1.2.2.4 外周血淋巴细胞分离 鼠尾静脉采血1 ml,PBS等倍稀释,加入2 ml Ficoll液面上,离心30 min(1 700 r/min),取淋巴细胞层,PBS洗涤2次。
1.2.3 结果检测
1.2.3.1 混合淋巴细胞反应(MLR) 培养液采用RPMI 1640加10%人体白蛋白。培养瓶加入供受体脾细胞悬液各1 ml(1×108 ml-1),细胞培养液5 ml,适量双抗(青、链霉素)。置于5%CO2孵箱37℃培养6 d,终止培养前12 h,按1×106单个核细胞加1 μCi3H-TDR。由液体闪烁计数仪测定cpm(脉冲数/分)值。
1.2.3.2 外周血T细胞亚群的检测 羊抗鼠CD8+单抗按1∶100效价每份标本加10 μl混合,37℃水浴30 min,加补体20 μl,台盼蓝染色后,计数200个以上淋巴细胞,计算CD8+淋巴细胞亚群的阳性细胞百分率。
, http://www.100md.com
1.2.3.3 移植心T细胞亚群检测 取排斥心脏标本,液氮保存,冰冻切片,丙酮固定10 min,0.3%H2O2甲醇溶液充分水洗30 min,2%血清覆盖组织,置37℃烘箱10 min,直接滴加CD8+抗体(1∶100效价)于组织上。再次孵育30 min,滴加ABC复合物,再经DAB-H2O2显色后裱片。
1.2.3.4 移植心排斥后标本 作病理检查。
1.3 实验分组 采用麻醉下开腹,将不同供者抗原一次性分别注入配对受者门静脉,注射总量为1 ml,细胞悬液浓度为1×108 ml-1共分3个实验组和1个对照组,各组样本量5只。对照组输注等量RPMI 1640液,其余3个实验组抗原种类分别为DST、DSSL和DSBM。环孢素A(CsA)剂量各组均为5 mg/(kg.d),管喂,术前6 d至术后28 d。
, http://www.100md.com
2 结果
2.1 移植物存活时间和混合淋巴细胞反应 见表1、表2。
表1 移植物存活时间
Tab.1 Time of the grafts survival Group
Antigens
Surviral time(day)
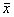 ±s
±s1
CsA
8,13,17,11,14
12.6±3.4
, http://www.100md.com
2
DST+CsA
38,45,30,25,38
35.2±7.8
3
DSST+CsA
55,50,49,48,60
52.4±5.0
4
DSBM+CsA
80,87,76,60,66
73.8±10.8
, 百拇医药
Note:n=5,P<0.004表2 混合淋巴细胞反应(MLR)
Tab.2 The outcome of 4 group mix lymphocyte reaction (MLR) Antigens
n
Time of postoperation
MLR (cpm)
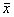 ±s
±sCsA
5
7
9 955,12 310,12 531,9 086
, http://www.100md.com
10 971±1 714
DST+CsA
5
7
9 901,8 714,7 210,7 140,8 039
8 201±1 150
4
21
6 609,6 147,6 540,7 101
6 599±392
DSSL+CsA
, 百拇医药 5
7
8 890,8 901,8 357,8 151,7 454
8 351±600
5
21
4 103,5 008,4 980,5 014,3 940
4 609±540
DSBM+CsA
5
7
7 405,8 151,8 357,7 494,7 005
, 百拇医药
7 682±558
5
21
4 196,3 725,2 866,2 913,3 210
3 382±569
Note:P<0.023
2.2 术后7 d外周血T细胞亚群(CD8+) 检测移植后7 d对照组和实验组T细胞亚群(CD8+)的变化,发现实验组与CsA对照组间存在明显统计学差异(P<0.001),而各实验组间的变化无统计学意义(P>0.163)。
2.3 组织病理学检查 CsA对照组在光镜下大量单核细胞浸润,组织充血水肿,心肌细胞有局灶性变性坏死,呈急性排斥反应表现。实验组则组织病理改变相对较轻,但仍有局灶性炎性细胞浸润。
, 百拇医药
3 讨论
门静脉耐受的概念早在1973年就已提出,继而Qian又证明门静脉注射异基因脾细胞可以诱导供体特异性耐受[1,2]。对于这类耐受的解释目前尚不清楚。Desquenne-Clark等认为是依靠建立一个长期、稳定的嵌合状态[3]。我们采用DST、DSSL、DSBM经门静脉输注,其平均移植物存活时间分别为35.2±7.8 d,52.4±5.0 d和73.8±10.8 d,明显高于对照组。并且以骨髓组诱导效果最好(P<0.004)。这可能是刺激抗原在肝脏内“滞留”,被肝内的某种特殊细胞摄取并处理,将其免疫原性转变为耐受原性形式而在耐受的诱导中发挥作用。Callery研究了肝Kupffer细胞封闭对经门静脉途径单核细胞输注诱导耐受的影响,认为Kupffer细胞对肝脏内刺激抗原的聚积具有特殊效应[4]。因此我们认为肝脏内发生的同种异体刺激抗原的积聚是门静脉耐受中最基本的步骤。这种抗原积聚越多,Kupffer细胞发挥的捕获效应(Trap effection)就越大。这也可解释本实验中输注DSSL、DSBM诱导免疫耐受的强度比DST高,它可使受者的MLR呈特异性下降,这主要是因为T细胞耐受的结果。这种强度的差别也显示出各实验组MLR下降的差异性(P<0.023)。这种受抗原影响的T细胞耐受的强弱,将直接关系到受体对移植物耐受的产生与维持。
, 百拇医药
门静脉耐受对T细胞亚群CD8+的影响还不十分清楚。结果分析,实验组除与CsA对照组存在差异外(P<0.001),其余组间并未显示出统计学差异(P>0.163)。当然,一方面影响T细胞亚群因素较多,难以反映客观情况,此外,随着对T细胞亚群在移植免疫中的功能研究的深入,发现在T细胞亚群如CD4+、CD8+中还存在一些亚类,这些高度分化的细胞群体通过不同的作用机制参与免疫应答[5,6]。如I型CD8+细胞可以抑制TH2 CD4+细胞的免疫应答。Ⅱ型CD8+细胞可以抑制TH1CD4+细胞的免疫反应。但这种抑制产生的确切机制以及是否具有规律性还需进一步深入研究。
总之,肝脏作为特殊免疫器官在免疫耐受中的作用和机制尚不清楚,特别是Kupffer细胞的闭封效应,肝脏的微环境在门静脉耐受形成和维持中所发生的变化和相关机制等问题,还有待于深入研究。
, 百拇医药
①本课题为国家博士点基金资助(C1025)
②上海市第一人民医院泌尿科,上海200085
作者简介:王 佳,男,35岁,讲师,在站博士后,主要从事肾移植和免疫耐受的研究;
指导教师,唐孝达,男,63岁,教授,博士生导师,主要从事器官移植及免疫耐受和临床泌尿系统疾病的研究
4 参考文献
[1] Triger D R M H, Cyhamon R, Wright J et al. Studies on hepatic uptake of antigen comparison of inferior vena cave and protal vein routes of immunization. Immunology, 1973;25:941
, 百拇医药
[2] Qian J H, Hashimoto T, Fujiwara H et al. Studies on the iuduction of tolerance to alloantigens. J Immunology, 1985;134:3656
[3] Desquenne-Clark L, Kimura H, Laji L. Comparsion of the abilities of MHC-compatible bone marrow cells and lymph nobe cells to induce tolerance of skin allografts in rats. Transplantation, 1993;56:390
[4] Callery M P, Mangino M J, Fly M W et al. A biologic basis for limited kupffer cell reactivity to portal derived endotoxin. Surgery, 1991;110:221
[5] 张凤蕴.血中的淋巴细胞亚群是淋巴系统的诊断指标吗?国外医学*免疫学分册,1991;14(6):321
[6] 张凤蕴.免疫调节:CD8+的新功能.国外医学.免疫学分册,1995;18(3):153
〔收稿1997-11-21 修回1998-05-19〕, http://www.100md.com