HIV-1核心蛋白p24在大肠杆菌中的表达与纯化①
作者:王宏伟 金宁一 戴 炜 李体远 郭志儒 殷 震
单位:王宏伟 金宁一 郭志儒 殷 震 (长春农牧大学基因工程实验室,长春 130062);戴 炜 解放军海军总医院,北京 100037;李体远 白求恩医科大学地方病研究所,长春 130021
关键词:原核载体;人免疫缺陷病毒;核心蛋白;纯化
中国免疫学杂志990904 摘 要 目的:探索进一步提高 HIV-1 p24 gag 蛋白在大肠杆菌中的表达效率,增加产物的纯化手段。方法:通过改造原核表达载体 pBV220和 pET28,构建了一种新的通用型温控原核表达载体 pVV5,将 HIV-1 gag 基因的 1 148~1 857 编码序列,插入到 pVV5b 和 pET28b 的相应位点中,构建了重组表达质粒 pEG1b 和 pEG7b,转化到大肠杆菌中进行表达,产物利用 IMAC 金属螯合层析柱进行纯化,纯化的表达产物用 HIV-1 标准阳性血清进行鉴定。结果:构建的重组表达质粒 pEG1b 和 pEG7b 在相应受体菌中表达重组蛋白的量为41%和28%,表达的外源蛋白经 IMAC 柱一步纯化后纯度超过80%,纯化后的重组蛋白可与 HIV-1 阳性血清发生 ELISA 反应。结论:构建的通用型温控原核表达载体可以高效地表达外源蛋白,在大肠杆菌中高效地表达 HIV-1 p24 可用于制备 HIV-1 感染的诊断试剂。
, 百拇医药
中国图书分类号 R373. 9
Expression and purification of the recombinant HIV-1 capsid protein p24 in E.coli
WANG Hong-Wei,JIN Ning-Yi,DAI Wei et al.
Genetic Engineering Laboratory ,University of Agriculture and Animal Sciences , Changchun 130062
Abstract Objective:To resesarch the way of increasing the expression efficiency of HIV-1 p24 gag gene in E.coli and improving the methods for the purification of the recombinant proteins.Methods:New kinds of novel fusion expression vector plasmid pVV5 were designed and construced by the reconstructing plasmid pBV220 and pET28.Two recombinant plasmids pEG1b and pEG7b were obtained by cloning HIV-1 p24 gag gene into the fitable site of pVV5b and pET28,After trasformating and inducing ,the recombinant proteins were expressed in E.coli and purified by IMAC,the purified products were identified by standard HIV-1 positive serum.Results:The expression levels of fusion HIV-1 p24 protein reach 42% and 28% for plsamids pEG1b and pEG7b respectively and the purity of the recombinant p24 was over 80% after purified by IMAC,the purified recombinant p24 proteins could be recognized by sera from HIV-1 seropositive individuals in ELISA.Conclusion:The way of constructing current novel expression vector for high level expression and purificating target protein was reasonable and the novel expression vector pVV5 as well as the expressed recombinant HIV-1 p24 provided a cheaper and efficient way for the production of HIV-1 diagnose reagents.
, 百拇医药
Key words Novel vector HIV-1 Capsid protein Purification
人I型免疫缺陷病毒(HIV-1)是导致人获得性免疫缺陷综合征的主要病原。目前对HIV-1感染的诊断,临床上的方法主要是通过检测患者血清或血浆中的特异性抗体水平,所检测的指标包括HIV-1 env基因的编码产物,包括外膜蛋白gp120,跨膜蛋白gp41和gag基因的编码产物,包括核心蛋白p24和基质蛋白p17等[1]。 病毒的核心蛋白(Capsid protein,CA)p24形成病毒粒子的疏水性衣壳,为构成病毒核心结构的主要蛋白。由于p24在病毒粒子中含量丰富(一般约占1 200个拷贝) [2],其序列在不同的毒株间相对保守,并且其引发的p24抗体水平可作为判断HIV感染和AIDS病情发展的间接指标,因此,p24在AIDS的研究与HIV-1感染诊断中占有重要地位。本研究通过自建通用型高效原核表达载体,在大肠杆菌中表达了重组p24,并对其进行了初步纯化、鉴定,对于AIDS的诊断,预防工作具有十分重要的意义。
, http://www.100md.com
1 材料与方法
1.1 菌株与质粒 质粒pET17-24由本室构建,含HIV-1 gag基因nt680-nt1857。质粒pBV220由中国预防医学科学院病毒所惠赠[3]。质粒pET28b,大肠杆菌BL21(DE3)plyss,HMS174(DE3)购自Novagen公司,大肠杆菌HB101,DH5α为本室保存菌株。
1.2 所用试剂与工具酶 Ni-NTA Agarose为德国QIAGEN公司产品,IpTG、尿素、NBT、BCIP为德国Boehringer Mannheim公司产品,p24单克隆抗体为本室制备,HIV-1标准阳性血清由中国预防医学科学院病毒所邵一鸣教授惠赠。
1.3 表达质粒的构建 有关的DNA操作参见《分子克隆》[4]。
1.4 工程菌的培养及诱导 重组质粒pBG-1b分别转化E.coli BL21、BL21(DE3)、 BL21(DE3)plyss、HMS174(DE3),于LB培养基中,于37℃振荡培养至OD600为0.8时,加入IPTG至终浓度1 mmol/L,诱导3~4 h 后收菌;重组质粒pBG-7b转化E.coli DH5α,于LB液培养基中于30℃振摇培养至OD600为0.45~0.60时,42℃诱导培养5~6 h,离心收菌,上SDS-PAGE,分析表达量。
, 百拇医药
1.5 SDS-PAGE和Western-blot 操作方法参见文献[5]。
1.6 重组蛋白的纯化
1.6.1 菌体的裂解与重组蛋白的存在形式分析[6] 将温控诱导后的菌体按1/100培养基体积重悬于buffer A(50 mmol/L NaH2P4,pH 8.0;300 mmol/L NaCl;10 mmol/L imidazole)中,加入溶菌酶至终浓度1 mg/ml,超声破碎后,离心,分别收集上清和沉淀,进行SDS-PAGE,用考马斯亮蓝R-250 染色,分析重组蛋白的存在形式。
1.6.2 上清中重组蛋白的纯化 将温控诱导后的菌体(含重组质粒pVG7b的受体菌DH5a)按1/100培养基体积重悬于buffer A中,超声破碎,离心,分离包涵体和上清,包涵体经buffer B(10 mmol/L Tris.Cl 100 mmol/L NaH2PO4,8 mol/L Orea,pH 8.0)中变性后,将混合物注入平衡好的微型层析柱,用不同PH值的buffer进行洗脱,上清中的重组蛋白用含有不同咪唑浓度的buffer进行洗脱,分步收集各洗脱液,取样后上SDS-PAGE观察重组蛋白纯度。
, http://www.100md.com
1.7 间接ELISA 将纯化的表达产物包被ELISA板,与不同HIV-1阳性血清进行间接ELISA反应。
2 结 果
2.1 温控型表达载体pVV5b的构建 对质粒pET28a/b、c,和质粒pBV220分别用 sty I酶、EcoRI酶进行酶切,经补平,连接后,构建了重组质粒pBE-4a/b、c,后者经 Sal I酶切除多余片段后,自身环化,构建了重组质粒pVV5a/b、c。从质粒pEG1b中,再调出p24 gag基因,定向克隆到质粒pVV5b中,构建了重组质粒pEG7b。
2.2 p24 gag蛋白的诱导表达 将含质粒pEG1b、pBG7b的工程菌经诱导表达后进行SDS-PAGE。均可见在30 kD处出现特异表达带。进一步分析发现表达产物大多数是以包涵体的形式存在(图1,表1)。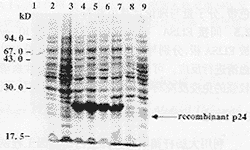
, http://www.100md.com
图1 重组p24蛋白的表达
Fig.1 SDS-PAGE analysis of expressed product
Note:Lane 1. Protein of standard molecular weights;Lane 2. E.coli BL21(DE3) containing pET28b plasmid induced with IPTG for 3 hours;Lane 3.E.coli BL21 containing pEG1b plasmid induced with IPTG for 3 hours;Lane 4.E.coli BL21(DE3) containing pEG1b plasmid induced with IPTG for 3 hours;Lane 5.E.coli BL21(DE3)plyss containing pEG1b plasmid induced with IPTG for 3 hours;Lane 6.E.coli HMS174(DE3) containing pEG1b plasmid induced with IPTG for 3 hours;Lane 7.E.coli DH5α containing pEG7b plasmid induced with 42℃ for 6 hours;Lane 8.E.coli DH5α containing pVV5b plasmid ininduced with 42℃ for 6 hours;Lane 9.E.coli DH5α containing pBV220 plasmid induced with 42℃ for 6 hours
, 百拇医药
表1 重组p24蛋白的表达量分析
Tab.1 The expression level analysis of recombinant p24 protein Recombinant plasmid
Strain
Expression level(%)
PEG1b
BL21
0
PEG1b
BL21(DE3)
40
, 百拇医药
PEG1b
BL21(DE3)plyss
42
PEG1b
HMS-174(DE3)
37
PBG7b
DH5a
28
2.3 表达产物的纯化 包涵体中的重组p24蛋白经一步IMAC金属螯合层析后纯度可达80%(图2)。
, http://www.100md.com
图2 包涵体中的重组蛋白的纯化
Fig.2 SDS-PAGE analysis of purified recombinant protein from inclusion bodies
Note:Lane 1. Induced E.coli DH5α containing pEG7b;Lane 2. Inclusion bodies;Lane 3. Result of the first washing procedure;Lane 4. Result of the second washing procedure
2.4 Western-blot分析 可见30 kD处出现一明显色带,分子量与理论计算值相符合。
2.5 间接ELISA 将纯化的表达产物按10 μg/孔包被ELISA板,分别与2份HIV阳性血清2份HIV阴性血清进行反应。可见该抗原可与HIV阳性血清发生较强的免疫反应而与HIV阴性血清的反应较弱。
, 百拇医药
3 讨 论
利用大肠杆菌表达异源蛋白是基因工程制药的一个重要途径,在原核表达载体pVV的构建过程中,我们保留了原来pET载体上的His-Tag和T7-Tag的多肽标签,His-Tag是6个串联组氨酸的小肽,当表达的外源基因产物的N端融合有His-tag的多肽标签时,该表达产物可直接利用IMAC固定化金属螯合层析柱对其进行纯化,T7-Tag是编码T7噬菌体基因10蛋白N端的11个aa的多肽,将其融合于外源基因产物的表达过程中,T7-tag的存在可以使外源基因表达水平提高40倍以上[6]。虽然携带有His-Tag的融合蛋白不适用于作为制备免疫用试剂,但是由于pVV载体中存在的苏氨酸蛋白酶切位点可用于作为对表达产物中的His-Tag的切除,以完成对表达的外源蛋白的加工修饰。
本实验中我们利用pVV载体在大肠杆菌中成功地高效表达了HIV-1 p24蛋白,表达产物具有良好的反应原性,可以特异性地与HIV-1标准阳性血清发生反应,因此可以用来作为HIV-1感染诊断试剂盒的原料,由于血液是HIV-1传播的主要途径之一,因此利用基因工程重组p24蛋白加强对血清样品的监测,对于控制HIV-1的传播具有十分重要的现实意义[7]。
, http://www.100md.com
①国家自然科学基金资助项目(基金批准号 39770661)
作者简介:王宏伟,男,26岁,病毒学专业硕士生,主要研究HIV-1分子生物学;
指导教师,殷 震,中国工程院院士,博士生导师,主要研究分子病毒学
4 参考文献
1 Veronese F,Copeland T,Draszlan S et al. Biochemical and immunological analysis of human immunodeficiency virus gag gene products p17 and p24.J Virol,1988; 62: 795
2 Ellinger I,Mach M ,Korn K et al.Cleavage and purification of prokaryotically expressed HIV gag and Env fusion proteins for detection of HIV antibodies in the ELISA.Virology,1991;180:811
, 百拇医药
3 张智清,姚立红,侯云德.含prpl启动子的原核高效表达载体的组建及其应用.病毒学报,1990;6(2):111
4 Sambrook J,Fritsch E F,Maniatis T et al.Molecular cloning: A laboratory manul .2nd ed.New York:Cold spring harbor laboratory press,1989:34-55
5 Daniel M,Bouag S,Edelstein J. Protein Methods.New York: A John Wiley & Son INC publication,1991:181-204
6 Olins P O C S,Devine S.Kavka:The T7 phage gene 10 leader RNA,a ribosome-binding site that dramatically enhances the expression of foreign genes in Escherichia coli.Gene,1988;73:227
7 Chargelegue D A.7-Year analysis of anti-gag (p17 and p24) antibodies in HIV-1 seropositine patient with haemophilin immunlglobulin G titre and activity are early predictor of clinical arouse. AIDS,1993;7:87
〔收稿日期:1998-02-06 修稿日期:1999-04-01〕, http://www.100md.com
单位:王宏伟 金宁一 郭志儒 殷 震 (长春农牧大学基因工程实验室,长春 130062);戴 炜 解放军海军总医院,北京 100037;李体远 白求恩医科大学地方病研究所,长春 130021
关键词:原核载体;人免疫缺陷病毒;核心蛋白;纯化
中国免疫学杂志990904 摘 要 目的:探索进一步提高 HIV-1 p24 gag 蛋白在大肠杆菌中的表达效率,增加产物的纯化手段。方法:通过改造原核表达载体 pBV220和 pET28,构建了一种新的通用型温控原核表达载体 pVV5,将 HIV-1 gag 基因的 1 148~1 857 编码序列,插入到 pVV5b 和 pET28b 的相应位点中,构建了重组表达质粒 pEG1b 和 pEG7b,转化到大肠杆菌中进行表达,产物利用 IMAC 金属螯合层析柱进行纯化,纯化的表达产物用 HIV-1 标准阳性血清进行鉴定。结果:构建的重组表达质粒 pEG1b 和 pEG7b 在相应受体菌中表达重组蛋白的量为41%和28%,表达的外源蛋白经 IMAC 柱一步纯化后纯度超过80%,纯化后的重组蛋白可与 HIV-1 阳性血清发生 ELISA 反应。结论:构建的通用型温控原核表达载体可以高效地表达外源蛋白,在大肠杆菌中高效地表达 HIV-1 p24 可用于制备 HIV-1 感染的诊断试剂。
, 百拇医药
中国图书分类号 R373. 9
Expression and purification of the recombinant HIV-1 capsid protein p24 in E.coli
WANG Hong-Wei,JIN Ning-Yi,DAI Wei et al.
Genetic Engineering Laboratory ,University of Agriculture and Animal Sciences , Changchun 130062
Abstract Objective:To resesarch the way of increasing the expression efficiency of HIV-1 p24 gag gene in E.coli and improving the methods for the purification of the recombinant proteins.Methods:New kinds of novel fusion expression vector plasmid pVV5 were designed and construced by the reconstructing plasmid pBV220 and pET28.Two recombinant plasmids pEG1b and pEG7b were obtained by cloning HIV-1 p24 gag gene into the fitable site of pVV5b and pET28,After trasformating and inducing ,the recombinant proteins were expressed in E.coli and purified by IMAC,the purified products were identified by standard HIV-1 positive serum.Results:The expression levels of fusion HIV-1 p24 protein reach 42% and 28% for plsamids pEG1b and pEG7b respectively and the purity of the recombinant p24 was over 80% after purified by IMAC,the purified recombinant p24 proteins could be recognized by sera from HIV-1 seropositive individuals in ELISA.Conclusion:The way of constructing current novel expression vector for high level expression and purificating target protein was reasonable and the novel expression vector pVV5 as well as the expressed recombinant HIV-1 p24 provided a cheaper and efficient way for the production of HIV-1 diagnose reagents.
, 百拇医药
Key words Novel vector HIV-1 Capsid protein Purification
人I型免疫缺陷病毒(HIV-1)是导致人获得性免疫缺陷综合征的主要病原。目前对HIV-1感染的诊断,临床上的方法主要是通过检测患者血清或血浆中的特异性抗体水平,所检测的指标包括HIV-1 env基因的编码产物,包括外膜蛋白gp120,跨膜蛋白gp41和gag基因的编码产物,包括核心蛋白p24和基质蛋白p17等[1]。 病毒的核心蛋白(Capsid protein,CA)p24形成病毒粒子的疏水性衣壳,为构成病毒核心结构的主要蛋白。由于p24在病毒粒子中含量丰富(一般约占1 200个拷贝) [2],其序列在不同的毒株间相对保守,并且其引发的p24抗体水平可作为判断HIV感染和AIDS病情发展的间接指标,因此,p24在AIDS的研究与HIV-1感染诊断中占有重要地位。本研究通过自建通用型高效原核表达载体,在大肠杆菌中表达了重组p24,并对其进行了初步纯化、鉴定,对于AIDS的诊断,预防工作具有十分重要的意义。
, http://www.100md.com
1 材料与方法
1.1 菌株与质粒 质粒pET17-24由本室构建,含HIV-1 gag基因nt680-nt1857。质粒pBV220由中国预防医学科学院病毒所惠赠[3]。质粒pET28b,大肠杆菌BL21(DE3)plyss,HMS174(DE3)购自Novagen公司,大肠杆菌HB101,DH5α为本室保存菌株。
1.2 所用试剂与工具酶 Ni-NTA Agarose为德国QIAGEN公司产品,IpTG、尿素、NBT、BCIP为德国Boehringer Mannheim公司产品,p24单克隆抗体为本室制备,HIV-1标准阳性血清由中国预防医学科学院病毒所邵一鸣教授惠赠。
1.3 表达质粒的构建 有关的DNA操作参见《分子克隆》[4]。
1.4 工程菌的培养及诱导 重组质粒pBG-1b分别转化E.coli BL21、BL21(DE3)、 BL21(DE3)plyss、HMS174(DE3),于LB培养基中,于37℃振荡培养至OD600为0.8时,加入IPTG至终浓度1 mmol/L,诱导3~4 h 后收菌;重组质粒pBG-7b转化E.coli DH5α,于LB液培养基中于30℃振摇培养至OD600为0.45~0.60时,42℃诱导培养5~6 h,离心收菌,上SDS-PAGE,分析表达量。
, 百拇医药
1.5 SDS-PAGE和Western-blot 操作方法参见文献[5]。
1.6 重组蛋白的纯化
1.6.1 菌体的裂解与重组蛋白的存在形式分析[6] 将温控诱导后的菌体按1/100培养基体积重悬于buffer A(50 mmol/L NaH2P4,pH 8.0;300 mmol/L NaCl;10 mmol/L imidazole)中,加入溶菌酶至终浓度1 mg/ml,超声破碎后,离心,分别收集上清和沉淀,进行SDS-PAGE,用考马斯亮蓝R-250 染色,分析重组蛋白的存在形式。
1.6.2 上清中重组蛋白的纯化 将温控诱导后的菌体(含重组质粒pVG7b的受体菌DH5a)按1/100培养基体积重悬于buffer A中,超声破碎,离心,分离包涵体和上清,包涵体经buffer B(10 mmol/L Tris.Cl 100 mmol/L NaH2PO4,8 mol/L Orea,pH 8.0)中变性后,将混合物注入平衡好的微型层析柱,用不同PH值的buffer进行洗脱,上清中的重组蛋白用含有不同咪唑浓度的buffer进行洗脱,分步收集各洗脱液,取样后上SDS-PAGE观察重组蛋白纯度。
, http://www.100md.com
1.7 间接ELISA 将纯化的表达产物包被ELISA板,与不同HIV-1阳性血清进行间接ELISA反应。
2 结 果
2.1 温控型表达载体pVV5b的构建 对质粒pET28a/b、c,和质粒pBV220分别用 sty I酶、EcoRI酶进行酶切,经补平,连接后,构建了重组质粒pBE-4a/b、c,后者经 Sal I酶切除多余片段后,自身环化,构建了重组质粒pVV5a/b、c。从质粒pEG1b中,再调出p24 gag基因,定向克隆到质粒pVV5b中,构建了重组质粒pEG7b。
2.2 p24 gag蛋白的诱导表达 将含质粒pEG1b、pBG7b的工程菌经诱导表达后进行SDS-PAGE。均可见在30 kD处出现特异表达带。进一步分析发现表达产物大多数是以包涵体的形式存在(图1,表1)。

, http://www.100md.com
图1 重组p24蛋白的表达
Fig.1 SDS-PAGE analysis of expressed product
Note:Lane 1. Protein of standard molecular weights;Lane 2. E.coli BL21(DE3) containing pET28b plasmid induced with IPTG for 3 hours;Lane 3.E.coli BL21 containing pEG1b plasmid induced with IPTG for 3 hours;Lane 4.E.coli BL21(DE3) containing pEG1b plasmid induced with IPTG for 3 hours;Lane 5.E.coli BL21(DE3)plyss containing pEG1b plasmid induced with IPTG for 3 hours;Lane 6.E.coli HMS174(DE3) containing pEG1b plasmid induced with IPTG for 3 hours;Lane 7.E.coli DH5α containing pEG7b plasmid induced with 42℃ for 6 hours;Lane 8.E.coli DH5α containing pVV5b plasmid ininduced with 42℃ for 6 hours;Lane 9.E.coli DH5α containing pBV220 plasmid induced with 42℃ for 6 hours
, 百拇医药
表1 重组p24蛋白的表达量分析
Tab.1 The expression level analysis of recombinant p24 protein Recombinant plasmid
Strain
Expression level(%)
PEG1b
BL21
0
PEG1b
BL21(DE3)
40
, 百拇医药
PEG1b
BL21(DE3)plyss
42
PEG1b
HMS-174(DE3)
37
PBG7b
DH5a
28
2.3 表达产物的纯化 包涵体中的重组p24蛋白经一步IMAC金属螯合层析后纯度可达80%(图2)。

, http://www.100md.com
图2 包涵体中的重组蛋白的纯化
Fig.2 SDS-PAGE analysis of purified recombinant protein from inclusion bodies
Note:Lane 1. Induced E.coli DH5α containing pEG7b;Lane 2. Inclusion bodies;Lane 3. Result of the first washing procedure;Lane 4. Result of the second washing procedure
2.4 Western-blot分析 可见30 kD处出现一明显色带,分子量与理论计算值相符合。
2.5 间接ELISA 将纯化的表达产物按10 μg/孔包被ELISA板,分别与2份HIV阳性血清2份HIV阴性血清进行反应。可见该抗原可与HIV阳性血清发生较强的免疫反应而与HIV阴性血清的反应较弱。
, 百拇医药
3 讨 论
利用大肠杆菌表达异源蛋白是基因工程制药的一个重要途径,在原核表达载体pVV的构建过程中,我们保留了原来pET载体上的His-Tag和T7-Tag的多肽标签,His-Tag是6个串联组氨酸的小肽,当表达的外源基因产物的N端融合有His-tag的多肽标签时,该表达产物可直接利用IMAC固定化金属螯合层析柱对其进行纯化,T7-Tag是编码T7噬菌体基因10蛋白N端的11个aa的多肽,将其融合于外源基因产物的表达过程中,T7-tag的存在可以使外源基因表达水平提高40倍以上[6]。虽然携带有His-Tag的融合蛋白不适用于作为制备免疫用试剂,但是由于pVV载体中存在的苏氨酸蛋白酶切位点可用于作为对表达产物中的His-Tag的切除,以完成对表达的外源蛋白的加工修饰。
本实验中我们利用pVV载体在大肠杆菌中成功地高效表达了HIV-1 p24蛋白,表达产物具有良好的反应原性,可以特异性地与HIV-1标准阳性血清发生反应,因此可以用来作为HIV-1感染诊断试剂盒的原料,由于血液是HIV-1传播的主要途径之一,因此利用基因工程重组p24蛋白加强对血清样品的监测,对于控制HIV-1的传播具有十分重要的现实意义[7]。
, http://www.100md.com
①国家自然科学基金资助项目(基金批准号 39770661)
作者简介:王宏伟,男,26岁,病毒学专业硕士生,主要研究HIV-1分子生物学;
指导教师,殷 震,中国工程院院士,博士生导师,主要研究分子病毒学
4 参考文献
1 Veronese F,Copeland T,Draszlan S et al. Biochemical and immunological analysis of human immunodeficiency virus gag gene products p17 and p24.J Virol,1988; 62: 795
2 Ellinger I,Mach M ,Korn K et al.Cleavage and purification of prokaryotically expressed HIV gag and Env fusion proteins for detection of HIV antibodies in the ELISA.Virology,1991;180:811
, 百拇医药
3 张智清,姚立红,侯云德.含prpl启动子的原核高效表达载体的组建及其应用.病毒学报,1990;6(2):111
4 Sambrook J,Fritsch E F,Maniatis T et al.Molecular cloning: A laboratory manul .2nd ed.New York:Cold spring harbor laboratory press,1989:34-55
5 Daniel M,Bouag S,Edelstein J. Protein Methods.New York: A John Wiley & Son INC publication,1991:181-204
6 Olins P O C S,Devine S.Kavka:The T7 phage gene 10 leader RNA,a ribosome-binding site that dramatically enhances the expression of foreign genes in Escherichia coli.Gene,1988;73:227
7 Chargelegue D A.7-Year analysis of anti-gag (p17 and p24) antibodies in HIV-1 seropositine patient with haemophilin immunlglobulin G titre and activity are early predictor of clinical arouse. AIDS,1993;7:87
〔收稿日期:1998-02-06 修稿日期:1999-04-01〕, http://www.100md.com