转基因小鼠肝癌细胞株的建立及生物学特性研究①
作者:吴震宇 陈诗书
单位:陈诗书 上海第二医科大学人类基因治疗研究中心,上海 200025;吴震宇 中国科学院上海生物化学研究所,上海 200031
关键词:小鼠γ-干扰素;肝癌细胞;逆转录病毒载体;MHC II类抗原;致瘤性
中国免疫学杂志991103 中国图书分类号 R392.11 R73.3
摘 要 目的:将细胞因子基因尽快应用于临床基因治疗。方法:用逆转录病毒载体pLXSN将小鼠γ-干扰素基因(mIFN-γ)导入小鼠肝癌细胞株,建立了转基因的肝癌细胞株H22-mIFN-γ,对该细胞株的生长、形态结构、DNA含量及细胞周期的变化、γ-干扰素的分泌、细胞的免疫原性及致瘤性等生物学特性进行了研究。结果:发现该株细胞的生长、形态结构、DNA含量及细胞周期均无明显改变,细胞能分泌一定活性的γ-干扰素,MHC II类抗原的表达量增加,细胞致瘤性明显下降。结论:为进一步开展异体乃至自体瘤苗进行基因治疗创造了条件。
, 百拇医药
The construction of transgene mouse hepatoma cell line and study
on biological characteristics
WU Zhen-Yu,CHEN Shi-Shu
Research Center for Human Gene Therapy, Shanghai Second Medical University, Shanghai 200025
Abstract Objective:In order to apply cytokines to clinical gene therapy earlier.Methods:Transduced mouse interferon-γ(mIFN-γ)gene into mouse hepatoma cell line H22 with retroviral vector LXSN. Results:There were no obvious changes in cell morphology,cell growth,cell cycle and DNA content of mIFN-γ gene modified cells.MHC Ⅱ antigen expression had increased in H22-mIFN-γ cell by indirect fluorometry and the tumorigenicity decreased significantly in H22-mIFN-γ cells.Conclusion:The transduction of mIFN-γ gene can increase the immunogenicity of hapatoma cells,which is the base of application of tumor vaccine to clinical gene therapy.
, 百拇医药
Key words Mouse interferon-γ Hepatoma cell Retroviral vector MHC II antigen Tumorigenicity
γ-干扰素以其独特的抗肿瘤特性一直深受人们的重视,随着基因治疗研究工作的不断深入,将包括γ-干扰素在内的众多细胞因子作为目的基因导入肿瘤细胞进行自体或异体转基因瘤苗的研究及基因治疗,这方面已开展了大量的工作[1]。肝癌在我国属于高发病症,其死亡率在各种恶性肿瘤的发病率中排列第二[2],我们用逆转录病毒载体将小鼠γ-干扰素基因导入小鼠肝癌细胞并对其生物学特征进行了研究,希望能为找到将γ-干扰素基因用于细胞因子基因治疗的新方法打下一定基础。
1 材料与方法
1.1 主要试剂和材料 小鼠γ-干扰素标准品(Sigma);FITC标记的兔抗大鼠免疫球蛋白(北医大);H-2 II类大鼠抗小鼠单抗(二军大);LIPOFECTAMINE(GIbco);pLXSN由Miller博士提供;PA317、H22细胞由本室传代保存。
, 百拇医药
1.2 包装体系PA317-mIFN-γ的建立 pL(mIFN-γ)SN由本室构建(另文发表),按LIPOFECTAMINE操作手册转染包装细胞PA317、G418筛选,得到PA317-mIFN-γ细胞,以pLXSN作空白转染,按文献[3]进行病毒滴度的测定。
1.3 转基因小鼠肝癌细胞H22-mIFN-γ的建立 用PA317-mIFN-γ细胞病毒上清(病毒滴度为2×105 CFU/ml)感染H22细胞,G418筛选,得到H22-mIFN-γ细胞。空白载体病毒上清作对照(得H22-LXSN)。
1.4 细胞形态的观察和生长曲线的测定 取对数生长期H22、H22-LXSN、H22-mIFN-γ细胞,用光学显微镜、透射电镜、扫描电镜对其外部形态和内部结构进行了观察并对细胞的生长曲线进行了测定[4]。
1.5 细胞DNA含量和细胞周期的测定 用流式细胞仪测定细胞各期DNA的含量。
, 百拇医药
1.6 γ-干扰素生物活性的测定 按文献[5]进行。
1.7 间接荧光法测定H-2 II类抗原的表达 用大鼠抗小鼠H-2 Ia单抗作为一抗,FITC标记的兔抗大鼠免疫球蛋白为二抗,用流式细胞仪进行测定。
1.8 细胞致瘤性的测定 按文献[4]进行。
2 结果
2.1 转基因小鼠肝癌细胞H22-mIFN-γ的建立 用病毒上清感染H22细胞,经G418筛选得到阳性克隆,感染率为50%~70%。用PCR方法检测转基因细胞中mIFN-γ (465bp)和选择标记基因NeoR (790bp)的存在,结果证实了mIFN-γ基因的转入(图1)。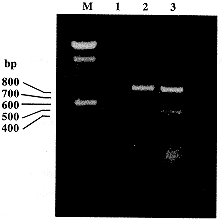
, 百拇医药 图1 基因修饰前后H22细胞基因组DNA的PCR检测
Fig.1 PCR analysis of H22 cell modified by mIFN-γ gene
Note:M. 100 bp DNA ladder marker;1,2,3. H22, H22-LXSN,H22-mIFN-γ + mIFN-γ/NeoR primer
2.2 细胞形态和生长情况的观察 从光镜和电镜的观察结果来看,转基因前后细胞的外部形态和内部结构均无明显变化,细胞的生长曲线也比较一致(图2)。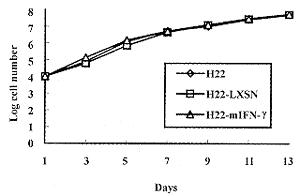
图2 细胞生长曲线
Fig.2 The growth curve of cell
, 百拇医药
2.3 细胞DNA含量和细胞周期的测定 经测定,细胞DNA含量和细胞周期无明显改变(表1)。
图3 mIFN-γ基因修饰前后肿瘤细胞在动物体内的生长曲线
Fig.3 The growth curve of mIFN-γ gene modified tumor cell in experimental animals
2.4 γ-干扰素生物活性的测定 经测定,细胞培养上清中有一定活性的γ-干扰素分泌,在6~48 U之间,连续传代发现该细胞能持续分泌一段时间,各克隆间有一定的差异(数据未列出)。
2.5 MHC II类抗原的表达测定 在H22-mIFN-γ细胞中,部分克隆的表达量有明显增加,其细胞阳性率和阳性峰平均倒数均有不同程度的增加,但在部分克隆中没有观察到表达量增加的现象(表2)。
, 百拇医药
2.6 转基因细胞的体内致瘤性结果 从图3中可以看出,转γ-干扰素基因细胞组动物肿瘤潜伏期延长,肿瘤生长缓慢,另外,动物的成活期明显延长。
表1 细胞周期测定结果
Tab.1 The determination result of cell cycle Cell
G1/G0
S
G2+M
H22
16.5
63.5
, 百拇医药
20.0
H22-LXSN
21.0
61.0
17.0
H22-mIFN-γ
10.4
71.2
18.4
表2 基因修饰前后H22细胞H-2 II类抗原表达的测定结果
Tab.2 H-2 II antigen expression in modified H22 cell
, 百拇医药
Negative control
H22
H22-LXSN
H22-mIFN-γ
Clone 1
Clone 4
Clone 7
Clone 10
Positive rate of H-2
2.04
10.58
11.82
, http://www.100md.com
19.90
26.10
15.66
3.83
8.80
Average reciprocal of positive peak
12.35
12.90
20.01
52.83
57.94
34.08
, 百拇医药
23.45
23.70
3 讨论
肝癌作为一种全球性的疾病,对其致病机制和防治手段的探索一直是人们研究的热点。传统的放疗、化疗和外科切除术是目前主要的治疗手段,但疗效不甚理想且有一定毒副作用,其应用受到一定限制,而基因治疗的兴起为最终解决这一难题带来了希望,如可以用转基因瘤苗增强机体的特异免疫反应以达到防治的目的。但目前应用自身瘤苗还有一定的难度,所以我们首先选用肝癌细胞株进行转基因试验,对转基因后细胞的生物学特性进行了研究。我们发现,外源γ-干扰素基因的导入并不会改变肿瘤细胞的生长行为,细胞形态也无明显变化,细胞能稳定表达外源基因;γ-干扰素基因修饰后细胞的免疫原性有所增加,表现在细胞表面MHC II类抗原的表达量增加,另外,基因修饰后肿瘤细胞的致瘤性也下降了,这为进一步开展异体乃至自体瘤苗进行基因治疗创造了条件。
, http://www.100md.com 在我们的试验中,各个细胞克隆间γ-干扰素的分泌活性有高有低,MHC II类抗原的表达量也有较大差异,这可能与外源基因的插入后整合的位置、方向等不同有关,同时可以看出,基因治疗过程中如何将外源基因进行定点整合依然是一个亟待解决的问题。
①国家‘863’高科技(No.Z-20-01-04)及国家自然科学基金(No.39600177)资助项目
作者简介:吴震宇,男,31岁,硕士;
陈诗书,男,教授,博士生导师,主要研究分子生物学
4 参考文献
1 Human gene marker/therapy clinical protocols. Hum Gen Ther, 1996; 7 (4): 567
, 百拇医药
2 李连第,张思维,鲁凤珠 et al. 中国恶性肿瘤死亡谱及分类构成特征研究. 中华肿瘤杂志, 1997; 19 (5): 323
3 胡 亮, 钱关祥, 沈文红 et al. PA317产生高滴度人TNF-α基因逆转录病毒的研究. 中国肿瘤生物治疗杂志, 1995; 2 (3): 235
4 吴震宇,陈诗书. 小鼠γ-干扰素基因修饰瘤苗的抗肿瘤研究. 中国肿瘤生物治疗杂志, 1998; 5 (2): 90
5 侯 健,王东星,胥军民. 人类细胞因子手册. 上海: 同济大学出版社, 1996: 25-26
收稿1998-08-14 修回1998-11-02, 百拇医药
单位:陈诗书 上海第二医科大学人类基因治疗研究中心,上海 200025;吴震宇 中国科学院上海生物化学研究所,上海 200031
关键词:小鼠γ-干扰素;肝癌细胞;逆转录病毒载体;MHC II类抗原;致瘤性
中国免疫学杂志991103 中国图书分类号 R392.11 R73.3
摘 要 目的:将细胞因子基因尽快应用于临床基因治疗。方法:用逆转录病毒载体pLXSN将小鼠γ-干扰素基因(mIFN-γ)导入小鼠肝癌细胞株,建立了转基因的肝癌细胞株H22-mIFN-γ,对该细胞株的生长、形态结构、DNA含量及细胞周期的变化、γ-干扰素的分泌、细胞的免疫原性及致瘤性等生物学特性进行了研究。结果:发现该株细胞的生长、形态结构、DNA含量及细胞周期均无明显改变,细胞能分泌一定活性的γ-干扰素,MHC II类抗原的表达量增加,细胞致瘤性明显下降。结论:为进一步开展异体乃至自体瘤苗进行基因治疗创造了条件。
, 百拇医药
The construction of transgene mouse hepatoma cell line and study
on biological characteristics
WU Zhen-Yu,CHEN Shi-Shu
Research Center for Human Gene Therapy, Shanghai Second Medical University, Shanghai 200025
Abstract Objective:In order to apply cytokines to clinical gene therapy earlier.Methods:Transduced mouse interferon-γ(mIFN-γ)gene into mouse hepatoma cell line H22 with retroviral vector LXSN. Results:There were no obvious changes in cell morphology,cell growth,cell cycle and DNA content of mIFN-γ gene modified cells.MHC Ⅱ antigen expression had increased in H22-mIFN-γ cell by indirect fluorometry and the tumorigenicity decreased significantly in H22-mIFN-γ cells.Conclusion:The transduction of mIFN-γ gene can increase the immunogenicity of hapatoma cells,which is the base of application of tumor vaccine to clinical gene therapy.
, 百拇医药
Key words Mouse interferon-γ Hepatoma cell Retroviral vector MHC II antigen Tumorigenicity
γ-干扰素以其独特的抗肿瘤特性一直深受人们的重视,随着基因治疗研究工作的不断深入,将包括γ-干扰素在内的众多细胞因子作为目的基因导入肿瘤细胞进行自体或异体转基因瘤苗的研究及基因治疗,这方面已开展了大量的工作[1]。肝癌在我国属于高发病症,其死亡率在各种恶性肿瘤的发病率中排列第二[2],我们用逆转录病毒载体将小鼠γ-干扰素基因导入小鼠肝癌细胞并对其生物学特征进行了研究,希望能为找到将γ-干扰素基因用于细胞因子基因治疗的新方法打下一定基础。
1 材料与方法
1.1 主要试剂和材料 小鼠γ-干扰素标准品(Sigma);FITC标记的兔抗大鼠免疫球蛋白(北医大);H-2 II类大鼠抗小鼠单抗(二军大);LIPOFECTAMINE(GIbco);pLXSN由Miller博士提供;PA317、H22细胞由本室传代保存。
, 百拇医药
1.2 包装体系PA317-mIFN-γ的建立 pL(mIFN-γ)SN由本室构建(另文发表),按LIPOFECTAMINE操作手册转染包装细胞PA317、G418筛选,得到PA317-mIFN-γ细胞,以pLXSN作空白转染,按文献[3]进行病毒滴度的测定。
1.3 转基因小鼠肝癌细胞H22-mIFN-γ的建立 用PA317-mIFN-γ细胞病毒上清(病毒滴度为2×105 CFU/ml)感染H22细胞,G418筛选,得到H22-mIFN-γ细胞。空白载体病毒上清作对照(得H22-LXSN)。
1.4 细胞形态的观察和生长曲线的测定 取对数生长期H22、H22-LXSN、H22-mIFN-γ细胞,用光学显微镜、透射电镜、扫描电镜对其外部形态和内部结构进行了观察并对细胞的生长曲线进行了测定[4]。
1.5 细胞DNA含量和细胞周期的测定 用流式细胞仪测定细胞各期DNA的含量。
, 百拇医药
1.6 γ-干扰素生物活性的测定 按文献[5]进行。
1.7 间接荧光法测定H-2 II类抗原的表达 用大鼠抗小鼠H-2 Ia单抗作为一抗,FITC标记的兔抗大鼠免疫球蛋白为二抗,用流式细胞仪进行测定。
1.8 细胞致瘤性的测定 按文献[4]进行。
2 结果
2.1 转基因小鼠肝癌细胞H22-mIFN-γ的建立 用病毒上清感染H22细胞,经G418筛选得到阳性克隆,感染率为50%~70%。用PCR方法检测转基因细胞中mIFN-γ (465bp)和选择标记基因NeoR (790bp)的存在,结果证实了mIFN-γ基因的转入(图1)。

, 百拇医药 图1 基因修饰前后H22细胞基因组DNA的PCR检测
Fig.1 PCR analysis of H22 cell modified by mIFN-γ gene
Note:M. 100 bp DNA ladder marker;1,2,3. H22, H22-LXSN,H22-mIFN-γ + mIFN-γ/NeoR primer
2.2 细胞形态和生长情况的观察 从光镜和电镜的观察结果来看,转基因前后细胞的外部形态和内部结构均无明显变化,细胞的生长曲线也比较一致(图2)。

图2 细胞生长曲线
Fig.2 The growth curve of cell
, 百拇医药
2.3 细胞DNA含量和细胞周期的测定 经测定,细胞DNA含量和细胞周期无明显改变(表1)。

图3 mIFN-γ基因修饰前后肿瘤细胞在动物体内的生长曲线
Fig.3 The growth curve of mIFN-γ gene modified tumor cell in experimental animals
2.4 γ-干扰素生物活性的测定 经测定,细胞培养上清中有一定活性的γ-干扰素分泌,在6~48 U之间,连续传代发现该细胞能持续分泌一段时间,各克隆间有一定的差异(数据未列出)。
2.5 MHC II类抗原的表达测定 在H22-mIFN-γ细胞中,部分克隆的表达量有明显增加,其细胞阳性率和阳性峰平均倒数均有不同程度的增加,但在部分克隆中没有观察到表达量增加的现象(表2)。
, 百拇医药
2.6 转基因细胞的体内致瘤性结果 从图3中可以看出,转γ-干扰素基因细胞组动物肿瘤潜伏期延长,肿瘤生长缓慢,另外,动物的成活期明显延长。
表1 细胞周期测定结果
Tab.1 The determination result of cell cycle Cell
G1/G0
S
G2+M
H22
16.5
63.5
, 百拇医药
20.0
H22-LXSN
21.0
61.0
17.0
H22-mIFN-γ
10.4
71.2
18.4
表2 基因修饰前后H22细胞H-2 II类抗原表达的测定结果
Tab.2 H-2 II antigen expression in modified H22 cell
, 百拇医药
Negative control
H22
H22-LXSN
H22-mIFN-γ
Clone 1
Clone 4
Clone 7
Clone 10
Positive rate of H-2
2.04
10.58
11.82
, http://www.100md.com
19.90
26.10
15.66
3.83
8.80
Average reciprocal of positive peak
12.35
12.90
20.01
52.83
57.94
34.08
, 百拇医药
23.45
23.70
3 讨论
肝癌作为一种全球性的疾病,对其致病机制和防治手段的探索一直是人们研究的热点。传统的放疗、化疗和外科切除术是目前主要的治疗手段,但疗效不甚理想且有一定毒副作用,其应用受到一定限制,而基因治疗的兴起为最终解决这一难题带来了希望,如可以用转基因瘤苗增强机体的特异免疫反应以达到防治的目的。但目前应用自身瘤苗还有一定的难度,所以我们首先选用肝癌细胞株进行转基因试验,对转基因后细胞的生物学特性进行了研究。我们发现,外源γ-干扰素基因的导入并不会改变肿瘤细胞的生长行为,细胞形态也无明显变化,细胞能稳定表达外源基因;γ-干扰素基因修饰后细胞的免疫原性有所增加,表现在细胞表面MHC II类抗原的表达量增加,另外,基因修饰后肿瘤细胞的致瘤性也下降了,这为进一步开展异体乃至自体瘤苗进行基因治疗创造了条件。
, http://www.100md.com 在我们的试验中,各个细胞克隆间γ-干扰素的分泌活性有高有低,MHC II类抗原的表达量也有较大差异,这可能与外源基因的插入后整合的位置、方向等不同有关,同时可以看出,基因治疗过程中如何将外源基因进行定点整合依然是一个亟待解决的问题。
①国家‘863’高科技(No.Z-20-01-04)及国家自然科学基金(No.39600177)资助项目
作者简介:吴震宇,男,31岁,硕士;
陈诗书,男,教授,博士生导师,主要研究分子生物学
4 参考文献
1 Human gene marker/therapy clinical protocols. Hum Gen Ther, 1996; 7 (4): 567
, 百拇医药
2 李连第,张思维,鲁凤珠 et al. 中国恶性肿瘤死亡谱及分类构成特征研究. 中华肿瘤杂志, 1997; 19 (5): 323
3 胡 亮, 钱关祥, 沈文红 et al. PA317产生高滴度人TNF-α基因逆转录病毒的研究. 中国肿瘤生物治疗杂志, 1995; 2 (3): 235
4 吴震宇,陈诗书. 小鼠γ-干扰素基因修饰瘤苗的抗肿瘤研究. 中国肿瘤生物治疗杂志, 1998; 5 (2): 90
5 侯 健,王东星,胥军民. 人类细胞因子手册. 上海: 同济大学出版社, 1996: 25-26
收稿1998-08-14 修回1998-11-02, 百拇医药