肿瘤坏死因子β诱导淋巴细胞化学发光及其增殖的研究
作者:俞越汉 丁鸣 马志章 王君晖 钱凯先 丁仁瑞
单位:浙江大学生命科学院免疫工程实验室,杭州310012
关键词:重组人肿瘤坏死因子β;淋巴细胞;化学发光;顺磁共振
中国免疫学杂志991204 摘 要 目的:探讨活性氧参与rhTNFβ诱导淋巴细胞活化作用的机理。方法:采用化学发光(CL)和顺磁共振法(ESR)研究rhTNFβ诱导人外周血淋巴细胞产生活性氧(OR)的动态变化及其增殖作用。结果:①用10~2 000 U/ml的rhTNFβ处理1×106 ml-1淋巴细胞均可诱发Ly-CL,其中以100 U/ml rhTNFβ处理18~20 min的CL峰值(RLI)为最高,所诱发的OR主要为OH.;②以15~62 U/ml的rhTNFβ处理淋巴细胞72 h,可明显地产生活化效应,这与TNFβ诱发淋巴细胞早期产生Ly-CL的强度相一致。结论:适当剂量的rhTNFβ可诱导人外周血淋巴细胞产生OR并促进其增殖。
, 百拇医药
中国图书分类号 R392.12
Study on the chemiluminescence and proliferation of
lymphocyte induced by rhTNFβ
YU Yue-Han, DING Ming, MA Zhi-Zhang et al.
College of Life Science, Hangzhou University,Hangzhou 310012
Abstract Objective:Study on the mechanism of lymphocyte's activation induced by rhTNFβ with the participation of active oxygen redicals (OR).Methods:It was using chemiluminescence(CL) and electron spin resonance(ESR) techniques. Results:1.The lymphocytes(1×106 ml-1)treated with 10~2 000 U/ml rhTNFβ can induce CL.The highest peak value of CL(RLI)was obtained at 100 U/ml rhTNFβ for 18~20 min.The induced OR was mainly OH.2.After the lymphocyte was treated with 15~62 U/ml rhTNFβ for 72 h,the proliferation effect was obviously observed.This effect was in agree with the CL intensity produced earlier.Conclusion:A suitable dose of rhTNFβ can induce OR production of lymphocyte and promote its proliferation.
, http://www.100md.com
Key words rhTNFβ Lymphocyte Chemiluminescence Electron spin resonance(ESR)
肿瘤坏死因子β(Tumor Necrosis Factorβ,TNFβ)又称淋巴毒素(Lymphotoxin,LT)是由活化淋巴细胞所产生[1] ,它具有抗肿瘤、抗病毒、诱导成纤维细胞、B细胞和胸腺细胞的增殖、分化以及调节免疫功能等广泛的生物学效应[2] 。而淋巴细胞化学发光(Lymphocyte Chemiluminescence,Ly-CL)则为淋巴细胞活化早期事件之一[3] 。据此,本文采用淋巴细胞化学发光(Ly-CL)和顺磁共振法(Electron Spin Resonance,ESR)研究TNFβ诱导人外周淋巴细胞产生活性氧自由基(Oxygen Radicals,OR)释放水平的动态变化及其与淋巴细胞增殖的相关性,为探讨活性氧参与TNFβ诱导淋巴细胞活化的作用机理提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 外周血淋巴细胞制备 按常规方法进行,细胞存活率>97%,粒细胞比例<3%。
1.2 药品和试剂 RPMI-1640(Gibco)按常规配制成完全1640,2-ME(Fluka),DMPO(Sigma),Luminol(Sigma)按司传平方法配置工作液[3],MTT(Sigma),黄嘌呤(Xanthine,X,Sigma),黄嘌呤氧化酶(Xanthine Oxidase,XOD,Sigma),rhTNFβ(由本实验室制备,电泳纯,细胞毒比活性为5×106 U/mG.P)[4],其余试剂均为国产。
1.3 淋巴细胞化学发光(LY-CL)的测定
1.3.1 仪器 BPCL超微弱智能发光测量仪(中科院生物物理所)。测量参数:测量时间10 s,标准光源计数1 000 s-1,测量电压1 100 V。测定结果由发光仪10 s计数自动记录,发光值(Relative Light Indensity, RLI)以加TNFβ后出现的Ly-CL值(RLI)的最高峰为峰值,达到峰值的时间为峰时,以对照组的RLI为本底,各处理组的峰值减去本底为纯峰值,并连续测定发光的动力学。
, http://www.100md.com
1.3.2 TNFβ诱导淋巴细胞化学发光的检测 取1.0×106 ml-1淋巴细胞或不同密度的淋巴细胞1 ml,加luminol工作液0.2 ml,测其本底后,再分别加入不同浓度的TNFβ或在不同密度的淋巴细胞中加入同一浓度(100 U/ml)TNFβ,并即刻测定其发光值。以此研究不同浓度的TNFβ对同一密度淋巴细胞以及同一浓度的TNFβ对不同密度淋巴细胞诱发Ly-CL(RLI)的影响。
1.4 顺磁共振法检测活性氧[5]
1.4.1 FeSO4 -H2O-DMPO捕捉羟自由基的体系(Fenton反应体系) 依次加入3%H2O2 1 200 μl, 0.1 mmol/L FeSO4 600 μl,0.2 mol/L DMPO 200 μl,混匀后2 min,用石英毛细管吸少量溶液后密封,置ESR谐振室测试。
, http://www.100md.com
1.4.2 黄嘌呤-黄嘌呤氧化酶-DMPO捕捉超氧阴离子的体系 取0.3 mol/L黄嘌呤1 200 μl,0.1 mmol/L EDTA 50 μl,0.2 mol/L DMPO 200 μl和1 U/ml黄嘌呤氧化酶500 μl混匀后2 min,取样置ESR谐振室测试。
1.5 TNFβ诱导人外周淋巴细胞的增殖作用 用1640完全培养液调整淋巴细胞,使其在96孔板中每孔细胞密度为1×105 /100 μl和不同浓度的TNFβ/100 μl,置37℃,5%CO2 、饱和湿度条件下培养72 h,实验结束前加10 μl(5 mg/ml)MTT,继续培养4 h,加DMSO 150 μl/孔置振荡器上振荡5 min,用酶标仪测每孔OD570值。
2 结果
2.1 TNFβ诱导淋巴细胞化学发光的动态变化 根据检测,淋巴细胞自身的化学发光值为2 085 RLI。当加入TNFβ后,即可诱导发出较强的化学发光(CL),不同浓度TNFβ所诱发的Ly-CL及其动态变化有一定差异(图1)。经50 min的间断测定表明,各不同浓度组的峰值出现于18~20 min之间,随后即逐渐衰减,至50 min时已趋平稳。比较各不同浓度组Ly-CL的峰值则以100U/ml组为最高,达到22 997 RLI。值得注意的是500~2 000 U/ml TNFβ的高剂量组,其诱发的RLI,均随剂量的增高而下降。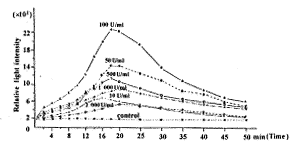
, http://www.100md.com
图1 不同浓度TNFβ诱导人外周血淋巴细胞(1.0×106 ml-1)化学发光的动态变化
Fig.1 The kinetic curves of chemiluminescence indentsity from human PBEC stimulated by TNFβ
2.2 淋巴细胞密度与TNFβ诱导Ly-CL的相关性
表1表明,TNFβ诱导Ly-CL的强度与细胞密度相关。当TNFβ剂量为100 U/ml,淋巴细胞密度为0.2×106~2.0×106 ml-1时,RLI与细胞密度呈线性关系。但随细胞量的进一步提高(>2.0×106 ml-1)则不再呈现线性关系。
, 百拇医药
表1 TNFβ(100 U/ml)刺激不同密度淋巴细胞的发光效应
Tab.1 Influence of different contents of lymphocytes on the Chemiluminescence stimulated by TNFβ(100 U/ml) Contention of
Background
CL peak value
Peak-time
Lymphocyte(×106 ml-1)
(RLI)
(RLI)
, 百拇医药
(Min)
0.1
434±26
10 349±1 1451)
7
0.5
1 210±84
4 4740±1 4461)
9
1.0
2 085±151
8 1950±3 6301)
, 百拇医药
11
2.0
3 930±243
12 5483±4 6931)
12
5.0
5 321±412
15 4940±9 3801)
14
Note: 1)P<0.01,compared with control TNFβ: 100 U/ml
2.3 顺磁共振检测的初步结果 分别在FeSO4-H2O2 -DMPO捕捉OH. 和X-XOD- DMPO捕捉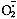 的体系中,获得标准的ESR波谱。经TNFβ温浴处理的淋巴细胞,DMPO捕捉的ESR波谱与标准自由基波谱比较,发现主要为羟自由基(OH. )信号,并含有少量的DMPO与
的体系中,获得标准的ESR波谱。经TNFβ温浴处理的淋巴细胞,DMPO捕捉的ESR波谱与标准自由基波谱比较,发现主要为羟自由基(OH. )信号,并含有少量的DMPO与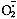 的加合物。
的加合物。
, 百拇医药
2.4 TNFβ诱导淋巴细胞的增殖 TNFβ的浓度在15~62 U/ml范围内,其促进外周血淋巴细胞的增殖效应随着TNFβ浓度的增高而增强;但当浓度进一步增高(>62 U/ml),这种促增殖效应逐渐减弱,而当浓度达到 1000U/ml时,则表现为抑制作用(图2)。
图2 TNFβ对外周血淋巴细胞的增殖影响
Fig.2 Effect of TNFβ on human peripheral blood lymphocytes proliferation
3 讨论
淋巴细胞化学发光(Ly-CL)是淋巴细胞活化的一种表现[6,7] ,其本质是淋巴细胞受抗原或有丝分裂原刺激后生成活性氧的反应[8,9] 。我们的研究显示TNFβ可诱导人外周淋巴细胞产生化学发光,其强度(峰值)在10~100 U/ml的TNFβ诱导下与其浓度呈正相关,但在500~2 000 U/ml时,则随TNFβ的浓度增高而下降。值得注意的是,TNFβ诱导淋巴细胞化学发光的峰时比ConA/PHA诱导为长,在18~20 min左右,而后者仅2~3 min。当TNFβ的浓度不变,Ly-CL强度与淋巴细胞密度呈线性关系,但当密度>2.0×106 ml-1时,则Ly-CL无明显增加。对此现象值得进一步作比较研究。
, 百拇医药
以DMPO为自旋捕捉剂对经TNFβ诱导的淋巴细胞样品进行检测,获得明显的自由基信号,4条主要吸收峰与DMPO捕捉的标准OH. ESR波谱相一致,说明本实验DMPO捕捉到的是淋巴细胞所释放的OH.。这一结果提示,TNFβ激发淋巴细胞产生化学发光的本质是释放羟自由基。它参与淋巴细胞的活化,并认为OR的生成是淋巴细胞活化的一种阳性信号[10] 。
研究不同浓度TNFβ对淋巴细胞的诱导增殖作用,发现在15~62 U/ml范围时,可有效地活化淋巴细胞,这与淋巴细胞早期诱发Ly-CL的强度相一致。但当浓度>62 U/ml以上,淋巴细胞的增殖即渐趋降低,这与100 U/ml浓度的TNFβ诱发Ly-CL的最高峰值不完全一致;而当浓度>500 U/ml则表现出抑制效应。就TNFβ而论,对淋巴细胞这种调节作用将为TNFβ应用于临床提供了实验依据,对其作用机理尚待进一步阐明。
, 百拇医药
资金项目:国家自然科学基金资助项目(批准号:39670815),浙江省自然科学基金资助项目(批准号:397050)
作者简介:俞越汉,男,36岁,硕士;马志章,女,57岁,教授,主要从事肿瘤免疫研究
参考文献
1 Shmid D S, Ruddle N H. Production and function of lymphotoxin secreted by cytolytic T cells,In cytolytic lymphocyte clones and complement as effectors of the human system. ER podack: CRC press,1988:245
2 徐人尔,李 平,倪卓昱et al. 淋巴毒素的研究进展. 中国肿瘤生物治疗杂志,1997;4(4):313
, http://www.100md.com
3 司传平,刘 涟. 人外周血淋巴细胞化学发光测定的最佳实验条件探讨. 中国免疫学杂志,1991;7(1):49
4 丁 鸣,马志章,应红宇et al.不同E.coli对人β-肿瘤坏死因子质粒(p20KLT)表达的影响及 其纯化研究. 中国免疫学杂志,1997;13(增刊):1
5 Zhao B L, Li X J, Xin W J. Study on the oxygen adicals released from human PMN leucocytes with respiratory burst by ESR. Cell Biology Int Report, 1989;13(6):529
6 Wrogemann K, Weiosemam M J, Paskar B A et al. Chemiluminescence and cell activation: Early activation of rat thymocytes can be monitored by chemiluminescence measurements. Eur J Immunol, 1978;8:749
, http://www.100md.com
7 Mookerjee B K, Wakerhe H, Sharon N et al. Chemiluminescence and lymphocytes proliferation:Parallelism in collaboration between subpopulations of thymus cells for both type of responses. J Leukocyte Biol, 1984;35:427
8 司传平,刘 涟. 淋巴细胞化学发光的研究进展. 国外医学.免疫学分册,1990;13(5):252
9 苏 枭,茅子均. 淋巴细胞化学发光的机制. 国外医学.免疫学分册,1992;15(2):67
10 Fidelus R K. The generation of oxygen radicals: A positive signal for lymphocyte activation. Cell Immunol,1988;113:175
收稿:1998-06-05 修回:1999-01-20
, http://www.100md.com
单位:浙江大学生命科学院免疫工程实验室,杭州310012
关键词:重组人肿瘤坏死因子β;淋巴细胞;化学发光;顺磁共振
中国免疫学杂志991204 摘 要 目的:探讨活性氧参与rhTNFβ诱导淋巴细胞活化作用的机理。方法:采用化学发光(CL)和顺磁共振法(ESR)研究rhTNFβ诱导人外周血淋巴细胞产生活性氧(OR)的动态变化及其增殖作用。结果:①用10~2 000 U/ml的rhTNFβ处理1×106 ml-1淋巴细胞均可诱发Ly-CL,其中以100 U/ml rhTNFβ处理18~20 min的CL峰值(RLI)为最高,所诱发的OR主要为OH.;②以15~62 U/ml的rhTNFβ处理淋巴细胞72 h,可明显地产生活化效应,这与TNFβ诱发淋巴细胞早期产生Ly-CL的强度相一致。结论:适当剂量的rhTNFβ可诱导人外周血淋巴细胞产生OR并促进其增殖。
, 百拇医药
中国图书分类号 R392.12
Study on the chemiluminescence and proliferation of
lymphocyte induced by rhTNFβ
YU Yue-Han, DING Ming, MA Zhi-Zhang et al.
College of Life Science, Hangzhou University,Hangzhou 310012
Abstract Objective:Study on the mechanism of lymphocyte's activation induced by rhTNFβ with the participation of active oxygen redicals (OR).Methods:It was using chemiluminescence(CL) and electron spin resonance(ESR) techniques. Results:1.The lymphocytes(1×106 ml-1)treated with 10~2 000 U/ml rhTNFβ can induce CL.The highest peak value of CL(RLI)was obtained at 100 U/ml rhTNFβ for 18~20 min.The induced OR was mainly OH.2.After the lymphocyte was treated with 15~62 U/ml rhTNFβ for 72 h,the proliferation effect was obviously observed.This effect was in agree with the CL intensity produced earlier.Conclusion:A suitable dose of rhTNFβ can induce OR production of lymphocyte and promote its proliferation.
, http://www.100md.com
Key words rhTNFβ Lymphocyte Chemiluminescence Electron spin resonance(ESR)
肿瘤坏死因子β(Tumor Necrosis Factorβ,TNFβ)又称淋巴毒素(Lymphotoxin,LT)是由活化淋巴细胞所产生[1] ,它具有抗肿瘤、抗病毒、诱导成纤维细胞、B细胞和胸腺细胞的增殖、分化以及调节免疫功能等广泛的生物学效应[2] 。而淋巴细胞化学发光(Lymphocyte Chemiluminescence,Ly-CL)则为淋巴细胞活化早期事件之一[3] 。据此,本文采用淋巴细胞化学发光(Ly-CL)和顺磁共振法(Electron Spin Resonance,ESR)研究TNFβ诱导人外周淋巴细胞产生活性氧自由基(Oxygen Radicals,OR)释放水平的动态变化及其与淋巴细胞增殖的相关性,为探讨活性氧参与TNFβ诱导淋巴细胞活化的作用机理提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 外周血淋巴细胞制备 按常规方法进行,细胞存活率>97%,粒细胞比例<3%。
1.2 药品和试剂 RPMI-1640(Gibco)按常规配制成完全1640,2-ME(Fluka),DMPO(Sigma),Luminol(Sigma)按司传平方法配置工作液[3],MTT(Sigma),黄嘌呤(Xanthine,X,Sigma),黄嘌呤氧化酶(Xanthine Oxidase,XOD,Sigma),rhTNFβ(由本实验室制备,电泳纯,细胞毒比活性为5×106 U/mG.P)[4],其余试剂均为国产。
1.3 淋巴细胞化学发光(LY-CL)的测定
1.3.1 仪器 BPCL超微弱智能发光测量仪(中科院生物物理所)。测量参数:测量时间10 s,标准光源计数1 000 s-1,测量电压1 100 V。测定结果由发光仪10 s计数自动记录,发光值(Relative Light Indensity, RLI)以加TNFβ后出现的Ly-CL值(RLI)的最高峰为峰值,达到峰值的时间为峰时,以对照组的RLI为本底,各处理组的峰值减去本底为纯峰值,并连续测定发光的动力学。
, http://www.100md.com
1.3.2 TNFβ诱导淋巴细胞化学发光的检测 取1.0×106 ml-1淋巴细胞或不同密度的淋巴细胞1 ml,加luminol工作液0.2 ml,测其本底后,再分别加入不同浓度的TNFβ或在不同密度的淋巴细胞中加入同一浓度(100 U/ml)TNFβ,并即刻测定其发光值。以此研究不同浓度的TNFβ对同一密度淋巴细胞以及同一浓度的TNFβ对不同密度淋巴细胞诱发Ly-CL(RLI)的影响。
1.4 顺磁共振法检测活性氧[5]
1.4.1 FeSO4 -H2O-DMPO捕捉羟自由基的体系(Fenton反应体系) 依次加入3%H2O2 1 200 μl, 0.1 mmol/L FeSO4 600 μl,0.2 mol/L DMPO 200 μl,混匀后2 min,用石英毛细管吸少量溶液后密封,置ESR谐振室测试。
, http://www.100md.com
1.4.2 黄嘌呤-黄嘌呤氧化酶-DMPO捕捉超氧阴离子的体系 取0.3 mol/L黄嘌呤1 200 μl,0.1 mmol/L EDTA 50 μl,0.2 mol/L DMPO 200 μl和1 U/ml黄嘌呤氧化酶500 μl混匀后2 min,取样置ESR谐振室测试。
1.5 TNFβ诱导人外周淋巴细胞的增殖作用 用1640完全培养液调整淋巴细胞,使其在96孔板中每孔细胞密度为1×105 /100 μl和不同浓度的TNFβ/100 μl,置37℃,5%CO2 、饱和湿度条件下培养72 h,实验结束前加10 μl(5 mg/ml)MTT,继续培养4 h,加DMSO 150 μl/孔置振荡器上振荡5 min,用酶标仪测每孔OD570值。
2 结果
2.1 TNFβ诱导淋巴细胞化学发光的动态变化 根据检测,淋巴细胞自身的化学发光值为2 085 RLI。当加入TNFβ后,即可诱导发出较强的化学发光(CL),不同浓度TNFβ所诱发的Ly-CL及其动态变化有一定差异(图1)。经50 min的间断测定表明,各不同浓度组的峰值出现于18~20 min之间,随后即逐渐衰减,至50 min时已趋平稳。比较各不同浓度组Ly-CL的峰值则以100U/ml组为最高,达到22 997 RLI。值得注意的是500~2 000 U/ml TNFβ的高剂量组,其诱发的RLI,均随剂量的增高而下降。

, http://www.100md.com
图1 不同浓度TNFβ诱导人外周血淋巴细胞(1.0×106 ml-1)化学发光的动态变化
Fig.1 The kinetic curves of chemiluminescence indentsity from human PBEC stimulated by TNFβ
2.2 淋巴细胞密度与TNFβ诱导Ly-CL的相关性
表1表明,TNFβ诱导Ly-CL的强度与细胞密度相关。当TNFβ剂量为100 U/ml,淋巴细胞密度为0.2×106~2.0×106 ml-1时,RLI与细胞密度呈线性关系。但随细胞量的进一步提高(>2.0×106 ml-1)则不再呈现线性关系。
, 百拇医药
表1 TNFβ(100 U/ml)刺激不同密度淋巴细胞的发光效应
Tab.1 Influence of different contents of lymphocytes on the Chemiluminescence stimulated by TNFβ(100 U/ml) Contention of
Background
CL peak value
Peak-time
Lymphocyte(×106 ml-1)
(RLI)
(RLI)
, 百拇医药
(Min)
0.1
434±26
10 349±1 1451)
7
0.5
1 210±84
4 4740±1 4461)
9
1.0
2 085±151
8 1950±3 6301)
, 百拇医药
11
2.0
3 930±243
12 5483±4 6931)
12
5.0
5 321±412
15 4940±9 3801)
14
Note: 1)P<0.01,compared with control TNFβ: 100 U/ml
2.3 顺磁共振检测的初步结果 分别在FeSO4-H2O2 -DMPO捕捉OH. 和X-XOD- DMPO捕捉
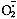 的体系中,获得标准的ESR波谱。经TNFβ温浴处理的淋巴细胞,DMPO捕捉的ESR波谱与标准自由基波谱比较,发现主要为羟自由基(OH. )信号,并含有少量的DMPO与
的体系中,获得标准的ESR波谱。经TNFβ温浴处理的淋巴细胞,DMPO捕捉的ESR波谱与标准自由基波谱比较,发现主要为羟自由基(OH. )信号,并含有少量的DMPO与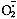 的加合物。
的加合物。, 百拇医药
2.4 TNFβ诱导淋巴细胞的增殖 TNFβ的浓度在15~62 U/ml范围内,其促进外周血淋巴细胞的增殖效应随着TNFβ浓度的增高而增强;但当浓度进一步增高(>62 U/ml),这种促增殖效应逐渐减弱,而当浓度达到 1000U/ml时,则表现为抑制作用(图2)。

图2 TNFβ对外周血淋巴细胞的增殖影响
Fig.2 Effect of TNFβ on human peripheral blood lymphocytes proliferation
3 讨论
淋巴细胞化学发光(Ly-CL)是淋巴细胞活化的一种表现[6,7] ,其本质是淋巴细胞受抗原或有丝分裂原刺激后生成活性氧的反应[8,9] 。我们的研究显示TNFβ可诱导人外周淋巴细胞产生化学发光,其强度(峰值)在10~100 U/ml的TNFβ诱导下与其浓度呈正相关,但在500~2 000 U/ml时,则随TNFβ的浓度增高而下降。值得注意的是,TNFβ诱导淋巴细胞化学发光的峰时比ConA/PHA诱导为长,在18~20 min左右,而后者仅2~3 min。当TNFβ的浓度不变,Ly-CL强度与淋巴细胞密度呈线性关系,但当密度>2.0×106 ml-1时,则Ly-CL无明显增加。对此现象值得进一步作比较研究。
, 百拇医药
以DMPO为自旋捕捉剂对经TNFβ诱导的淋巴细胞样品进行检测,获得明显的自由基信号,4条主要吸收峰与DMPO捕捉的标准OH. ESR波谱相一致,说明本实验DMPO捕捉到的是淋巴细胞所释放的OH.。这一结果提示,TNFβ激发淋巴细胞产生化学发光的本质是释放羟自由基。它参与淋巴细胞的活化,并认为OR的生成是淋巴细胞活化的一种阳性信号[10] 。
研究不同浓度TNFβ对淋巴细胞的诱导增殖作用,发现在15~62 U/ml范围时,可有效地活化淋巴细胞,这与淋巴细胞早期诱发Ly-CL的强度相一致。但当浓度>62 U/ml以上,淋巴细胞的增殖即渐趋降低,这与100 U/ml浓度的TNFβ诱发Ly-CL的最高峰值不完全一致;而当浓度>500 U/ml则表现出抑制效应。就TNFβ而论,对淋巴细胞这种调节作用将为TNFβ应用于临床提供了实验依据,对其作用机理尚待进一步阐明。
, 百拇医药
资金项目:国家自然科学基金资助项目(批准号:39670815),浙江省自然科学基金资助项目(批准号:397050)
作者简介:俞越汉,男,36岁,硕士;马志章,女,57岁,教授,主要从事肿瘤免疫研究
参考文献
1 Shmid D S, Ruddle N H. Production and function of lymphotoxin secreted by cytolytic T cells,In cytolytic lymphocyte clones and complement as effectors of the human system. ER podack: CRC press,1988:245
2 徐人尔,李 平,倪卓昱et al. 淋巴毒素的研究进展. 中国肿瘤生物治疗杂志,1997;4(4):313
, http://www.100md.com
3 司传平,刘 涟. 人外周血淋巴细胞化学发光测定的最佳实验条件探讨. 中国免疫学杂志,1991;7(1):49
4 丁 鸣,马志章,应红宇et al.不同E.coli对人β-肿瘤坏死因子质粒(p20KLT)表达的影响及 其纯化研究. 中国免疫学杂志,1997;13(增刊):1
5 Zhao B L, Li X J, Xin W J. Study on the oxygen adicals released from human PMN leucocytes with respiratory burst by ESR. Cell Biology Int Report, 1989;13(6):529
6 Wrogemann K, Weiosemam M J, Paskar B A et al. Chemiluminescence and cell activation: Early activation of rat thymocytes can be monitored by chemiluminescence measurements. Eur J Immunol, 1978;8:749
, http://www.100md.com
7 Mookerjee B K, Wakerhe H, Sharon N et al. Chemiluminescence and lymphocytes proliferation:Parallelism in collaboration between subpopulations of thymus cells for both type of responses. J Leukocyte Biol, 1984;35:427
8 司传平,刘 涟. 淋巴细胞化学发光的研究进展. 国外医学.免疫学分册,1990;13(5):252
9 苏 枭,茅子均. 淋巴细胞化学发光的机制. 国外医学.免疫学分册,1992;15(2):67
10 Fidelus R K. The generation of oxygen radicals: A positive signal for lymphocyte activation. Cell Immunol,1988;113:175
收稿:1998-06-05 修回:1999-01-20
, http://www.100md.com