人Fas抗原表位预测*
作者:宋建勋1 朱锡华1 陈克敏1,2'k, http://www.100md.com
单位:宋建勋 朱锡华 第三军医大学免疫学教研室,中国人民解放军免疫学研究所 重庆400038; 陈克敏 美国哥伦比亚大学'k, http://www.100md.com
关键词:Fas B细胞表位 预测'k, http://www.100md.com
免疫学杂志990104'k, http://www.100md.com
摘 要 采用可及性和可塑性方案,结合抗原性方案、二级结构方案及综合位点预测方案对人Fas抗原的B细胞表位进行预测,结果显示:人Fas抗原B细胞表位可能位于N-末端残基51-78,102-110,145-157等区域内或附近。由于残基102、120位有2个潜在的N-糖基化位点(Asn-X-Ser/Thr),对表位的形成有一定影响,人Fas抗原的B细胞表位可能位于51-78,100-157区域内。'k, http://www.100md.com
中图号 R392.11'k, http://www.100md.com
PREDICTION OF B-CELL EPITOPES OF HUMAN FAS(H-FAS) ANTIGEN'k, http://www.100md.com
Song Jianxun, Zhu Xihua, Chen Kemin'k, http://www.100md.com
(Department of Immunology, The Thrid Military Medical University, Chongqing 400038)'k, http://www.100md.com
Abstract B-cell epitopes of H-Fas antigen were predicted by using accessibility and flexibility schemes, associated with antigenicity, secondary structure and multiple site prediction. The results demonstrated that the B cell epitopes of H-Fas were probably at or adjacent to its N-terminal No. 51-78, 102-110, 145-157. Thinking the B-cell epitopes can be affected by two potential site of N-glycosy1 in N-terminal No. 102,120(Asn-X-Ser/Thr), the B-cell epitopes of H-Fas antigen possibly localized in its N-terminal No. 51-78, 100-157.
Key words Fas, B-cell epitopes, Predictionq5, http://www.100md.com
Fas抗原表位与信号传导关系密切,不同的表位启动的信号传导效果有差异,其中有的表位是启动死亡信号传导所必需[1]。抗人Fas mAb能诱导Fas+敏感细胞凋亡,那么,其所识别的Fas抗原胞外区表位与死亡信号传导必定相关。明确能诱导Fas抗敏感细胞凋亡的Fas抗原表位对于Fas抗原信号传导机制的研究,尤其是死亡信号传导的早期事件具有重要意义。本文采用可及性和可塑性方案,结合抗原性方案、二级结构方案及表位分析方案对人Fas抗原的B细胞表位进行预测。q5, http://www.100md.com
1 材料与方法q5, http://www.100md.com
1.1 人Fas抗原(H-Fas)胞外区AA序列 根据Itoh等[2]及Oehm等[3]克隆的人细胞表面Fas抗原cDNA基因序列推导得知。q5, http://www.100md.com
1.2 可及性方案和可塑性方案的预测方法 采用Goldkey软件(北京军事医学科学院吴加金等编制),把H-Fas抗原胞外区AA序列输入第一工作区,用7个AA为一组的分析参数。高于阈值的峰为可及性或可塑性位点。 * * * *q5, http://www.100md.com
Sequence:H-FAS(extracellular domain)q5, http://www.100md.com
* * * *q5, http://www.100md.com
Sequenceq5, http://www.100md.com
lengthq5, http://www.100md.com
157q5, http://www.100md.com
Residuesq5, http://www.100md.com
10q5, http://www.100md.com
20q5, http://www.100md.com
30q5, http://www.100md.com
40q5, http://www.100md.com
50q5, http://www.100md.com
RLSSKSVNAQq5, http://www.100md.com
VTDINSKGLE
LRKTVTTVET6w-3&, http://www.100md.com
QNLEGLHHDG6w-3&, http://www.100md.com
QFCHKPCPPG6w-3&, http://www.100md.com
606w-3&, http://www.100md.com
706w-3&, http://www.100md.com
806w-3&, http://www.100md.com
906w-3&, http://www.100md.com
1006w-3&, http://www.100md.com
ERKARDCTVN6w-3&, http://www.100md.com
GDEPDCVPCQ6w-3&, http://www.100md.com
EGKEYTDKAH6w-3&, http://www.100md.com
FSSKCRRCRL6w-3&, http://www.100md.com
CDEGHGLEVE6w-3&, http://www.100md.com
1106w-3&, http://www.100md.com
1206w-3&, http://www.100md.com
1306w-3&, http://www.100md.com
1406w-3&, http://www.100md.com
1506w-3&, http://www.100md.com
INCTRTQNTK6w-3&, http://www.100md.com
CRCKPNFFCN6w-3&, http://www.100md.com
STVCEHCDPC6w-3&, http://www.100md.com
TKCEHGIIKE6w-3&, http://www.100md.com
CTLTSNTKCK6w-3&, http://www.100md.com
1606w-3&, http://www.100md.com
1706w-3&, http://www.100md.com
1806w-3&, http://www.100md.com
EEGSRSN6w-3&, http://www.100md.com
1.3 抗原性方案和二级结构预测方案的预测方法 采用Goldkey软件(同上),用7个AA为一组的分析参数。高于阀值的峰为抗原性位点。Garnier氏方法预测二级结构,寻找转角(Turn)易形成区域。
1.4 综合位点预测方案的预测方法(6种预测方案综合预测法) 采用同一软件,方法同上,高于阀值的峰为综合预测表位位点。k63{ie, 百拇医药
2 结果k63{ie, 百拇医药
2.1 可及性方案和可塑性方案的预测结果 N-末端AA残基第4-38,45-55,58-62,68-81,93-94,102-108,142-154为可及性区域,以50、75、105、155残基附近可及性程度为高,可能位于人Fas抗原表面(见图1)。N-末端AA残基4-5,14-18,22-34,47-54,60-63,69-74,81-82,102-110,142-154为可塑性区域,以50、105、155残基附近可塑性程度为高,可能具有一定柔韧性(见图2)。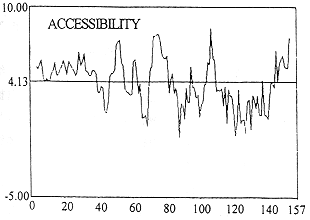 k63{ie, 百拇医药
k63{ie, 百拇医药
图1 人Fas抗原可及性预测k63{ie, 百拇医药
Fig 1 Accessibility prediction of H-Fas k63{ie, 百拇医药
k63{ie, 百拇医药
图2 人Fas抗原可塑性预测k63{ie, 百拇医药
Fig 2 Flexibility prediction of H-Fask63{ie, 百拇医药
2.2 抗原性方案和二级结构预测方案的预测结果 N-末端AA残基第4-9,18-26,32-47,50-58,74-89,105-114,121-129,131-132,144-150为抗原性区域,以20、38、55、77、81残基附近抗原性为强(见图3)。N-末端AA残基2-3,37-46,51-58,61-64,81-94,102-114,115-130,142-146,152-157为转角易形成区域(图4)。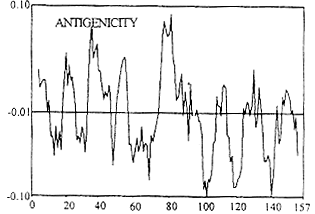 k63{ie, 百拇医药
k63{ie, 百拇医药
图3 人Fas抗原抗原性预测k63{ie, 百拇医药
Fig 3 Antigenicity prediction of H-FasH-FAS length=157k63{ie, 百拇医药
H=helix, E=exptended, T=turn, C=coil
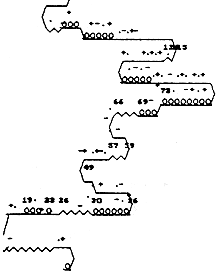
图4 人Fas抗原二级结构预测(H=螺旋/α-螺旋,E=伸展/β-折迭,T=转角,C=无规则卷曲)^!/?, http://www.100md.com
Fig 4 Prediction of H-Fas secondary structure(H=Helix/α-Helix, E=extended/β-Sheet, T=turn,C=Coil)^!/?, http://www.100md.com
2.3 人Fas B细胞表位预测结果 综合上述几个方案的预测结果。重点研究可及性和可塑性方案,结合抗原性预测、二级结构预测及综合位点预测方案结果(见图5),得出人Fas抗原的B细胞表位可能位于N-末端AA残基51-78,102-110,145-157区域或它们附近(未考虑糖链的影响)。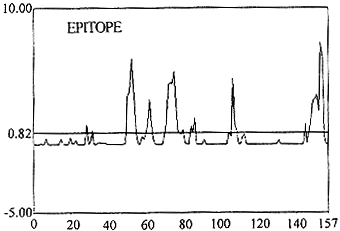 ^!/?, http://www.100md.com
^!/?, http://www.100md.com
图5 人Fas抗原表位分析^!/?, http://www.100md.com
Fig 5 Epitope analysis of H-Fas^!/?, http://www.100md.com
3 讨论^!/?, http://www.100md.com
3.1 B细胞蛋白抗原表位预测 B细胞识别蛋白抗原时,是以其表面的B细胞抗原受体(BCR)与蛋白抗原表位(抗原决定簇)结合,此过程与抗原抗体的结合相同。B细胞蛋白抗原表位的预测自从80年代Hopp和Woods提出亲水性参数对抗原表位预测的方法以来,已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨大的推动作用。现已被大众认可并具有较好预测效果的方法,主要有6种:①亲水性方案(Hydrophilicity),尤以Hopp和Woods方案最为有名。认为蛋白抗原各AA残基可分为亲水残基和疏水残基两类。在机体内,疏水性残基一般埋在蛋白内部,而亲水性残基位于表面,因此蛋白的亲水部位与蛋白的抗原位点有密切的联系。Hopp和Woods方案是以残基由有机相环境转移到水相环境的自由能为依据计算各个AA的亲水性。现已明确,亲水性部位与表位并无很好的一致性,即高亲水部位不一定是表位,表位也不一定是亲水性部位[4]。②可及性方案(Accessibility),指蛋白抗原中AA残基被溶剂分子接触的可能性,它反映了蛋白抗原内、外各层各残基的分布组成。③抗原性方案(Antigenicity)。认为除亲水性AA残基外,疏水性AA残基也经常出现在表位中,各残基在蛋白抗原位点中的相对出现率对抗原表位的定位预测有一定意义。许多蛋白抗原表位研究已证实,疏水性AA残基对表位形成亦有贡献。④可塑性方案(Flexibility)。指蛋白抗原构象不是刚性不变的,其多肽骨架有一定程度的活动性,活动性强的AA残基即可塑性大的位点,易形成抗原表位。⑤电荷分布方案(Charge distribution)。认为对碱性抗原特异的抗体多趋于酸性,对酸性抗原特异的抗体多趋于碱性。但现在理解电荷作用引起的只是非特异性结合。⑥二极结构预测(Secondary structure)。认为β转角结构为凸出结构,多出现在蛋白抗原表面,利于与抗体嵌合,较可能成为抗原表位。α螺旋、β片层结构规则,不易形变,较难嵌合抗体,一般不作为抗原位点[5~8]。
预测B细胞蛋白抗原表位一般以上述多种方案综合考虑,尤以可及性方案、可塑性方案、抗原性方案及二级结构预测为重要。概括而言,作为B细胞蛋白抗原的表位首先应易于位于或移动于蛋白抗原表面,有利于与B细胞抗原受体或抗体结合,另外,要有一定柔韧性,因为抗原与抗原受体或抗体结合时蛋白构象有一定变化。|]?r), http://www.100md.com
3.2 Fas抗原表位分析 H-Fas抗原能引起免疫应答的表位(功能性表位)位于其胞外区,其跨膜区和胞内区因存在空间位阻,不能成为其功能性表位。H-Fas抗原胞外区157个AA,MW为17.573+8KD(8KD为存在的潜在的糖链分子量),理论上应存在4~6个功能性表位,即能被B细胞识别,或与抗体结合。经过可及性方案、可塑性方案以及抗原性方案、二级结构预测、表位分析预测等综合考虑可能位于N-末端AA残基51-78,102-110,145-157等区域内或它们附近。由于H-Fas N-末端AA残基102位和120位有2个潜在的N-糖基化位点(Asn-×-Ser/Thr),对表位形成有一定影响,可能会改变或形成新的表位,H-Fas抗原的B细胞表位可能位于51-78,100-157区域内。这是一个比较粗的预测结果,只是排除了一些不易成为H-Fas抗原表位的肽段。至于其精细表位(4-9个AA残基)的确定可以在明确表位所在区域后,进一步采用交叠肽合成方法分析,并随分析的进行,合成的交叠肽逐渐缩短,以至最后确定Fas抗原的精细表位[9,10]。|]?r), http://www.100md.com
*全军“九五”医药卫生科研重点项目基金|]?r), http://www.100md.com
第一作者:男,30岁,博士,讲师|]?r), http://www.100md.com
参考文献|]?r), http://www.100md.com
[1] 宋建勋,朱锡华.Fas抗原表位与死亡信号传导的关系.免疫学杂志,1997,13(3):206|]?r), http://www.100md.com
[2] Itoh N,Yonehara S,Ishil A, et al. The polypeptide encoded by the cDNA for human cell surface antigen Fas can mediate apoptosis. Cell, 1991, 66(4):233|]?r), http://www.100md.com
[3] Oehm A,Behrmann I,Falk W, et al. Purification and molecular cloning of the Apo-1 cell surface antigen, a member of the tumor necrosis factor/nerve growth factor receptor superfamily. J Biol Chem, 1992,267(15):10709
[4] 吴玉章,朱锡华.蛋白质抗原表位的研究.科学,1994,185:93-y9lljp, http://www.100md.com
[5]` Shih DT, Boettiger D,Buck CA.Epitopes of adhesion-perturbing monoclonal antibodies map within a predicted alpha-helical domaein of the integrin beta 1 subunit. J Cell Sci, 1997,110(20):2619-y9lljp, http://www.100md.com
[6] Beezhold DH,Kostyal DA,Sussman GL.IgE epitope analysis of the hevein preprotein: a major latex allergen. Clin Exp Immunol. 1997,108(1):114-y9lljp, http://www.100md.com
[7] Barlow DJ,Edwards MS,Thornton JM, et al. Continuous and discontinuous protein antigenic determinants. Nature, 1986,322(6081):747-y9lljp, http://www.100md.com
[8] Shih DT,Edelman JM,Horwitz AF, et al. Structure/function analysis of the integrin β1 subnit by epitope mapping. J Cell Bio, 1993,122(6):1361-y9lljp, http://www.100md.com
[9] Holm L,Sander C.Mapping the protein universe. Science, 1996, 273(5275):595-y9lljp, http://www.100md.com
[10] Gershoni JM,Stem B, Venisova G.Combinatorial libraries, epitope structure and the prediction of protein conformations. Immunol Today, 1997,18(3):108-y9lljp, http://www.100md.com
(1998-06-09收稿;1998-09-23修回)(宋建勋1 朱锡华1 陈克敏1,2)
单位:宋建勋 朱锡华 第三军医大学免疫学教研室,中国人民解放军免疫学研究所 重庆400038; 陈克敏 美国哥伦比亚大学'k, http://www.100md.com
关键词:Fas B细胞表位 预测'k, http://www.100md.com
免疫学杂志990104'k, http://www.100md.com
摘 要 采用可及性和可塑性方案,结合抗原性方案、二级结构方案及综合位点预测方案对人Fas抗原的B细胞表位进行预测,结果显示:人Fas抗原B细胞表位可能位于N-末端残基51-78,102-110,145-157等区域内或附近。由于残基102、120位有2个潜在的N-糖基化位点(Asn-X-Ser/Thr),对表位的形成有一定影响,人Fas抗原的B细胞表位可能位于51-78,100-157区域内。'k, http://www.100md.com
中图号 R392.11'k, http://www.100md.com
PREDICTION OF B-CELL EPITOPES OF HUMAN FAS(H-FAS) ANTIGEN'k, http://www.100md.com
Song Jianxun, Zhu Xihua, Chen Kemin'k, http://www.100md.com
(Department of Immunology, The Thrid Military Medical University, Chongqing 400038)'k, http://www.100md.com
Abstract B-cell epitopes of H-Fas antigen were predicted by using accessibility and flexibility schemes, associated with antigenicity, secondary structure and multiple site prediction. The results demonstrated that the B cell epitopes of H-Fas were probably at or adjacent to its N-terminal No. 51-78, 102-110, 145-157. Thinking the B-cell epitopes can be affected by two potential site of N-glycosy1 in N-terminal No. 102,120(Asn-X-Ser/Thr), the B-cell epitopes of H-Fas antigen possibly localized in its N-terminal No. 51-78, 100-157.
Key words Fas, B-cell epitopes, Predictionq5, http://www.100md.com
Fas抗原表位与信号传导关系密切,不同的表位启动的信号传导效果有差异,其中有的表位是启动死亡信号传导所必需[1]。抗人Fas mAb能诱导Fas+敏感细胞凋亡,那么,其所识别的Fas抗原胞外区表位与死亡信号传导必定相关。明确能诱导Fas抗敏感细胞凋亡的Fas抗原表位对于Fas抗原信号传导机制的研究,尤其是死亡信号传导的早期事件具有重要意义。本文采用可及性和可塑性方案,结合抗原性方案、二级结构方案及表位分析方案对人Fas抗原的B细胞表位进行预测。q5, http://www.100md.com
1 材料与方法q5, http://www.100md.com
1.1 人Fas抗原(H-Fas)胞外区AA序列 根据Itoh等[2]及Oehm等[3]克隆的人细胞表面Fas抗原cDNA基因序列推导得知。q5, http://www.100md.com
1.2 可及性方案和可塑性方案的预测方法 采用Goldkey软件(北京军事医学科学院吴加金等编制),把H-Fas抗原胞外区AA序列输入第一工作区,用7个AA为一组的分析参数。高于阈值的峰为可及性或可塑性位点。 * * * *q5, http://www.100md.com
Sequence:H-FAS(extracellular domain)q5, http://www.100md.com
* * * *q5, http://www.100md.com
Sequenceq5, http://www.100md.com
lengthq5, http://www.100md.com
157q5, http://www.100md.com
Residuesq5, http://www.100md.com
10q5, http://www.100md.com
20q5, http://www.100md.com
30q5, http://www.100md.com
40q5, http://www.100md.com
50q5, http://www.100md.com
RLSSKSVNAQq5, http://www.100md.com
VTDINSKGLE
LRKTVTTVET6w-3&, http://www.100md.com
QNLEGLHHDG6w-3&, http://www.100md.com
QFCHKPCPPG6w-3&, http://www.100md.com
606w-3&, http://www.100md.com
706w-3&, http://www.100md.com
806w-3&, http://www.100md.com
906w-3&, http://www.100md.com
1006w-3&, http://www.100md.com
ERKARDCTVN6w-3&, http://www.100md.com
GDEPDCVPCQ6w-3&, http://www.100md.com
EGKEYTDKAH6w-3&, http://www.100md.com
FSSKCRRCRL6w-3&, http://www.100md.com
CDEGHGLEVE6w-3&, http://www.100md.com
1106w-3&, http://www.100md.com
1206w-3&, http://www.100md.com
1306w-3&, http://www.100md.com
1406w-3&, http://www.100md.com
1506w-3&, http://www.100md.com
INCTRTQNTK6w-3&, http://www.100md.com
CRCKPNFFCN6w-3&, http://www.100md.com
STVCEHCDPC6w-3&, http://www.100md.com
TKCEHGIIKE6w-3&, http://www.100md.com
CTLTSNTKCK6w-3&, http://www.100md.com
1606w-3&, http://www.100md.com
1706w-3&, http://www.100md.com
1806w-3&, http://www.100md.com
EEGSRSN6w-3&, http://www.100md.com
1.3 抗原性方案和二级结构预测方案的预测方法 采用Goldkey软件(同上),用7个AA为一组的分析参数。高于阀值的峰为抗原性位点。Garnier氏方法预测二级结构,寻找转角(Turn)易形成区域。
1.4 综合位点预测方案的预测方法(6种预测方案综合预测法) 采用同一软件,方法同上,高于阀值的峰为综合预测表位位点。k63{ie, 百拇医药
2 结果k63{ie, 百拇医药
2.1 可及性方案和可塑性方案的预测结果 N-末端AA残基第4-38,45-55,58-62,68-81,93-94,102-108,142-154为可及性区域,以50、75、105、155残基附近可及性程度为高,可能位于人Fas抗原表面(见图1)。N-末端AA残基4-5,14-18,22-34,47-54,60-63,69-74,81-82,102-110,142-154为可塑性区域,以50、105、155残基附近可塑性程度为高,可能具有一定柔韧性(见图2)。
 k63{ie, 百拇医药
k63{ie, 百拇医药图1 人Fas抗原可及性预测k63{ie, 百拇医药
Fig 1 Accessibility prediction of H-Fas
 k63{ie, 百拇医药
k63{ie, 百拇医药图2 人Fas抗原可塑性预测k63{ie, 百拇医药
Fig 2 Flexibility prediction of H-Fask63{ie, 百拇医药
2.2 抗原性方案和二级结构预测方案的预测结果 N-末端AA残基第4-9,18-26,32-47,50-58,74-89,105-114,121-129,131-132,144-150为抗原性区域,以20、38、55、77、81残基附近抗原性为强(见图3)。N-末端AA残基2-3,37-46,51-58,61-64,81-94,102-114,115-130,142-146,152-157为转角易形成区域(图4)。
 k63{ie, 百拇医药
k63{ie, 百拇医药图3 人Fas抗原抗原性预测k63{ie, 百拇医药
Fig 3 Antigenicity prediction of H-FasH-FAS length=157k63{ie, 百拇医药
H=helix, E=exptended, T=turn, C=coil


图4 人Fas抗原二级结构预测(H=螺旋/α-螺旋,E=伸展/β-折迭,T=转角,C=无规则卷曲)^!/?, http://www.100md.com
Fig 4 Prediction of H-Fas secondary structure(H=Helix/α-Helix, E=extended/β-Sheet, T=turn,C=Coil)^!/?, http://www.100md.com
2.3 人Fas B细胞表位预测结果 综合上述几个方案的预测结果。重点研究可及性和可塑性方案,结合抗原性预测、二级结构预测及综合位点预测方案结果(见图5),得出人Fas抗原的B细胞表位可能位于N-末端AA残基51-78,102-110,145-157区域或它们附近(未考虑糖链的影响)。
 ^!/?, http://www.100md.com
^!/?, http://www.100md.com图5 人Fas抗原表位分析^!/?, http://www.100md.com
Fig 5 Epitope analysis of H-Fas^!/?, http://www.100md.com
3 讨论^!/?, http://www.100md.com
3.1 B细胞蛋白抗原表位预测 B细胞识别蛋白抗原时,是以其表面的B细胞抗原受体(BCR)与蛋白抗原表位(抗原决定簇)结合,此过程与抗原抗体的结合相同。B细胞蛋白抗原表位的预测自从80年代Hopp和Woods提出亲水性参数对抗原表位预测的方法以来,已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨大的推动作用。现已被大众认可并具有较好预测效果的方法,主要有6种:①亲水性方案(Hydrophilicity),尤以Hopp和Woods方案最为有名。认为蛋白抗原各AA残基可分为亲水残基和疏水残基两类。在机体内,疏水性残基一般埋在蛋白内部,而亲水性残基位于表面,因此蛋白的亲水部位与蛋白的抗原位点有密切的联系。Hopp和Woods方案是以残基由有机相环境转移到水相环境的自由能为依据计算各个AA的亲水性。现已明确,亲水性部位与表位并无很好的一致性,即高亲水部位不一定是表位,表位也不一定是亲水性部位[4]。②可及性方案(Accessibility),指蛋白抗原中AA残基被溶剂分子接触的可能性,它反映了蛋白抗原内、外各层各残基的分布组成。③抗原性方案(Antigenicity)。认为除亲水性AA残基外,疏水性AA残基也经常出现在表位中,各残基在蛋白抗原位点中的相对出现率对抗原表位的定位预测有一定意义。许多蛋白抗原表位研究已证实,疏水性AA残基对表位形成亦有贡献。④可塑性方案(Flexibility)。指蛋白抗原构象不是刚性不变的,其多肽骨架有一定程度的活动性,活动性强的AA残基即可塑性大的位点,易形成抗原表位。⑤电荷分布方案(Charge distribution)。认为对碱性抗原特异的抗体多趋于酸性,对酸性抗原特异的抗体多趋于碱性。但现在理解电荷作用引起的只是非特异性结合。⑥二极结构预测(Secondary structure)。认为β转角结构为凸出结构,多出现在蛋白抗原表面,利于与抗体嵌合,较可能成为抗原表位。α螺旋、β片层结构规则,不易形变,较难嵌合抗体,一般不作为抗原位点[5~8]。
预测B细胞蛋白抗原表位一般以上述多种方案综合考虑,尤以可及性方案、可塑性方案、抗原性方案及二级结构预测为重要。概括而言,作为B细胞蛋白抗原的表位首先应易于位于或移动于蛋白抗原表面,有利于与B细胞抗原受体或抗体结合,另外,要有一定柔韧性,因为抗原与抗原受体或抗体结合时蛋白构象有一定变化。|]?r), http://www.100md.com
3.2 Fas抗原表位分析 H-Fas抗原能引起免疫应答的表位(功能性表位)位于其胞外区,其跨膜区和胞内区因存在空间位阻,不能成为其功能性表位。H-Fas抗原胞外区157个AA,MW为17.573+8KD(8KD为存在的潜在的糖链分子量),理论上应存在4~6个功能性表位,即能被B细胞识别,或与抗体结合。经过可及性方案、可塑性方案以及抗原性方案、二级结构预测、表位分析预测等综合考虑可能位于N-末端AA残基51-78,102-110,145-157等区域内或它们附近。由于H-Fas N-末端AA残基102位和120位有2个潜在的N-糖基化位点(Asn-×-Ser/Thr),对表位形成有一定影响,可能会改变或形成新的表位,H-Fas抗原的B细胞表位可能位于51-78,100-157区域内。这是一个比较粗的预测结果,只是排除了一些不易成为H-Fas抗原表位的肽段。至于其精细表位(4-9个AA残基)的确定可以在明确表位所在区域后,进一步采用交叠肽合成方法分析,并随分析的进行,合成的交叠肽逐渐缩短,以至最后确定Fas抗原的精细表位[9,10]。|]?r), http://www.100md.com
*全军“九五”医药卫生科研重点项目基金|]?r), http://www.100md.com
第一作者:男,30岁,博士,讲师|]?r), http://www.100md.com
参考文献|]?r), http://www.100md.com
[1] 宋建勋,朱锡华.Fas抗原表位与死亡信号传导的关系.免疫学杂志,1997,13(3):206|]?r), http://www.100md.com
[2] Itoh N,Yonehara S,Ishil A, et al. The polypeptide encoded by the cDNA for human cell surface antigen Fas can mediate apoptosis. Cell, 1991, 66(4):233|]?r), http://www.100md.com
[3] Oehm A,Behrmann I,Falk W, et al. Purification and molecular cloning of the Apo-1 cell surface antigen, a member of the tumor necrosis factor/nerve growth factor receptor superfamily. J Biol Chem, 1992,267(15):10709
[4] 吴玉章,朱锡华.蛋白质抗原表位的研究.科学,1994,185:93-y9lljp, http://www.100md.com
[5]` Shih DT, Boettiger D,Buck CA.Epitopes of adhesion-perturbing monoclonal antibodies map within a predicted alpha-helical domaein of the integrin beta 1 subunit. J Cell Sci, 1997,110(20):2619-y9lljp, http://www.100md.com
[6] Beezhold DH,Kostyal DA,Sussman GL.IgE epitope analysis of the hevein preprotein: a major latex allergen. Clin Exp Immunol. 1997,108(1):114-y9lljp, http://www.100md.com
[7] Barlow DJ,Edwards MS,Thornton JM, et al. Continuous and discontinuous protein antigenic determinants. Nature, 1986,322(6081):747-y9lljp, http://www.100md.com
[8] Shih DT,Edelman JM,Horwitz AF, et al. Structure/function analysis of the integrin β1 subnit by epitope mapping. J Cell Bio, 1993,122(6):1361-y9lljp, http://www.100md.com
[9] Holm L,Sander C.Mapping the protein universe. Science, 1996, 273(5275):595-y9lljp, http://www.100md.com
[10] Gershoni JM,Stem B, Venisova G.Combinatorial libraries, epitope structure and the prediction of protein conformations. Immunol Today, 1997,18(3):108-y9lljp, http://www.100md.com
(1998-06-09收稿;1998-09-23修回)(宋建勋1 朱锡华1 陈克敏1,2)