树突细胞从凋亡癌细胞获取抗原后的免疫应答
作者:吴刚 韩本立 余宏 裴雪涛$2:^}8/, 百拇医药
单位:吴刚(第三军医大学西南医院肝胆中心,重庆 400038); 韩本立(第三军医大学西南医院肝胆中心,重庆 400038); 余宏(重庆市急救中心,重庆 400010); 裴雪涛(军事 医学科学院放射医学研究所实验血液研究室,北京 100850)$2:^}8/, 百拇医药
关键词:树突状细胞;凋亡细胞;抗原提呈;细胞毒T淋巴细胞$2:^}8/, 百拇医药
免疫学杂志000103 摘 要:目的 观察树突状细胞(DCs )从凋亡胆管癌细胞获取抗原后,体外诱导抗肿瘤免疫应答及对胆管癌细胞的特异性免疫杀 伤效果。方法 用粒-巨噬细胞集落刺激因子(GM- CSF)加白介素-4(IL-4)从人外周血分化、诱导DCs、γ-射线在体外诱导培 养的人胆管癌细胞凋亡,将DCs、T淋巴细胞和凋亡胆管癌细胞共培养,同时设计不同类 型肿瘤细胞(坏死胆管癌细胞及培养胆管癌细胞)作对照,7d后,分离、富集DCs、T 淋巴细胞进行免疫应答及肿瘤细胞杀伤试验。结果 与 凋亡胆管癌细胞共培养之DCs可以有效提呈胆管癌细胞抗原,有强烈的免疫应答,刺激的 细胞毒T淋巴细胞(CTLs)特异性地杀伤胆管癌细胞。结论 用GM-CSF加IL-4从人外周血分化、诱导的DCs能从凋亡胆管癌细胞 有效提呈肿瘤抗原并诱导出显著的杀伤胆管癌细胞的免疫反应,可望成为有效的肿瘤特异性 免疫治疗新途径。$2:^}8/, 百拇医药
中图分类号:R392.11 文献标识码:A$2:^}8/, 百拇医药
Dendritic cells acquire antigen from apo ptotic hepatochlangioma cells and induce special CTLs$2:^}8/, 百拇医药
WU Gang HAN Ben-li$2:^}8/, 百拇医药
(Department of Hepatobiliary, Southwest Hospital,the Third Military Medical$2:^}8/, 百拇医药
University,Chongqing 400038,China)$2:^}8/, 百拇医药
YU Hong$2:^}8/, 百拇医药
(E mergency Medical Center,Chongqing 400010,China)
PEI Xue-tao/gu, 百拇医药
(Institute of Radiation M edicine, Academy of Military Medical Sci ence, Beijing 100850, China)/gu, 百拇医药
Abstract:Objective To inv estiga te the ability of dendritic cells(DCs)ac quiring antigen from apoptotic hepatochl angioma cells and inducing CTLs activati on.Methods DCs were pre pared from peripherad blood mononuclear induce d with gra-nulocyt e/macrophage colony-stimulating factor(G M-CSF) and interleukin-4.Apoptosis of he patochlangioma cells were induced with γ-radiation.We design these experiment groups including(1)coculture of DCs and apoptotic cancer cells and T cells,(2)co culture of DCs and necrosis cancer cells and T cells,(3)coculture of DCs and cul tured cancer cell and T cells,(4)cocultu re of DCs and T cell,(5)cocuture of DCs and cultured cancer cell.They are cocult ured for 7 days.Results On ly DCs cocultured with apoptotic cells c an induce special CTLs,while the group o f necrosis cancer cells and culture cell s can not.Conclusions H uman de ndritic cells can efficiently present an tigen derived from apoptotic cells and s timulate special CTLs.It will probably b ecome effective especial antitumor imm unological therapeuty.
Key words:dendritic cell s(DCs);cytotoxic T lymphocytes(CTLs);apo p tosis;hepatochlangioma▲tx3/-%, http://www.100md.com
树突状细胞(DCs)是专职的抗原提呈细胞,在宿主的免疫反应中起着重要作用 [1]。临床观察证明:不同的肿瘤存在肿瘤相关抗原(TAA)[2],肿瘤自 发性消失的出现证明了特异性抗肿瘤免疫的存在,但绝大多数恶性肿瘤呈进行性生长又表明 ,免疫机制不能完全有效地保护宿主[3]。许多证据表明免疫机制失能不是由于缺 乏 肿瘤抗原而是由于这些抗原不能有效提呈给T细胞产生特异性免疫反应之故[4]。 本实验进行了通过DCs提呈凋亡胆管癌细胞抗原并诱导特异性CTLs杀伤肿瘤细胞,通 过这一途径意欲打破肿瘤的免疫耐受,重建抗肿瘤特异性免疫反应,探索出一条有效的肿瘤 特异性免疫治疗新途径。tx3/-%, http://www.100md.com
1 材料与方法tx3/-%, http://www.100md.com
1.1 材料tx3/-%, http://www.100md.com
1.1.1 主要试剂:γ-射线照射源,军事医学科学院放射医学研究所60Co 源,剂量率2.07~2.23Gy/min;淋巴细胞分离液M450,英国进口分装( 上海化学试剂厂);CD2、CD19 Magnetic Beads 磁性分离试剂盒(Coulter公司);人T淋巴细胞富集柱(R&D公司);鼠抗人单 克隆荧光抗体CD1a (PE)、B7(FITC)(Pharmingen公司);培 养基(IMDM)(Gibcol Brl公司);胎牛血清(北京军区军马所);马血清 (北京军区军马所);重组人造血细胞生长因子(rHGFs),GM-CSF、IL-4 (Glaco公司)。tx3/-%, http://www.100md.com
1.1.2 细胞株:QBC939胆管癌细胞(第三军医大学西南医院王曙光博士惠赠) ;HepG2肝癌细胞、IL-60白血病细胞由军事医学科学院放射医学研究所血液研究 室保存。tx3/-%, http://www.100md.com
1.1.3 人外周血:来自自愿供血者。tx3/-%, http://www.100md.com
1.2 方法tx3/-%, http://www.100md.com
1.2.1 从人外周血定向诱导分化和培养树突状细胞:人外周血肝素抗凝,4∶1比例 与0.5%甲基纤维素混匀静置约30min,将红细胞自然沉降至界限分明,吸出上层( 上 清)有核细胞部分,通过淋巴细胞分离液(Ficoll-Paque)获取单个核细胞带 ;CD2、CD19免疫磁珠从单个核细胞悬液中去除T、B淋巴细胞并制成105/m l的细胞浓度悬液备用;24孔培养板每孔加1ml IMDM培养基,37°C、5%C O 2及饱和湿度的条件下,每孔单核细胞的初始浓度:2×104/ml,细胞因子:G M-CSF 50ng/ml、IL-4 1 000ng/ml每48h加入培养体系1 次,连续4次,1周半量换液。
1.2.2 从外周血分离T淋巴细胞:用T淋巴细胞富集柱从外周血中获取T淋巴细胞。/ho, http://www.100md.com
1.2.3 凋亡胆管癌细胞制备:取5×106胆管癌细胞4Gy照射6h使细胞出 现凋亡。/ho, http://www.100md.com
1.2.4 树突状细胞吞噬凋亡小体负载抗原:IMDM培养基,37°C、5%CO 2及饱和湿度的条件下,从人外周血定向诱导分化和培养树突状细胞并在培养的第3dDC s、T淋巴细胞和凋亡胆管癌细胞共培养;为了证明凋亡是抗原交叉提呈中的重要环节,设 计了DCs、T淋巴细胞和坏死胆管癌细胞共培养组(胆管癌细胞加入低渗盐水在37°C 、5%CO2及饱和湿度的条件下培养30min)以及正常培养的胆管癌细胞;为了证 明 DC的抗原提呈作用及免疫刺激功能,设计了T淋巴细胞和凋亡胆管癌细胞共培养组,为了 证明负载抗原后的DC刺激特异性CTLs,设计了DCs、T淋巴细胞共培养组。共培养 7d后,收集DC、T淋巴细胞备用。/ho, http://www.100md.com
1.2.5 从共培养中分离、富集树突状细胞、T淋巴细胞:分别从24孔板收集DCs 、T与凋亡胆管癌细胞,DCs、T与坏死肿瘤细胞、DCs与T淋巴细胞、T淋巴细胞与 凋亡胆管癌细胞的培养液,用IMDM培养液悬浮细胞,离心(650×g,10min) 洗细胞1次,离心(200×g,10min)洗细胞2次,洗凋亡小体和坏死肿瘤细胞, 再用培养基重悬细胞,获得受凋亡胆管癌细胞和坏死胆管癌细胞刺激的DCs与T细胞;用 去T淋巴细胞的免疫磁珠法按实验手册所述的方法将T淋巴细胞、DCs分离或用人T淋巴 细胞富集柱(R&D公司,美国)收集,分别获得T细胞、DCs备用。/ho, http://www.100md.com
1.2.6 负载抗原后DCs的免疫活性:4组DCs(受凋亡胆管癌细胞刺激、坏死胆 管癌细胞刺激、正常培养的胆管癌细胞及自体T淋巴细胞的刺激)用IMDM培养基悬浮, 浓度为5×105/ml,分别以1×103/孔,5×103/孔,1×104 /孔加入96孔圆底培养板,用单核细胞作对照组,每组各3个复孔,每孔再加入同种T细 胞1×105,终体积为200μl,37°C、5% CO2及饱和湿度的条件下 培养96h, 于培养前18h加H3-TdR,0.5μCi/孔。收集细胞,液闪计数检测cpm值 ,结果用3孔平均值表示。
1.2.7 CTLs杀伤活性试验(MTT法):按前述方法获得共培养7d后各组T淋 巴细胞,靶细胞分别是胆管癌细胞、HepG2肝癌细胞、HL-60白血病细胞,效靶 比为1∶1、15∶1、30∶1。分别以1×104/孔,1.5×105/孔,3 ×105/孔加入96孔圆底培养板,用未受刺激的T淋巴细胞作对照组,每组各3个复 孔,每孔再加入肿瘤细胞1×104/孔,终体积为200μl,37°C、5%CO 2及饱和湿度的条件下,培养4h,弃去100μl上清,加入MTT液(5mg/ml )20μl/ml,上述相同条件继续培养2h。每孔加入酸化异丙醇100μl,振荡5 min,在波长570nm处测OD值。?jkv&, 百拇医药
2 结果?jkv&, 百拇医药
2.1 电镜观察 透射电镜可见DCs伸展的突起,胞浆中富含线粒 体,较少溶酶体,并 可见凋亡物质(凋亡小体)(见图1);扫描电镜还拍摄到DC正在捕捉凋亡小体(见图2);γ-射线照射促使胆管癌细胞发生凋亡并释放凋亡小体(见图3)。 ?jkv&, 百拇医药
?jkv&, 百拇医药
图1 透射电镜显示树突状细胞吞噬的凋亡小体(×7600)?jkv&, 百拇医药
Fig1 Transmission electron microscopy revealed apoptotic material and body of apoptotic cell within the cytoplasm of glutaraldehyde-fixed DCs ?jkv&, 百拇医药
?jkv&, 百拇医药
图2 扫描电镜显示树突状细胞捕捉凋亡小体(×4200)?jkv&, 百拇医药
Fig2 Scaning electr on microscopy revealed DC trapping body of apoptotic cell ?jkv&, 百拇医药
?jkv&, 百拇医药
图3 透射电镜显示胆管癌细胞发生凋亡形成凋亡小体(×7600)
Fig3 Transmission electron microscopy revealed that he-patochlangioma cell had finished apoptosis(programmed cell death)(×7600)\ezt, http://www.100md.com
2.2 DCs的免疫刺激活性 同种自体混合淋巴细胞反应时,少量 DCs即可强烈激发T淋巴细胞的增殖,在抗原处理DCs 72h后,其激发能力进一步 增强(P<0.05)(见图4)。而对照组由于是单核细胞而非DCs,故并不能有 效激发T淋巴细胞的增殖。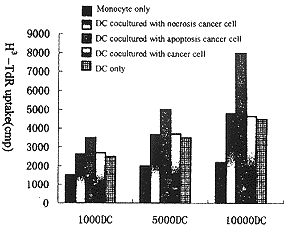 \ezt, http://www.100md.com
\ezt, http://www.100md.com
图4 负载抗原后树突状细胞的免疫刺激活性\ezt, http://www.100md.com
Fig4 The MLR stimul atory capacity of DCs presented antigene\ezt, http://www.100md.com
2.3 CTLs杀伤活性试验(MTT法) (1)组T细胞是来自 DCs+T淋巴细胞和凋亡胆管癌细胞共培养组。在细胞杀伤试验3种靶细胞中能特异性地 识别并杀伤胆管癌细胞,其杀伤能力与效应细胞数量成正比,故说明DCs通过凋亡胆管癌细胞 获取胆管癌细胞抗原刺激T淋巴细胞产生特异性CTLs。(2)组T淋巴细胞是来自DC s+T淋巴细胞和胆管癌细胞共培养组。由于在细胞杀伤试验中,仅能有限地杀伤胆管癌细 胞,说明DCs不能有效地从培养的胆管癌细胞中获取抗原,从而有效刺激T淋巴细胞产生 特异性CTLs。(3)组T细胞是来自DCs+T淋巴细胞和坏死胆管癌细胞共培养组。 在细胞杀伤试验中,不能特异性地杀伤胆管癌细胞,故说明DCs不能从坏死胆管癌细胞中 获取抗原。(4)组T细胞是来自DCs+T淋巴细胞无肿瘤细胞共培养组。DCs如果无 抗原呈递增的对象,其本身是不能刺激T细胞产生特异性CTLs的,故在细胞杀 伤试验中 识别及杀伤3种靶细胞的效率极低。(5)组T细胞是来自T淋巴细胞+凋亡胆管癌细胞无 DCs共培养组。在无DCs条件下,仅有T细胞和凋亡胆管癌细胞,缺乏DCs抗原提呈 并刺激T细胞产生特异性CTLs,故在细胞杀伤试验中T细胞不具有杀伤肿瘤细胞的能力 。(6)组T细胞是来自外周血分离出的T细胞作对照组。由于缺乏DCs 抗原提呈和刺激作用,在细胞杀伤试验中T细胞不具有特异性杀伤肿瘤细胞的能力(见图5 ~图7)。
图5 效靶比为30∶14, http://www.100md.com
Fig5 Effector:target ratio 30∶1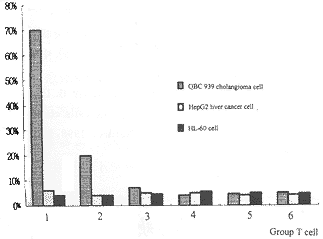 4, http://www.100md.com
4, http://www.100md.com
图6 效靶比为15∶14, http://www.100md.com
Fig6 Effector:target ratio 15∶1 4, http://www.100md.com
4, http://www.100md.com
图7 效靶比为1∶14, http://www.100md.com
Fig7 Effector:target ratio 1∶1 Figure 5~7 dendritic cells acquire antigen from apopotic cholangioma cells and induce class I-restricted CTLs4, http://www.100md.com
3 讨论4, http://www.100md.com
DCs在免疫系统中扮演了一个重要角色,它们是最有效的专职抗原提呈细胞。树突状细胞 在分化发育过程中存在2个不同的阶段,作为未成熟的DCs,具有摄取、处理抗原的能力 并存在于全身非淋巴性组织中,一旦发育为成熟的DCs,抗原捕获能力丧失,却成为能 激活静息T细胞激发初次免疫反应的抗原递呈细胞[5]。本研究发现并证实了DCs而非单核细胞可以有效提呈凋亡胆管癌细胞的抗原(坏死胆管癌细胞和培养的胆管癌细胞却不能有效地传递抗原给DCs),刺激MHC-I限制的特异性CTLs[6]。4, http://www.100md.com
3.1 以树突状细胞为基础的肿瘤特异性免疫治疗现状 目前DCs提呈肿瘤抗原的方法主要有:①抗原多肽刺激的DCs;②酸提抗原刺激的DCs;③肿瘤抗原编码基因导入DCs;④肿瘤mRNA刺激DCs;⑤细胞因子基因修饰DCs及其与 肿瘤细胞融合。但上述方法要么存在抗原提呈效果不甚满意,要么存在技术上的困难而难于 推广运用。如抗原多肽刺激DCs,Duke University的LYERLY用C EA-RNA刺激自体DCs治疗消化道CEA阳性恶性肿瘤,已进入临床Ⅰ期试验[ 7],但目前存在的问题是:已知的抗原肽并不一定能诱导最佳的抗原肿瘤免疫反应,针对单一抗原决定簇的CTLs克隆未必能诱导抗肿瘤免疫反应。因此,针对多个抗原决定簇的CTLs克隆共同作用可能发挥最佳的抗肿瘤作用。为解决上述方法的不足又有学者通过 酸提抗原刺激DCs来解决,如用肿瘤细胞的蛋白提取物刺激DCs能克服肿瘤抗原多肽刺 激存在的某些不足,它无需明确肿瘤抗原,可能有多种不同的抗原刺激DCs,从而诱导针 对不同抗原决定簇的CTLs克隆等。但用肿瘤细胞的膜提取物刺激DCs存在的不足是: 肿瘤细胞蛋白提取物中的抗原成分复杂,其中包括机体自身的正常抗原刺激DCs后,免疫 机体存在诱发自身免疫性疾病的潜在危险。随后有学者将肿瘤抗原编码基因导入DCs转呈 肿瘤抗原,肿瘤抗原编码基因导入后能在DCs内持续表达肿瘤抗原,可以克服抗原直接刺 激的DCs由于抗原-MHC复合物解离或细胞MHC分子降解对其诱导T细胞免疫应答所 产生的不利影响。加拿大McMASTER大学病理生理系王永红等[8]在体 外用腺病毒介导肿瘤相关抗原编码基因修饰DCs细胞可以表达肿瘤特异性抗原,无毒性, 能有效刺激肿瘤免疫反应。还有用肿瘤mRNA来刺激DCs,将来源于肿瘤细胞的mRN A刺激DCs能诱导小鼠产生特异性的抗肿瘤免疫反应,提示用肿瘤mRNA可能替代肿瘤 抗原刺激DCs,用于肿瘤免疫治疗。最近,第二军医大学曹雪涛等将GM-CSF基因修 饰DCs然后与肿瘤细胞融合,融合的DCs表达自身的表面免疫应答相关分子及分泌细胞因子,同时获得肿瘤细胞的肿瘤抗原信息,据报道有显著的免疫治疗作用[9]。但 该方法技术条件要求甚高,推广运用有一定难度。本实验研究发现用GM-CSF加IL- 4从外周血单核细胞诱导之DCs与凋亡胆管癌细胞共培养,可以有效提呈胆管癌细胞抗原,有强烈的免疫应答,刺激的细胞毒T淋巴细胞(CTLs)特异性地杀伤胆管癌细胞。为肿瘤特异性免疫治疗提供了新的思路和依据。
既往在细胞凋亡与免疫系统研究中,侧重于免疫细胞发育过程中的免疫细胞凋亡导致的成熟 T细胞对自身抗原的免疫耐受机制及自身免疫性疾病发病机制的研究。最新研究发现:包裹 在凋亡小体外面的膜性物质是一种与原生存细胞膜相一致的免疫原性物质,当凋亡小体被早 期DCs吞噬后,凋亡小体膜携带的抗原能被树突状细胞的MHC-I分子所提呈,从而诱 导MHC-I分子限制的特异性CTLs。这突破了原来靶细胞胞浆中的抗原是被细胞本身 的MHC-I分子处理和提呈的概念[10]。*:q^%[, http://www.100md.com
3.2 展望 众所周知,通过肿瘤的常规疗法(手术、放疗、化疗)往往难以获得根治,难以解 决转移和复发的问题,且常有明显的损伤和毒副作用,如能激发、增强机体对肿瘤的主动免疫排斥反应,则有可能达到根治肿瘤的目的,而且这在本质上属于一种生理性治疗措施。那么,在体内应该能建立类似于体外定向诱导分化DCs和诱导肿瘤细胞凋亡的可控条件,获得大量高纯度的DCs及体内诱导的能传递抗原给DCs的肿瘤细胞凋亡小体,通过DCs提呈抗原诱导特异性CTLs进行主动特异性免疫抗肿瘤治疗,将在肿瘤的免疫治疗上创造出令人吃惊的效果。这是值得我们进行深入研究、开发和应用的领域。■*:q^%[, http://www.100md.com
基金项目:国家杰出青年科学基金资助项目(3982511)*:q^%[, http://www.100md.com
作者简介:吴刚(1963-),男,重庆市人,主治医 师,博士,主要从事树突细胞的临床运用方面的研究。*:q^%[, http://www.100md.com
参考文献:*:q^%[, http://www.100md.com
[1]SCHULER G,THUMER M,ROMANIN.Dendritic Cell:from ignored cell to major players in T-cell-mediated immunity[J].Int Arch Allergy Immunol,1997,112:317~322.*:q^%[, http://www.100md.com
[2]BOON T.Teaching the immune system to fight cancer[J].Sci Am,1993,3:82~86.*:q^%[, http://www.100md.com
[3]THOMAS T,WALTER JS, MICHAEL T.Gene- based strategies for the immunotherapy of cancer [J].J Exp Med, 1997,75:478~481 .
[4]BOON T,VAN DER BRUGGEN P. Human tumo r antigens recognized by Tlymphocytes[J].J Exp Med,1996,183:725~729.q*yg'[m, 百拇医药
[5]SCHULER G,STEINMAN RM. De ndritic Cel ls as Adjuvants for Immune-mediated Resi stance to Tumors[J]. J Exp Med, 1997,186 :1183~1187.q*yg'[m, 百拇医药
[6]WATTS C.Capture and proc essing of exogenous antigens for presentation on MHC molecules[J].Annu Rev Immunol,1997,15:821~825.q*yg'[m, 百拇医药
[7]LYERLY HK.A Phase I Study of Active Immu-notherapy with Ca rcinoembryonic Ant igen RNA-Pulsed Autologous Human Culture d Dendritic Cells in Patients with Metas tatic Malignancies Expressing Carcinoemb ryonic Antigen[J].Human Gene Ther,1998,9:394~402.q*yg'[m, 百拇医药
[8] WAN YH,BRAMSON J, CARTER R ,et al. De ndritic Cells Transduced with an Adenoviral Vector Encoding a Model Tumor-Associ ated Antigen for Tumor Vaccination[J].Human Gene Ther, 1997,8:1355~1363.q*yg'[m, 百拇医药
[9]章卫平,曹雪涛,黄 欣,等.基因修饰的树突状细胞融合后 的瘤苗抗肿瘤免疫应答的实验研究[J].中华医学杂志,1997,77:39~42.q*yg'[m, 百拇医药
[10]MATTHEW L,ALBERT BS, NINA B.Dendritic cells acquire antigen from apoptotic cells and induce class I-restri cted CTLs[J].Nature,1998,392:86~89.q*yg'[m, 百拇医药
收稿日期:1999-07-09q*yg'[m, 百拇医药
修回日期:1999-09-16(吴刚 韩本立 余宏 裴雪涛)
单位:吴刚(第三军医大学西南医院肝胆中心,重庆 400038); 韩本立(第三军医大学西南医院肝胆中心,重庆 400038); 余宏(重庆市急救中心,重庆 400010); 裴雪涛(军事 医学科学院放射医学研究所实验血液研究室,北京 100850)$2:^}8/, 百拇医药
关键词:树突状细胞;凋亡细胞;抗原提呈;细胞毒T淋巴细胞$2:^}8/, 百拇医药
免疫学杂志000103 摘 要:目的 观察树突状细胞(DCs )从凋亡胆管癌细胞获取抗原后,体外诱导抗肿瘤免疫应答及对胆管癌细胞的特异性免疫杀 伤效果。方法 用粒-巨噬细胞集落刺激因子(GM- CSF)加白介素-4(IL-4)从人外周血分化、诱导DCs、γ-射线在体外诱导培 养的人胆管癌细胞凋亡,将DCs、T淋巴细胞和凋亡胆管癌细胞共培养,同时设计不同类 型肿瘤细胞(坏死胆管癌细胞及培养胆管癌细胞)作对照,7d后,分离、富集DCs、T 淋巴细胞进行免疫应答及肿瘤细胞杀伤试验。结果 与 凋亡胆管癌细胞共培养之DCs可以有效提呈胆管癌细胞抗原,有强烈的免疫应答,刺激的 细胞毒T淋巴细胞(CTLs)特异性地杀伤胆管癌细胞。结论 用GM-CSF加IL-4从人外周血分化、诱导的DCs能从凋亡胆管癌细胞 有效提呈肿瘤抗原并诱导出显著的杀伤胆管癌细胞的免疫反应,可望成为有效的肿瘤特异性 免疫治疗新途径。$2:^}8/, 百拇医药
中图分类号:R392.11 文献标识码:A$2:^}8/, 百拇医药
Dendritic cells acquire antigen from apo ptotic hepatochlangioma cells and induce special CTLs$2:^}8/, 百拇医药
WU Gang HAN Ben-li$2:^}8/, 百拇医药
(Department of Hepatobiliary, Southwest Hospital,the Third Military Medical$2:^}8/, 百拇医药
University,Chongqing 400038,China)$2:^}8/, 百拇医药
YU Hong$2:^}8/, 百拇医药
(E mergency Medical Center,Chongqing 400010,China)
PEI Xue-tao/gu, 百拇医药
(Institute of Radiation M edicine, Academy of Military Medical Sci ence, Beijing 100850, China)/gu, 百拇医药
Abstract:Objective To inv estiga te the ability of dendritic cells(DCs)ac quiring antigen from apoptotic hepatochl angioma cells and inducing CTLs activati on.Methods DCs were pre pared from peripherad blood mononuclear induce d with gra-nulocyt e/macrophage colony-stimulating factor(G M-CSF) and interleukin-4.Apoptosis of he patochlangioma cells were induced with γ-radiation.We design these experiment groups including(1)coculture of DCs and apoptotic cancer cells and T cells,(2)co culture of DCs and necrosis cancer cells and T cells,(3)coculture of DCs and cul tured cancer cell and T cells,(4)cocultu re of DCs and T cell,(5)cocuture of DCs and cultured cancer cell.They are cocult ured for 7 days.Results On ly DCs cocultured with apoptotic cells c an induce special CTLs,while the group o f necrosis cancer cells and culture cell s can not.Conclusions H uman de ndritic cells can efficiently present an tigen derived from apoptotic cells and s timulate special CTLs.It will probably b ecome effective especial antitumor imm unological therapeuty.
Key words:dendritic cell s(DCs);cytotoxic T lymphocytes(CTLs);apo p tosis;hepatochlangioma▲tx3/-%, http://www.100md.com
树突状细胞(DCs)是专职的抗原提呈细胞,在宿主的免疫反应中起着重要作用 [1]。临床观察证明:不同的肿瘤存在肿瘤相关抗原(TAA)[2],肿瘤自 发性消失的出现证明了特异性抗肿瘤免疫的存在,但绝大多数恶性肿瘤呈进行性生长又表明 ,免疫机制不能完全有效地保护宿主[3]。许多证据表明免疫机制失能不是由于缺 乏 肿瘤抗原而是由于这些抗原不能有效提呈给T细胞产生特异性免疫反应之故[4]。 本实验进行了通过DCs提呈凋亡胆管癌细胞抗原并诱导特异性CTLs杀伤肿瘤细胞,通 过这一途径意欲打破肿瘤的免疫耐受,重建抗肿瘤特异性免疫反应,探索出一条有效的肿瘤 特异性免疫治疗新途径。tx3/-%, http://www.100md.com
1 材料与方法tx3/-%, http://www.100md.com
1.1 材料tx3/-%, http://www.100md.com
1.1.1 主要试剂:γ-射线照射源,军事医学科学院放射医学研究所60Co 源,剂量率2.07~2.23Gy/min;淋巴细胞分离液M450,英国进口分装( 上海化学试剂厂);CD2、CD19 Magnetic Beads 磁性分离试剂盒(Coulter公司);人T淋巴细胞富集柱(R&D公司);鼠抗人单 克隆荧光抗体CD1a (PE)、B7(FITC)(Pharmingen公司);培 养基(IMDM)(Gibcol Brl公司);胎牛血清(北京军区军马所);马血清 (北京军区军马所);重组人造血细胞生长因子(rHGFs),GM-CSF、IL-4 (Glaco公司)。tx3/-%, http://www.100md.com
1.1.2 细胞株:QBC939胆管癌细胞(第三军医大学西南医院王曙光博士惠赠) ;HepG2肝癌细胞、IL-60白血病细胞由军事医学科学院放射医学研究所血液研究 室保存。tx3/-%, http://www.100md.com
1.1.3 人外周血:来自自愿供血者。tx3/-%, http://www.100md.com
1.2 方法tx3/-%, http://www.100md.com
1.2.1 从人外周血定向诱导分化和培养树突状细胞:人外周血肝素抗凝,4∶1比例 与0.5%甲基纤维素混匀静置约30min,将红细胞自然沉降至界限分明,吸出上层( 上 清)有核细胞部分,通过淋巴细胞分离液(Ficoll-Paque)获取单个核细胞带 ;CD2、CD19免疫磁珠从单个核细胞悬液中去除T、B淋巴细胞并制成105/m l的细胞浓度悬液备用;24孔培养板每孔加1ml IMDM培养基,37°C、5%C O 2及饱和湿度的条件下,每孔单核细胞的初始浓度:2×104/ml,细胞因子:G M-CSF 50ng/ml、IL-4 1 000ng/ml每48h加入培养体系1 次,连续4次,1周半量换液。
1.2.2 从外周血分离T淋巴细胞:用T淋巴细胞富集柱从外周血中获取T淋巴细胞。/ho, http://www.100md.com
1.2.3 凋亡胆管癌细胞制备:取5×106胆管癌细胞4Gy照射6h使细胞出 现凋亡。/ho, http://www.100md.com
1.2.4 树突状细胞吞噬凋亡小体负载抗原:IMDM培养基,37°C、5%CO 2及饱和湿度的条件下,从人外周血定向诱导分化和培养树突状细胞并在培养的第3dDC s、T淋巴细胞和凋亡胆管癌细胞共培养;为了证明凋亡是抗原交叉提呈中的重要环节,设 计了DCs、T淋巴细胞和坏死胆管癌细胞共培养组(胆管癌细胞加入低渗盐水在37°C 、5%CO2及饱和湿度的条件下培养30min)以及正常培养的胆管癌细胞;为了证 明 DC的抗原提呈作用及免疫刺激功能,设计了T淋巴细胞和凋亡胆管癌细胞共培养组,为了 证明负载抗原后的DC刺激特异性CTLs,设计了DCs、T淋巴细胞共培养组。共培养 7d后,收集DC、T淋巴细胞备用。/ho, http://www.100md.com
1.2.5 从共培养中分离、富集树突状细胞、T淋巴细胞:分别从24孔板收集DCs 、T与凋亡胆管癌细胞,DCs、T与坏死肿瘤细胞、DCs与T淋巴细胞、T淋巴细胞与 凋亡胆管癌细胞的培养液,用IMDM培养液悬浮细胞,离心(650×g,10min) 洗细胞1次,离心(200×g,10min)洗细胞2次,洗凋亡小体和坏死肿瘤细胞, 再用培养基重悬细胞,获得受凋亡胆管癌细胞和坏死胆管癌细胞刺激的DCs与T细胞;用 去T淋巴细胞的免疫磁珠法按实验手册所述的方法将T淋巴细胞、DCs分离或用人T淋巴 细胞富集柱(R&D公司,美国)收集,分别获得T细胞、DCs备用。/ho, http://www.100md.com
1.2.6 负载抗原后DCs的免疫活性:4组DCs(受凋亡胆管癌细胞刺激、坏死胆 管癌细胞刺激、正常培养的胆管癌细胞及自体T淋巴细胞的刺激)用IMDM培养基悬浮, 浓度为5×105/ml,分别以1×103/孔,5×103/孔,1×104 /孔加入96孔圆底培养板,用单核细胞作对照组,每组各3个复孔,每孔再加入同种T细 胞1×105,终体积为200μl,37°C、5% CO2及饱和湿度的条件下 培养96h, 于培养前18h加H3-TdR,0.5μCi/孔。收集细胞,液闪计数检测cpm值 ,结果用3孔平均值表示。
1.2.7 CTLs杀伤活性试验(MTT法):按前述方法获得共培养7d后各组T淋 巴细胞,靶细胞分别是胆管癌细胞、HepG2肝癌细胞、HL-60白血病细胞,效靶 比为1∶1、15∶1、30∶1。分别以1×104/孔,1.5×105/孔,3 ×105/孔加入96孔圆底培养板,用未受刺激的T淋巴细胞作对照组,每组各3个复 孔,每孔再加入肿瘤细胞1×104/孔,终体积为200μl,37°C、5%CO 2及饱和湿度的条件下,培养4h,弃去100μl上清,加入MTT液(5mg/ml )20μl/ml,上述相同条件继续培养2h。每孔加入酸化异丙醇100μl,振荡5 min,在波长570nm处测OD值。?jkv&, 百拇医药
2 结果?jkv&, 百拇医药
2.1 电镜观察 透射电镜可见DCs伸展的突起,胞浆中富含线粒 体,较少溶酶体,并 可见凋亡物质(凋亡小体)(见图1);扫描电镜还拍摄到DC正在捕捉凋亡小体(见图2);γ-射线照射促使胆管癌细胞发生凋亡并释放凋亡小体(见图3)。
 ?jkv&, 百拇医药
?jkv&, 百拇医药图1 透射电镜显示树突状细胞吞噬的凋亡小体(×7600)?jkv&, 百拇医药
Fig1 Transmission electron microscopy revealed apoptotic material and body of apoptotic cell within the cytoplasm of glutaraldehyde-fixed DCs
 ?jkv&, 百拇医药
?jkv&, 百拇医药图2 扫描电镜显示树突状细胞捕捉凋亡小体(×4200)?jkv&, 百拇医药
Fig2 Scaning electr on microscopy revealed DC trapping body of apoptotic cell
 ?jkv&, 百拇医药
?jkv&, 百拇医药图3 透射电镜显示胆管癌细胞发生凋亡形成凋亡小体(×7600)
Fig3 Transmission electron microscopy revealed that he-patochlangioma cell had finished apoptosis(programmed cell death)(×7600)\ezt, http://www.100md.com
2.2 DCs的免疫刺激活性 同种自体混合淋巴细胞反应时,少量 DCs即可强烈激发T淋巴细胞的增殖,在抗原处理DCs 72h后,其激发能力进一步 增强(P<0.05)(见图4)。而对照组由于是单核细胞而非DCs,故并不能有 效激发T淋巴细胞的增殖。
 \ezt, http://www.100md.com
\ezt, http://www.100md.com图4 负载抗原后树突状细胞的免疫刺激活性\ezt, http://www.100md.com
Fig4 The MLR stimul atory capacity of DCs presented antigene\ezt, http://www.100md.com
2.3 CTLs杀伤活性试验(MTT法) (1)组T细胞是来自 DCs+T淋巴细胞和凋亡胆管癌细胞共培养组。在细胞杀伤试验3种靶细胞中能特异性地 识别并杀伤胆管癌细胞,其杀伤能力与效应细胞数量成正比,故说明DCs通过凋亡胆管癌细胞 获取胆管癌细胞抗原刺激T淋巴细胞产生特异性CTLs。(2)组T淋巴细胞是来自DC s+T淋巴细胞和胆管癌细胞共培养组。由于在细胞杀伤试验中,仅能有限地杀伤胆管癌细 胞,说明DCs不能有效地从培养的胆管癌细胞中获取抗原,从而有效刺激T淋巴细胞产生 特异性CTLs。(3)组T细胞是来自DCs+T淋巴细胞和坏死胆管癌细胞共培养组。 在细胞杀伤试验中,不能特异性地杀伤胆管癌细胞,故说明DCs不能从坏死胆管癌细胞中 获取抗原。(4)组T细胞是来自DCs+T淋巴细胞无肿瘤细胞共培养组。DCs如果无 抗原呈递增的对象,其本身是不能刺激T细胞产生特异性CTLs的,故在细胞杀 伤试验中 识别及杀伤3种靶细胞的效率极低。(5)组T细胞是来自T淋巴细胞+凋亡胆管癌细胞无 DCs共培养组。在无DCs条件下,仅有T细胞和凋亡胆管癌细胞,缺乏DCs抗原提呈 并刺激T细胞产生特异性CTLs,故在细胞杀伤试验中T细胞不具有杀伤肿瘤细胞的能力 。(6)组T细胞是来自外周血分离出的T细胞作对照组。由于缺乏DCs 抗原提呈和刺激作用,在细胞杀伤试验中T细胞不具有特异性杀伤肿瘤细胞的能力(见图5 ~图7)。

图5 效靶比为30∶14, http://www.100md.com
Fig5 Effector:target ratio 30∶1
 4, http://www.100md.com
4, http://www.100md.com图6 效靶比为15∶14, http://www.100md.com
Fig6 Effector:target ratio 15∶1
 4, http://www.100md.com
4, http://www.100md.com图7 效靶比为1∶14, http://www.100md.com
Fig7 Effector:target ratio 1∶1 Figure 5~7 dendritic cells acquire antigen from apopotic cholangioma cells and induce class I-restricted CTLs4, http://www.100md.com
3 讨论4, http://www.100md.com
DCs在免疫系统中扮演了一个重要角色,它们是最有效的专职抗原提呈细胞。树突状细胞 在分化发育过程中存在2个不同的阶段,作为未成熟的DCs,具有摄取、处理抗原的能力 并存在于全身非淋巴性组织中,一旦发育为成熟的DCs,抗原捕获能力丧失,却成为能 激活静息T细胞激发初次免疫反应的抗原递呈细胞[5]。本研究发现并证实了DCs而非单核细胞可以有效提呈凋亡胆管癌细胞的抗原(坏死胆管癌细胞和培养的胆管癌细胞却不能有效地传递抗原给DCs),刺激MHC-I限制的特异性CTLs[6]。4, http://www.100md.com
3.1 以树突状细胞为基础的肿瘤特异性免疫治疗现状 目前DCs提呈肿瘤抗原的方法主要有:①抗原多肽刺激的DCs;②酸提抗原刺激的DCs;③肿瘤抗原编码基因导入DCs;④肿瘤mRNA刺激DCs;⑤细胞因子基因修饰DCs及其与 肿瘤细胞融合。但上述方法要么存在抗原提呈效果不甚满意,要么存在技术上的困难而难于 推广运用。如抗原多肽刺激DCs,Duke University的LYERLY用C EA-RNA刺激自体DCs治疗消化道CEA阳性恶性肿瘤,已进入临床Ⅰ期试验[ 7],但目前存在的问题是:已知的抗原肽并不一定能诱导最佳的抗原肿瘤免疫反应,针对单一抗原决定簇的CTLs克隆未必能诱导抗肿瘤免疫反应。因此,针对多个抗原决定簇的CTLs克隆共同作用可能发挥最佳的抗肿瘤作用。为解决上述方法的不足又有学者通过 酸提抗原刺激DCs来解决,如用肿瘤细胞的蛋白提取物刺激DCs能克服肿瘤抗原多肽刺 激存在的某些不足,它无需明确肿瘤抗原,可能有多种不同的抗原刺激DCs,从而诱导针 对不同抗原决定簇的CTLs克隆等。但用肿瘤细胞的膜提取物刺激DCs存在的不足是: 肿瘤细胞蛋白提取物中的抗原成分复杂,其中包括机体自身的正常抗原刺激DCs后,免疫 机体存在诱发自身免疫性疾病的潜在危险。随后有学者将肿瘤抗原编码基因导入DCs转呈 肿瘤抗原,肿瘤抗原编码基因导入后能在DCs内持续表达肿瘤抗原,可以克服抗原直接刺 激的DCs由于抗原-MHC复合物解离或细胞MHC分子降解对其诱导T细胞免疫应答所 产生的不利影响。加拿大McMASTER大学病理生理系王永红等[8]在体 外用腺病毒介导肿瘤相关抗原编码基因修饰DCs细胞可以表达肿瘤特异性抗原,无毒性, 能有效刺激肿瘤免疫反应。还有用肿瘤mRNA来刺激DCs,将来源于肿瘤细胞的mRN A刺激DCs能诱导小鼠产生特异性的抗肿瘤免疫反应,提示用肿瘤mRNA可能替代肿瘤 抗原刺激DCs,用于肿瘤免疫治疗。最近,第二军医大学曹雪涛等将GM-CSF基因修 饰DCs然后与肿瘤细胞融合,融合的DCs表达自身的表面免疫应答相关分子及分泌细胞因子,同时获得肿瘤细胞的肿瘤抗原信息,据报道有显著的免疫治疗作用[9]。但 该方法技术条件要求甚高,推广运用有一定难度。本实验研究发现用GM-CSF加IL- 4从外周血单核细胞诱导之DCs与凋亡胆管癌细胞共培养,可以有效提呈胆管癌细胞抗原,有强烈的免疫应答,刺激的细胞毒T淋巴细胞(CTLs)特异性地杀伤胆管癌细胞。为肿瘤特异性免疫治疗提供了新的思路和依据。
既往在细胞凋亡与免疫系统研究中,侧重于免疫细胞发育过程中的免疫细胞凋亡导致的成熟 T细胞对自身抗原的免疫耐受机制及自身免疫性疾病发病机制的研究。最新研究发现:包裹 在凋亡小体外面的膜性物质是一种与原生存细胞膜相一致的免疫原性物质,当凋亡小体被早 期DCs吞噬后,凋亡小体膜携带的抗原能被树突状细胞的MHC-I分子所提呈,从而诱 导MHC-I分子限制的特异性CTLs。这突破了原来靶细胞胞浆中的抗原是被细胞本身 的MHC-I分子处理和提呈的概念[10]。*:q^%[, http://www.100md.com
3.2 展望 众所周知,通过肿瘤的常规疗法(手术、放疗、化疗)往往难以获得根治,难以解 决转移和复发的问题,且常有明显的损伤和毒副作用,如能激发、增强机体对肿瘤的主动免疫排斥反应,则有可能达到根治肿瘤的目的,而且这在本质上属于一种生理性治疗措施。那么,在体内应该能建立类似于体外定向诱导分化DCs和诱导肿瘤细胞凋亡的可控条件,获得大量高纯度的DCs及体内诱导的能传递抗原给DCs的肿瘤细胞凋亡小体,通过DCs提呈抗原诱导特异性CTLs进行主动特异性免疫抗肿瘤治疗,将在肿瘤的免疫治疗上创造出令人吃惊的效果。这是值得我们进行深入研究、开发和应用的领域。■*:q^%[, http://www.100md.com
基金项目:国家杰出青年科学基金资助项目(3982511)*:q^%[, http://www.100md.com
作者简介:吴刚(1963-),男,重庆市人,主治医 师,博士,主要从事树突细胞的临床运用方面的研究。*:q^%[, http://www.100md.com
参考文献:*:q^%[, http://www.100md.com
[1]SCHULER G,THUMER M,ROMANIN.Dendritic Cell:from ignored cell to major players in T-cell-mediated immunity[J].Int Arch Allergy Immunol,1997,112:317~322.*:q^%[, http://www.100md.com
[2]BOON T.Teaching the immune system to fight cancer[J].Sci Am,1993,3:82~86.*:q^%[, http://www.100md.com
[3]THOMAS T,WALTER JS, MICHAEL T.Gene- based strategies for the immunotherapy of cancer [J].J Exp Med, 1997,75:478~481 .
[4]BOON T,VAN DER BRUGGEN P. Human tumo r antigens recognized by Tlymphocytes[J].J Exp Med,1996,183:725~729.q*yg'[m, 百拇医药
[5]SCHULER G,STEINMAN RM. De ndritic Cel ls as Adjuvants for Immune-mediated Resi stance to Tumors[J]. J Exp Med, 1997,186 :1183~1187.q*yg'[m, 百拇医药
[6]WATTS C.Capture and proc essing of exogenous antigens for presentation on MHC molecules[J].Annu Rev Immunol,1997,15:821~825.q*yg'[m, 百拇医药
[7]LYERLY HK.A Phase I Study of Active Immu-notherapy with Ca rcinoembryonic Ant igen RNA-Pulsed Autologous Human Culture d Dendritic Cells in Patients with Metas tatic Malignancies Expressing Carcinoemb ryonic Antigen[J].Human Gene Ther,1998,9:394~402.q*yg'[m, 百拇医药
[8] WAN YH,BRAMSON J, CARTER R ,et al. De ndritic Cells Transduced with an Adenoviral Vector Encoding a Model Tumor-Associ ated Antigen for Tumor Vaccination[J].Human Gene Ther, 1997,8:1355~1363.q*yg'[m, 百拇医药
[9]章卫平,曹雪涛,黄 欣,等.基因修饰的树突状细胞融合后 的瘤苗抗肿瘤免疫应答的实验研究[J].中华医学杂志,1997,77:39~42.q*yg'[m, 百拇医药
[10]MATTHEW L,ALBERT BS, NINA B.Dendritic cells acquire antigen from apoptotic cells and induce class I-restri cted CTLs[J].Nature,1998,392:86~89.q*yg'[m, 百拇医药
收稿日期:1999-07-09q*yg'[m, 百拇医药
修回日期:1999-09-16(吴刚 韩本立 余宏 裴雪涛)