去甲肾上腺素对大鼠体外抗体生成的影响
作者:彭聿平 邱一华 戴丽 黄慧伟r\$s(, 百拇医药
单位:彭聿平(南通医学院生理学教研室,江苏 南通 226001);邱一华(南通医学院生理学教研室,江苏 南通 226001);戴丽(南通医学院生理学教研室,江苏 南通 226001);黄慧伟(南通医学院生理学教研室,江苏 南通 226001)r\$s(, 百拇医药
关键词:去甲肾上腺素;抗体;神经递质;淋巴细胞;神经免疫调节r\$s(, 百拇医药
免疫学杂志000311 [摘 要]目的 观察不同浓度去甲肾上腺素(NA,10-10~10-6mol/L)对大鼠体外抗体生成的影响,并初步探讨其作用机制。方法 在体外用绵羊红细胞(SRBC)刺激大鼠肠系膜淋巴结B细胞转化成抗体形成细胞(AFC),然后检测其抗体生成量。结果 ①10-10、10-9、10-8和10-7mol/L NA都能显著抑制体外抗体生成,其中10-8mol/L NA的作用最强。②β受体激动剂异丙基肾上腺素亦能明显减弱体外抗体生成。③α受体拮抗剂酚妥拉明和β受体拮抗剂心得安不能单独阻断NA抑制体外抗体生成的作用,而两者共同作用时,能完全阻断NA的作用。④NA仍能抑制先用SRBC刺激24h或48h后的淋巴细胞的抗体生成,但不能抑制用SRBC刺激72h或96h后的淋巴细胞的抗体生成。结论 NA可非浓度依赖性地抑制大鼠的体外抗体生成,此作用可能由淋巴细胞上的α和β受体共同介导,且NA可能主要影响淋巴细胞转化的中期阶段。r\$s(, 百拇医药
[中图分类号]R392 [文献标识码]Ar\$s(, 百拇医药
[文章编号]1000-8861(2000)03-0200-04r\$s(, 百拇医药
Eeffect of noradrenaline on the antibody synthesis of rats in v itror\$s(, 百拇医药
PENG Yu-ping,QIU Yi-hua,DAI li,HUANG Hui-weir\$s(, 百拇医药
(Department of Physiology,Nantong Medical College,Nantong 226001,China)
[Abstract]Objective In the present study,the effect of NA on the antibody synthesis and the primary mechanism were investigated with the aid of the assay for antibody synthesis in vitro.Methods Various concentrations of NA(10-10to 10-6mol/L)with sheep red blood cells(SRBC) were simultaneously added to the lymphocyte suspension of mesenteric lymph node of rats and incubated 5days.Results NA at the concentrations of 10-10,10-9,10-8or 10-7mol/L significantly suppressed the antibody synthesis in vitro,having a strongest suppression at 10-8mol/L.Isoprenaline,a β-adrenergic receptor agonist,remarkably impaired the antibody synthesis of rats in vitro.While α-adrenergic receptor antagonist phentolamine or β-adrenergic receptor antagonist propranolol respectively with NA acted on the lymphocytes,the antibody synthesis still significantly decreased.However,when they acted together the inhibition of antibody synthesis by NA was completely blocked.NA still have the inhibitory effect on the lymphocytes incubated with SRBC for 24 hours or 48 hours,rather than 72h and 96h.Conclusion NA can cause concentration-independent suppression of the antibody synthesis of rats in vitro,which may be mediated together by α-adrenergic and βadrenergic receptors and act on the middle stage of lymphocyte transformation.
[Key words]noradrenaline;antibody;neurotransmitters;lymphocyte;neuroimmunomodulationgl\@, 百拇医药
淋巴组织有丰富的交感神经分布[1,2],切除支配淋巴组织的交感神经后免疫应答发生了改变[3,4],去甲肾上腺素(noradrenaline,NA)能影响整体和离体动物的免疫功能[5,6]。以往的研究表明:NA可抑制大鼠的T细胞增殖[7];在体液免疫应答期间,中枢和淋巴组织中的NA含量发生了变化[8]。众多的研究表明,肾上腺素能神经及其递质NA与免疫功能密切相关。但目前关于NA对淋巴细胞作用的受体及其机制等尚不十分清楚。为此,本研究从细胞水平探讨NA对B细胞功能的作用、作用受体和作用时间等初步机制,籍以说明交感神经递质对体液免疫功能的调节作用。gl\@, 百拇医药
1 材料和方法gl\@, 百拇医药
1.1 动物 Sprague-Dawley大鼠,体重180~250g,雌雄兼用,由本院实验动物中心提供。gl\@, 百拇医药
1.2 药品和试剂 去甲肾上腺素(noradrenaline,Fluka)、异丙基肾上腺素(isoproterenol hydrochloride,Sigma)、酚妥拉明(phentolamine hydrochloride,Sigma)和心得安(propranolol hydrochloride,Sigma)在临用前用细胞培养液配制。细胞培养液:RPMI 1640(roswell park memoral institute me-dium 1640,Gibco)用双蒸水配制,加入碳酸氢钠2.1g/L,丙酮酸钠0.11g/L,hepes[N-(2-羟乙基)哌嗪-N′-2-乙烷磺酸,Merck]5.5g/L,1%2-巯基乙醇0.4ml/L,青霉素105U/L和链霉素105U/L,正压过滤除菌,分装4°C保存,使用时加入灭活的新生小牛血清(上海第二医科大学),浓度为10%。gl\@, 百拇医药
1.3 SRBC悬液的制备 取年青绵羊颈静脉血,与SRBC抗凝保存液1∶3混合抗凝,然后用含5%小牛血清的PBS洗涤3次,用细胞培养液按红细胞压积配成2%SRBC悬液,或者用含5%小牛血清的PBS制成1%SRBC悬液。
1.4 B淋巴细胞转化生成AFC 无菌取出大鼠的肠系膜淋巴结,加入细胞培养液,制成单细胞悬液,浓度为1×107细胞/ml。每毫升细胞悬液加入2%SRBC悬液150μl,于24孔细胞培养板中,混匀,置CO2细胞培养箱(ESPEC BNA-311,日本)内孵育(5%CO2,饱和湿度,37°C)5d。)a!4c6, http://www.100md.com
1.5 AFC的抗体生成量检测 参照以往的方法略加改进[9]。取上述培养5d后的悬液于试管中,离心弃上清,加入1%SRBC悬液1ml,1∶30补体(由豚鼠心脏血清制备)1ml,PBS 2.5ml,混匀,置37°C水浴1h,离心后取上清,在752C分光光度计413 nm波长处测其光密度(optical density,OD)值。)a!4c6, http://www.100md.com
1.6 统计学处理 用配伍组试验的方差分析和Q检验(Newman-Keuls法)比较各实验组与对照组的差异显著性,结果用 ±s表示。)a!4c6, http://www.100md.com
±s表示。)a!4c6, http://www.100md.com
2 结果)a!4c6, http://www.100md.com
2.1 不同浓度NA对体外抗体生成的影响 在含有SRBC的肠系膜淋巴结细胞悬液中加入10-10、10-9、10-8、10-7或10-6mol/L NA,孵育5d,然后检测AFC的抗体生成量。统计分析表明:10-10、10-9、10-8和10-7mol/L NA的OD值显著低于对照组,其中10-8mol/L NA的作用最强,而10-6mol/L NA的OD值没有明显降低(见图1)。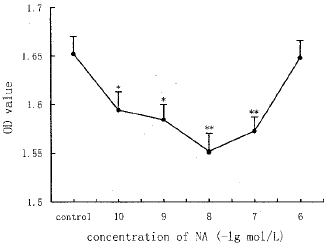 )a!4c6, http://www.100md.com
)a!4c6, http://www.100md.com
图1不同浓度NA对体外抗体生成的影响)a!4c6, http://www.100md.com
Fig1 Effect of different concentration of NA on the antibody synthesis in vitro Each point is mean and standard error of 6 repetitions.
NA was added simultaneously with SRBC to lymphocyte suspension and incubated for 5 days.*P<0.05,**P<0.01,compared with control57juo, 百拇医药
2.2 β受体激动剂异丙基肾上腺素对体外抗体生成的影响 在含有SRBC的肠系膜淋巴结细胞悬液中加入β受体激动剂异丙基肾上腺素(isoproterenol),孵育5d。结果与不加受体激动剂的对照组比较,明显降低,与NA组比较,亦显著降低(见表1)。57juo, 百拇医药
表 1 β受体激动剂异丙基肾上腺素对体外抗体生成的影响57juo, 百拇医药
Tab1 Effect of β-adrenergic receptor angonist on the antibody synthesis in vitro Group57juo, 百拇医药
n57juo, 百拇医药
OD value57juo, 百拇医药
Control57juo, 百拇医药
657juo, 百拇医药
1.612±0.03757juo, 百拇医药
NA(10-8mol/L)57juo, 百拇医药
657juo, 百拇医药
1.562±0.025*57juo, 百拇医药
Isoproterenol(10-8mol/L)57juo, 百拇医药
657juo, 百拇医药
1.511±0.037**+57juo, 百拇医药
*P<0.05,**P<0.01,compared with control;+P<0.05,compared with NA group.57juo, 百拇医药
2.3 α和β受体拮抗剂对NA抑制体外抗体生成作用的影响 在含有SRBC的肠系膜淋巴结细胞悬液中同时加入NA和α受体拮抗剂酚妥拉明(Phen)或β受体拮抗剂心得安(Prop),或者在含有SRBC的肠系膜淋巴结细胞悬液中同时加入NA、Phen和Prop,孵育5d。设两组对照:①空白组(不加任何药品);②NA组(不加受体拮抗剂)。结果表明:Phen+NA组和Prop+NA组的OD值都仍然明显低于空白对照组,而与NA对照组比较无显著差异;但Phen+Prop+NA组的OD值升高,与空白对照组无明显差别,而显著低于NA对照组(见表2)。
表2 α和β受体拮抗剂对NA抑制体外抗体生成作用的影响0nh4^, 百拇医药
Tab2 Effect of α and β-receptor antagonist on the action of NA inhibiting antibody synthesis in vitro Group0nh4^, 百拇医药
n0nh4^, 百拇医药
OD value0nh4^, 百拇医药
Control0nh4^, 百拇医药
60nh4^, 百拇医药
1.630±0.0310nh4^, 百拇医药
NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.544±0.036**0nh4^, 百拇医药
Phentolamine(10-7mol/L)+NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.579±0.013**0nh4^, 百拇医药
Propranolol(10-7mol/L)+NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.558±0.024**0nh4^, 百拇医药
Phen+Prop+NA(concentration same as above)0nh4^, 百拇医药
60nh4^, 百拇医药
1.655±0.041++0nh4^, 百拇医药
**P<0.01,compared with control;++P<0.01,compared with NA group
2.4 NA不同作用时间对体外抗体生成的影响 在SRBC刺激淋巴细胞后的24、48、72和96h分别加入NA,孵育至5d。设两组对照:①空白组(不加NA);②NA 0h组(NA与SRBC同时加入到淋巴细胞悬液中培养)。结果表明:NA 24h和48h组的OD值明显低于空白对照组,且24h组的OD值还明显低于NA 0h对照组;而72和96h组的OD值与空白对照组无显著差别,且明显高于NA 0h对照组(见图2)。 '#u#et, 百拇医药
'#u#et, 百拇医药
图2 NA不同作用时间对体外抗体生成的影响'#u#et, 百拇医药
Fig2 Effect at different times of the action of NA on the antibody synthesis in vitro Eacth point represents mean and standard deviation of 6 replicates.At abscissa,0h shows NA was added simultaneously with SRBC to lymphocyte suspension and incubated for 5d,and 12,24,48,72 and 96h show NA was added to lymphocyte suspension which had been incubated with SRBC for 12,24,48,72 or96 h.'#u#et, 百拇医药
**P<0.01,compared with control;++P<0.01,compared with NA 0h group'#u#et, 百拇医药
3 讨论'#u#et, 百拇医药
NA是经典的神经递质,国外较多学者从各个不同角度研究NA与免疫系统之间的关系,发现NA能调节免疫功能,但对于NA影响免疫功能的作用机制等问题尚不清楚。本研究在离体条件下,应用细胞培养方法,用绵羊红细胞(sheep red blood cells,SRBC)刺激大鼠肠系膜淋巴结中B细胞转化为抗体形成细胞(antibody forming cell,AFC),然后检测其抗体生成量。发现10-10、10-9、10-8和10-7mol/L NA都能显著抑制体外抗体生成,其中10-8mol/L NA的作用最强,而10-6mol/L NA无明显的抑制作用。这种随着NA浓度增高作用相对加强,而增高到一定浓度后作用消失的现象,与我们以前研究的NA影响T细胞增殖的结果类似,提示NA影响免疫细胞功能的机制比较复杂,可能高浓度的NA通过多种途径产生多种效应,正性和负性效应抵消,导致作用消失,而对于NA抑制体外抗体生成的作用,可能10-8mol/L是比较适宜的浓度。
关于NA对淋巴细胞作用的受体尚不十分清楚。有作者报道NA对淋巴细胞的作用是通过α受体介导[10];也有报道NA的作用与β受体有关[11];另有报道NA的作用既不通过α受体也不通过β受体介导[6]。本研究用β受体激动剂异丙基肾上腺素进行实验,发现异丙基肾上腺素(10-8mol/L)也能显著减弱大鼠的体外抗体生成,且比同浓度的NA的作用强,说明淋巴细胞上的β受体兴奋更能抑制其抗体生成。进一步用α受体拮抗剂酚妥拉明和β受体拮抗剂心得安实验,发现两种拮抗剂分别与NA作用于淋巴细胞时,虽然其抗体生成比NA单独作用时有所增加,但差异没有显著性,且仍然明显低于空白对照组,说明α受体拮抗剂或β受体拮抗剂都不能单独地完全阻断NA的抑制抗体生成的作用。当两种拮抗剂共同与NA作用于淋巴细胞时,其抗体生成回升至与空白对照组无显著差异,也高于NA单独作用时的抗体生成,说明α受体拮抗剂和β受体拮抗剂共同作用于淋巴细胞时,能完全阻断NA的抑制抗体生成的作用。上述结果提示:NA抑制体外抗体生成的作用可能既通过淋巴细胞上的α受体又通过β受体介导,所以只阻断一种肾上腺素能受体而不能完全阻断NA的作用,这也解释了为什么有各种不同报道的原因。关于在整体条件下,以哪一种NA受体作用为主,或者在不同的生理情况下两种受体是否发挥不同的作用,还需进一步探讨。?(dvm3, 百拇医药
由于B细胞被SRBC激活而分化为AFC和生成抗体的时间较长,且作用较复杂,为探讨NA抑制体外抗体生成的作用发生在哪一环节,我们在淋巴细胞被SRBC刺激后的24、48、72或96h,分别加入NA。发现NA在淋巴细胞被SRBC刺激后24或48h再与其作用至5d,抗体生成仍然明显减少,且24h的结果比NA同时加入的结果更低;而淋巴细胞被SRBC刺激后72或96h后,NA再与其作用至5d,抗体生成没有明显降低。提示NA可能主要作用于淋巴细胞转化的中期阶段,可能NA在淋巴细胞激活后24h起重要作用,这时淋巴细胞上的受体数目和细胞内的信使物质最多。?(dvm3, 百拇医药
我们以前的研究表明:NA可抑制由Con A诱导的T细胞增殖。本研究用的SRBC是TD抗原,所以,NA抑制体外抗体生成的结果是NA对B细胞的直接作用还是通过T细胞的间接抑制作用,有待于进一步探讨。?(dvm3, 百拇医药
综合本研究结果,说明NA可非浓度依赖性地抑制大鼠的体外抗体生成,此作用可能既通过淋巴细胞上的α受体又通过β受体介导,且NA可能主要影响淋巴细胞转化的中期阶段。?(dvm3, 百拇医药
[作者简介]彭聿平(1956-),女,江苏南通市人,副教授,研究生,主要从事神经免疫学的研究。
参考文献&+, http://www.100md.com
[1]KENDALL MD,SHAWAF AA.Innervation of the rat thymus gland[J].Brain Behav Immunopharmacol,1991,3:45~55.&+, http://www.100md.com
[2]STEVENS-FELTEN SY,BELLINGER DL.Nora-drenergic and peptidergic innervation of lymphoid organs[J].Chem Immunol,1997,69:99~131.&+, http://www.100md.com
[3]ALITO AE,ROMEO HE,BALER R.Autonomic nervous system regulation of murine immune responses as assessed by local surgical sympathetic and parasympathetic denervation[J].Acta Physiol Phamracol Latinoam, 1987,37:305~319.&+, http://www.100md.com
[4]ESQUIFINO AI,CARDINALLI DP.Local regulation of the immune response by the autonomic nervous system[J].Neuroimmunomodulation, 1994,1:265~273.&+, http://www.100md.com
[5]MADDEN KS,MOYNIHAN JA,BRENNER GJ,et al.Sympathetic nervous system modulation of the immune system.Ⅲ.Alterations in T and B cell prolife-ration and differentiation in vitro following chemical sympathectomy[J].J Neuroimmunol,1994,49(1-2):77~87.&+, http://www.100md.com
[6]COOK-MILLS JM,COHEN RL,PERLMAN RL,et al.Inhibition of lymphocyte activation by catecho-lamines:evidence for a non-classical mechanism of catecholamine action[J].Immunology,1995,85(4):544~549.&+, http://www.100md.com
[7]彭聿平,邱一华,张清泉,等.去甲肾上腺素对T淋巴细胞增殖的影响[J].中国应用生理学杂志,1995,11:75~78.&+, http://www.100md.com
[8]彭聿平,邱一华,张清泉,等.免疫应答期间脑和淋巴器官内去甲肾上腺素含量的变化[J].中国应用生理学杂志,1995,11:144~147.&+, http://www.100md.com
[9]CUNNINGHAM AJ,SZENBERG A.Further impro-vements in the plaque technique for detecting single antibody-forming cells[J].Immunology, 1968,14:599~600.&+, http://www.100md.com
[10]FELSNER P,HOFER D,RINNER I,et al.Adrenergic suppression of peripheral blood T cell reactivity in the rat is due to activation of peripheral alpha2-receptors[J].J Neuroimmunol,1995,57(1-2):27~34.&+, http://www.100md.com
[11]SANDERS VM,BAKER RA,RAMER-QUINN DS,et al.Differential expression of the beta 2-adrenergic receptor by Th1 and Th2 clones:implications for cytokine production and B cell help[J].J Immunol,1997,158(9):4200~4210.&+, http://www.100md.com
[收稿日期] 1999-08-10;[修回日期] 1999-11-16(彭聿平 邱一华 戴丽 黄慧伟)
单位:彭聿平(南通医学院生理学教研室,江苏 南通 226001);邱一华(南通医学院生理学教研室,江苏 南通 226001);戴丽(南通医学院生理学教研室,江苏 南通 226001);黄慧伟(南通医学院生理学教研室,江苏 南通 226001)r\$s(, 百拇医药
关键词:去甲肾上腺素;抗体;神经递质;淋巴细胞;神经免疫调节r\$s(, 百拇医药
免疫学杂志000311 [摘 要]目的 观察不同浓度去甲肾上腺素(NA,10-10~10-6mol/L)对大鼠体外抗体生成的影响,并初步探讨其作用机制。方法 在体外用绵羊红细胞(SRBC)刺激大鼠肠系膜淋巴结B细胞转化成抗体形成细胞(AFC),然后检测其抗体生成量。结果 ①10-10、10-9、10-8和10-7mol/L NA都能显著抑制体外抗体生成,其中10-8mol/L NA的作用最强。②β受体激动剂异丙基肾上腺素亦能明显减弱体外抗体生成。③α受体拮抗剂酚妥拉明和β受体拮抗剂心得安不能单独阻断NA抑制体外抗体生成的作用,而两者共同作用时,能完全阻断NA的作用。④NA仍能抑制先用SRBC刺激24h或48h后的淋巴细胞的抗体生成,但不能抑制用SRBC刺激72h或96h后的淋巴细胞的抗体生成。结论 NA可非浓度依赖性地抑制大鼠的体外抗体生成,此作用可能由淋巴细胞上的α和β受体共同介导,且NA可能主要影响淋巴细胞转化的中期阶段。r\$s(, 百拇医药
[中图分类号]R392 [文献标识码]Ar\$s(, 百拇医药
[文章编号]1000-8861(2000)03-0200-04r\$s(, 百拇医药
Eeffect of noradrenaline on the antibody synthesis of rats in v itror\$s(, 百拇医药
PENG Yu-ping,QIU Yi-hua,DAI li,HUANG Hui-weir\$s(, 百拇医药
(Department of Physiology,Nantong Medical College,Nantong 226001,China)
[Abstract]Objective In the present study,the effect of NA on the antibody synthesis and the primary mechanism were investigated with the aid of the assay for antibody synthesis in vitro.Methods Various concentrations of NA(10-10to 10-6mol/L)with sheep red blood cells(SRBC) were simultaneously added to the lymphocyte suspension of mesenteric lymph node of rats and incubated 5days.Results NA at the concentrations of 10-10,10-9,10-8or 10-7mol/L significantly suppressed the antibody synthesis in vitro,having a strongest suppression at 10-8mol/L.Isoprenaline,a β-adrenergic receptor agonist,remarkably impaired the antibody synthesis of rats in vitro.While α-adrenergic receptor antagonist phentolamine or β-adrenergic receptor antagonist propranolol respectively with NA acted on the lymphocytes,the antibody synthesis still significantly decreased.However,when they acted together the inhibition of antibody synthesis by NA was completely blocked.NA still have the inhibitory effect on the lymphocytes incubated with SRBC for 24 hours or 48 hours,rather than 72h and 96h.Conclusion NA can cause concentration-independent suppression of the antibody synthesis of rats in vitro,which may be mediated together by α-adrenergic and βadrenergic receptors and act on the middle stage of lymphocyte transformation.
[Key words]noradrenaline;antibody;neurotransmitters;lymphocyte;neuroimmunomodulationgl\@, 百拇医药
淋巴组织有丰富的交感神经分布[1,2],切除支配淋巴组织的交感神经后免疫应答发生了改变[3,4],去甲肾上腺素(noradrenaline,NA)能影响整体和离体动物的免疫功能[5,6]。以往的研究表明:NA可抑制大鼠的T细胞增殖[7];在体液免疫应答期间,中枢和淋巴组织中的NA含量发生了变化[8]。众多的研究表明,肾上腺素能神经及其递质NA与免疫功能密切相关。但目前关于NA对淋巴细胞作用的受体及其机制等尚不十分清楚。为此,本研究从细胞水平探讨NA对B细胞功能的作用、作用受体和作用时间等初步机制,籍以说明交感神经递质对体液免疫功能的调节作用。gl\@, 百拇医药
1 材料和方法gl\@, 百拇医药
1.1 动物 Sprague-Dawley大鼠,体重180~250g,雌雄兼用,由本院实验动物中心提供。gl\@, 百拇医药
1.2 药品和试剂 去甲肾上腺素(noradrenaline,Fluka)、异丙基肾上腺素(isoproterenol hydrochloride,Sigma)、酚妥拉明(phentolamine hydrochloride,Sigma)和心得安(propranolol hydrochloride,Sigma)在临用前用细胞培养液配制。细胞培养液:RPMI 1640(roswell park memoral institute me-dium 1640,Gibco)用双蒸水配制,加入碳酸氢钠2.1g/L,丙酮酸钠0.11g/L,hepes[N-(2-羟乙基)哌嗪-N′-2-乙烷磺酸,Merck]5.5g/L,1%2-巯基乙醇0.4ml/L,青霉素105U/L和链霉素105U/L,正压过滤除菌,分装4°C保存,使用时加入灭活的新生小牛血清(上海第二医科大学),浓度为10%。gl\@, 百拇医药
1.3 SRBC悬液的制备 取年青绵羊颈静脉血,与SRBC抗凝保存液1∶3混合抗凝,然后用含5%小牛血清的PBS洗涤3次,用细胞培养液按红细胞压积配成2%SRBC悬液,或者用含5%小牛血清的PBS制成1%SRBC悬液。
1.4 B淋巴细胞转化生成AFC 无菌取出大鼠的肠系膜淋巴结,加入细胞培养液,制成单细胞悬液,浓度为1×107细胞/ml。每毫升细胞悬液加入2%SRBC悬液150μl,于24孔细胞培养板中,混匀,置CO2细胞培养箱(ESPEC BNA-311,日本)内孵育(5%CO2,饱和湿度,37°C)5d。)a!4c6, http://www.100md.com
1.5 AFC的抗体生成量检测 参照以往的方法略加改进[9]。取上述培养5d后的悬液于试管中,离心弃上清,加入1%SRBC悬液1ml,1∶30补体(由豚鼠心脏血清制备)1ml,PBS 2.5ml,混匀,置37°C水浴1h,离心后取上清,在752C分光光度计413 nm波长处测其光密度(optical density,OD)值。)a!4c6, http://www.100md.com
1.6 统计学处理 用配伍组试验的方差分析和Q检验(Newman-Keuls法)比较各实验组与对照组的差异显著性,结果用
 ±s表示。)a!4c6, http://www.100md.com
±s表示。)a!4c6, http://www.100md.com2 结果)a!4c6, http://www.100md.com
2.1 不同浓度NA对体外抗体生成的影响 在含有SRBC的肠系膜淋巴结细胞悬液中加入10-10、10-9、10-8、10-7或10-6mol/L NA,孵育5d,然后检测AFC的抗体生成量。统计分析表明:10-10、10-9、10-8和10-7mol/L NA的OD值显著低于对照组,其中10-8mol/L NA的作用最强,而10-6mol/L NA的OD值没有明显降低(见图1)。
 )a!4c6, http://www.100md.com
)a!4c6, http://www.100md.com图1不同浓度NA对体外抗体生成的影响)a!4c6, http://www.100md.com
Fig1 Effect of different concentration of NA on the antibody synthesis in vitro Each point is mean and standard error of 6 repetitions.
NA was added simultaneously with SRBC to lymphocyte suspension and incubated for 5 days.*P<0.05,**P<0.01,compared with control57juo, 百拇医药
2.2 β受体激动剂异丙基肾上腺素对体外抗体生成的影响 在含有SRBC的肠系膜淋巴结细胞悬液中加入β受体激动剂异丙基肾上腺素(isoproterenol),孵育5d。结果与不加受体激动剂的对照组比较,明显降低,与NA组比较,亦显著降低(见表1)。57juo, 百拇医药
表 1 β受体激动剂异丙基肾上腺素对体外抗体生成的影响57juo, 百拇医药
Tab1 Effect of β-adrenergic receptor angonist on the antibody synthesis in vitro Group57juo, 百拇医药
n57juo, 百拇医药
OD value57juo, 百拇医药
Control57juo, 百拇医药
657juo, 百拇医药
1.612±0.03757juo, 百拇医药
NA(10-8mol/L)57juo, 百拇医药
657juo, 百拇医药
1.562±0.025*57juo, 百拇医药
Isoproterenol(10-8mol/L)57juo, 百拇医药
657juo, 百拇医药
1.511±0.037**+57juo, 百拇医药
*P<0.05,**P<0.01,compared with control;+P<0.05,compared with NA group.57juo, 百拇医药
2.3 α和β受体拮抗剂对NA抑制体外抗体生成作用的影响 在含有SRBC的肠系膜淋巴结细胞悬液中同时加入NA和α受体拮抗剂酚妥拉明(Phen)或β受体拮抗剂心得安(Prop),或者在含有SRBC的肠系膜淋巴结细胞悬液中同时加入NA、Phen和Prop,孵育5d。设两组对照:①空白组(不加任何药品);②NA组(不加受体拮抗剂)。结果表明:Phen+NA组和Prop+NA组的OD值都仍然明显低于空白对照组,而与NA对照组比较无显著差异;但Phen+Prop+NA组的OD值升高,与空白对照组无明显差别,而显著低于NA对照组(见表2)。
表2 α和β受体拮抗剂对NA抑制体外抗体生成作用的影响0nh4^, 百拇医药
Tab2 Effect of α and β-receptor antagonist on the action of NA inhibiting antibody synthesis in vitro Group0nh4^, 百拇医药
n0nh4^, 百拇医药
OD value0nh4^, 百拇医药
Control0nh4^, 百拇医药
60nh4^, 百拇医药
1.630±0.0310nh4^, 百拇医药
NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.544±0.036**0nh4^, 百拇医药
Phentolamine(10-7mol/L)+NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.579±0.013**0nh4^, 百拇医药
Propranolol(10-7mol/L)+NA(10-8mol/L)0nh4^, 百拇医药
60nh4^, 百拇医药
1.558±0.024**0nh4^, 百拇医药
Phen+Prop+NA(concentration same as above)0nh4^, 百拇医药
60nh4^, 百拇医药
1.655±0.041++0nh4^, 百拇医药
**P<0.01,compared with control;++P<0.01,compared with NA group
2.4 NA不同作用时间对体外抗体生成的影响 在SRBC刺激淋巴细胞后的24、48、72和96h分别加入NA,孵育至5d。设两组对照:①空白组(不加NA);②NA 0h组(NA与SRBC同时加入到淋巴细胞悬液中培养)。结果表明:NA 24h和48h组的OD值明显低于空白对照组,且24h组的OD值还明显低于NA 0h对照组;而72和96h组的OD值与空白对照组无显著差别,且明显高于NA 0h对照组(见图2)。
 '#u#et, 百拇医药
'#u#et, 百拇医药图2 NA不同作用时间对体外抗体生成的影响'#u#et, 百拇医药
Fig2 Effect at different times of the action of NA on the antibody synthesis in vitro Eacth point represents mean and standard deviation of 6 replicates.At abscissa,0h shows NA was added simultaneously with SRBC to lymphocyte suspension and incubated for 5d,and 12,24,48,72 and 96h show NA was added to lymphocyte suspension which had been incubated with SRBC for 12,24,48,72 or96 h.'#u#et, 百拇医药
**P<0.01,compared with control;++P<0.01,compared with NA 0h group'#u#et, 百拇医药
3 讨论'#u#et, 百拇医药
NA是经典的神经递质,国外较多学者从各个不同角度研究NA与免疫系统之间的关系,发现NA能调节免疫功能,但对于NA影响免疫功能的作用机制等问题尚不清楚。本研究在离体条件下,应用细胞培养方法,用绵羊红细胞(sheep red blood cells,SRBC)刺激大鼠肠系膜淋巴结中B细胞转化为抗体形成细胞(antibody forming cell,AFC),然后检测其抗体生成量。发现10-10、10-9、10-8和10-7mol/L NA都能显著抑制体外抗体生成,其中10-8mol/L NA的作用最强,而10-6mol/L NA无明显的抑制作用。这种随着NA浓度增高作用相对加强,而增高到一定浓度后作用消失的现象,与我们以前研究的NA影响T细胞增殖的结果类似,提示NA影响免疫细胞功能的机制比较复杂,可能高浓度的NA通过多种途径产生多种效应,正性和负性效应抵消,导致作用消失,而对于NA抑制体外抗体生成的作用,可能10-8mol/L是比较适宜的浓度。
关于NA对淋巴细胞作用的受体尚不十分清楚。有作者报道NA对淋巴细胞的作用是通过α受体介导[10];也有报道NA的作用与β受体有关[11];另有报道NA的作用既不通过α受体也不通过β受体介导[6]。本研究用β受体激动剂异丙基肾上腺素进行实验,发现异丙基肾上腺素(10-8mol/L)也能显著减弱大鼠的体外抗体生成,且比同浓度的NA的作用强,说明淋巴细胞上的β受体兴奋更能抑制其抗体生成。进一步用α受体拮抗剂酚妥拉明和β受体拮抗剂心得安实验,发现两种拮抗剂分别与NA作用于淋巴细胞时,虽然其抗体生成比NA单独作用时有所增加,但差异没有显著性,且仍然明显低于空白对照组,说明α受体拮抗剂或β受体拮抗剂都不能单独地完全阻断NA的抑制抗体生成的作用。当两种拮抗剂共同与NA作用于淋巴细胞时,其抗体生成回升至与空白对照组无显著差异,也高于NA单独作用时的抗体生成,说明α受体拮抗剂和β受体拮抗剂共同作用于淋巴细胞时,能完全阻断NA的抑制抗体生成的作用。上述结果提示:NA抑制体外抗体生成的作用可能既通过淋巴细胞上的α受体又通过β受体介导,所以只阻断一种肾上腺素能受体而不能完全阻断NA的作用,这也解释了为什么有各种不同报道的原因。关于在整体条件下,以哪一种NA受体作用为主,或者在不同的生理情况下两种受体是否发挥不同的作用,还需进一步探讨。?(dvm3, 百拇医药
由于B细胞被SRBC激活而分化为AFC和生成抗体的时间较长,且作用较复杂,为探讨NA抑制体外抗体生成的作用发生在哪一环节,我们在淋巴细胞被SRBC刺激后的24、48、72或96h,分别加入NA。发现NA在淋巴细胞被SRBC刺激后24或48h再与其作用至5d,抗体生成仍然明显减少,且24h的结果比NA同时加入的结果更低;而淋巴细胞被SRBC刺激后72或96h后,NA再与其作用至5d,抗体生成没有明显降低。提示NA可能主要作用于淋巴细胞转化的中期阶段,可能NA在淋巴细胞激活后24h起重要作用,这时淋巴细胞上的受体数目和细胞内的信使物质最多。?(dvm3, 百拇医药
我们以前的研究表明:NA可抑制由Con A诱导的T细胞增殖。本研究用的SRBC是TD抗原,所以,NA抑制体外抗体生成的结果是NA对B细胞的直接作用还是通过T细胞的间接抑制作用,有待于进一步探讨。?(dvm3, 百拇医药
综合本研究结果,说明NA可非浓度依赖性地抑制大鼠的体外抗体生成,此作用可能既通过淋巴细胞上的α受体又通过β受体介导,且NA可能主要影响淋巴细胞转化的中期阶段。?(dvm3, 百拇医药
[作者简介]彭聿平(1956-),女,江苏南通市人,副教授,研究生,主要从事神经免疫学的研究。
参考文献&+, http://www.100md.com
[1]KENDALL MD,SHAWAF AA.Innervation of the rat thymus gland[J].Brain Behav Immunopharmacol,1991,3:45~55.&+, http://www.100md.com
[2]STEVENS-FELTEN SY,BELLINGER DL.Nora-drenergic and peptidergic innervation of lymphoid organs[J].Chem Immunol,1997,69:99~131.&+, http://www.100md.com
[3]ALITO AE,ROMEO HE,BALER R.Autonomic nervous system regulation of murine immune responses as assessed by local surgical sympathetic and parasympathetic denervation[J].Acta Physiol Phamracol Latinoam, 1987,37:305~319.&+, http://www.100md.com
[4]ESQUIFINO AI,CARDINALLI DP.Local regulation of the immune response by the autonomic nervous system[J].Neuroimmunomodulation, 1994,1:265~273.&+, http://www.100md.com
[5]MADDEN KS,MOYNIHAN JA,BRENNER GJ,et al.Sympathetic nervous system modulation of the immune system.Ⅲ.Alterations in T and B cell prolife-ration and differentiation in vitro following chemical sympathectomy[J].J Neuroimmunol,1994,49(1-2):77~87.&+, http://www.100md.com
[6]COOK-MILLS JM,COHEN RL,PERLMAN RL,et al.Inhibition of lymphocyte activation by catecho-lamines:evidence for a non-classical mechanism of catecholamine action[J].Immunology,1995,85(4):544~549.&+, http://www.100md.com
[7]彭聿平,邱一华,张清泉,等.去甲肾上腺素对T淋巴细胞增殖的影响[J].中国应用生理学杂志,1995,11:75~78.&+, http://www.100md.com
[8]彭聿平,邱一华,张清泉,等.免疫应答期间脑和淋巴器官内去甲肾上腺素含量的变化[J].中国应用生理学杂志,1995,11:144~147.&+, http://www.100md.com
[9]CUNNINGHAM AJ,SZENBERG A.Further impro-vements in the plaque technique for detecting single antibody-forming cells[J].Immunology, 1968,14:599~600.&+, http://www.100md.com
[10]FELSNER P,HOFER D,RINNER I,et al.Adrenergic suppression of peripheral blood T cell reactivity in the rat is due to activation of peripheral alpha2-receptors[J].J Neuroimmunol,1995,57(1-2):27~34.&+, http://www.100md.com
[11]SANDERS VM,BAKER RA,RAMER-QUINN DS,et al.Differential expression of the beta 2-adrenergic receptor by Th1 and Th2 clones:implications for cytokine production and B cell help[J].J Immunol,1997,158(9):4200~4210.&+, http://www.100md.com
[收稿日期] 1999-08-10;[修回日期] 1999-11-16(彭聿平 邱一华 戴丽 黄慧伟)