泡沫病毒载体的研究进展
作者:唐东红 代解杰 仝品芬 董德祥
单位:中国医学科学院,医学生物学研究所 昆明 650118
关键词:
病毒学报000321 中图分类号:R373;Q782 文献标识码:A
文章编号:1000-721(2000)03-0282-03
以逆转录病毒为载体的基因转移系统在80年代得到了一定的发展,迄今用于研究和临床基因治疗的载体种类也日渐增加,应用也逐渐广泛,其中应用最广的是腺病毒和逆转录病毒载体。随着对泡沫病毒(foamy viruses,FV)研究的不断深入,特别是FV基因表达调控特点及病毒与宿主细胞之间相互作用的特点,不同于其它逆转录病毒复制的独特特征,不明显的致病作用,使得FV成为逆转录病毒基因转移载体而被应用,并展示良好的应用前景。泡沫病毒,也称合胞体病毒,是逆转录病毒的重要成员。迄今逆转录病毒科(Retroviridae)有三个亚科,它们包括肿瘤病毒亚科(Oncovirinae)、慢病毒亚科(Lentivirinae)、泡沫病毒亚科(Spumavirinae)[1]。其中肿瘤病毒亚科的病毒和慢病毒亚科的病毒是人类及各种动物疾病的病原,始终为人们所关注及重视。泡沫病毒在自然界广泛存在,有着较广泛的宿主范围。可从多种哺乳类动物中分离出来,包括人类、非人灵长类、牛、猫、狗、仓鼠、海狮等。人类首次认识FV 在40多年前(1955年),由于它引起灵长类动物培养细胞的污染而得到认识,随后大量的FV被分离自健康的或有病的不同种类的个体。70年代,人泡沫病毒(HFV)由患鼻咽癌的病人中分离出,随后又从de Quervain及Graves病人中分离出,曾一度激发人们探寻FV与疾病的关系。80年代由于HIV及HTLV对人类的危害,又使人们对其作为逆转录病毒的第三个亚科的泡沫病毒的研究趋于活跃。直至90年代初,人们从HFV转基因小鼠的研究[2]发现,HFV能引起动物神经系统退行性疾病。近年的研究表明[3-7]:FV与某种特定疾病的关系不能确定,包括曾一度很肯定的de Quervain和甲状腺的Graves病。从FV感染的动物模型的研究[8-10]也表明了这一结果。
, 百拇医药
1 病毒特点及分子生物学特性
FV为有囊膜的单股正链RNA病毒,与其它两个科病毒一样,在逆转录后DNA拷贝被插入宿主的染色体中,其基因组都是从5′-3′的Gag-Pol-Env以二聚体形式被装配在病毒粒子中。在基因组中,gag、pol、env为成熟的具有感染性的病毒的必备成分,其中pol编码逆转录酶;gag编码病毒壳蛋白;env编码囊膜糖蛋白。电镜下,病毒粒子呈二十面体球形,直径100nm~140nm,内含直径30nm~50nm的核芯,病毒粒子外的囊膜上有5nm~15nm放射状的纤突[11]。
此外,FV还有其它一些特点,病毒感染动物后,宿主虽有免疫应答,仍能引起动物低水平持续感染,直至终生,不表现任何病理损伤。感染细胞的CPE为自发形成的泡沫样空泡化合胞体,其特征是胞浆内空泡的积累和内质网的膨胀所致。FV可感染来自不同种类的不同类型的细胞系,有着广泛的细胞嗜性和宿主范围[12]。
, 百拇医药
泡沫病毒具有复杂的基因组织,详见图1[1]。FV是迄今发现的基因组最长的逆转录病毒,例如HFV、SFV-1、SFV-3基因组RNA分别为11.67kb、11.52kb、11.62kb,前病毒cDNA为12kb~13kb,两端为长末端重复序列(LTR),长度为1 305bp~1 760bp,中间部分为gag、pol、env三个基本基因。此外,在Env与3′LTR之间有2~3个ORF(开放性阅读框架),编码自身的反式激活因子(Tas)。HFV的Tas又称Bel-l,SFV-1、SFV-3的Tas分别为Taf-1、Taf-3。从一系列的缺失突变的研究得出:Bel-1与FV转录的起始位点相关,它编码36kD的转录活化因子蛋白,可产生在FV启动子指导下的转录作用。已研究确定了Bel-1调节基因是病毒复制的最基本基因。HFV拥有第三个开放性阅读框架Bel-3,在较低等的灵长类病毒及牛泡沫病毒中没有Bel-3。近年的研究[13,14]表明,SFV-1、SFV-3及HFV在Env区域还包括了第二个可激活的内部功能性启动子(IP)。这个IP将指导早期感染时Bel-1因子的转录活化功能。有关IP的存在使得泡沫病毒基因的表达调控比其它逆转录病毒更显复杂。过去一直认为逆转录病毒科所有病毒均与一种同样相似的机制装配和进行逆转录,而近几年的研究表明,FV的基因表达调控有许多不同于其它逆转录病毒的独特特点。Yu等[15]研究发现,HFV的逆转录酶及Pol蛋白是直接由剪接mRNA翻译产生,而不象其它逆转录病毒一样需产生Gag-Pol前体,它的翻译可独立于Gag而产生。
, 百拇医药
FV由于其独特的分子生物学特征,对于发展逆转录载体系统提供了机会。病毒载体介导的基因转移,是目前基因治疗的主要方法。逆转录病毒载体有许多优点,如传导率高,整合准确,可将外源基因转移入人体的许多不同类型的细胞,但也存在着令人不安的难题,其中最主要的是潜在的致癌可能性,而FV却有着与其它逆转录病毒不同的特点。因此有学者[16]从现代病毒学的角度提出,如果一种病毒不是任何一种病的病原,那它可作为一种载体用于基因治疗。FV可携带同源基因进入不同物种、不同型别的细胞。迄今为止,在自然感染及实验感染的动物中没有证实有何疾病与之对应,有关FV的内源系列也没有证实,SFV-1基因组大小为13kb,HFV基因组长度为11kb,提示了以FV为载体能携带较长的异源DNA。实际上HFV已被用于构建载体了。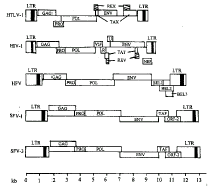
图1 逆转录病毒三个亚科的前病毒DNA基因组结构
, http://www.100md.com Figure 1 Genomic organization of proviral DNA
of three retroviral subfamilies
The three retroviral subfamilies are represented by HTLV-1 (oncovirus), HIV-1 (lentivirus), and HFV, SFV-1, as well as SFV-3 (spumavirus).
2 以HFV为基础的可复制载体的构建及应用
在删除了Bel-2、Bel-3编码区后,构建的具感染性的可复制载体pFOV-1、-2、-3、-7[17],研究证明它能稳定表达大片段异源结构蛋白。通过导入自杀基因构建了的另一类HFV的可复制载体[18]。研究表明,自杀基因对于消除无论是体内还是体外的肿瘤细胞都是有效的,在肿瘤的基因治疗研究中,将自杀基因导入肿瘤细胞以激活自杀机制的策略占有重要地位,而自杀基因怎样才能更有效地导入预知的固体瘤中则是抗癌基因治疗的问题。Nestler[18]所建立的HFV传递系统能克服这个问题。他们分别将HSV-TK基因,EC-CD基因及EC-pnp基因、gfp基因插入到pFOV-7中,通过分析证明了所插入的外源基因能够稳定表达,并分别用各自的片段处理原药(prodrug)后,根据载体对特异细胞杀灭的病毒的有效性和稳定性证明,pFOV-7/pnp优于所使用的其它两种自杀基因,提出pFOV-7/pnp可作为导入固体瘤的一种候选病毒载体。虽然使用可复制型逆转录病毒载体是需要更多更有效的动物实验来评估其危害性,如病毒可能在体内复制等,但HFV载体在这方面的严格性及忧虑却远远小于其它逆转录病毒载体。
, 百拇医药
3 以HFV为基础的缺陷复制载体的构建及优点
用已标记的目的基因替代env和Bel-1构建了缺陷复制载体[19]:pFGPSN、pFGMAP、pFdelGP、pHSPV13。这些载体与辅助病毒质粒共染包装成病毒颗粒。也有用目的基因代替了Bel-1、Bel-2,用能稳定表达Bel-1的BHK-21细胞系作为包装细胞在Bel-1基因区域反式互补装配成病毒颗粒,其启动子由SV40早期启动子代替,构建出了两个载体RFF62及HSG11[20]。研究表明,HFV载体具有优于目前常用的逆转录病毒载体的许多优点。且已证明了它在较宽范围的基因转移方面的运用前景。以MLV及腺病毒的相关病毒为基础的载体是目前流行的整合载体系统,但两者的局限是基因组大小、宿主范围及细胞增殖的需要。而FV的优点是有较大的基因组,较宽的宿主范围,改良的不需有丝分裂(及静止期)细胞进行有效的转染,而且HFV载体不需由人血清激活,也不需添加polycation来进行有效转染,因此它特别适合在体内基因的转染。Russell和Miller[19]注意到HFV载体能感染细胞周期中处于静止期的细胞,这一点可以把它用于将目的基因转移到非增殖期的靶细胞(如神经细胞)中。此外,HFV载体还有以下优点可利用:①由于FV有不同于其它逆转录病毒的复制特点,如前所述的YU等认为的FV的Pol蛋白可独立于Gag蛋白而表达,所以无论是Gag还是Pol,所表达的功能缺陷的病毒突变体都以反式作用与缺陷载体进行互补。从理论上讲,可构建出分别表达Gag、Env、Pol的结构的装配细胞系。②在缺乏Bel-1时,HFV启动子不能启动病毒复制,可设计出一个由于病毒复制的基本基因完全从系统中排除,由一个可替换的外源启动子来控制的安全的基因转移机制的装配细胞系,这样才能通过反式互补作用分别表达Gag、Env、Pol。
, 百拇医药
总之,发展以泡沫病毒例如以SFV-1、HFV为基础的基因转移载体,有比其它病毒载体更多的优点和应用前景。关于这方面的研究和应用仍在继续。随着对FV基因表达调控,尤其是内部启动子、LTR、Tas、细胞因子等精细机制及病毒与宿主细胞的相互作用的深入研究,相信它会在临床基因治疗中发挥更多更好的作用。
作者简介:唐东红(1966-),女,云南昆明人,理学学士,助理研究员,从事病毒学、分子生物学和实验动物学等方面的研究。
参考文献:
[1] Neuman-Haefielin D, Fleps U, Schweizer M, et al. Foamy viruses[J]. Intervirology, 1993, 35: 196-207.
[2] Bothe K, Aguzzi A, Lassmann H, et al. Progressive encephalopathy and myopathy in transgenic mice expressing human foamy virus genes[J]. Science, 1991, 253:555-557.
, 百拇医药
[3] Center For Disease Control. Nonhuman primate spumavirus infection among persons with occupational exposure in United States[J]. JAMA, 1997, 227: 783-785.
[4] Weiss R A. A virus in search of a disease[J]. Science, 1988, 333:497-498.
[5] Schweizer M, Turek R, Reinhardt M, et al. Absence of foamy virus DNA in Graves' disease[J]. AIDS Res and Hum Retroviruses, 1994, 10: 601-605.
[6] Schweizer M, Turek R, Hahn H, et al. Markers of foamy virus infections in monkeys, apes, and accidentally infected human: Appropriate testing fails to confirm suspected foamy virus prevalence in humans[J]. AIDS Res and Hum Retroviruses, 1995, 11: 161-170.
, 百拇医药
[7] Goepfert P A, et al. Analysis of West Afriaca hunters for foamy virus infections[J]. AIDS Res and Hum Retroviruses, 1996, 12: 1725-1730.
[8] Aguzzi A. The foamy virus family: molecular biology, epidemiology and neuropathology[J]. Biochim Biophy Acta, 1993, 1155: 1-24.
[9] Swack N S, Hsinng G D. Pathogenesis of simian foamy virus infection in natural and experientmental hosts[J]. Infect Immun, 1975, 12:470-474.
, 百拇医药
[10] Schmidt M, Niewiesk S, Heeney J, et al. Mouse model to study the replication of primate foamy viruses[J]. J Gen Virol, 1997, 78: 1929-1933.
[11] Mergia A, Luciw P A. Replication and regulation of primate foamy viruses[J]. Virology, 1991, 184: 475-482.
[12] Mergia A, Lung N J, Blackwell J. Cell tropism of the simian foamy virus type 1 (SFC-1)[J]. J Med Primatol, 1996, 25:2-7.
[13] Mergia A, Shaw R E S, Lackner J E, et al. Relationship of the env genes and the endonuclease domain of the pol genes of simian foamy virus type 1 and human foamy virus[J]. J Virol, 1990, 64: 406-410
, 百拇医药
[14] Lochelt M, Yu S F, Linial M L, et al. The human foamy virus internal promoter is required for efficient gene expression and infectivity[J]. Virology, 1995, 206: 601-610.
[15] Yu S F, Baldwin D N, Gwynn S R, et al. Human foamy virus replication: A pathway distinct from that of retroviruses and hepadnaviruses[J]. Science, 1996, 271: 1579-1582.
[16] Weiss R A. Foamy virus bubble on[J]. Nature, 1996, 380:201.
, http://www.100md.com
[17] Schmidt M, Bethwilim A. Replicating foamy virus based vectors directing high level expression of foreign genes[J]. Virology, 1995, 210:167-1781277.
[18] Nesteler U, Heinkelein M, et al. Foamy virus vectors for suicide gene thearpy[J]. Gene Thearpy, 1997, 4: 1270-1277.
[19] Russell D W, Miller A D. Foamy virus vectors[J]. J Virol, 1996, 70:217-222.
[20] Bioniasz P D, Erlwein O, Aguzzi A, et al. Gene transfer using replication-defective foamy virus vectors [J]. Virology, 1997, 235: 65-72.
收稿日期:1998-10-29;修回日期:1999-04-06, http://www.100md.com
单位:中国医学科学院,医学生物学研究所 昆明 650118
关键词:
病毒学报000321 中图分类号:R373;Q782 文献标识码:A
文章编号:1000-721(2000)03-0282-03
以逆转录病毒为载体的基因转移系统在80年代得到了一定的发展,迄今用于研究和临床基因治疗的载体种类也日渐增加,应用也逐渐广泛,其中应用最广的是腺病毒和逆转录病毒载体。随着对泡沫病毒(foamy viruses,FV)研究的不断深入,特别是FV基因表达调控特点及病毒与宿主细胞之间相互作用的特点,不同于其它逆转录病毒复制的独特特征,不明显的致病作用,使得FV成为逆转录病毒基因转移载体而被应用,并展示良好的应用前景。泡沫病毒,也称合胞体病毒,是逆转录病毒的重要成员。迄今逆转录病毒科(Retroviridae)有三个亚科,它们包括肿瘤病毒亚科(Oncovirinae)、慢病毒亚科(Lentivirinae)、泡沫病毒亚科(Spumavirinae)[1]。其中肿瘤病毒亚科的病毒和慢病毒亚科的病毒是人类及各种动物疾病的病原,始终为人们所关注及重视。泡沫病毒在自然界广泛存在,有着较广泛的宿主范围。可从多种哺乳类动物中分离出来,包括人类、非人灵长类、牛、猫、狗、仓鼠、海狮等。人类首次认识FV 在40多年前(1955年),由于它引起灵长类动物培养细胞的污染而得到认识,随后大量的FV被分离自健康的或有病的不同种类的个体。70年代,人泡沫病毒(HFV)由患鼻咽癌的病人中分离出,随后又从de Quervain及Graves病人中分离出,曾一度激发人们探寻FV与疾病的关系。80年代由于HIV及HTLV对人类的危害,又使人们对其作为逆转录病毒的第三个亚科的泡沫病毒的研究趋于活跃。直至90年代初,人们从HFV转基因小鼠的研究[2]发现,HFV能引起动物神经系统退行性疾病。近年的研究表明[3-7]:FV与某种特定疾病的关系不能确定,包括曾一度很肯定的de Quervain和甲状腺的Graves病。从FV感染的动物模型的研究[8-10]也表明了这一结果。
, 百拇医药
1 病毒特点及分子生物学特性
FV为有囊膜的单股正链RNA病毒,与其它两个科病毒一样,在逆转录后DNA拷贝被插入宿主的染色体中,其基因组都是从5′-3′的Gag-Pol-Env以二聚体形式被装配在病毒粒子中。在基因组中,gag、pol、env为成熟的具有感染性的病毒的必备成分,其中pol编码逆转录酶;gag编码病毒壳蛋白;env编码囊膜糖蛋白。电镜下,病毒粒子呈二十面体球形,直径100nm~140nm,内含直径30nm~50nm的核芯,病毒粒子外的囊膜上有5nm~15nm放射状的纤突[11]。
此外,FV还有其它一些特点,病毒感染动物后,宿主虽有免疫应答,仍能引起动物低水平持续感染,直至终生,不表现任何病理损伤。感染细胞的CPE为自发形成的泡沫样空泡化合胞体,其特征是胞浆内空泡的积累和内质网的膨胀所致。FV可感染来自不同种类的不同类型的细胞系,有着广泛的细胞嗜性和宿主范围[12]。
, 百拇医药
泡沫病毒具有复杂的基因组织,详见图1[1]。FV是迄今发现的基因组最长的逆转录病毒,例如HFV、SFV-1、SFV-3基因组RNA分别为11.67kb、11.52kb、11.62kb,前病毒cDNA为12kb~13kb,两端为长末端重复序列(LTR),长度为1 305bp~1 760bp,中间部分为gag、pol、env三个基本基因。此外,在Env与3′LTR之间有2~3个ORF(开放性阅读框架),编码自身的反式激活因子(Tas)。HFV的Tas又称Bel-l,SFV-1、SFV-3的Tas分别为Taf-1、Taf-3。从一系列的缺失突变的研究得出:Bel-1与FV转录的起始位点相关,它编码36kD的转录活化因子蛋白,可产生在FV启动子指导下的转录作用。已研究确定了Bel-1调节基因是病毒复制的最基本基因。HFV拥有第三个开放性阅读框架Bel-3,在较低等的灵长类病毒及牛泡沫病毒中没有Bel-3。近年的研究[13,14]表明,SFV-1、SFV-3及HFV在Env区域还包括了第二个可激活的内部功能性启动子(IP)。这个IP将指导早期感染时Bel-1因子的转录活化功能。有关IP的存在使得泡沫病毒基因的表达调控比其它逆转录病毒更显复杂。过去一直认为逆转录病毒科所有病毒均与一种同样相似的机制装配和进行逆转录,而近几年的研究表明,FV的基因表达调控有许多不同于其它逆转录病毒的独特特点。Yu等[15]研究发现,HFV的逆转录酶及Pol蛋白是直接由剪接mRNA翻译产生,而不象其它逆转录病毒一样需产生Gag-Pol前体,它的翻译可独立于Gag而产生。
, 百拇医药
FV由于其独特的分子生物学特征,对于发展逆转录载体系统提供了机会。病毒载体介导的基因转移,是目前基因治疗的主要方法。逆转录病毒载体有许多优点,如传导率高,整合准确,可将外源基因转移入人体的许多不同类型的细胞,但也存在着令人不安的难题,其中最主要的是潜在的致癌可能性,而FV却有着与其它逆转录病毒不同的特点。因此有学者[16]从现代病毒学的角度提出,如果一种病毒不是任何一种病的病原,那它可作为一种载体用于基因治疗。FV可携带同源基因进入不同物种、不同型别的细胞。迄今为止,在自然感染及实验感染的动物中没有证实有何疾病与之对应,有关FV的内源系列也没有证实,SFV-1基因组大小为13kb,HFV基因组长度为11kb,提示了以FV为载体能携带较长的异源DNA。实际上HFV已被用于构建载体了。

图1 逆转录病毒三个亚科的前病毒DNA基因组结构
, http://www.100md.com Figure 1 Genomic organization of proviral DNA
of three retroviral subfamilies
The three retroviral subfamilies are represented by HTLV-1 (oncovirus), HIV-1 (lentivirus), and HFV, SFV-1, as well as SFV-3 (spumavirus).
2 以HFV为基础的可复制载体的构建及应用
在删除了Bel-2、Bel-3编码区后,构建的具感染性的可复制载体pFOV-1、-2、-3、-7[17],研究证明它能稳定表达大片段异源结构蛋白。通过导入自杀基因构建了的另一类HFV的可复制载体[18]。研究表明,自杀基因对于消除无论是体内还是体外的肿瘤细胞都是有效的,在肿瘤的基因治疗研究中,将自杀基因导入肿瘤细胞以激活自杀机制的策略占有重要地位,而自杀基因怎样才能更有效地导入预知的固体瘤中则是抗癌基因治疗的问题。Nestler[18]所建立的HFV传递系统能克服这个问题。他们分别将HSV-TK基因,EC-CD基因及EC-pnp基因、gfp基因插入到pFOV-7中,通过分析证明了所插入的外源基因能够稳定表达,并分别用各自的片段处理原药(prodrug)后,根据载体对特异细胞杀灭的病毒的有效性和稳定性证明,pFOV-7/pnp优于所使用的其它两种自杀基因,提出pFOV-7/pnp可作为导入固体瘤的一种候选病毒载体。虽然使用可复制型逆转录病毒载体是需要更多更有效的动物实验来评估其危害性,如病毒可能在体内复制等,但HFV载体在这方面的严格性及忧虑却远远小于其它逆转录病毒载体。
, 百拇医药
3 以HFV为基础的缺陷复制载体的构建及优点
用已标记的目的基因替代env和Bel-1构建了缺陷复制载体[19]:pFGPSN、pFGMAP、pFdelGP、pHSPV13。这些载体与辅助病毒质粒共染包装成病毒颗粒。也有用目的基因代替了Bel-1、Bel-2,用能稳定表达Bel-1的BHK-21细胞系作为包装细胞在Bel-1基因区域反式互补装配成病毒颗粒,其启动子由SV40早期启动子代替,构建出了两个载体RFF62及HSG11[20]。研究表明,HFV载体具有优于目前常用的逆转录病毒载体的许多优点。且已证明了它在较宽范围的基因转移方面的运用前景。以MLV及腺病毒的相关病毒为基础的载体是目前流行的整合载体系统,但两者的局限是基因组大小、宿主范围及细胞增殖的需要。而FV的优点是有较大的基因组,较宽的宿主范围,改良的不需有丝分裂(及静止期)细胞进行有效的转染,而且HFV载体不需由人血清激活,也不需添加polycation来进行有效转染,因此它特别适合在体内基因的转染。Russell和Miller[19]注意到HFV载体能感染细胞周期中处于静止期的细胞,这一点可以把它用于将目的基因转移到非增殖期的靶细胞(如神经细胞)中。此外,HFV载体还有以下优点可利用:①由于FV有不同于其它逆转录病毒的复制特点,如前所述的YU等认为的FV的Pol蛋白可独立于Gag蛋白而表达,所以无论是Gag还是Pol,所表达的功能缺陷的病毒突变体都以反式作用与缺陷载体进行互补。从理论上讲,可构建出分别表达Gag、Env、Pol的结构的装配细胞系。②在缺乏Bel-1时,HFV启动子不能启动病毒复制,可设计出一个由于病毒复制的基本基因完全从系统中排除,由一个可替换的外源启动子来控制的安全的基因转移机制的装配细胞系,这样才能通过反式互补作用分别表达Gag、Env、Pol。
, 百拇医药
总之,发展以泡沫病毒例如以SFV-1、HFV为基础的基因转移载体,有比其它病毒载体更多的优点和应用前景。关于这方面的研究和应用仍在继续。随着对FV基因表达调控,尤其是内部启动子、LTR、Tas、细胞因子等精细机制及病毒与宿主细胞的相互作用的深入研究,相信它会在临床基因治疗中发挥更多更好的作用。
作者简介:唐东红(1966-),女,云南昆明人,理学学士,助理研究员,从事病毒学、分子生物学和实验动物学等方面的研究。
参考文献:
[1] Neuman-Haefielin D, Fleps U, Schweizer M, et al. Foamy viruses[J]. Intervirology, 1993, 35: 196-207.
[2] Bothe K, Aguzzi A, Lassmann H, et al. Progressive encephalopathy and myopathy in transgenic mice expressing human foamy virus genes[J]. Science, 1991, 253:555-557.
, 百拇医药
[3] Center For Disease Control. Nonhuman primate spumavirus infection among persons with occupational exposure in United States[J]. JAMA, 1997, 227: 783-785.
[4] Weiss R A. A virus in search of a disease[J]. Science, 1988, 333:497-498.
[5] Schweizer M, Turek R, Reinhardt M, et al. Absence of foamy virus DNA in Graves' disease[J]. AIDS Res and Hum Retroviruses, 1994, 10: 601-605.
[6] Schweizer M, Turek R, Hahn H, et al. Markers of foamy virus infections in monkeys, apes, and accidentally infected human: Appropriate testing fails to confirm suspected foamy virus prevalence in humans[J]. AIDS Res and Hum Retroviruses, 1995, 11: 161-170.
, 百拇医药
[7] Goepfert P A, et al. Analysis of West Afriaca hunters for foamy virus infections[J]. AIDS Res and Hum Retroviruses, 1996, 12: 1725-1730.
[8] Aguzzi A. The foamy virus family: molecular biology, epidemiology and neuropathology[J]. Biochim Biophy Acta, 1993, 1155: 1-24.
[9] Swack N S, Hsinng G D. Pathogenesis of simian foamy virus infection in natural and experientmental hosts[J]. Infect Immun, 1975, 12:470-474.
, 百拇医药
[10] Schmidt M, Niewiesk S, Heeney J, et al. Mouse model to study the replication of primate foamy viruses[J]. J Gen Virol, 1997, 78: 1929-1933.
[11] Mergia A, Luciw P A. Replication and regulation of primate foamy viruses[J]. Virology, 1991, 184: 475-482.
[12] Mergia A, Lung N J, Blackwell J. Cell tropism of the simian foamy virus type 1 (SFC-1)[J]. J Med Primatol, 1996, 25:2-7.
[13] Mergia A, Shaw R E S, Lackner J E, et al. Relationship of the env genes and the endonuclease domain of the pol genes of simian foamy virus type 1 and human foamy virus[J]. J Virol, 1990, 64: 406-410
, 百拇医药
[14] Lochelt M, Yu S F, Linial M L, et al. The human foamy virus internal promoter is required for efficient gene expression and infectivity[J]. Virology, 1995, 206: 601-610.
[15] Yu S F, Baldwin D N, Gwynn S R, et al. Human foamy virus replication: A pathway distinct from that of retroviruses and hepadnaviruses[J]. Science, 1996, 271: 1579-1582.
[16] Weiss R A. Foamy virus bubble on[J]. Nature, 1996, 380:201.
, http://www.100md.com
[17] Schmidt M, Bethwilim A. Replicating foamy virus based vectors directing high level expression of foreign genes[J]. Virology, 1995, 210:167-1781277.
[18] Nesteler U, Heinkelein M, et al. Foamy virus vectors for suicide gene thearpy[J]. Gene Thearpy, 1997, 4: 1270-1277.
[19] Russell D W, Miller A D. Foamy virus vectors[J]. J Virol, 1996, 70:217-222.
[20] Bioniasz P D, Erlwein O, Aguzzi A, et al. Gene transfer using replication-defective foamy virus vectors [J]. Virology, 1997, 235: 65-72.
收稿日期:1998-10-29;修回日期:1999-04-06, http://www.100md.com