人PrP基因体外诱导细胞凋亡的初步研究
作者:赵霞 董小平 周伟 洪涛
单位:中国预防医学科学院病毒学研究所,北京 100052
关键词:朊蛋白;基因转染;中国仓鼠卵巢细胞;细胞凋亡
病毒学报000304 摘要:朊蛋白为可传播性海绵样脑病的感染因子。将编码朊病毒蛋白的PrP标准及突变DNA序列分别连接到真核表达载体pcDNA3.1中,并分别转入中国仓鼠卵巢细胞(CHO)。经过RT-PCR、RNA dot blot、Western blot鉴定证实,得到了稳定表达人标准(CHOs)和终止密码突变PrP基因(CHOm)的细胞系。对此细胞系进一步研究发现,带有标准人PrP序列的CHO细胞系的生长速度比其它对照细胞系为慢,但细胞周期无明显变化。用全反式维甲酸处理细胞后,CHOs细胞系呈现出Hoechest33258核质深染、DNA ladder电泳图形及细胞流式光度术分析凋亡细胞群和G1细胞亚群增加,而在同样的处理条件下对照细胞系未出现凋亡征象。这提示朊蛋白可能参与细胞程序化死亡的调控过程。
, 百拇医药
中图分类号:S852.65+9.7 文献标识码:A
文章编号:1000-8721(2000)03-0207-05
Expression of Human PrP Gene in CHO Induces the Features of Apoptosis
ZHAO Xia,DONG Xiao-ping,ZHOU Wei,HUNG Tao
(Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China)
Abstract: Prion is considered to be the infectious agent for the transmissible spongiform encephalopathy. The standard and mutated human PrP genes were separately inserted into an eukaryotic expression vector and transfected into CHO cell, respectively, generating CHOs strain containing the standard PrP gene and CHOm strain containing the mutated PrP gene. Analysis of the cellular DNA, RNA and protein revealed that the transfected human PrP gene was persistently transcribed and expressed in CHOs strain. During the passages, the CHOs cell line showed a slowly duplicating rate as compared with the mock, but the CHOc containing only expression vector and the CHOm showed not any changes of cell life cycles. After treatment with RA, the cell line CHOs showed deeply stained chromatin with Hoechst 33258. DNA ladder pattern in agarose gel electrophoresis and the flow cytometry both revealed clusters of apoptotic cells and increasing amount of G1 subgroup cells, whereas the other CHO cell lines failed to show any features of apoptosis. It suggests that human prion protein might play a role in controlling cell programmed death.
, http://www.100md.com
Key words: prion; gene transfection; CHO cell; cell apoptosis
朊病毒病(prion disease)或可传播性海绵样脑病(transmissible spongiform encephalopathy,TSE)为一组累及人、动物中枢神经系统致死性脑病。尽管病变性朊蛋白PrPSc是主要致病因子的观点被人们广泛接受,但对其正常异构体膜蛋白PrPC的生物学功能了解甚少。有报道PrP参与淋巴细胞活化或作为某些神经细胞群的营养因子[1]。PrPC还可能在突触的正常功能中起一定作用[2]。研究还显示,去除PrP基因的小鼠其发育和行为基本正常,因而推测PrP分子或许不是细胞正常生理功能所必需的[3,4]。为了探讨朊蛋白的正常生理功能,我们构建了含有人PrP基因的真核表达载体,并将其转入中国仓鼠卵巢细胞(CHO),经过DNA、RNA、Western blot鉴定,得到了稳定表达人PrP基因的CHO细胞系。对此细胞系的进一步研究发现,它的生长速度比未转染的细胞慢,在细胞凋亡诱导剂全反式维甲酸的作用下发生凋亡征象。
, http://www.100md.com
材料与方法
1 质粒构建 以我们构建的人标准PrP(s)和点突变PrP(m)基因质粒[5]为模板,进行PCR扩增。上游引物:5'AAG CTTGCA GTC ATT ATG GCG AAC CTT GGC3'(5'端带有HindⅢ位点),下游引物:5'GGA TCCTTA TCC CAC TAT CAG GAA GAT GAG G3'(5'端带有BamHI位点)。点突变PrP(m)基因在nt194位存在有中国汉族人群特有的G→A的突变,致使在65位氨基酸形成终止密码[5]。PCR按常规法进行,反应条件为:94℃1min,58℃1min,72℃1min。将PCR扩增PrP片段连接到载体pGEM-T中,酶切、测序鉴定。用HindⅢ和BamHI游离克隆的PrP(s)和PrP(m)基因片段连接到载体pcDNA3.1中,构成质粒pcDNA3.1-PrP(s)和pcDNA3.1-PrP(m)。
2 细胞培养和转染 CHO细胞在含有10%小牛血清的DMEM培养液中生长。细胞转染按GIBCO BRL公司的LipofectAMINE Reagent试剂盒说明书进行。用含800μg/mlG418筛选抗G418的阳性细胞。将转染了质粒pcDNA3.1、pcDNA3.1-PrP(s)、pcDNA3.1-PrP(m)的细胞系分别命名为:CHOc、CHOs和CHOm。细胞DNA及RNA的提取按常规方法进行。
, 百拇医药
3 RT-PCR 1μg细胞RNA同1μl oligo(dT)18(0.1μg)75℃变性5min,自然冷却。加入0.5μl AMV(200μ/μl),1μl RNasin,4μl 2.5mmol/L dNTP,37℃作用1h。PCR反应同上,以5μl反转录产物为模板进行PCR反应。
4 RNA dot blot 将提取细胞总RNA各20μg点样于硝酸纤维素膜(Amersham公司)上,80℃烘烤2h。以32P-标记的人PrP基因PCR产物作为RNA/DNA杂交探针,探针标记按随机引物标记试剂盒(Promega公司,Prime-α-Gene-labeling system)说明书进行。按照分子克隆所述方法进行杂交、洗膜。-80℃曝光72h,冲洗X-光片。
5 Western blot 按照《分子克隆》所述方法从培养细胞中提取总蛋白,Bradford法测定蛋白浓度。蛋白质电泳和免疫印迹按常规方法进行。
, 百拇医药
6 生长曲线(MTT法) 将细胞接种于96孔细胞培养板,浓度为2?500个细胞/孔。每24h取4个平行孔加入MTT使终浓度达到5mg/ml,37℃孵育4h。加脱色液处理1h以上,空白对照以DMEM培养液代替细胞悬液。在酶标光度仪上于570nm处测定OD值,每点取4个平等孔的平均值。总共测定120h。
7 诱导凋亡 将四种细胞按1×105浓度分别传代,待细胞贴壁后48h,换成含有10μmol/L的全反式维甲酸(all-trans retinoic acid,RA)的培养液,继续孵育72~120h。
8 流式细胞光度术 取对数生长期或经RA诱导的细胞,加入适量的75%乙醇固定细胞24h。离心收集细胞,加入终浓度为50μg/ml的RNase,37℃消化30min。加65μg/ml的碘化丙啶染液作用1h,经尼龙膜过滤后,以标准程序用FACSan流式细胞光度计(Becton Dickinson公司)对细胞进行分析。
, http://www.100md.com
9 Hoechest33258染色 将细胞以1×105浓度接种于盖玻片上,经全反式维甲酸诱导后,对细胞进行Hoechst33258染色。以343nm的紫外光激发,荧光显微镜下观察细胞内染色质的着色情况。
10 DNA ladder的检测 收集细胞,用150μl裂解缓冲液(1%NP-40,20mmol/L EDTA,50mmol/L Tis-HCl,pH7.5)处理10s。1?600g离心5min,收集上清重复抽提,合并两次抽提的上清。加入终浓度为1%的SDS,5μg/μl RNase A 56℃作用2h,蛋白酶K(终浓度为2.5μg/μl)37℃消化2h,乙醇沉淀DNA。1%的琼脂糖凝胶电泳检测。
结 果
1 真核表达载体的构建及其鉴定
PrP蛋白氨基酸序列为PrP基因的第二个外显子所编码[6]。为了在真核细胞中表达人PrP蛋白并使其蛋白前体加工成为成熟的朊病毒蛋白,即带有信号肽并剪切掉羧基端的23个氨基酸,我们设计的引物位于第二个外显子的两端。PCR扩增后经琼脂糖凝胶电泳均在预期的759bp位置出现一条带。扩增片段连接到克隆载体pGEM-T中经测序证明其正确后,将PrP(s)、PrP(m)分别亚克隆入真核表达质粒pcDNA3.1,重组质粒经酶切分析以鉴定插入片段的性质和方向(结果未显)。
, 百拇医药
2 建立了稳定表达PrP基因的CHO细胞系
提取细胞DNA进行了人PrP基因的扩增,在转染了人PrP基因的细胞系CHOs和CHOm中可扩增出一条约800bp的条带,而在相应的CHO细胞和转染了pcDNA3.1的空载体的细胞中无扩增条带出现(结果未显)。这表明我们建立的这两株细胞系带有人PrP基因。RT-PCR结果显示,在CHOs和CHOm细胞中可出现特异性扩增条带(图1a)。进一步采用RNA blot印迹方法,结果显示CHOs和CHOm细胞RNA中存在有阳性杂交斑点。这表明在CHOs和CHOm细胞系中有人PrP基因的转录(图1b)。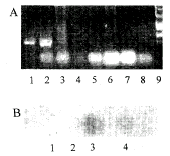
图1 人PrP基因在4种CHO细胞系中的转录
Figure 1 Transcription of human PrP gene in four CHO cell lines
, 百拇医药
A. Lane 1-4. RT-PCR; Lane 5-8. Direct PCR using the cellular RNAs as the templates; 1,5. CHOm; 2,6. CHOs; 3,7. CHOc; 4,8. CHO; 9. 1kb DNA ladder. B. Analyzed with RNA dot blot hybridization. 1. CHO; 2. CHOc; 3. CHOs; 4. CHOm.
提取细胞蛋白,用PrP蛋白特异的单克隆抗体3F4(Dr.Chen惠赠)进行Western blot检测。结果发现CHOs细胞中有一条约35kD的阳性蛋白条带。而在CHO细胞、CHOc细胞和CHOm细胞系中却未发现相似大小的阳性条带(图2)。表明CHOs细胞系的人PrP基因可稳定地表达人PrP蛋白。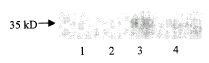
图2 Western blot检测4种细胞系中PrP蛋白的表达
, 百拇医药
Figure 2 Identification of the expression of PrP protein with Western blot in four CHO cell lines
1. CHO; 2. CHOc; 3. CHOs; 4. CHOm
3 转染的人PrP基因的细胞系生长速度减慢
在细胞传代培养过程中我们发现,CHOs的生长速度明显较其他细胞系为慢,为了准确测定不同细胞系的生长速度,采用MTT法进行细胞生长曲线的测定。比较120h的生长曲线可以看出,CHOs细胞在570nm的平均吸光值为0.38,而其它三种细胞的平均吸光值在0.55~0.65之间(图3)。与这三种细胞在120h的平均吸光值相比,CHOs的吸光值仅为前者的60.3%。这些结果证明:CHOs细胞系的生长速度不仅明显慢于亲本CHO细胞和带有空载体的对照细胞系CHOc,而且慢于带有突变的人PrP基因的细胞系CHOm。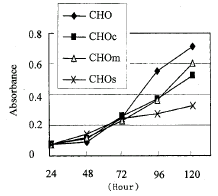
, 百拇医药
图3 MTT法测定4种CHO细胞系连续培养5天的生长曲线
Figure 3 Growth curves of the four CHO cell lines continuously cultured for five days tested by MTT assay
4 在RA诱导下转染了人PrP基因的细胞系的凋亡
在光学显微镜下观察,不同细胞系的形态未发现有明显的改变。同时在细胞传代后72h对CHO、CHOc、CHOm、CHOs进行的细胞流式光度术分析,也未见有细胞周期时相的明显变化(结果未显)。因此,我们采用低浓度的细胞凋亡诱导剂在相同的条件下处理四种细胞,以观察不同细胞系出现凋亡的情况。
细胞经10μl mol/L全反式维甲酸处理96h后用Hoechest 33258进行染色,荧光显微镜下观察。图4显示:CHO、CHOc、CHOm细胞胞核呈均匀蓝色,无深染的亮点,表明染色质均呈均匀分布,而CHOs细胞出现有呈深染亮点核质的细胞,表明染色质发生了凝集。计数100个CHOs细胞,约有10个细胞呈现深染亮点核质,说明约10%CHOs细胞发生了凋亡。
, 百拇医药
在细胞经全反式维甲酸处理96h后,分别提取四种细胞中的DNA,然后经1%的琼脂糖凝胶电泳分析。从图5可以看出,细胞CHO、CHOc、CHOm中都未能检测到“ladder”,而从CHOs细胞的提取物在琼脂糖凝胶电泳中呈现“ladder”样电泳条带。
以全反式维甲酸处理细胞120h后,分别收集细胞CHO、CHOc、CHOs、CHOm,经乙醇固定PI染色后进行细胞流式光度术分析,结果细胞CHOs的散点图上可见凋亡的细胞群体(结果未显)。同时从它们的直方图上可以看出,在整个CHOs细胞群体中,G1期细胞占53%,S期为28%,G2+M期为19%。其它三种细胞中,G1期细胞占22%~27%,S期为51%~56%,G2+M期为18%~27%。G1期细胞上升了26%~31%,S期细胞下降了23%~26%。由此可见,与CHO、CHOc、CHOm细胞相比,CHOs整个周期运转速度减慢,倍增时间延长,并且部分细胞出现凋亡现象(表1)。
, 百拇医药
图4 4种CHO细胞系Hoechest33258染色(40×10)
Figure 4 Hoechest33258 staining of the four CHO cell lines(40×10)
A. CHO; B. CHOc; C. CHOm; D. CHOs.
图5 CHOs细胞系中出现降解的DNA片段1%琼脂糖电泳(EB染色)
Figure 5 1% agarose gel electrophoresis of DNA fragmentation in CHOs cell line (EB staining)
1. CHO; 2. CHOc; 3. CHOs; 4. CHOm; 5. λDNA/HindⅢ.
, http://www.100md.com
表1 RA诱导后4钟CHO细胞系的细胞周期时相分析
Table 1 Analysis of cell phases of the four CHO cell lines after RA induction Cell line
G1(%)
S(%)
G2+M(%)
CHO
26
56
18
CHOc
, http://www.100md.com 27
54
19
CHOm
22
51
27
CHOs
53
28
19
讨 论
PrP蛋白的功能至今还不清楚,因为在进化过程中非常保守,推测它在细胞的生理活动中起一定的作用。缺失PrP基因的小鼠发育正常,几乎没有缺陷,只是长期电位(与短期记忆和学习有关)的突触现象受到损伤[7],但没有发现有行为变化[8]。有些小鼠会出现异常的睡眠,它们在老年时表现出小脑神经元的退行性病变[9]。但这些改变与PrP基因缺失的关系尚未得到明确的证实。
, http://www.100md.com
朊病毒病的主要病理特征是神经元细胞的丢失,神经胶质细胞增生,从而表现出海绵样脑病的解剖学特征。但在整个发病过程中所呈现的是退行性变,不出现渗出、浸润等炎症病理反应,无明显神经细胞坏死的表现。这些特点与细胞凋亡的病理改变十分相似。对Scrapie感染的羊进行单细胞分析时,DNA片段化与凋亡是一致的[10]。细胞培养实验表明,朊病毒病中神经细胞的死亡是凋亡引起的[11,12]。我们发现转染了人标准PrP基因的CHO细胞系生长速度降低,在细胞凋亡诱导剂的作用下,细胞出现了染色质浓缩深染,DNA ladder形成,细胞流式光度术下出现凋亡细胞群体等细胞凋亡征象。而在同样条件下对照细胞系无凋亡细胞出现。这再次证明了PrP蛋白可能参与细胞凋亡过程。
从我们的实验结果可以看出,PrP蛋白直接诱导细胞凋亡作用似乎较弱,未经全反式维甲酸诱导之前,从四种细胞的流式细胞光度术的结果上看不出细胞周期的明显差异,CHOs细胞系除了生长速度缓慢以外未发现有明显的凋亡征象。这提示在实验条件下,PrP蛋白尚不足以直接造成转染细胞发生凋亡,有可能使细胞处于易于凋亡的“敏感状态”,在其它因素的共同所用下,或者累积到一定量时才可能出现明显的凋亡征象。对PrP蛋白与其它凋亡调节蛋白关系的研究将有助于进一步了解PrP蛋白在细胞凋亡中的作用。
, 百拇医药
将带有65位氨基酸终止密码突变的人PrP序列转染至CHO细胞(CHOm)后未能出现类似的细胞凋亡现象,这表明PrP蛋白的N-末端65个氨基酸多肽链不参与细胞凋亡的调节过程。朊蛋白的神经毒性作用集团主要集中于106~126位氨基酸多肽链区域[11,13],一些实验表明由PrP106-126诱导的细胞死亡可归因于凋亡,细胞的凋亡程度依赖于PrP106-126的浓度[14]。这些结果都表明PrP蛋白N-末端的无规卷曲区域可能不直接参与致病过程。
将野生型小胶质细胞和PrP0/0皮层细胞共培养,后者对200μmol/L的PrP仍然有抗性。这个结果提示PrPC表达对于神经毒易感性是必需的[14]。结合我们的实验结果可以推测,PrP蛋白的表达或累积可能使细胞处于某种“敏感状态”,在其它一些未知因素的刺激、诱导或协同作用下使细胞发生凋亡或死亡。
基金项目:国家863高技术研究发展计划(863-102-110-003-05)
, 百拇医药
作者简介:赵霞(1970-),女,山东,博士,从事人类朊病毒病研究。现在美国Vanderbilt大学医学部肾病研究室从事博士后工作。
联系作者:董小平,E-mail:dongxp@ihw.com.cn
参考文献:
[1]Liberski P P. The enigma of slow viruses: facts and artifacts[J]. Arch Virol Suppl, 1993: 1-263.
[2]Collinge J, Whittington M A, Sidle K C L, et al. Prion protein is necessary for normal synaptic function[J]. Nature, 1994, 370: 295-297.
, 百拇医药
[3]Prusiner S B. Genetic and infectious prion diseases[J]. Arch Neurol, 1993, 50: 1129-1153.
[4]Palmer M S, Collinge J. Human prion diseases[J]. Curr Opin Neurol Neurosurg, 1992, 5: 895-901.
[5]赵霞,董小平,张宝云,等.利用GST融合蛋白表达系统表达人PrP蛋白[J]. 中华实验和临床病毒学杂志, 1999,13:124-127.
[6]Carmie P, Patric C, Chris C. Genomic structure of the human prion protein gene[J]. Am J Human Genetic, 1991, 49: 320-329.
, http://www.100md.com
[7]Whittington M A, Sidle K C, Gowlland I, et al. Rescue of neurophysiological phenotype seen in Prp nude mice by transgene encoding human prion protein[J]. Nature Genet, 1995, 9: 197-201.
[8]Bueler H R, Fisher M, Lang Y, et al. Normal development and behavior of mice lacking the neuronal cell-surface PrP protein[J]. Nature, 1992, 356(6370): 577-582.
[9]Sakaguchi S, Katamine S, Nishida N, et al. Loss of cerebellar Pukinje cells in aged mice homozygous for a disrupted PrP gene[J]. Nature, 1996, 380: 528-531.
, http://www.100md.com
[10]Fairbaim D W, Carnahan K G, Thwaits R N, et al. Detection of apoptosis induced DNA cleavage in scrapie-infected sheep brain[J]. FEMS Microbiol Lett, 1994, 115: 341-346.
[11]Forloni G, Angeretti N, Chiesa R, et al. Neurotoxicity of a prion protein fragment[J]. Nature, 1993, 362: 543-546.
[12]Muller WEG, Ushijima H, Schroder H C, et al. Cytoprotective effect of NMDA receptor antagonists on prion protein(PrionSc)-induced toxicity in rat cortical cell cultures[J]. Eur J Pharmacol, 1993, 246: 261-267.
, http://www.100md.com
[13]Tagliavini F, Prelli F, Verga L, et al. Synthetic peptides homologous to prion protein residues 106-147 form amyloid-like fibril in vitro[J]. Proc Nalt Acad Sci USA, 1993, 90: 9678-9682.
[14]Giese A, Groschup M H, Hess B, et al. Neuronal cell death in scrapie-infected mice is due to apoptosis[J]. Brain Pathol, 1995, 5: 213-221.
收稿日期:1999-12-27;修回日期:2000-02-24, 百拇医药
单位:中国预防医学科学院病毒学研究所,北京 100052
关键词:朊蛋白;基因转染;中国仓鼠卵巢细胞;细胞凋亡
病毒学报000304 摘要:朊蛋白为可传播性海绵样脑病的感染因子。将编码朊病毒蛋白的PrP标准及突变DNA序列分别连接到真核表达载体pcDNA3.1中,并分别转入中国仓鼠卵巢细胞(CHO)。经过RT-PCR、RNA dot blot、Western blot鉴定证实,得到了稳定表达人标准(CHOs)和终止密码突变PrP基因(CHOm)的细胞系。对此细胞系进一步研究发现,带有标准人PrP序列的CHO细胞系的生长速度比其它对照细胞系为慢,但细胞周期无明显变化。用全反式维甲酸处理细胞后,CHOs细胞系呈现出Hoechest33258核质深染、DNA ladder电泳图形及细胞流式光度术分析凋亡细胞群和G1细胞亚群增加,而在同样的处理条件下对照细胞系未出现凋亡征象。这提示朊蛋白可能参与细胞程序化死亡的调控过程。
, 百拇医药
中图分类号:S852.65+9.7 文献标识码:A
文章编号:1000-8721(2000)03-0207-05
Expression of Human PrP Gene in CHO Induces the Features of Apoptosis
ZHAO Xia,DONG Xiao-ping,ZHOU Wei,HUNG Tao
(Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China)
Abstract: Prion is considered to be the infectious agent for the transmissible spongiform encephalopathy. The standard and mutated human PrP genes were separately inserted into an eukaryotic expression vector and transfected into CHO cell, respectively, generating CHOs strain containing the standard PrP gene and CHOm strain containing the mutated PrP gene. Analysis of the cellular DNA, RNA and protein revealed that the transfected human PrP gene was persistently transcribed and expressed in CHOs strain. During the passages, the CHOs cell line showed a slowly duplicating rate as compared with the mock, but the CHOc containing only expression vector and the CHOm showed not any changes of cell life cycles. After treatment with RA, the cell line CHOs showed deeply stained chromatin with Hoechst 33258. DNA ladder pattern in agarose gel electrophoresis and the flow cytometry both revealed clusters of apoptotic cells and increasing amount of G1 subgroup cells, whereas the other CHO cell lines failed to show any features of apoptosis. It suggests that human prion protein might play a role in controlling cell programmed death.
, http://www.100md.com
Key words: prion; gene transfection; CHO cell; cell apoptosis
朊病毒病(prion disease)或可传播性海绵样脑病(transmissible spongiform encephalopathy,TSE)为一组累及人、动物中枢神经系统致死性脑病。尽管病变性朊蛋白PrPSc是主要致病因子的观点被人们广泛接受,但对其正常异构体膜蛋白PrPC的生物学功能了解甚少。有报道PrP参与淋巴细胞活化或作为某些神经细胞群的营养因子[1]。PrPC还可能在突触的正常功能中起一定作用[2]。研究还显示,去除PrP基因的小鼠其发育和行为基本正常,因而推测PrP分子或许不是细胞正常生理功能所必需的[3,4]。为了探讨朊蛋白的正常生理功能,我们构建了含有人PrP基因的真核表达载体,并将其转入中国仓鼠卵巢细胞(CHO),经过DNA、RNA、Western blot鉴定,得到了稳定表达人PrP基因的CHO细胞系。对此细胞系的进一步研究发现,它的生长速度比未转染的细胞慢,在细胞凋亡诱导剂全反式维甲酸的作用下发生凋亡征象。
, http://www.100md.com
材料与方法
1 质粒构建 以我们构建的人标准PrP(s)和点突变PrP(m)基因质粒[5]为模板,进行PCR扩增。上游引物:5'AAG CTTGCA GTC ATT ATG GCG AAC CTT GGC3'(5'端带有HindⅢ位点),下游引物:5'GGA TCCTTA TCC CAC TAT CAG GAA GAT GAG G3'(5'端带有BamHI位点)。点突变PrP(m)基因在nt194位存在有中国汉族人群特有的G→A的突变,致使在65位氨基酸形成终止密码[5]。PCR按常规法进行,反应条件为:94℃1min,58℃1min,72℃1min。将PCR扩增PrP片段连接到载体pGEM-T中,酶切、测序鉴定。用HindⅢ和BamHI游离克隆的PrP(s)和PrP(m)基因片段连接到载体pcDNA3.1中,构成质粒pcDNA3.1-PrP(s)和pcDNA3.1-PrP(m)。
2 细胞培养和转染 CHO细胞在含有10%小牛血清的DMEM培养液中生长。细胞转染按GIBCO BRL公司的LipofectAMINE Reagent试剂盒说明书进行。用含800μg/mlG418筛选抗G418的阳性细胞。将转染了质粒pcDNA3.1、pcDNA3.1-PrP(s)、pcDNA3.1-PrP(m)的细胞系分别命名为:CHOc、CHOs和CHOm。细胞DNA及RNA的提取按常规方法进行。
, 百拇医药
3 RT-PCR 1μg细胞RNA同1μl oligo(dT)18(0.1μg)75℃变性5min,自然冷却。加入0.5μl AMV(200μ/μl),1μl RNasin,4μl 2.5mmol/L dNTP,37℃作用1h。PCR反应同上,以5μl反转录产物为模板进行PCR反应。
4 RNA dot blot 将提取细胞总RNA各20μg点样于硝酸纤维素膜(Amersham公司)上,80℃烘烤2h。以32P-标记的人PrP基因PCR产物作为RNA/DNA杂交探针,探针标记按随机引物标记试剂盒(Promega公司,Prime-α-Gene-labeling system)说明书进行。按照分子克隆所述方法进行杂交、洗膜。-80℃曝光72h,冲洗X-光片。
5 Western blot 按照《分子克隆》所述方法从培养细胞中提取总蛋白,Bradford法测定蛋白浓度。蛋白质电泳和免疫印迹按常规方法进行。
, 百拇医药
6 生长曲线(MTT法) 将细胞接种于96孔细胞培养板,浓度为2?500个细胞/孔。每24h取4个平行孔加入MTT使终浓度达到5mg/ml,37℃孵育4h。加脱色液处理1h以上,空白对照以DMEM培养液代替细胞悬液。在酶标光度仪上于570nm处测定OD值,每点取4个平等孔的平均值。总共测定120h。
7 诱导凋亡 将四种细胞按1×105浓度分别传代,待细胞贴壁后48h,换成含有10μmol/L的全反式维甲酸(all-trans retinoic acid,RA)的培养液,继续孵育72~120h。
8 流式细胞光度术 取对数生长期或经RA诱导的细胞,加入适量的75%乙醇固定细胞24h。离心收集细胞,加入终浓度为50μg/ml的RNase,37℃消化30min。加65μg/ml的碘化丙啶染液作用1h,经尼龙膜过滤后,以标准程序用FACSan流式细胞光度计(Becton Dickinson公司)对细胞进行分析。
, http://www.100md.com
9 Hoechest33258染色 将细胞以1×105浓度接种于盖玻片上,经全反式维甲酸诱导后,对细胞进行Hoechst33258染色。以343nm的紫外光激发,荧光显微镜下观察细胞内染色质的着色情况。
10 DNA ladder的检测 收集细胞,用150μl裂解缓冲液(1%NP-40,20mmol/L EDTA,50mmol/L Tis-HCl,pH7.5)处理10s。1?600g离心5min,收集上清重复抽提,合并两次抽提的上清。加入终浓度为1%的SDS,5μg/μl RNase A 56℃作用2h,蛋白酶K(终浓度为2.5μg/μl)37℃消化2h,乙醇沉淀DNA。1%的琼脂糖凝胶电泳检测。
结 果
1 真核表达载体的构建及其鉴定
PrP蛋白氨基酸序列为PrP基因的第二个外显子所编码[6]。为了在真核细胞中表达人PrP蛋白并使其蛋白前体加工成为成熟的朊病毒蛋白,即带有信号肽并剪切掉羧基端的23个氨基酸,我们设计的引物位于第二个外显子的两端。PCR扩增后经琼脂糖凝胶电泳均在预期的759bp位置出现一条带。扩增片段连接到克隆载体pGEM-T中经测序证明其正确后,将PrP(s)、PrP(m)分别亚克隆入真核表达质粒pcDNA3.1,重组质粒经酶切分析以鉴定插入片段的性质和方向(结果未显)。
, 百拇医药
2 建立了稳定表达PrP基因的CHO细胞系
提取细胞DNA进行了人PrP基因的扩增,在转染了人PrP基因的细胞系CHOs和CHOm中可扩增出一条约800bp的条带,而在相应的CHO细胞和转染了pcDNA3.1的空载体的细胞中无扩增条带出现(结果未显)。这表明我们建立的这两株细胞系带有人PrP基因。RT-PCR结果显示,在CHOs和CHOm细胞中可出现特异性扩增条带(图1a)。进一步采用RNA blot印迹方法,结果显示CHOs和CHOm细胞RNA中存在有阳性杂交斑点。这表明在CHOs和CHOm细胞系中有人PrP基因的转录(图1b)。

图1 人PrP基因在4种CHO细胞系中的转录
Figure 1 Transcription of human PrP gene in four CHO cell lines
, 百拇医药
A. Lane 1-4. RT-PCR; Lane 5-8. Direct PCR using the cellular RNAs as the templates; 1,5. CHOm; 2,6. CHOs; 3,7. CHOc; 4,8. CHO; 9. 1kb DNA ladder. B. Analyzed with RNA dot blot hybridization. 1. CHO; 2. CHOc; 3. CHOs; 4. CHOm.
提取细胞蛋白,用PrP蛋白特异的单克隆抗体3F4(Dr.Chen惠赠)进行Western blot检测。结果发现CHOs细胞中有一条约35kD的阳性蛋白条带。而在CHO细胞、CHOc细胞和CHOm细胞系中却未发现相似大小的阳性条带(图2)。表明CHOs细胞系的人PrP基因可稳定地表达人PrP蛋白。
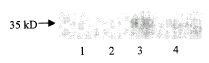
图2 Western blot检测4种细胞系中PrP蛋白的表达
, 百拇医药
Figure 2 Identification of the expression of PrP protein with Western blot in four CHO cell lines
1. CHO; 2. CHOc; 3. CHOs; 4. CHOm
3 转染的人PrP基因的细胞系生长速度减慢
在细胞传代培养过程中我们发现,CHOs的生长速度明显较其他细胞系为慢,为了准确测定不同细胞系的生长速度,采用MTT法进行细胞生长曲线的测定。比较120h的生长曲线可以看出,CHOs细胞在570nm的平均吸光值为0.38,而其它三种细胞的平均吸光值在0.55~0.65之间(图3)。与这三种细胞在120h的平均吸光值相比,CHOs的吸光值仅为前者的60.3%。这些结果证明:CHOs细胞系的生长速度不仅明显慢于亲本CHO细胞和带有空载体的对照细胞系CHOc,而且慢于带有突变的人PrP基因的细胞系CHOm。

, 百拇医药
图3 MTT法测定4种CHO细胞系连续培养5天的生长曲线
Figure 3 Growth curves of the four CHO cell lines continuously cultured for five days tested by MTT assay
4 在RA诱导下转染了人PrP基因的细胞系的凋亡
在光学显微镜下观察,不同细胞系的形态未发现有明显的改变。同时在细胞传代后72h对CHO、CHOc、CHOm、CHOs进行的细胞流式光度术分析,也未见有细胞周期时相的明显变化(结果未显)。因此,我们采用低浓度的细胞凋亡诱导剂在相同的条件下处理四种细胞,以观察不同细胞系出现凋亡的情况。
细胞经10μl mol/L全反式维甲酸处理96h后用Hoechest 33258进行染色,荧光显微镜下观察。图4显示:CHO、CHOc、CHOm细胞胞核呈均匀蓝色,无深染的亮点,表明染色质均呈均匀分布,而CHOs细胞出现有呈深染亮点核质的细胞,表明染色质发生了凝集。计数100个CHOs细胞,约有10个细胞呈现深染亮点核质,说明约10%CHOs细胞发生了凋亡。
, 百拇医药
在细胞经全反式维甲酸处理96h后,分别提取四种细胞中的DNA,然后经1%的琼脂糖凝胶电泳分析。从图5可以看出,细胞CHO、CHOc、CHOm中都未能检测到“ladder”,而从CHOs细胞的提取物在琼脂糖凝胶电泳中呈现“ladder”样电泳条带。
以全反式维甲酸处理细胞120h后,分别收集细胞CHO、CHOc、CHOs、CHOm,经乙醇固定PI染色后进行细胞流式光度术分析,结果细胞CHOs的散点图上可见凋亡的细胞群体(结果未显)。同时从它们的直方图上可以看出,在整个CHOs细胞群体中,G1期细胞占53%,S期为28%,G2+M期为19%。其它三种细胞中,G1期细胞占22%~27%,S期为51%~56%,G2+M期为18%~27%。G1期细胞上升了26%~31%,S期细胞下降了23%~26%。由此可见,与CHO、CHOc、CHOm细胞相比,CHOs整个周期运转速度减慢,倍增时间延长,并且部分细胞出现凋亡现象(表1)。

, 百拇医药
图4 4种CHO细胞系Hoechest33258染色(40×10)
Figure 4 Hoechest33258 staining of the four CHO cell lines(40×10)
A. CHO; B. CHOc; C. CHOm; D. CHOs.

图5 CHOs细胞系中出现降解的DNA片段1%琼脂糖电泳(EB染色)
Figure 5 1% agarose gel electrophoresis of DNA fragmentation in CHOs cell line (EB staining)
1. CHO; 2. CHOc; 3. CHOs; 4. CHOm; 5. λDNA/HindⅢ.
, http://www.100md.com
表1 RA诱导后4钟CHO细胞系的细胞周期时相分析
Table 1 Analysis of cell phases of the four CHO cell lines after RA induction Cell line
G1(%)
S(%)
G2+M(%)
CHO
26
56
18
CHOc
, http://www.100md.com 27
54
19
CHOm
22
51
27
CHOs
53
28
19
讨 论
PrP蛋白的功能至今还不清楚,因为在进化过程中非常保守,推测它在细胞的生理活动中起一定的作用。缺失PrP基因的小鼠发育正常,几乎没有缺陷,只是长期电位(与短期记忆和学习有关)的突触现象受到损伤[7],但没有发现有行为变化[8]。有些小鼠会出现异常的睡眠,它们在老年时表现出小脑神经元的退行性病变[9]。但这些改变与PrP基因缺失的关系尚未得到明确的证实。
, http://www.100md.com
朊病毒病的主要病理特征是神经元细胞的丢失,神经胶质细胞增生,从而表现出海绵样脑病的解剖学特征。但在整个发病过程中所呈现的是退行性变,不出现渗出、浸润等炎症病理反应,无明显神经细胞坏死的表现。这些特点与细胞凋亡的病理改变十分相似。对Scrapie感染的羊进行单细胞分析时,DNA片段化与凋亡是一致的[10]。细胞培养实验表明,朊病毒病中神经细胞的死亡是凋亡引起的[11,12]。我们发现转染了人标准PrP基因的CHO细胞系生长速度降低,在细胞凋亡诱导剂的作用下,细胞出现了染色质浓缩深染,DNA ladder形成,细胞流式光度术下出现凋亡细胞群体等细胞凋亡征象。而在同样条件下对照细胞系无凋亡细胞出现。这再次证明了PrP蛋白可能参与细胞凋亡过程。
从我们的实验结果可以看出,PrP蛋白直接诱导细胞凋亡作用似乎较弱,未经全反式维甲酸诱导之前,从四种细胞的流式细胞光度术的结果上看不出细胞周期的明显差异,CHOs细胞系除了生长速度缓慢以外未发现有明显的凋亡征象。这提示在实验条件下,PrP蛋白尚不足以直接造成转染细胞发生凋亡,有可能使细胞处于易于凋亡的“敏感状态”,在其它因素的共同所用下,或者累积到一定量时才可能出现明显的凋亡征象。对PrP蛋白与其它凋亡调节蛋白关系的研究将有助于进一步了解PrP蛋白在细胞凋亡中的作用。
, 百拇医药
将带有65位氨基酸终止密码突变的人PrP序列转染至CHO细胞(CHOm)后未能出现类似的细胞凋亡现象,这表明PrP蛋白的N-末端65个氨基酸多肽链不参与细胞凋亡的调节过程。朊蛋白的神经毒性作用集团主要集中于106~126位氨基酸多肽链区域[11,13],一些实验表明由PrP106-126诱导的细胞死亡可归因于凋亡,细胞的凋亡程度依赖于PrP106-126的浓度[14]。这些结果都表明PrP蛋白N-末端的无规卷曲区域可能不直接参与致病过程。
将野生型小胶质细胞和PrP0/0皮层细胞共培养,后者对200μmol/L的PrP仍然有抗性。这个结果提示PrPC表达对于神经毒易感性是必需的[14]。结合我们的实验结果可以推测,PrP蛋白的表达或累积可能使细胞处于某种“敏感状态”,在其它一些未知因素的刺激、诱导或协同作用下使细胞发生凋亡或死亡。
基金项目:国家863高技术研究发展计划(863-102-110-003-05)
, 百拇医药
作者简介:赵霞(1970-),女,山东,博士,从事人类朊病毒病研究。现在美国Vanderbilt大学医学部肾病研究室从事博士后工作。
联系作者:董小平,E-mail:dongxp@ihw.com.cn
参考文献:
[1]Liberski P P. The enigma of slow viruses: facts and artifacts[J]. Arch Virol Suppl, 1993: 1-263.
[2]Collinge J, Whittington M A, Sidle K C L, et al. Prion protein is necessary for normal synaptic function[J]. Nature, 1994, 370: 295-297.
, 百拇医药
[3]Prusiner S B. Genetic and infectious prion diseases[J]. Arch Neurol, 1993, 50: 1129-1153.
[4]Palmer M S, Collinge J. Human prion diseases[J]. Curr Opin Neurol Neurosurg, 1992, 5: 895-901.
[5]赵霞,董小平,张宝云,等.利用GST融合蛋白表达系统表达人PrP蛋白[J]. 中华实验和临床病毒学杂志, 1999,13:124-127.
[6]Carmie P, Patric C, Chris C. Genomic structure of the human prion protein gene[J]. Am J Human Genetic, 1991, 49: 320-329.
, http://www.100md.com
[7]Whittington M A, Sidle K C, Gowlland I, et al. Rescue of neurophysiological phenotype seen in Prp nude mice by transgene encoding human prion protein[J]. Nature Genet, 1995, 9: 197-201.
[8]Bueler H R, Fisher M, Lang Y, et al. Normal development and behavior of mice lacking the neuronal cell-surface PrP protein[J]. Nature, 1992, 356(6370): 577-582.
[9]Sakaguchi S, Katamine S, Nishida N, et al. Loss of cerebellar Pukinje cells in aged mice homozygous for a disrupted PrP gene[J]. Nature, 1996, 380: 528-531.
, http://www.100md.com
[10]Fairbaim D W, Carnahan K G, Thwaits R N, et al. Detection of apoptosis induced DNA cleavage in scrapie-infected sheep brain[J]. FEMS Microbiol Lett, 1994, 115: 341-346.
[11]Forloni G, Angeretti N, Chiesa R, et al. Neurotoxicity of a prion protein fragment[J]. Nature, 1993, 362: 543-546.
[12]Muller WEG, Ushijima H, Schroder H C, et al. Cytoprotective effect of NMDA receptor antagonists on prion protein(PrionSc)-induced toxicity in rat cortical cell cultures[J]. Eur J Pharmacol, 1993, 246: 261-267.
, http://www.100md.com
[13]Tagliavini F, Prelli F, Verga L, et al. Synthetic peptides homologous to prion protein residues 106-147 form amyloid-like fibril in vitro[J]. Proc Nalt Acad Sci USA, 1993, 90: 9678-9682.
[14]Giese A, Groschup M H, Hess B, et al. Neuronal cell death in scrapie-infected mice is due to apoptosis[J]. Brain Pathol, 1995, 5: 213-221.
收稿日期:1999-12-27;修回日期:2000-02-24, 百拇医药