多重PCR法检测对虾皮下和造血器官坏死杆状病毒
作者:夏春 刘津 黄捷
单位:夏春 刘津(中国农业大学动物医学院,北京 100094);黄捷(中国水产科学研究院黄海水产研究所,山东 青岛 266071)
关键词:多重PCR法;皮下和造血器官坏死杆状病毒;对虾;暴发性流行病
病毒学报000315 摘要:根据对虾皮下和造血器官坏死杆状病毒(HHNBV)HHNBV-XIA靶基因序列设计了4个多重PCR法用引物(P1、P2、P3、P4)。采用了五种引物组合形式分别对HHNBV-XIA、HHNBV基因和PRDV-JAPAN片段进行了特异扩增,建立了多重PCR检测HHNBV方法。通过优化多重PCR法检测HHNBV条件,可从阳性感染的中国对虾fg级DNA中定性检测出皮下和造血器官坏死杆状病毒。
中图分类号:S945.1+9 文献标识码:A
, http://www.100md.com
文章编号:1000-8721(2000)03-0262-04
Detection of Hypodermal and Hematopoietic Necrosis Baculovirus of
Penaeid Shrimp by One-tube Multiplex PCR Method
XIA Chun,LIU Jin
(Department of Microbiology and Infection, College of Veterinary Medicine, China Agricultural University. Beijing 100094, China)
HUANG Jie
, 百拇医药
(Yellow Sea Fisheries Research Institute, Shandong, Qingdao 266071, China)
Abstract: In order to control the explosive epidemic disease of Penaeid shrimp in China, the one tube multiplex polymerase chain reaction (Multiplex PCR) were developed for detection of hypodermal and hematopoietic necrosis baculovirus (HHNBV). Four primers (P1, P2, P3 and P4) were prepared, based on the analysis on HHNBV-XIA and Penaeid rod-shaped DNA virus. The P2/P3/P4 specified HHNBV genome was used in the Multiplex PCR. The results showed that a high sensitivity about fg grade of HHNBV-XIA and Penaeid shrimp DNA infected with HHNBV was achieved with the Mlultiplex PCR.
, http://www.100md.com
Key words: Multiplex PCR; hypodermal and hematopoietic necrosis baculovirus (HHNBV); Penaeid shrimp; explosive epidemic disease
对虾皮下和造血器官坏死杆状病毒(hypodermal and hematopoietic necrosis baculovirus,HHNBV)[1]、对虾杆状DNA病毒(penaeid rod-ohaped DNA virus,PRDV)[2]和白斑杆状病毒(wtite spot baculovirus, WSBV)[3]是引起太平洋沿岸各国养殖对虾暴发性死亡的病原。这三种病毒十分相似,感染对虾后都呈现相似的病理变化,均不形成一般杆状病毒感染所产生的包含体。最近,一些实验结果初步表明,HHNBV、PRDV和WSBV为同类病毒,属杆状病毒属C杆状病毒亚群中的新病毒;我国学者又称由HHNBV引起的对虾疾病为对虾暴发性流行病[4]。
, 百拇医药
为了加强对HHNBV的诊断、预测和分子流行病学调查,作者克隆、测序了一段PCR靶DNA,定名为HHNBV-XIA(登录序号AB021155)[5]。还根据HHNBV-XIA序列建立了套式PCR法检测HHNBV[6]。Kimura等[2]和Lo等[3]也分别报道了套式PCR法检测PRDV和WSBV。但是,在套式PCR的实际应用中,由于第一次PCR产物难以纯化,二次PCR后,HHNBV和PRDV均出现非特异性扩增带[2,6],影响结果的判断。套式PCR也耗资费时。为了节省时间和资金,并能一次定性检出HHNBV感染,本研究根据HHNBV-XIA基因序列设计了多个引物,率先建立了多重PCR检测HHNBV的方法。现将结果报道如下。
材料与方法
1 引物设计 如图1所示,根据HHNBV-XIA序列(AB021155)采用GENETYX7.3软件在Power Macintosh G3微机上设计了4个多重PCR法用引物(P1、P2、P3、P4)。P2和P4为正引物,序列分别为:5'CTGGAGAGGACAAGAC(P2)和5'ACGCTATCCAGTATCACG(P4);P1和P3为反引物,序列分别为:5'CATGGCTGCTTCACAGAC(P1)和5'TTCATCAGATGCTACTGC(P3)。
, http://www.100md.com
图1 多重PCR用引物
Figure 1 Schematic representation of the multiplex PCR layout used to amplify HHNBV DNA[5], the positions of the primers (P1-4) were indicated
2 多重PCR扩增HHNBV-XIA基因 采用五种组合对HHNBV-XIA基因进行多重PCR扩增。五种引物组合分别为Ⅰ(P1/P3/P4)、Ⅱ(P2/P3/P4)、Ⅲ(P2/P1/P4)、Ⅳ(P1/P2/P3)和Ⅴ(P1/P2/P3/P4)。正、反引物各200pmol(等摩尔)添加入一反应管内,参照华美公司Taq DNA酶说明进行多重PCR扩增。模板DNA添加量为1ng,PCR反应总体积为50μl。PCR程序是首先98℃热变性8min,加入Taq酶。再94℃热变性1min,然后55℃退火1min,72℃延伸1min。PCR反应在HYBAID公司的PCRSprint仪上进行30个循环。PCR产物经1.0%琼脂糖电泳后,采用Alpha Imager 2000 Documentation & Analysis Systems(Alpha Innottech Corporation)观察结果。
, http://www.100md.com
3 多重PCR反应条件 从Ⅰ~Ⅴ种引物组合中选出最适合多重PCR扩增HHNBV-XIA基因的组合Ⅱ(P2/P3/P4)进行。用Milli-Q制备超纯水稀释25mmol/L Mg离子(Promega公司),使每50μl PCR反应管内Mg离子浓度分别为2.5mmol/L、2.0mmol/L、1.5mmol/L、1.0mmol/L、0.5mmol/L和0mmol/L。再如上述PCR扩增条件进行30个循环。随后继续再从0~2.5mol/L Mg离子PCR反应中选出适合多重PCR扩增的Mg离子浓度(1.5mmol/L),按上述PCR扩增条件分别进行25、30、35、40和50个循环。
4 多重PCR法的检出界限 采用PE BIO20紫外分光度(Perkin Elmer)计测定含HHNBV-XIA基因的T载体(Promega)DNA浓度,再用TE缓冲液分别调至1ng/μl、1fg/μl、pg/μl和pfg/μl 4个稀释度,在Mg离子浓度为1.5mmol/L,采用引物组合Ⅱ(P2/P3/P4),按前述PCR扩增条件分别进行多重PCR,反应为32个循环。
, http://www.100md.com
5 多重PCR法的应用 取6尾感染HHNBV的阳性对虾内脏匀浆,参照夏春和黄捷的方法[2]提取DNA后,分别调至1μg/μl、1ng/μl和1fg/μl 3个稀释度,再采用引物Ⅱ(P2/P3/P4)组合,如上述PCR扩增条件进行多重PCR,循环32个周期。PCR产物以1%琼脂糖凝胶电泳、照相。同时设对照,日本对虾杆状DNA病毒(PRDV)模板[2]和阴性中国对虾基因组DNA。
结 果
1 多重PCR扩增HHNBV-XIA基因
Ⅰ~Ⅴ五种引物组合后PCR扩增结果如图2所示。引物组合Ⅱ(P2/P3/P4)最适用多重PCR,可清晰的扩增出970bp和560bp两条目的带,并无非特异性杂带。其它四种引物组合结果有杂带等缺陷。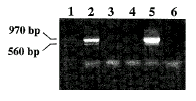
, 百拇医药
图2 五种引物组合进行多重PCR扩增结果
Figure 2 Effect of the multiplex PCR using five sectional primers(Ⅰ~Ⅴ)
Lane 1.P1/P3/P4 primers;Lane2.P2/P3/P4 primers;Lane 3.P2/P1/P4 primers;Lane 4.P1/P2/P3 primers;Lane 5.P1/P2/P3/P4 primers;6.PCR marker/(100bp ladder).
2 多重PCR反应条件 采用引物组合2(P2/P3/P4)在各种镁离子浓度下进行多重PCR扩增HHNBV-XIA结果如图3(A)所示。在1.0mmol/L和1.5mmol/L反应管内可清晰的扩增出970bp和560bp两条目的带,并无非特异性杂带。结果1.5mmol/L Mg离子适用。在1.5mmol/L Mg离子浓度下采用25~50个循环进行多重PCR结果如图3(B)所示。30个和35个循环间可见清晰的扩增目的带;970bp和560bp,32个循环合适。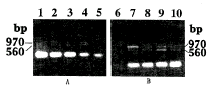
, http://www.100md.com
图3 镁离子浓度、循环数对多重PCR的影响
Figure 3 Influence of Mg2+ concentration and number of cycle on multiplex PCR using P2/P3/P4 primers
Lane 1. 2.5 mmol/L Mg2+; Lane 2. 2.0 mmol/L Mg2+; Lane 3. 1.5mmol/L Mg2+; Lane 4. 1.0mmol/L Mg2+; Lane 5. 0.5mmol Mg2+; Lane 6. 25 cycles; Lane 7.30 cycles; Lane 8. 35 cycles; Lane 9. 40 cycles; Lane 10. 50 cycles.
, http://www.100md.com
3 多重PCR法的检出界限
以HHNBV-XIA-T载体为模板进行多重PCR扩增结果如图4所示。1ng/μl和1fg/μl和反应管均可见可两条清晰的目的带且无非特异性杂带。因此,多重PCR法的检出界限为fg。
图4 多重PCR检出界限
Figure 4 Sensitivity of the multiplex PCR using P2/P3/P4 primers
Lane 1. PCR marker (100bp ladder); Lane 2. l ng/μl; Lane 3. 1fg/μl; Lane 4. pg/μl; Lane 5. pfg/μl.
, 百拇医药
4 多重PCR法的应用
多重PCR法的应用结果如图5所示,即可从1fg/μl阳性感染的中国对虾DNA中检出HHNBV。同时也能检出日本对虾杆状DNA病毒(PRDV),并且不与阴性中国对虾基因组DNA反应。
图5 多重PCR法的应用
Figure 5 Detection of HHNBV from Penaeid shrimp
Lane 1. PCR marker (100bp ladder); Lane 2. 1ng; Lane 3: 1fg; Lane 4: 1pg; Lane 5. PRDV template DNA; Lane 6. Penaeid shrimp DNA without HHNBV.
, 百拇医药
讨 论
对虾暴发性流行病是死亡率极高的传染病,其病原HHNBV、PRDV或WSBV感染对虾后,胃上皮细胞核和淋巴样细胞核肥大,虾壳上可形成白斑,且这三种不同名称的病毒均不形成一般杆状病毒感染所产生的包含体。最近,一些实验结果也初步表明,HHNBV、PRDV和WSBV为同类病毒。作者认为发生在我国、日本、泰国等地的对虾暴发性流行病的病原为同类病毒的不同毒株[4]。我们证实了HHNBV PCR靶基因(HHNBV-XIA)仅0.3%有别于PRDV,并建立了PCR法检测HHNBV[5,6]。本研究又进行了单管多重PCR法检测HHNBV。
1~5种引物组合(图2)进行PCR扩增后,仅2(P2/P3/P4)型组合适用于多重PCR,其它四种引物组合都有缺陷。可能是因为多引物更易形成多聚体,也易发生非特异性扩增。因此作者优化了PCR条件,即在1.0mmol/L~2.5mmol/L 4个镁离子浓度下和25~50个循环反应范围,1.5mmol/L镁离子和32循环更适用于多重PCR。
, 百拇医药
多重PCR法检出界限为fg/μl级HHNBV-XIA-T载体。也可从fg/μl阳性感染的对虾DNA中检出HHNBV。同时也能检出日本对虾杆状DNA病毒(PRDV),并且不与阴性中国对虾基因组DNA反应,这些显示出多重PCR法良好的特异性和灵敏性,如再继续以套式PCR法扩增HHNBV其灵敏度可再提高千倍。
本文建立了多重PCR法检测中国对虾HHNBV即暴发性流行病。该法能节省时间和资金、并能一次定性检出HHNBV感染。既可用于HHNBV的早期诊断,亦可在净化亲虾、防治对虾暴发性病毒病上起作用。
(致谢:感谢日本农林水产省养殖研究所山野惠佑博士提供日本对虾杆状DNA病毒(PRDV)基因)
基金项目:国家教委留学回国人员科研启动基金资助
作者简介:夏春(1962-),男,湖北,副教授,博士,研究方向为微生物学与免疫学。E-mail:xiachun@public.east.cn.net.
, 百拇医药
参考文献:
[1]黄捷,宋晓铃,于佳,等.对虾暴发性流行病的病原和病理学[J].海洋水产研究,1995,1:1-7.
[2]Kimura T, Yamano K, Nakano H, et al. Detection of Penaeid Rod-shaped DNA Virus (PRDV) by PCR[J]. Fish Pathology, 1996,31(2): 93-98.
[3]Lo C-F, Leu J H, Ho C-H, et al. Detection of baculovirus associated with white spot syndrome (WSBV) in Penaeid shrimp using polymerase chain reaction [J]. Dis Aquat Org, 1996, 25: 133~141.
[4]夏春.对虾病毒病的研究进展[J].世界农业,1997,97(10):40-41
[5]夏春,刘津.PCR检测对虾暴发性流行病靶基因的克隆和序列分析[J].病毒学报,1999,15: 364~367.
[6]夏春,黄捷.PCR法检测对虾皮下和造血组织坏死杆状病毒[J].微生物学报,1999,39(2),60-71.
收稿日期:1999-03-16;修回日期:1999-10-12, 百拇医药
单位:夏春 刘津(中国农业大学动物医学院,北京 100094);黄捷(中国水产科学研究院黄海水产研究所,山东 青岛 266071)
关键词:多重PCR法;皮下和造血器官坏死杆状病毒;对虾;暴发性流行病
病毒学报000315 摘要:根据对虾皮下和造血器官坏死杆状病毒(HHNBV)HHNBV-XIA靶基因序列设计了4个多重PCR法用引物(P1、P2、P3、P4)。采用了五种引物组合形式分别对HHNBV-XIA、HHNBV基因和PRDV-JAPAN片段进行了特异扩增,建立了多重PCR检测HHNBV方法。通过优化多重PCR法检测HHNBV条件,可从阳性感染的中国对虾fg级DNA中定性检测出皮下和造血器官坏死杆状病毒。
中图分类号:S945.1+9 文献标识码:A
, http://www.100md.com
文章编号:1000-8721(2000)03-0262-04
Detection of Hypodermal and Hematopoietic Necrosis Baculovirus of
Penaeid Shrimp by One-tube Multiplex PCR Method
XIA Chun,LIU Jin
(Department of Microbiology and Infection, College of Veterinary Medicine, China Agricultural University. Beijing 100094, China)
HUANG Jie
, 百拇医药
(Yellow Sea Fisheries Research Institute, Shandong, Qingdao 266071, China)
Abstract: In order to control the explosive epidemic disease of Penaeid shrimp in China, the one tube multiplex polymerase chain reaction (Multiplex PCR) were developed for detection of hypodermal and hematopoietic necrosis baculovirus (HHNBV). Four primers (P1, P2, P3 and P4) were prepared, based on the analysis on HHNBV-XIA and Penaeid rod-shaped DNA virus. The P2/P3/P4 specified HHNBV genome was used in the Multiplex PCR. The results showed that a high sensitivity about fg grade of HHNBV-XIA and Penaeid shrimp DNA infected with HHNBV was achieved with the Mlultiplex PCR.
, http://www.100md.com
Key words: Multiplex PCR; hypodermal and hematopoietic necrosis baculovirus (HHNBV); Penaeid shrimp; explosive epidemic disease
对虾皮下和造血器官坏死杆状病毒(hypodermal and hematopoietic necrosis baculovirus,HHNBV)[1]、对虾杆状DNA病毒(penaeid rod-ohaped DNA virus,PRDV)[2]和白斑杆状病毒(wtite spot baculovirus, WSBV)[3]是引起太平洋沿岸各国养殖对虾暴发性死亡的病原。这三种病毒十分相似,感染对虾后都呈现相似的病理变化,均不形成一般杆状病毒感染所产生的包含体。最近,一些实验结果初步表明,HHNBV、PRDV和WSBV为同类病毒,属杆状病毒属C杆状病毒亚群中的新病毒;我国学者又称由HHNBV引起的对虾疾病为对虾暴发性流行病[4]。
, 百拇医药
为了加强对HHNBV的诊断、预测和分子流行病学调查,作者克隆、测序了一段PCR靶DNA,定名为HHNBV-XIA(登录序号AB021155)[5]。还根据HHNBV-XIA序列建立了套式PCR法检测HHNBV[6]。Kimura等[2]和Lo等[3]也分别报道了套式PCR法检测PRDV和WSBV。但是,在套式PCR的实际应用中,由于第一次PCR产物难以纯化,二次PCR后,HHNBV和PRDV均出现非特异性扩增带[2,6],影响结果的判断。套式PCR也耗资费时。为了节省时间和资金,并能一次定性检出HHNBV感染,本研究根据HHNBV-XIA基因序列设计了多个引物,率先建立了多重PCR检测HHNBV的方法。现将结果报道如下。
材料与方法
1 引物设计 如图1所示,根据HHNBV-XIA序列(AB021155)采用GENETYX7.3软件在Power Macintosh G3微机上设计了4个多重PCR法用引物(P1、P2、P3、P4)。P2和P4为正引物,序列分别为:5'CTGGAGAGGACAAGAC(P2)和5'ACGCTATCCAGTATCACG(P4);P1和P3为反引物,序列分别为:5'CATGGCTGCTTCACAGAC(P1)和5'TTCATCAGATGCTACTGC(P3)。

, http://www.100md.com
图1 多重PCR用引物
Figure 1 Schematic representation of the multiplex PCR layout used to amplify HHNBV DNA[5], the positions of the primers (P1-4) were indicated
2 多重PCR扩增HHNBV-XIA基因 采用五种组合对HHNBV-XIA基因进行多重PCR扩增。五种引物组合分别为Ⅰ(P1/P3/P4)、Ⅱ(P2/P3/P4)、Ⅲ(P2/P1/P4)、Ⅳ(P1/P2/P3)和Ⅴ(P1/P2/P3/P4)。正、反引物各200pmol(等摩尔)添加入一反应管内,参照华美公司Taq DNA酶说明进行多重PCR扩增。模板DNA添加量为1ng,PCR反应总体积为50μl。PCR程序是首先98℃热变性8min,加入Taq酶。再94℃热变性1min,然后55℃退火1min,72℃延伸1min。PCR反应在HYBAID公司的PCRSprint仪上进行30个循环。PCR产物经1.0%琼脂糖电泳后,采用Alpha Imager 2000 Documentation & Analysis Systems(Alpha Innottech Corporation)观察结果。
, http://www.100md.com
3 多重PCR反应条件 从Ⅰ~Ⅴ种引物组合中选出最适合多重PCR扩增HHNBV-XIA基因的组合Ⅱ(P2/P3/P4)进行。用Milli-Q制备超纯水稀释25mmol/L Mg离子(Promega公司),使每50μl PCR反应管内Mg离子浓度分别为2.5mmol/L、2.0mmol/L、1.5mmol/L、1.0mmol/L、0.5mmol/L和0mmol/L。再如上述PCR扩增条件进行30个循环。随后继续再从0~2.5mol/L Mg离子PCR反应中选出适合多重PCR扩增的Mg离子浓度(1.5mmol/L),按上述PCR扩增条件分别进行25、30、35、40和50个循环。
4 多重PCR法的检出界限 采用PE BIO20紫外分光度(Perkin Elmer)计测定含HHNBV-XIA基因的T载体(Promega)DNA浓度,再用TE缓冲液分别调至1ng/μl、1fg/μl、pg/μl和pfg/μl 4个稀释度,在Mg离子浓度为1.5mmol/L,采用引物组合Ⅱ(P2/P3/P4),按前述PCR扩增条件分别进行多重PCR,反应为32个循环。
, http://www.100md.com
5 多重PCR法的应用 取6尾感染HHNBV的阳性对虾内脏匀浆,参照夏春和黄捷的方法[2]提取DNA后,分别调至1μg/μl、1ng/μl和1fg/μl 3个稀释度,再采用引物Ⅱ(P2/P3/P4)组合,如上述PCR扩增条件进行多重PCR,循环32个周期。PCR产物以1%琼脂糖凝胶电泳、照相。同时设对照,日本对虾杆状DNA病毒(PRDV)模板[2]和阴性中国对虾基因组DNA。
结 果
1 多重PCR扩增HHNBV-XIA基因
Ⅰ~Ⅴ五种引物组合后PCR扩增结果如图2所示。引物组合Ⅱ(P2/P3/P4)最适用多重PCR,可清晰的扩增出970bp和560bp两条目的带,并无非特异性杂带。其它四种引物组合结果有杂带等缺陷。

, 百拇医药
图2 五种引物组合进行多重PCR扩增结果
Figure 2 Effect of the multiplex PCR using five sectional primers(Ⅰ~Ⅴ)
Lane 1.P1/P3/P4 primers;Lane2.P2/P3/P4 primers;Lane 3.P2/P1/P4 primers;Lane 4.P1/P2/P3 primers;Lane 5.P1/P2/P3/P4 primers;6.PCR marker/(100bp ladder).
2 多重PCR反应条件 采用引物组合2(P2/P3/P4)在各种镁离子浓度下进行多重PCR扩增HHNBV-XIA结果如图3(A)所示。在1.0mmol/L和1.5mmol/L反应管内可清晰的扩增出970bp和560bp两条目的带,并无非特异性杂带。结果1.5mmol/L Mg离子适用。在1.5mmol/L Mg离子浓度下采用25~50个循环进行多重PCR结果如图3(B)所示。30个和35个循环间可见清晰的扩增目的带;970bp和560bp,32个循环合适。

, http://www.100md.com
图3 镁离子浓度、循环数对多重PCR的影响
Figure 3 Influence of Mg2+ concentration and number of cycle on multiplex PCR using P2/P3/P4 primers
Lane 1. 2.5 mmol/L Mg2+; Lane 2. 2.0 mmol/L Mg2+; Lane 3. 1.5mmol/L Mg2+; Lane 4. 1.0mmol/L Mg2+; Lane 5. 0.5mmol Mg2+; Lane 6. 25 cycles; Lane 7.30 cycles; Lane 8. 35 cycles; Lane 9. 40 cycles; Lane 10. 50 cycles.
, http://www.100md.com
3 多重PCR法的检出界限
以HHNBV-XIA-T载体为模板进行多重PCR扩增结果如图4所示。1ng/μl和1fg/μl和反应管均可见可两条清晰的目的带且无非特异性杂带。因此,多重PCR法的检出界限为fg。

图4 多重PCR检出界限
Figure 4 Sensitivity of the multiplex PCR using P2/P3/P4 primers
Lane 1. PCR marker (100bp ladder); Lane 2. l ng/μl; Lane 3. 1fg/μl; Lane 4. pg/μl; Lane 5. pfg/μl.
, 百拇医药
4 多重PCR法的应用
多重PCR法的应用结果如图5所示,即可从1fg/μl阳性感染的中国对虾DNA中检出HHNBV。同时也能检出日本对虾杆状DNA病毒(PRDV),并且不与阴性中国对虾基因组DNA反应。

图5 多重PCR法的应用
Figure 5 Detection of HHNBV from Penaeid shrimp
Lane 1. PCR marker (100bp ladder); Lane 2. 1ng; Lane 3: 1fg; Lane 4: 1pg; Lane 5. PRDV template DNA; Lane 6. Penaeid shrimp DNA without HHNBV.
, 百拇医药
讨 论
对虾暴发性流行病是死亡率极高的传染病,其病原HHNBV、PRDV或WSBV感染对虾后,胃上皮细胞核和淋巴样细胞核肥大,虾壳上可形成白斑,且这三种不同名称的病毒均不形成一般杆状病毒感染所产生的包含体。最近,一些实验结果也初步表明,HHNBV、PRDV和WSBV为同类病毒。作者认为发生在我国、日本、泰国等地的对虾暴发性流行病的病原为同类病毒的不同毒株[4]。我们证实了HHNBV PCR靶基因(HHNBV-XIA)仅0.3%有别于PRDV,并建立了PCR法检测HHNBV[5,6]。本研究又进行了单管多重PCR法检测HHNBV。
1~5种引物组合(图2)进行PCR扩增后,仅2(P2/P3/P4)型组合适用于多重PCR,其它四种引物组合都有缺陷。可能是因为多引物更易形成多聚体,也易发生非特异性扩增。因此作者优化了PCR条件,即在1.0mmol/L~2.5mmol/L 4个镁离子浓度下和25~50个循环反应范围,1.5mmol/L镁离子和32循环更适用于多重PCR。
, 百拇医药
多重PCR法检出界限为fg/μl级HHNBV-XIA-T载体。也可从fg/μl阳性感染的对虾DNA中检出HHNBV。同时也能检出日本对虾杆状DNA病毒(PRDV),并且不与阴性中国对虾基因组DNA反应,这些显示出多重PCR法良好的特异性和灵敏性,如再继续以套式PCR法扩增HHNBV其灵敏度可再提高千倍。
本文建立了多重PCR法检测中国对虾HHNBV即暴发性流行病。该法能节省时间和资金、并能一次定性检出HHNBV感染。既可用于HHNBV的早期诊断,亦可在净化亲虾、防治对虾暴发性病毒病上起作用。
(致谢:感谢日本农林水产省养殖研究所山野惠佑博士提供日本对虾杆状DNA病毒(PRDV)基因)
基金项目:国家教委留学回国人员科研启动基金资助
作者简介:夏春(1962-),男,湖北,副教授,博士,研究方向为微生物学与免疫学。E-mail:xiachun@public.east.cn.net.
, 百拇医药
参考文献:
[1]黄捷,宋晓铃,于佳,等.对虾暴发性流行病的病原和病理学[J].海洋水产研究,1995,1:1-7.
[2]Kimura T, Yamano K, Nakano H, et al. Detection of Penaeid Rod-shaped DNA Virus (PRDV) by PCR[J]. Fish Pathology, 1996,31(2): 93-98.
[3]Lo C-F, Leu J H, Ho C-H, et al. Detection of baculovirus associated with white spot syndrome (WSBV) in Penaeid shrimp using polymerase chain reaction [J]. Dis Aquat Org, 1996, 25: 133~141.
[4]夏春.对虾病毒病的研究进展[J].世界农业,1997,97(10):40-41
[5]夏春,刘津.PCR检测对虾暴发性流行病靶基因的克隆和序列分析[J].病毒学报,1999,15: 364~367.
[6]夏春,黄捷.PCR法检测对虾皮下和造血组织坏死杆状病毒[J].微生物学报,1999,39(2),60-71.
收稿日期:1999-03-16;修回日期:1999-10-12, 百拇医药