PCR-LIS-SSCP快速分析非缺失型α-地中海贫血点突变
作者:赵永忠 徐湘民* 徐钤
单位:510515 广州,第一军医大学分子生物学研究所
关键词:单链构象多态性;低离子强度;α-地中海贫血;α-珠蛋白基因
中华医学遗传学杂志990215 【摘要】 目的 建立一种简便快速的筛查非缺失型α-地中海贫血点突变的SSCP分析方法。方法 在选择性扩增α2珠蛋白基因的基础上,巢式PCR扩增突变热点区域,低离子强度(LIS)条件下将PCR产物热变性,用非变性胶电泳分析其SSCP。结果 LIS条件下处理样品,PCR产物变性效率明显提高,电泳结果可检出区别于野生型对照的3种含基因突变的电泳带型,且电泳时间仅需3小时。结论 PCR-LIS-SSCP可用于快速筛查非缺失型α-地中海贫血点突变。
Rapid detection of non-deletional α-thalassemia mutations by PCR-LIS-SSCP
, 百拇医药
ZHAO Yongzhong, XU Xiangmin*,XU Qian.
*Institute of Molecular Biology, The First Military Medical University,Guangzhou 510515 P.R. China E-mail:gzxuxm@publicl.guangzhou.gd.cn
【Abstract】 Objective To establish a rapid and convenient single strand conformation polymorphism (SSCP) analysis method for detecting the point mutation of non-deletional α-thalassemia. Methods The 543bp DNA fragment spanning the hot spot region mainly responsible for non-deletional α-thalassemia was nested amplified using the selective amplification of α2 globin gene as a template and was denatured with low ionic strength(LIS) solution followed by SSCP analysis.Results LIS buffer was more efficient for ssDNA formation than formamide buffer was and the formation of ssDNA was very stable. In addition to a normal electrophoresis pattern, at least three SSCP profiles can be detected by the present method when the DNA samples bearing non-deletional genes of Hb H disease were screened. Confirmed by DNA sequencing analysis, the DNAs represented these profiles have turned out to be the different three mutants, i.e., the αCS mutation, the αQS mutation and the αWestmead mutation, respectively. Only 3 hours were needed to complete the electrophoresis procedure of this method. Conclusion PCR-LIS-SSCP can be used as a tool in rapid screening for the alterations in human α-globin gene.
, 百拇医药
【Key words】 Single strand conformation polymorphism Low ionic strength α-thalassemia
α-globin gene
除基因缺失外,部分α-地中海贫血(α-地贫)是由于基因点突变或小的缺失所致,此类α-地贫称为非缺失型α-地贫[1]。我国地贫高发区该类α-地贫的分子病理基础有待进一步的研究阐明。分析非缺失型α-地贫突变主要涉及到点突变分析技术。单链构象多态性(single strand conformation polymorphism, SSCP)分析是常用的点突变分析技术[2],Maruya等[3]采用低离子强度(low ionic strength, LIS)上样缓冲液处理样品来提高单链产率和分离效果的尝试值得注意,该项被称为LIS-SSCP的技术在HLA分型的应用中取得了良好的效果。我们参照该方法并用于中国人非缺失型α-地中海贫血点突变分析,报告如下。
, 百拇医药
1 材料和方法
1.1 样品 血红蛋白H(hemoglobin H, Hb H)病的诊断标准按文献[4]。确诊指标为血红蛋白电泳出现HbH区带和/或有家系资料。取患者新鲜全血1ml,用200μl 0.5mol/L EDTA抗凝。样品DNA的抽提按文献[5]的方法。
1.2 PCR试剂 寡核苷酸引物由中科院上海细胞生物学研究所合成。用于扩增α珠蛋白基因的引物序列如下:P1:5′-TGGAGGGTGGAGACGTCCTG-3′(nt 6464~6483);P3:5′-CCATTGTTGGCACATTCC-GGGACA-3′(nt 7525~7548);P4:5′-GGCAAGAA-GGTGGCCGAC-3′(nt 6997~7014); P5:5′-GCAC-ATTCCGGGACAGAG-3′(nt 7522~7539)。引物的位置数据来自Genbank文件HUMHBA4.SEQ。Taq酶及缓冲液为加拿大Genda Technology公司产品,dNTP购自Promega公司。
, 百拇医药
1.3 PCR扩增 P1+P3为选择性扩增α2珠蛋白基因的外引物,P4+P5为巢式引物。外引物扩增时,50μl反应总体积中含gDNA0.1~0.5μg,50mmol/L Tris-HCl (pH9.2),16mmol/L (NH4)2SO4,2.25mmol/L MgCl2,每种引物0.25μmol/L, 0.2mmol/L dNTP, 10%DMSO和Taq酶2U。内引物反应体系与以上相同,除模板改用按1∶1000稀释的1 085bp片段(外引物产物,取1μl)外。热循环参数:P1+P3为96℃10分钟,热启动,95℃1分钟,60℃ 1分钟,72℃ 3分钟,30个循环,最后一个循环72℃延伸5分钟。P4+P5则为96℃ 10分钟,热启动95℃ 1分钟,55℃1分钟,72℃1分钟,30循环,最后一个循环72℃延伸5分钟。
1.4 样品处理 SS-缓冲液(含0.05%溴酚蓝,0.05%二甲苯青FF,1mmol/L EDTA和95%甲酰胺溶液)用于普通SSCP,LIS-缓冲液(含0.05%溴酚蓝,0.01二甲苯青FF和10%蔗糖溶液)用于LIS-SSCP。取5μl PCR产物,加10μl SS-缓冲液,混匀,98℃置5分钟,立即冰浴,上样。或取1μl PCR产物,加20μl LIS-缓冲液,98℃置5分钟,取5μl上样。
, 百拇医药
1.5 电泳分离 8%聚丙烯酰胺凝胶按N,N′甲叉丙烯酰胺∶丙烯酰胺=1∶19或1∶49的比例配制,凝胶大小为10.5cm×12.5cm,厚度为1mm。电泳采用0.5×TBE缓冲液;温度15℃,电压300V,电流20mA,电泳时间3小时。结果检测采用银染法[6]。
2 结果
2.1 PCR扩增结果 用P1+P3选择性扩增α2-珠蛋白基因以区分非缺失型HbH病(ααT/--)和缺失型HbH病DNA(-α3.7/--SEA和-α4.2/--SEA)。前者有α2-珠蛋白基因特异性扩增产物(1 085bp)出现,而后者则为PCR阴性反应。将上述特异性α2-珠蛋白基因产物稀释1 000倍,取1μl稀释物作为50μl PCR反应体系的模板,用引物P4+P5进行巢式PCR,扩增突变热点区域。结果可见大小与预期的543bp片段相符的特异性扩增产物,该PCR产物用于SSCP分析(PCR结果未显示)。
, 百拇医药
2.2 点突变检测结果 图1的结果显示,LIS条件下,单链生成率明显高于传统方法,且重现性好。待检HbH病样品经2次扩增的PCR片段为α2-珠蛋白基因的突变热点区,该片段在8%聚丙烯酰胺凝胶中(甲叉丙烯酰胺与丙烯酰胺之比为1∶19)进行LIS-SSCP分析,可清楚的检测出至少3种与野生型不同的电泳带型(图2)。示异常带型的样品分别经测序确认为αCS(α2,142 TAA→CAA)终止密码突变、αQS(α2,CTG→CCG,125 Leu→Pro)突变和α2,122CAG→CAC(His→Gln)错义突变(测序结果未显示)。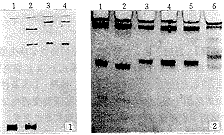
图1 低离子强度条件下单链生成效率 1:543bp双链PCR产物对照;2:甲酰胺变性处理样品;3、4:LIS溶液变性处理样品 图2 非缺失型α-地贫突变热点区域的PCR-LIS-SSCP分析图谱 1:野生型对照;2:αQS突变;3~5:αCS突变;6:α2,122 CAG→CAC (His→Gln)错义突变
, 百拇医药
Fig 1 The efficiency of ssDNA formation under conditions of denaturing samples with LIS buffer Lane 1:543bp dsDNA control; DNA samples containing the 543bp DNA fragment were denatured at 98℃ for 5 minutes with formamide loading buffer (lane 2) or with LIS loading buffer (lanes 3,4). Electrophoresis was run on 8% gel at 15℃ in 0.5×TBE for 3 hours. Fig 2 PCR-LIS-SSCP analysis of the 543bp fragments bearing the point mutations causing α-thalassemias Lane l:Wild type control; lanes 2-6: The three SSCP profiles can be detected on the gel; Confirmed by DNA sequencing analysis, the DNAs represented these profiles have turned out to be the different three mutants, i.e., the αQS mutation(lane 2), the αCS mutation(lanes 3-5) and the αWestmead mutation(lane 6), respectively (data not shown). Electrophoresis was run under the same conditions as described above (see the legend in Fig 1)
, http://www.100md.com
3 讨论
单链构象多态性(SSCP)分析,是依据单链DNA或RNA在非变性聚丙烯酰胺凝胶电泳体系中以构象为基础的电泳行为来鉴定DNA序列改变的一项技术[2]。该技术因操作简单和适用面广而被广泛采用,但此法也有影响因素多而致重复性差,及突变检出率相对低(一般约为70%~80%)的缺点[7]。Maruya等[3]首先建立的用于HLA分型的PCR-LIS-SSCP,是一项通过上样前提高单链生成率来改进分离效果的分析技术。LIS变性液提高单链生成率的基本原理是:溶液离子强度降低可使核酸分子的变性温度和复性效率降低。同时由于较常规方法使用了更多的LIS变性液处理样品,也使待分离的PCR产物更加稀释而致复性效率下降。而在甲酰胺变性条件下,变性后的单链DNA较易复性,因此单链生成效率低。我们采用LIS-SSCP分析α2珠蛋白基因片段的结果,显示出单链生成效率较甲酰胺变性法显著增高(图1),且电泳时间较一般方法大为缩短(从需过夜减至3小时左右),后者克服了因长时间电泳而带来的带型弥散的不足,因而有助于提高分离效果及增强实验的可重复性。非缺失型α-地贫突变热点区域PCR-LIS-SSCP分析结果表明,在8%聚丙烯酰胺凝胶中(甲叉丙烯酰胺与丙烯酰胺之比为1∶19),可清楚地检测出至少3种与野生型不同的电泳带型(图2),甲叉丙烯酰胺与丙烯酰胺之比为1∶49时,则仅见2种与野生型不同的电泳带型(αCS和αQS突变),因此我们的实验选用了1∶19的配方。在针对不同检测片段时,凝胶中的这一比例需根据具体情况调整。另外值得一提的是在LIS条件下热变性,样品毋需立即转入冰浴中,一般在室温条件下保存4~5小时亦不会影响分析结果。此外,我们还采用了简单快速的银染方法,提高了检测灵敏度,且无需使用同位素,使该项技术更易普及。我们已将该方法用于临床样品的分子筛查,期望寻找到α-地贫新的突变。
, 百拇医药
本课题由国家自然科学基金(39770799)、广东省自然科学基金(950572)和国家计生委科研项目基金资助
*为课题负责人和通信联系人
参考文献
[1] Higgs DR, Vickers MA, Wilkie AOM, et al. A review of the molecular genetics of the human α-globin gene cluster. Blood, 1989, 73(5)∶1081-1104.
[2] Orita M, Lwahana H, Kanazawa H, et al. Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms. Proc Natl Acad Sci USA, 1989, 86(8)∶2766-2770.
, http://www.100md.com
[3] Maruya E, Saji H, Yokoyama S. PCR-LIS-SSCP(low ionic strength single-strand conformation polymorphism)——a simple method for high-resolution allele typing of HLA-DRB1,-DQB1,and -DPB1. Genome Res, 1996, 6(1)∶51-57.
[4] 张之南主编.血液病诊断及疗效标准.第1版.天津:天津科学技术出版社,1991.44.
[5] Lahiri DK, Schabel G. DNA isolation by a rapid method from human blood samples: effects of MgCl2, EDTA, storage time, and temperature on DNA yield and quality. Biochem Genet, 1993, 31(7-8)∶321-328.
[6] 杜凯.DNA序列测定.见:卢圣栋主编.现代分子生物学实验技术.第1版.北京:高等教育出版社,1992.359-360.
[7] Fujita K, Silver J. Single strand conformational polymorphism. PCR Method Appl,1994,4(3)∶317-140.
(收稿:1998-04-20 修回:1998-07-06), 百拇医药(赵永忠 徐湘民* 徐钤)
单位:510515 广州,第一军医大学分子生物学研究所
关键词:单链构象多态性;低离子强度;α-地中海贫血;α-珠蛋白基因
中华医学遗传学杂志990215 【摘要】 目的 建立一种简便快速的筛查非缺失型α-地中海贫血点突变的SSCP分析方法。方法 在选择性扩增α2珠蛋白基因的基础上,巢式PCR扩增突变热点区域,低离子强度(LIS)条件下将PCR产物热变性,用非变性胶电泳分析其SSCP。结果 LIS条件下处理样品,PCR产物变性效率明显提高,电泳结果可检出区别于野生型对照的3种含基因突变的电泳带型,且电泳时间仅需3小时。结论 PCR-LIS-SSCP可用于快速筛查非缺失型α-地中海贫血点突变。
Rapid detection of non-deletional α-thalassemia mutations by PCR-LIS-SSCP
, 百拇医药
ZHAO Yongzhong, XU Xiangmin*,XU Qian.
*Institute of Molecular Biology, The First Military Medical University,Guangzhou 510515 P.R. China E-mail:gzxuxm@publicl.guangzhou.gd.cn
【Abstract】 Objective To establish a rapid and convenient single strand conformation polymorphism (SSCP) analysis method for detecting the point mutation of non-deletional α-thalassemia. Methods The 543bp DNA fragment spanning the hot spot region mainly responsible for non-deletional α-thalassemia was nested amplified using the selective amplification of α2 globin gene as a template and was denatured with low ionic strength(LIS) solution followed by SSCP analysis.Results LIS buffer was more efficient for ssDNA formation than formamide buffer was and the formation of ssDNA was very stable. In addition to a normal electrophoresis pattern, at least three SSCP profiles can be detected by the present method when the DNA samples bearing non-deletional genes of Hb H disease were screened. Confirmed by DNA sequencing analysis, the DNAs represented these profiles have turned out to be the different three mutants, i.e., the αCS mutation, the αQS mutation and the αWestmead mutation, respectively. Only 3 hours were needed to complete the electrophoresis procedure of this method. Conclusion PCR-LIS-SSCP can be used as a tool in rapid screening for the alterations in human α-globin gene.
, 百拇医药
【Key words】 Single strand conformation polymorphism Low ionic strength α-thalassemia
α-globin gene
除基因缺失外,部分α-地中海贫血(α-地贫)是由于基因点突变或小的缺失所致,此类α-地贫称为非缺失型α-地贫[1]。我国地贫高发区该类α-地贫的分子病理基础有待进一步的研究阐明。分析非缺失型α-地贫突变主要涉及到点突变分析技术。单链构象多态性(single strand conformation polymorphism, SSCP)分析是常用的点突变分析技术[2],Maruya等[3]采用低离子强度(low ionic strength, LIS)上样缓冲液处理样品来提高单链产率和分离效果的尝试值得注意,该项被称为LIS-SSCP的技术在HLA分型的应用中取得了良好的效果。我们参照该方法并用于中国人非缺失型α-地中海贫血点突变分析,报告如下。
, 百拇医药
1 材料和方法
1.1 样品 血红蛋白H(hemoglobin H, Hb H)病的诊断标准按文献[4]。确诊指标为血红蛋白电泳出现HbH区带和/或有家系资料。取患者新鲜全血1ml,用200μl 0.5mol/L EDTA抗凝。样品DNA的抽提按文献[5]的方法。
1.2 PCR试剂 寡核苷酸引物由中科院上海细胞生物学研究所合成。用于扩增α珠蛋白基因的引物序列如下:P1:5′-TGGAGGGTGGAGACGTCCTG-3′(nt 6464~6483);P3:5′-CCATTGTTGGCACATTCC-GGGACA-3′(nt 7525~7548);P4:5′-GGCAAGAA-GGTGGCCGAC-3′(nt 6997~7014); P5:5′-GCAC-ATTCCGGGACAGAG-3′(nt 7522~7539)。引物的位置数据来自Genbank文件HUMHBA4.SEQ。Taq酶及缓冲液为加拿大Genda Technology公司产品,dNTP购自Promega公司。
, 百拇医药
1.3 PCR扩增 P1+P3为选择性扩增α2珠蛋白基因的外引物,P4+P5为巢式引物。外引物扩增时,50μl反应总体积中含gDNA0.1~0.5μg,50mmol/L Tris-HCl (pH9.2),16mmol/L (NH4)2SO4,2.25mmol/L MgCl2,每种引物0.25μmol/L, 0.2mmol/L dNTP, 10%DMSO和Taq酶2U。内引物反应体系与以上相同,除模板改用按1∶1000稀释的1 085bp片段(外引物产物,取1μl)外。热循环参数:P1+P3为96℃10分钟,热启动,95℃1分钟,60℃ 1分钟,72℃ 3分钟,30个循环,最后一个循环72℃延伸5分钟。P4+P5则为96℃ 10分钟,热启动95℃ 1分钟,55℃1分钟,72℃1分钟,30循环,最后一个循环72℃延伸5分钟。
1.4 样品处理 SS-缓冲液(含0.05%溴酚蓝,0.05%二甲苯青FF,1mmol/L EDTA和95%甲酰胺溶液)用于普通SSCP,LIS-缓冲液(含0.05%溴酚蓝,0.01二甲苯青FF和10%蔗糖溶液)用于LIS-SSCP。取5μl PCR产物,加10μl SS-缓冲液,混匀,98℃置5分钟,立即冰浴,上样。或取1μl PCR产物,加20μl LIS-缓冲液,98℃置5分钟,取5μl上样。
, 百拇医药
1.5 电泳分离 8%聚丙烯酰胺凝胶按N,N′甲叉丙烯酰胺∶丙烯酰胺=1∶19或1∶49的比例配制,凝胶大小为10.5cm×12.5cm,厚度为1mm。电泳采用0.5×TBE缓冲液;温度15℃,电压300V,电流20mA,电泳时间3小时。结果检测采用银染法[6]。
2 结果
2.1 PCR扩增结果 用P1+P3选择性扩增α2-珠蛋白基因以区分非缺失型HbH病(ααT/--)和缺失型HbH病DNA(-α3.7/--SEA和-α4.2/--SEA)。前者有α2-珠蛋白基因特异性扩增产物(1 085bp)出现,而后者则为PCR阴性反应。将上述特异性α2-珠蛋白基因产物稀释1 000倍,取1μl稀释物作为50μl PCR反应体系的模板,用引物P4+P5进行巢式PCR,扩增突变热点区域。结果可见大小与预期的543bp片段相符的特异性扩增产物,该PCR产物用于SSCP分析(PCR结果未显示)。
, 百拇医药
2.2 点突变检测结果 图1的结果显示,LIS条件下,单链生成率明显高于传统方法,且重现性好。待检HbH病样品经2次扩增的PCR片段为α2-珠蛋白基因的突变热点区,该片段在8%聚丙烯酰胺凝胶中(甲叉丙烯酰胺与丙烯酰胺之比为1∶19)进行LIS-SSCP分析,可清楚的检测出至少3种与野生型不同的电泳带型(图2)。示异常带型的样品分别经测序确认为αCS(α2,142 TAA→CAA)终止密码突变、αQS(α2,CTG→CCG,125 Leu→Pro)突变和α2,122CAG→CAC(His→Gln)错义突变(测序结果未显示)。

图1 低离子强度条件下单链生成效率 1:543bp双链PCR产物对照;2:甲酰胺变性处理样品;3、4:LIS溶液变性处理样品 图2 非缺失型α-地贫突变热点区域的PCR-LIS-SSCP分析图谱 1:野生型对照;2:αQS突变;3~5:αCS突变;6:α2,122 CAG→CAC (His→Gln)错义突变
, 百拇医药
Fig 1 The efficiency of ssDNA formation under conditions of denaturing samples with LIS buffer Lane 1:543bp dsDNA control; DNA samples containing the 543bp DNA fragment were denatured at 98℃ for 5 minutes with formamide loading buffer (lane 2) or with LIS loading buffer (lanes 3,4). Electrophoresis was run on 8% gel at 15℃ in 0.5×TBE for 3 hours. Fig 2 PCR-LIS-SSCP analysis of the 543bp fragments bearing the point mutations causing α-thalassemias Lane l:Wild type control; lanes 2-6: The three SSCP profiles can be detected on the gel; Confirmed by DNA sequencing analysis, the DNAs represented these profiles have turned out to be the different three mutants, i.e., the αQS mutation(lane 2), the αCS mutation(lanes 3-5) and the αWestmead mutation(lane 6), respectively (data not shown). Electrophoresis was run under the same conditions as described above (see the legend in Fig 1)
, http://www.100md.com
3 讨论
单链构象多态性(SSCP)分析,是依据单链DNA或RNA在非变性聚丙烯酰胺凝胶电泳体系中以构象为基础的电泳行为来鉴定DNA序列改变的一项技术[2]。该技术因操作简单和适用面广而被广泛采用,但此法也有影响因素多而致重复性差,及突变检出率相对低(一般约为70%~80%)的缺点[7]。Maruya等[3]首先建立的用于HLA分型的PCR-LIS-SSCP,是一项通过上样前提高单链生成率来改进分离效果的分析技术。LIS变性液提高单链生成率的基本原理是:溶液离子强度降低可使核酸分子的变性温度和复性效率降低。同时由于较常规方法使用了更多的LIS变性液处理样品,也使待分离的PCR产物更加稀释而致复性效率下降。而在甲酰胺变性条件下,变性后的单链DNA较易复性,因此单链生成效率低。我们采用LIS-SSCP分析α2珠蛋白基因片段的结果,显示出单链生成效率较甲酰胺变性法显著增高(图1),且电泳时间较一般方法大为缩短(从需过夜减至3小时左右),后者克服了因长时间电泳而带来的带型弥散的不足,因而有助于提高分离效果及增强实验的可重复性。非缺失型α-地贫突变热点区域PCR-LIS-SSCP分析结果表明,在8%聚丙烯酰胺凝胶中(甲叉丙烯酰胺与丙烯酰胺之比为1∶19),可清楚地检测出至少3种与野生型不同的电泳带型(图2),甲叉丙烯酰胺与丙烯酰胺之比为1∶49时,则仅见2种与野生型不同的电泳带型(αCS和αQS突变),因此我们的实验选用了1∶19的配方。在针对不同检测片段时,凝胶中的这一比例需根据具体情况调整。另外值得一提的是在LIS条件下热变性,样品毋需立即转入冰浴中,一般在室温条件下保存4~5小时亦不会影响分析结果。此外,我们还采用了简单快速的银染方法,提高了检测灵敏度,且无需使用同位素,使该项技术更易普及。我们已将该方法用于临床样品的分子筛查,期望寻找到α-地贫新的突变。
, 百拇医药
本课题由国家自然科学基金(39770799)、广东省自然科学基金(950572)和国家计生委科研项目基金资助
*为课题负责人和通信联系人
参考文献
[1] Higgs DR, Vickers MA, Wilkie AOM, et al. A review of the molecular genetics of the human α-globin gene cluster. Blood, 1989, 73(5)∶1081-1104.
[2] Orita M, Lwahana H, Kanazawa H, et al. Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms. Proc Natl Acad Sci USA, 1989, 86(8)∶2766-2770.
, http://www.100md.com
[3] Maruya E, Saji H, Yokoyama S. PCR-LIS-SSCP(low ionic strength single-strand conformation polymorphism)——a simple method for high-resolution allele typing of HLA-DRB1,-DQB1,and -DPB1. Genome Res, 1996, 6(1)∶51-57.
[4] 张之南主编.血液病诊断及疗效标准.第1版.天津:天津科学技术出版社,1991.44.
[5] Lahiri DK, Schabel G. DNA isolation by a rapid method from human blood samples: effects of MgCl2, EDTA, storage time, and temperature on DNA yield and quality. Biochem Genet, 1993, 31(7-8)∶321-328.
[6] 杜凯.DNA序列测定.见:卢圣栋主编.现代分子生物学实验技术.第1版.北京:高等教育出版社,1992.359-360.
[7] Fujita K, Silver J. Single strand conformational polymorphism. PCR Method Appl,1994,4(3)∶317-140.
(收稿:1998-04-20 修回:1998-07-06), 百拇医药(赵永忠 徐湘民* 徐钤)