汉滩病毒核衣壳蛋白主要B细胞表位的识别及其基因定位
作者:白雪帆 汪毅 潘蕾 黄长形 李光玉 杨为松
单位:710038 西安,第西军医大学唐都医院感染病诊疗中心
关键词:汉滩病毒;抗体,单克隆;噬菌体肽库
中华传染病杂志990408 【摘要】 目的 确定汉滩病毒核衣壳蛋白(NP)B细胞表位的基因定位。方法 将DNase Ⅰ随机消化的汉滩病毒76/118株S基因片段与丝状噬菌体载体连接后转化MC1061菌,成功构建了汉滩病毒S基因-多肽片段噬菌体肽库。应用12株国产抗汉滩病毒单克隆抗体对表达汉滩病毒NP多肽片段的噬菌体文库进行了3~4轮淘筛(biopanning),并对阳性噬菌体克隆进行了扩增和测序。结果 确定了S基因产物——病毒核衣壳蛋白氨基端的一个B细胞线性抗原表位,该表位覆盖aa1-aa86的范围,相当于S基因bp37-294,其核心序列可能由aa15-66构成。结论 该线性表位能与多种抗汉滩病毒单克隆抗体发生交叉反应,是汉滩病毒NP的主要抗原表位。
, http://www.100md.com
The recognition and mapping of epitopes of Hantaan virus nucleocapsid protein by S gene-peptide fragment phage display libraries
BAI Xuefan, WANG Yi, PAN Lei, et al.
Department of Infectious Diseases, Fourth Military Medical University, Xian 710038
【Abstract】 Objective In order to construct the library of Hantaan virus S gene-peptide fragments on phages, screening the epitopes of nucleocapsid protein with monoclonal antibodies against Hantaviruses. Methods Hantaan virus S gene from recombinant plasmid pUC-HTNV-S was digested with DNase Ⅰ and ligated with filamentous phage vector that has been cut with Sfi I. The ligation were transformed into E. coli MC1061 for constructing the phage library of Hantaan virus S gene-peptide fragments. After biopanning with some strains of monoclonal antibodies, the positive phage clones were picked out for sequencing. Results A linear epitope consisting of amino acid (aa) 1-86 within nucleocapsid protein reading frame was determined and its core sequence consists of aa 15-66. Conclusion The linear epitope is a major and cross-reactive antigenic epitope. The findings above are helpful for elucidating the relationship between molecular structure and function of Hantaviruses.
, 百拇医药
【Key words】 Hantaan virus Antibodies, monoclonal Bacteriophages peptide libraries
核衣壳蛋白(Nucleocapsid Protein, NP)是汉坦病毒(hantaviruses, HV)的主要结构蛋白。已知HV约45000~51000的NP由428~433个氨基酸组成,其N端约100个氨基酸大部分具有亲水性,且能被患者血清及许多单克隆抗体所识别[1-3]。虽然对HV NP氨基端蛋白的原核表达产物的抗原性及免疫原性已进行了许多研究,并已用于出血热的血清学诊断,但该抗原表位的精确一级结构及其基因定位迄今尚未明确。噬菌体表面呈现技术的出现为大量快速地筛检基因-多肽片段文库提供了可能。我们应用单克隆抗体对表达HV汉滩型76/118株S基因随机多肽片段的噬菌体文库进行筛选,并确定了汉滩型病毒(Hantaan virus, HTNV)NP 氨基端的一个主要线性抗原表位。
, 百拇医药
材料与方法
一、单克隆抗体
抗-HV单克隆抗体L13F3、R31、48A、28B和C321为中国预防医学科学院病毒学研究所出血热室惠赠;3G1和5H5为第四军医大学微生物学教研室制备,H7、F3、B9、B11和H11为南京军区军事医学研究所提供;GDO5为美国陆军传染病研究所Schmaljohn CS博士惠赠。所有单克隆抗体均经盐析初步纯化,以Protein G Sepharose 4FF层析柱(Pharmacia)提取IgG(图1),并与生物素(ECL Protein biotynylation module, Amersham)交联。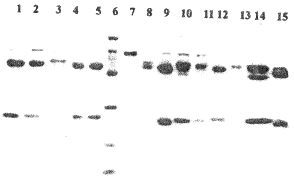
1~5分别为McAb L13F3、C321、R31、48A和28B,6为蛋白相对分子质量标准,从上至下依次为94700,66000,45000,31000,21500和14500,7~15分别为P53蛋白及McAb 5H5、3G1、H7、H11、F3、B11、B9和GD05
, 百拇医药
图1 纯化的抗-HV McAb的SDS-PAGE
二、丝状噬菌体
可用于表达融合蛋白的丝状噬菌体fuse 5和fuse 2 由美国密苏里大学Smith GP教授领导的实验室构建并惠赠[4]。fuse 5属fd-tet类丝状噬菌体表达载体,结构特点为在其基因Ⅲ区构建了两个单向Sfi Ⅰ克隆位点,便于外源性基因的克隆和表达;该载体的基因Ⅲ功能即感染宿主菌的功能因定向突变产生的读码框发生框移而丧失,但仍可通过其它转化方式导入受体菌并在其中大量扩增;而一旦插入的外源性基因使基因Ⅲ的读框恢复,该类噬菌体便可恢复感染功能;同时该类载体含有四环素(tetracyclin, tet)抗性基因,便于在相应的抗性培养中形成四环素抗性克隆,而且其伴随宿主菌大量增殖时对后者无严重影响。
三、汉滩病毒S基因随机多肽片段噬菌体文库的构建[5]
, http://www.100md.com
酶切消化含有HTNV 76-118株S基因的重组质粒pUC18-HTNV-S,回收纯化的S基因;用DNase Ⅰ随机消化并回收50~300bp大小的片段,与克隆接头连接[6]。用Sfi Ⅰ消化提取噬菌体fuse 5的复制型DNA,回收克隆载体,与DNase Ⅰ消化的S基因随机核苷酸片段连接并电击转化MC1061菌,提取表达融合蛋白的噬菌体,测定文库效价。
四、噬菌体表位文库的亲合筛选
(一) Biopanning 以1mg/ml链霉亲合素4℃过夜包被聚苯乙烯平皿,5%BSA室温2小时封闭,0.05% Tween 20-TBS(T-TBS)洗6次,然后加入生物素化的单克隆抗体,室温温育2小时后同上洗3次,加入以0.05%-TBS稀释的表达有融合蛋白的重组噬菌体,4℃过夜温育。次日以0.05%T-TBS洗10次,最后1次浸泡10分钟,分别收集各次洗液。加入0.025mol pH2.2的HCl洗脱液,室温轻轻振摇10分钟,将洗脱回收的噬菌体液转入1.5ml Eppendorf管中,立即加入约1/6体积0.05mmol/L pH9.0 Tris-HCl,经中和后的噬菌体液以Microcon 30(Amicon Inc,USA)浓缩,转染预先饥饿培养的K91/Kan菌,室温20分钟后加入约1ml LB/tet(0.2μg/ml)/Kan(100μg/ml),37℃40分钟后补加tet至20μg/ml,铺LB/tet平板,37℃过夜培养,次日计数菌落数并收集全部菌落提取噬菌体。根据免疫筛检结果同上进行第2、3次亲合筛选。
, http://www.100md.com
(二) 免疫筛检 1. Immunoblot:取部分转化的K91/Kan菌涂布于LB/Tet/Kan抗性平皿,挑取生长的菌落(一般约92个)转种于另一同样的平皿、硝基纤维素膜(覆盖于一LB/Tet/Kan抗性平皿上)及相应的96孔培养板中,过夜培养后将硝基纤维素膜表面生长的菌落洗去,封闭后加入单克隆抗体,并继之与辣根过氧化物酶交联的抗小鼠IgG抗体结合,常规显色并记录结果。实验中常规设置阳性(以McAb GDO5筛选出的阳性重组噬菌体)和阴性(空白噬菌体fuse 2)对照[7]。2. ELISA:用链霉亲合素包被96孔聚苯乙烯微板,加入生物素化的相应单抗,然后与噬菌体(取自与Immunoblot相同的平皿)结合,继之与1∶5000稀释的辣根过氧化物酶交联的抗M13(HRP/Anti-M13,Pharmacia Biotech)结合,最后加入呈色底物并常规测定吸光值A。
五、核苷酸序列测定
对免疫筛检获得的阳性克隆过夜扩大培养后常规提取单链DNA模板,以Pharmacia的T7 Sequencing Kit测定其核苷酸序列,应用微机软件(pcgene)分析汇总结果。
, 百拇医药
六、交叉反应重组噬菌体ELISA
选取L13F3、5H5、R31和B11等单抗筛检获得的阳性克隆菌(插入子的核苷酸序列均已测定),扩大培养后提取重组噬菌体。同上以链霉亲合素包被96孔聚苯乙烯板,加入生物素化的各株单抗,然后与不同克隆的噬菌体结合,最后依次加入HRP/Anti-M13和呈色底物并常规测定A值。
结果
一、汉滩病毒76/118株S基因表位文库的亲合筛检
用13株抗HV单克隆抗体对HTNV 76/118株S基因随机多肽文库进行Biopanning及ELISA检测,结果见表1。
表1 HTNV 76/118株S基因随机多肽
文库免疫筛检结果 单克隆抗体
, http://www.100md.com
结构蛋白
特异性
ELISA检测阳性率(%)
第1次筛检
第2次筛检
第3次筛检
L13F3(SP)*
抗NP
98.9
100.0
(SC)*
57.6
-
, http://www.100md.com
C321(SP)
抗NP
0
0
0
R31(SP)
抗NP
5.4
77.2
92.4
28B(SP)
抗GP2
0
, 百拇医药
0
0
48A(SP)
抗GP2
0
0
0
3G1(SP)
抗GP2/NP
0
0
0
5H5(SP)
, 百拇医药
抗NP
8.7
100.0
(SC)
8.7
-
H7(SP)
?
1.1
0
0
(SC)
7.6
, 百拇医药
-
-
H11(SP)
?
4.3
0
0
F3(SP)
?
0
4.3
3.3
B9(SP)
, http://www.100md.com ?
0
0
0
B11(SP)
?
0
2.2
13
* SP和SC表示用两种不同的克隆接头构建的文库
二、对单抗筛检获得的病毒S基因阳性克隆的核苷酸序列测定及分析
挑取单克隆抗体L13F3、5H5、R31和B11等识别的部分阳性克隆,提取单链DNA模板进行核苷酸序列测定,发现4株单抗识别位点的编码基因定位大致相同,均在S片段第37~294位硷基(bp)的范围内,相当于读框内第1~86位氨基酸(aa)。不同克隆多肽相应的氨基酸序列长短不一,主要有aa15~66,15~86和1~86(见图2),相应表位的抗原性强弱(以ELISA测定值为代表)与表位的大小成正比。
, 百拇医药
图2 单克隆抗体识别的汉滩病毒76/118株核衣壳蛋白不同多肽-表位的氨基酸序列
三、交叉反应重组噬菌体ELISA的测定结果
挑取用McAb L13F3、5H5、R31和B11亲和筛检获得的重组噬菌体克隆(其外源性插入子及其表达产物的序列详表2)各1个,经扩大培养后提取重组噬菌体,与不同单抗进行交叉免疫学测定,结果见表3。
表2 不同重组噬菌体克隆外源性插入子
及其表达产物的结构特性 筛检用单抗
克隆编号
在S基因中
的位置
相应表达产物的
, 百拇医药
氨基酸序列*
L13F3
P2~C2
bp79~234
aa15~66
R31
P3~D5
bp37~294
aa1~86
5H5
P1~A3
bp79~234
, 百拇医药 aa15~66
B11
P4~F3
bp79~234
aa15~66
* 为相当于读框内的氨基酸序列
表3 不同重组噬菌体克隆与不同株
单抗交叉ELISA的测定结果* McAb
重组噬菌体克隆
L13F3(C2)
R31(D5)
, 百拇医药
5H5(A3)
B11(F3)
L13F3
++++
++++
++++
++++
R31
++
+++
+++
++
5H5
, 百拇医药
++++
++++
++++
++++
B11
+
+
+
+
F3
-
-
-
-
, 百拇医药
C321
-
-
-
-
H7
-
-
-
-
H11
-
-
-
, 百拇医药
-
* 测定结果均以A值表示,A≥1.0时为++++,≥0.5时为+++,≥0.25倍时为+,≥阴性对照A值2.5倍时为+,<阴性对照A值2.5倍时为-
由表3可见,L13F3、5H5、R31和B11与该4株单抗筛检获得的重组噬菌体均可产生交叉反应,但反应强度不同,推测与单抗的亲和力大小有关。余4株单抗与上述重组噬菌体均不发生反应,表明这4株单抗所针对的抗原表位可能与前面4株不同。
讨论
血清学研究早已发现,HV NP具有很强的抗原性和免疫原性,患者对NP的抗体应答不仅出现得早,而且滴度高。应用单克隆抗体进行的研究表明,抗NP血清或单抗虽然没有中和活性,但用NP免疫的动物仍可产生一定的抗病毒免疫。此外还发现抗NP血清或单抗可与多种血清型病毒抗原产生交叉反应,而NP抗原也可与汉坦病毒属内的多种血清型病毒的免疫血清产生交叉反应,表明汉坦病毒NP具有共同的抗原决定簇。上述研究结果已为其后陆续发表的汉滩病毒属病毒S基因核苷酸序列的测定和比较所证实。
, http://www.100md.com
国内学者应用单克隆抗体对HV NP的抗原表位的分析表明[8,9],我国野鼠型毒株C4(Hantaan型)和家鼠型毒株L99(Seoul型)NP上至少存在7个两型病毒共有的组特异性表位,2个家鼠型抗原特异性表位和3个野鼠型特异性表位。这些组特异性抗原表位和型特异性抗原表位分布于NP上两个完全不同的区域。
关于汉滩病毒属病毒NP抗原表位的研究,近年已有较多的报道。Vapalahti等[10]应用PEPSCAN技术,对连续交错合成的覆盖NP全长的141个14肽进行了免疫检测。用兔抗汉滩病毒免疫血清检测后发现了6个多肽抗原线性表位(Linear epitope),但是用14份急性期(发病1周内)和2份恢复期患者血清进行NP抗原表位检测时,却未能获得明确的与全部患者血清发生共同反应的抗原表位,反应样式因人而异,主要集中在aa1-17,22-47,73-89,91-116,247-266和274-296,且几乎均位于NP氨基酸序列的亲水区。Gott等[1-3]分别应用重组DNA技术表达NP的部分片段,并进行了免疫学测定和动物实验,表明NP的B细胞表位主要位于NP的氨基端,读框内aa62-79可能对表位的抗原性和免疫原性起到重要作用,而紧靠NP氨基端61个氨基酸构成的多肽几乎没有抗原性。上述研究结果虽然初步定位了NP的主要线性抗原表位,但由于研究技术的限制,均未能准确地测定出表位的大小和组成。
, 百拇医药
我们应用多株具有不同抗原反应谱的国产单克隆抗体,对呈现在噬菌体表面的汉滩病毒76-118株随机NP多肽片段进行了免疫筛检,结果表明汉滩病毒N端从读框内启始密码(第1个氨基酸)起至第86位氨基酸的范围内为该病毒的主要的线性表位,这一表位可被我国学者制备的广谱(组特异性)单抗L13F3、B11和型特异性单抗5H5(野鼠型)及R31(家鼠型)所识别。与此基因定位类似的主要线性表位也已在用抗普马拉型(PUUV)单抗对PUUV S基因噬菌体肽库的筛选中得到证实。实验还发现,汉滩病毒NP氨基端这一多肽表位的抗原强度与其大小成正比,最小似不能小于52个氨基酸,即必须包括aa15-66这一核心序列,否则抗原性将明显减弱,以至于无法测出。由于保证阳性噬菌体克隆免疫学筛检(如ELISA)的敏感度既需要具有一定抗原反应强度的呈现在噬菌体表面的抗原多肽,同时要求一定表面呈现噬菌体的数量,因此不排除存在更小的靠近NP氨基端的具有较强抗原反应性的抗原多肽,这一工作有待进行S基因的分段高效表达或对合成肽进行免疫检测来证实。汉滩病毒NP这一主要线性抗原表位的发现和基因定位,为HV分子生物学研究和诊断抗原的研制提供了重要的资料,对本实验证实的表位进行深入研究有可能进一步从分子水平上揭示HV的结构和功能特性。
, 百拇医药
(本研究部分工作为作者1996年在德国海德堡大学分子遗传学研究所完成,在此对该所Bautz EKF教授和Fack F博士曾经给予的指导和帮助表示感谢)
本研究受中国-欧共体合作科研基金资助[基金编号C11*-CT94-0024(DG 12 HSMU)]
参考文献
1 Gott P, Zoller L, Darai G, et al. A major antigenic domain of Hantaviruses is located on the aminoproximal site of the viral nucleocapsid protein. Virus Res, 1997,14:31-40.
2 Elgh F, Lundkvist A, Alexeyev OA, et al. A major antigenic domain for the human humoral response to Puumala virus nucleocapsid protein is located at the amino-termanus. J Virol Meths, 1996,59:161-172.
, 百拇医药
3 白雪帆,杨为松,张文彬,等.流行性出血热病人对三种病毒结构蛋白的抗体应答.中华传染病杂志,1992,10:187-191.
4 Smith GP, Scott, JK. Libraries of peptides and proteins displayed on filamentous phage. Methods in Enzymology, 1993,217:228-259.
5 白雪帆,Fack F,杭长寿,等.汉滩病毒S基因-多肽噬菌体表面呈现文库的构建.细胞与分子免疫学杂志,1998,15:1-5.
6 Petersen G, Song DY, Hugle-Dorr B, et al. Mapping of linear epitopes recognized by monoclonal antibodies with gene-fragment phage display libraries. Mol Gen Genet, 1995,249:425-431.
, 百拇医药
7 Fack F, Hugle-Dorr B, Song DY, et al. Epitope mapping by phage display: random versus gene-fragment libraries. J Immunol Methods, 1997,206:43-52.
8 梁米芳,宋干,杭长寿,等.用单克隆抗体分析流行性出血热病毒的核蛋白抗原表位.病毒学报,1989,5:24-30.
9 徐志凯,安献禄,汪美先.用单克隆抗体分析肾综合征出血热病毒抗原性的研究.中华微生物学和免疫学杂志,1986,6:34-37.
10 Vapalahti O, Kallio-Kokko H, Narvanen A, et al. Human B-cell epitopes of Puumalavirus nucleocapsid protein, the major antigen in early serological response. J Med Virol, 1995,46:293-303.
(收稿:1998-11-02 修回:1999-03-20), http://www.100md.com
单位:710038 西安,第西军医大学唐都医院感染病诊疗中心
关键词:汉滩病毒;抗体,单克隆;噬菌体肽库
中华传染病杂志990408 【摘要】 目的 确定汉滩病毒核衣壳蛋白(NP)B细胞表位的基因定位。方法 将DNase Ⅰ随机消化的汉滩病毒76/118株S基因片段与丝状噬菌体载体连接后转化MC1061菌,成功构建了汉滩病毒S基因-多肽片段噬菌体肽库。应用12株国产抗汉滩病毒单克隆抗体对表达汉滩病毒NP多肽片段的噬菌体文库进行了3~4轮淘筛(biopanning),并对阳性噬菌体克隆进行了扩增和测序。结果 确定了S基因产物——病毒核衣壳蛋白氨基端的一个B细胞线性抗原表位,该表位覆盖aa1-aa86的范围,相当于S基因bp37-294,其核心序列可能由aa15-66构成。结论 该线性表位能与多种抗汉滩病毒单克隆抗体发生交叉反应,是汉滩病毒NP的主要抗原表位。
, http://www.100md.com
The recognition and mapping of epitopes of Hantaan virus nucleocapsid protein by S gene-peptide fragment phage display libraries
BAI Xuefan, WANG Yi, PAN Lei, et al.
Department of Infectious Diseases, Fourth Military Medical University, Xian 710038
【Abstract】 Objective In order to construct the library of Hantaan virus S gene-peptide fragments on phages, screening the epitopes of nucleocapsid protein with monoclonal antibodies against Hantaviruses. Methods Hantaan virus S gene from recombinant plasmid pUC-HTNV-S was digested with DNase Ⅰ and ligated with filamentous phage vector that has been cut with Sfi I. The ligation were transformed into E. coli MC1061 for constructing the phage library of Hantaan virus S gene-peptide fragments. After biopanning with some strains of monoclonal antibodies, the positive phage clones were picked out for sequencing. Results A linear epitope consisting of amino acid (aa) 1-86 within nucleocapsid protein reading frame was determined and its core sequence consists of aa 15-66. Conclusion The linear epitope is a major and cross-reactive antigenic epitope. The findings above are helpful for elucidating the relationship between molecular structure and function of Hantaviruses.
, 百拇医药
【Key words】 Hantaan virus Antibodies, monoclonal Bacteriophages peptide libraries
核衣壳蛋白(Nucleocapsid Protein, NP)是汉坦病毒(hantaviruses, HV)的主要结构蛋白。已知HV约45000~51000的NP由428~433个氨基酸组成,其N端约100个氨基酸大部分具有亲水性,且能被患者血清及许多单克隆抗体所识别[1-3]。虽然对HV NP氨基端蛋白的原核表达产物的抗原性及免疫原性已进行了许多研究,并已用于出血热的血清学诊断,但该抗原表位的精确一级结构及其基因定位迄今尚未明确。噬菌体表面呈现技术的出现为大量快速地筛检基因-多肽片段文库提供了可能。我们应用单克隆抗体对表达HV汉滩型76/118株S基因随机多肽片段的噬菌体文库进行筛选,并确定了汉滩型病毒(Hantaan virus, HTNV)NP 氨基端的一个主要线性抗原表位。
, 百拇医药
材料与方法
一、单克隆抗体
抗-HV单克隆抗体L13F3、R31、48A、28B和C321为中国预防医学科学院病毒学研究所出血热室惠赠;3G1和5H5为第四军医大学微生物学教研室制备,H7、F3、B9、B11和H11为南京军区军事医学研究所提供;GDO5为美国陆军传染病研究所Schmaljohn CS博士惠赠。所有单克隆抗体均经盐析初步纯化,以Protein G Sepharose 4FF层析柱(Pharmacia)提取IgG(图1),并与生物素(ECL Protein biotynylation module, Amersham)交联。

1~5分别为McAb L13F3、C321、R31、48A和28B,6为蛋白相对分子质量标准,从上至下依次为94700,66000,45000,31000,21500和14500,7~15分别为P53蛋白及McAb 5H5、3G1、H7、H11、F3、B11、B9和GD05
, 百拇医药
图1 纯化的抗-HV McAb的SDS-PAGE
二、丝状噬菌体
可用于表达融合蛋白的丝状噬菌体fuse 5和fuse 2 由美国密苏里大学Smith GP教授领导的实验室构建并惠赠[4]。fuse 5属fd-tet类丝状噬菌体表达载体,结构特点为在其基因Ⅲ区构建了两个单向Sfi Ⅰ克隆位点,便于外源性基因的克隆和表达;该载体的基因Ⅲ功能即感染宿主菌的功能因定向突变产生的读码框发生框移而丧失,但仍可通过其它转化方式导入受体菌并在其中大量扩增;而一旦插入的外源性基因使基因Ⅲ的读框恢复,该类噬菌体便可恢复感染功能;同时该类载体含有四环素(tetracyclin, tet)抗性基因,便于在相应的抗性培养中形成四环素抗性克隆,而且其伴随宿主菌大量增殖时对后者无严重影响。
三、汉滩病毒S基因随机多肽片段噬菌体文库的构建[5]
, http://www.100md.com
酶切消化含有HTNV 76-118株S基因的重组质粒pUC18-HTNV-S,回收纯化的S基因;用DNase Ⅰ随机消化并回收50~300bp大小的片段,与克隆接头连接[6]。用Sfi Ⅰ消化提取噬菌体fuse 5的复制型DNA,回收克隆载体,与DNase Ⅰ消化的S基因随机核苷酸片段连接并电击转化MC1061菌,提取表达融合蛋白的噬菌体,测定文库效价。
四、噬菌体表位文库的亲合筛选
(一) Biopanning 以1mg/ml链霉亲合素4℃过夜包被聚苯乙烯平皿,5%BSA室温2小时封闭,0.05% Tween 20-TBS(T-TBS)洗6次,然后加入生物素化的单克隆抗体,室温温育2小时后同上洗3次,加入以0.05%-TBS稀释的表达有融合蛋白的重组噬菌体,4℃过夜温育。次日以0.05%T-TBS洗10次,最后1次浸泡10分钟,分别收集各次洗液。加入0.025mol pH2.2的HCl洗脱液,室温轻轻振摇10分钟,将洗脱回收的噬菌体液转入1.5ml Eppendorf管中,立即加入约1/6体积0.05mmol/L pH9.0 Tris-HCl,经中和后的噬菌体液以Microcon 30(Amicon Inc,USA)浓缩,转染预先饥饿培养的K91/Kan菌,室温20分钟后加入约1ml LB/tet(0.2μg/ml)/Kan(100μg/ml),37℃40分钟后补加tet至20μg/ml,铺LB/tet平板,37℃过夜培养,次日计数菌落数并收集全部菌落提取噬菌体。根据免疫筛检结果同上进行第2、3次亲合筛选。
, http://www.100md.com
(二) 免疫筛检 1. Immunoblot:取部分转化的K91/Kan菌涂布于LB/Tet/Kan抗性平皿,挑取生长的菌落(一般约92个)转种于另一同样的平皿、硝基纤维素膜(覆盖于一LB/Tet/Kan抗性平皿上)及相应的96孔培养板中,过夜培养后将硝基纤维素膜表面生长的菌落洗去,封闭后加入单克隆抗体,并继之与辣根过氧化物酶交联的抗小鼠IgG抗体结合,常规显色并记录结果。实验中常规设置阳性(以McAb GDO5筛选出的阳性重组噬菌体)和阴性(空白噬菌体fuse 2)对照[7]。2. ELISA:用链霉亲合素包被96孔聚苯乙烯微板,加入生物素化的相应单抗,然后与噬菌体(取自与Immunoblot相同的平皿)结合,继之与1∶5000稀释的辣根过氧化物酶交联的抗M13(HRP/Anti-M13,Pharmacia Biotech)结合,最后加入呈色底物并常规测定吸光值A。
五、核苷酸序列测定
对免疫筛检获得的阳性克隆过夜扩大培养后常规提取单链DNA模板,以Pharmacia的T7 Sequencing Kit测定其核苷酸序列,应用微机软件(pcgene)分析汇总结果。
, 百拇医药
六、交叉反应重组噬菌体ELISA
选取L13F3、5H5、R31和B11等单抗筛检获得的阳性克隆菌(插入子的核苷酸序列均已测定),扩大培养后提取重组噬菌体。同上以链霉亲合素包被96孔聚苯乙烯板,加入生物素化的各株单抗,然后与不同克隆的噬菌体结合,最后依次加入HRP/Anti-M13和呈色底物并常规测定A值。
结果
一、汉滩病毒76/118株S基因表位文库的亲合筛检
用13株抗HV单克隆抗体对HTNV 76/118株S基因随机多肽文库进行Biopanning及ELISA检测,结果见表1。
表1 HTNV 76/118株S基因随机多肽
文库免疫筛检结果 单克隆抗体
, http://www.100md.com
结构蛋白
特异性
ELISA检测阳性率(%)
第1次筛检
第2次筛检
第3次筛检
L13F3(SP)*
抗NP
98.9
100.0
(SC)*
57.6
-
, http://www.100md.com
C321(SP)
抗NP
0
0
0
R31(SP)
抗NP
5.4
77.2
92.4
28B(SP)
抗GP2
0
, 百拇医药
0
0
48A(SP)
抗GP2
0
0
0
3G1(SP)
抗GP2/NP
0
0
0
5H5(SP)
, 百拇医药
抗NP
8.7
100.0
(SC)
8.7
-
H7(SP)
?
1.1
0
0
(SC)
7.6
, 百拇医药
-
-
H11(SP)
?
4.3
0
0
F3(SP)
?
0
4.3
3.3
B9(SP)
, http://www.100md.com ?
0
0
0
B11(SP)
?
0
2.2
13
* SP和SC表示用两种不同的克隆接头构建的文库
二、对单抗筛检获得的病毒S基因阳性克隆的核苷酸序列测定及分析
挑取单克隆抗体L13F3、5H5、R31和B11等识别的部分阳性克隆,提取单链DNA模板进行核苷酸序列测定,发现4株单抗识别位点的编码基因定位大致相同,均在S片段第37~294位硷基(bp)的范围内,相当于读框内第1~86位氨基酸(aa)。不同克隆多肽相应的氨基酸序列长短不一,主要有aa15~66,15~86和1~86(见图2),相应表位的抗原性强弱(以ELISA测定值为代表)与表位的大小成正比。


, 百拇医药
图2 单克隆抗体识别的汉滩病毒76/118株核衣壳蛋白不同多肽-表位的氨基酸序列
三、交叉反应重组噬菌体ELISA的测定结果
挑取用McAb L13F3、5H5、R31和B11亲和筛检获得的重组噬菌体克隆(其外源性插入子及其表达产物的序列详表2)各1个,经扩大培养后提取重组噬菌体,与不同单抗进行交叉免疫学测定,结果见表3。
表2 不同重组噬菌体克隆外源性插入子
及其表达产物的结构特性 筛检用单抗
克隆编号
在S基因中
的位置
相应表达产物的
, 百拇医药
氨基酸序列*
L13F3
P2~C2
bp79~234
aa15~66
R31
P3~D5
bp37~294
aa1~86
5H5
P1~A3
bp79~234
, 百拇医药 aa15~66
B11
P4~F3
bp79~234
aa15~66
* 为相当于读框内的氨基酸序列
表3 不同重组噬菌体克隆与不同株
单抗交叉ELISA的测定结果* McAb
重组噬菌体克隆
L13F3(C2)
R31(D5)
, 百拇医药
5H5(A3)
B11(F3)
L13F3
++++
++++
++++
++++
R31
++
+++
+++
++
5H5
, 百拇医药
++++
++++
++++
++++
B11
+
+
+
+
F3
-
-
-
-
, 百拇医药
C321
-
-
-
-
H7
-
-
-
-
H11
-
-
-
, 百拇医药
-
* 测定结果均以A值表示,A≥1.0时为++++,≥0.5时为+++,≥0.25倍时为+,≥阴性对照A值2.5倍时为+,<阴性对照A值2.5倍时为-
由表3可见,L13F3、5H5、R31和B11与该4株单抗筛检获得的重组噬菌体均可产生交叉反应,但反应强度不同,推测与单抗的亲和力大小有关。余4株单抗与上述重组噬菌体均不发生反应,表明这4株单抗所针对的抗原表位可能与前面4株不同。
讨论
血清学研究早已发现,HV NP具有很强的抗原性和免疫原性,患者对NP的抗体应答不仅出现得早,而且滴度高。应用单克隆抗体进行的研究表明,抗NP血清或单抗虽然没有中和活性,但用NP免疫的动物仍可产生一定的抗病毒免疫。此外还发现抗NP血清或单抗可与多种血清型病毒抗原产生交叉反应,而NP抗原也可与汉坦病毒属内的多种血清型病毒的免疫血清产生交叉反应,表明汉坦病毒NP具有共同的抗原决定簇。上述研究结果已为其后陆续发表的汉滩病毒属病毒S基因核苷酸序列的测定和比较所证实。
, http://www.100md.com
国内学者应用单克隆抗体对HV NP的抗原表位的分析表明[8,9],我国野鼠型毒株C4(Hantaan型)和家鼠型毒株L99(Seoul型)NP上至少存在7个两型病毒共有的组特异性表位,2个家鼠型抗原特异性表位和3个野鼠型特异性表位。这些组特异性抗原表位和型特异性抗原表位分布于NP上两个完全不同的区域。
关于汉滩病毒属病毒NP抗原表位的研究,近年已有较多的报道。Vapalahti等[10]应用PEPSCAN技术,对连续交错合成的覆盖NP全长的141个14肽进行了免疫检测。用兔抗汉滩病毒免疫血清检测后发现了6个多肽抗原线性表位(Linear epitope),但是用14份急性期(发病1周内)和2份恢复期患者血清进行NP抗原表位检测时,却未能获得明确的与全部患者血清发生共同反应的抗原表位,反应样式因人而异,主要集中在aa1-17,22-47,73-89,91-116,247-266和274-296,且几乎均位于NP氨基酸序列的亲水区。Gott等[1-3]分别应用重组DNA技术表达NP的部分片段,并进行了免疫学测定和动物实验,表明NP的B细胞表位主要位于NP的氨基端,读框内aa62-79可能对表位的抗原性和免疫原性起到重要作用,而紧靠NP氨基端61个氨基酸构成的多肽几乎没有抗原性。上述研究结果虽然初步定位了NP的主要线性抗原表位,但由于研究技术的限制,均未能准确地测定出表位的大小和组成。
, 百拇医药
我们应用多株具有不同抗原反应谱的国产单克隆抗体,对呈现在噬菌体表面的汉滩病毒76-118株随机NP多肽片段进行了免疫筛检,结果表明汉滩病毒N端从读框内启始密码(第1个氨基酸)起至第86位氨基酸的范围内为该病毒的主要的线性表位,这一表位可被我国学者制备的广谱(组特异性)单抗L13F3、B11和型特异性单抗5H5(野鼠型)及R31(家鼠型)所识别。与此基因定位类似的主要线性表位也已在用抗普马拉型(PUUV)单抗对PUUV S基因噬菌体肽库的筛选中得到证实。实验还发现,汉滩病毒NP氨基端这一多肽表位的抗原强度与其大小成正比,最小似不能小于52个氨基酸,即必须包括aa15-66这一核心序列,否则抗原性将明显减弱,以至于无法测出。由于保证阳性噬菌体克隆免疫学筛检(如ELISA)的敏感度既需要具有一定抗原反应强度的呈现在噬菌体表面的抗原多肽,同时要求一定表面呈现噬菌体的数量,因此不排除存在更小的靠近NP氨基端的具有较强抗原反应性的抗原多肽,这一工作有待进行S基因的分段高效表达或对合成肽进行免疫检测来证实。汉滩病毒NP这一主要线性抗原表位的发现和基因定位,为HV分子生物学研究和诊断抗原的研制提供了重要的资料,对本实验证实的表位进行深入研究有可能进一步从分子水平上揭示HV的结构和功能特性。
, 百拇医药
(本研究部分工作为作者1996年在德国海德堡大学分子遗传学研究所完成,在此对该所Bautz EKF教授和Fack F博士曾经给予的指导和帮助表示感谢)
本研究受中国-欧共体合作科研基金资助[基金编号C11*-CT94-0024(DG 12 HSMU)]
参考文献
1 Gott P, Zoller L, Darai G, et al. A major antigenic domain of Hantaviruses is located on the aminoproximal site of the viral nucleocapsid protein. Virus Res, 1997,14:31-40.
2 Elgh F, Lundkvist A, Alexeyev OA, et al. A major antigenic domain for the human humoral response to Puumala virus nucleocapsid protein is located at the amino-termanus. J Virol Meths, 1996,59:161-172.
, 百拇医药
3 白雪帆,杨为松,张文彬,等.流行性出血热病人对三种病毒结构蛋白的抗体应答.中华传染病杂志,1992,10:187-191.
4 Smith GP, Scott, JK. Libraries of peptides and proteins displayed on filamentous phage. Methods in Enzymology, 1993,217:228-259.
5 白雪帆,Fack F,杭长寿,等.汉滩病毒S基因-多肽噬菌体表面呈现文库的构建.细胞与分子免疫学杂志,1998,15:1-5.
6 Petersen G, Song DY, Hugle-Dorr B, et al. Mapping of linear epitopes recognized by monoclonal antibodies with gene-fragment phage display libraries. Mol Gen Genet, 1995,249:425-431.
, 百拇医药
7 Fack F, Hugle-Dorr B, Song DY, et al. Epitope mapping by phage display: random versus gene-fragment libraries. J Immunol Methods, 1997,206:43-52.
8 梁米芳,宋干,杭长寿,等.用单克隆抗体分析流行性出血热病毒的核蛋白抗原表位.病毒学报,1989,5:24-30.
9 徐志凯,安献禄,汪美先.用单克隆抗体分析肾综合征出血热病毒抗原性的研究.中华微生物学和免疫学杂志,1986,6:34-37.
10 Vapalahti O, Kallio-Kokko H, Narvanen A, et al. Human B-cell epitopes of Puumalavirus nucleocapsid protein, the major antigen in early serological response. J Med Virol, 1995,46:293-303.
(收稿:1998-11-02 修回:1999-03-20), http://www.100md.com