人肺癌细胞中蛋白激酶C亚类与cAMP-PKA系统相关性的研究*
作者:王向阳 柳惠图 胡云英
单位:北京师范大学生物系细胞增殖及调控生物学开放实验室,北京 100875
关键词:细胞增殖;蛋白激酶Cα;环腺苷酸-蛋白激酶A;六甲撑双乙酰胺;蛋白激酶C抑制剂Calphostin;C;人肺癌细胞
解剖学报/980414 摘 要 为了探讨蛋白激酶Cα(PKCα)及其与环腺苷酸-蛋白激酶A(cAMP-PKA)信号系统的相关性,用六甲撑双乙酰胺(hexamethylene bisacetamide, HMBA)和PKC 抑制剂 Calphostin C 分别处理人肺癌细胞LTEPa-2,统计细胞生长百分数,测定cAMP水平。用斑点杂交方法检测PKCα基因表达,并测定表达反义PKCα的人肺癌LTEPa-2细胞中PKC与PKA激酶活性。结果显示:5μmol/L HMBA处理人肺癌LTEPa-2细胞3d后,细胞增殖明显被阻抑,PKCα基因表达下降,cAMP水平升高。0.15mg/L PKC抑制剂Calphostin C导致人肺癌细胞增殖速度减慢时,cAMP水平也升高。在表达反义PKCα的人肺癌LTEPα-2细胞中,当PKCα基因和蛋白表达被阻抑、PKC活性明显降低的同时,PKA活性则显著升高。结果提示:在人肺癌细胞中PKCα亚类和cAMP-PKA通路显示出拮抗关系。PKCα和PKA两套信号系统相互作用,共同调节人肺癌细胞的增殖和转化。
, 百拇医药
蛋白激酶C(protein kinase C, PKC)和依赖于cAMP的蛋白激酶A(protein kinase A, PKA)作为真核细胞中两类主要的蛋白激酶系统,在细胞的增殖和转化中具有重要的调节作用[1]。cAMP-PKA信号通路和肌醇磷脂通路的作用本质与相关性决定于两者所控制的细胞系统;在一些内分泌组织、淋巴瘤细胞,PKC促进cAMP的形成,而在神经胶质瘤细胞、卵巢肉瘤细胞、血小板、嗜中性粒细胞,两套系统又表现出相互拮抗的作用。随着研究工作的深入,PKC家族成员的分子异质性使得PKC各亚类激活的信号传导途径和cAMP-PKA信号系统之间的关系也愈益被人们所关注。为此,我们以人肺癌细胞LTEPa-2为模型,探讨了PKCα亚类与cAMP-PKA信号系统间调节作用的相关性。
材料和方法
1.细胞培养
正常人胚肺细胞(2BS)、人肺癌细胞LTEPa-2及经药物处理的LTEPa-2细胞分别培养在含10%小牛血清的DMEM培养基中,于37℃和5%CO2培养箱中生长。
, 百拇医药
2.细胞生长曲线
细胞以1×104数接种在24孔板,24h后分别加入终浓度为5μmol/L六甲撑双乙酰胺(hexamethylene bisacetamide, HMBA)或0.15mg/L的PKC抑制剂Calphostin C于3个孔中,每天用计数器(coulter counter)计数,连续计数4d,以细胞数为纵坐标,处理时间(d)为横坐标绘制生长曲线。
3.RNA斑点杂交
3.1 RNA的提纯:收集LTEPa-2细胞及经HMBA处理的LTEPa-2细胞,用一步法[2]提取细胞总RNA,分装贮存于-70℃备用。
3.2 探针制备:PKC cDNA(2.28kb/Sall):英国 Imperial Cancer foundation P.J.Parker 博士惠赠;探针标记采用随机引物标记试剂盒进行(美国 Promega 公司)。
, http://www.100md.com
3.3 RNA斑点杂交:基本按Thomas[3]方法,将硝酸纤维素膜浸泡于无RNase的水中后,转入10×SSC浸泡1h后待用。RNA样品用20×SSC梯度稀释后68℃变性15min,点样于膜上,室温晾干后,80℃真空烘烤2h。预杂交4~6h,加入α-32P标记的探针于42℃水浴中杂交18~22h,洗膜后在-70℃与X线胶片曝光,常规显影、定影。
4.cAMP 水平测定
收集细胞后加入5%三氯乙酸至1ml,混悬后放置30min,离心后留取上清,加入0.5ml 1mol/L HCl,加入2倍体积的饱和乙醚,反复抽提5次,然后用HClO4和KOH将溶液pH调至7.0。置70℃蒸干。cAMP含量测定依据试剂盒的说明程序进行(中国医学科学院基础所提供)。cAMP含量以pg/106细胞表示。
5.PKC和PKA活性测定
, 百拇医药
激酶活性测定见文献[4,5]。收集细胞加入裂解液,超声破碎、离心,留取部分上清,测定PKA活性,反应管内含20mmol/L Tris*Cl pH7.5, 5mmol/L MgCl2, 50μg Histon(type Ⅲ),1.5μmol/L cAMP与酶提取液。加入γ-32P-ATP,30℃反应3min,终止反应,点膜,液闪法测定。其余部分上清液通过DEAE-52纤维素柱,初步提纯和测定PKC活性,反应管内含25mmol/L Tris*Cl pH7.5, 5mmol/L MgCl2, 500μmol/L CaCl2, 50μg Histon (type Ⅲ); PS/DG 10μg/0.2μg与酶提取液,加入γ-32P-ATP, 30℃反应5min,终止反应,点膜,液闪法测定,同时测定总蛋白含量。
结 果
1.HMBA对人肺癌LTEPa-2细胞生长,cAMP水平及PKCα基因表达的影响
, 百拇医药
当用5μmol/L HMBA处理LTEPa-2细胞时,可见在处理的不同时间细胞增殖速度受到明显的抑制(图1),并且在作用后的LTEPa-2细胞中cAMP含量明显升高(图2A),同时与增殖密切相关的PKCα基因表达水平也显著下降(图2B)。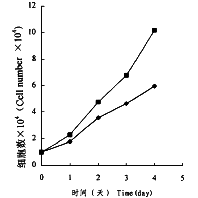
图1 HMBA(5μmol/L)处理对LTEPa-2细胞增殖的影响
■.LTEPa-2细胞
◆.LTEPa-2细胞+HMBA(5μmol/L)
Fig.2 The effect of HMBA (5μmol/L)treatment on proliferation of LTEPa-2 cells■.LTEPa-2 cells
, http://www.100md.com
◆.HMBA(5μmol/L)-treated LTEPa-2 cells
图2 HMBA(5μmol/L)处理3d对LTEPa-2细胞中
cAMP水平(A)与PKCα基因表达(B)的影响
A.cAMP水平 B.PKC α基因表达
a.LTEPa-2细胞 b.HMBA(5μmol/L)处理LTEPa-2细胞3d
(a)点印迹杂交结果 (b)点印迹杂交结果薄层扫描定量分析
Fig.2 The effect of HMBA (5μmol/L) treatment for 3 day on
, http://www.100md.com
cAMP level (A) and PKCα gene expression(B)
A.The level of cAMP B.The PKCα gene expression
a.LTEPa-2 cells b.HMBA(5μmol/L)-treated LTEPa-2 cells for 3 day
(a) Dot blot (b)Quantitative analysis of Dot blot by thin-layer scanning
2.PKC抑制剂Calphostin C对人肺癌LTEPa-2细胞中PKC活性和cAMP水平的影响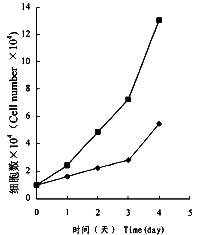
, http://www.100md.com 图3 Calphostin C(0.15mg/L)处理对LTEPa-2细胞增殖的影响
■.LTEPa-2细胞 ◆.Calphostin C(0.15mg/L)处理的LTEPa-2细胞
Fig.3 The effect of Calphostin C(0.15mg/L) treatment on proliferation of LTEPa-2 cells
■.LTEPa-2 cells ◆.Calphostin C(0.15 mg/L)-treated LTEPa-2 cells
当用PKC特异性抑制剂Calphostin C(0.15mg/L)处理人肺癌LTEPa-2细胞时,细胞增殖明显被抑制(图3)的同时,细胞中总PKC活性明显下降(图4A),而cAMP水平则上升(图4B)。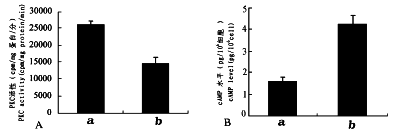
, http://www.100md.com
图4 Calphostin C(0.15mg/L)处理3d对LTEPa-2细胞中PKC活性(A)与
cAMP水平(B)的影响 A.PKC活性 B.cAMP水平
a.LTEPa-2细胞 b.Calphostin C(0.15mg/L)处理LTEPa-2细胞3d
Fig.4 The effect of Calphostin C(0.15mg/L) treatment for 3 days on PKC activity(A) and cAMP level(B)in LTEPa-2 cells
A.The activity of PKC B.The level of cAMP
a.LTEPa-2 cells b.Calphostin C(0.15mg/L)-treated LTEPa-2 cells for 3 days
, 百拇医药
3.表达反义PKCα mRNA的人肺癌LTEPa-2细胞中PKA活
性的变化
我们运用已建立的表达反义PKCα mRNA的人肺癌细胞(LT.AS4),进一步观察了PKC活性与PKA活性变化的相关性。在LT.AS4细胞中PKCα基因和蛋白水平明显下降和细胞增殖显著被抑制(另文发表)的同时,PKC活性也被阻抑,而PKA活性则明显增强(图5A,B)。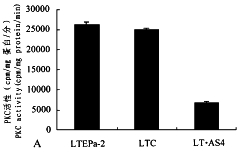
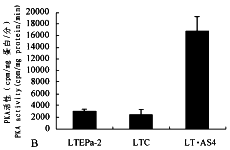
图5 表达反义PKCα的人肺癌LTEPa-2细胞中PKC(A)和PKA(B)的活性
LTEPa-2.人肺癌细胞 LTC.表达空载体LTEPa-2细胞 LT.AS4.表达反义PKCαmRNA的LTEPa-2细胞
, http://www.100md.com
Fig.5 The activity of PKC(A) and PKA(B) in LTEPa-2 cells expressing antisense PKCα mRNA
LTEPa-2:human lung cancer cells LTC:LTEPa-2 cells transfected with vector only LT.AS4:LTEPa-2 cells expressing antisense PKCα mRNA
讨 论
真核细胞内多种信号传导通路相互协调、相互作用构成了一个复杂的调节网络,共同精确地调节细胞的各种生理功能。我们以人肺癌细胞LTEPa-2为实验对象,探讨了PKC和cAMP-PKA系统在细胞增殖中的可能作用及两套系统之间的相关性。用5μmol/L HMBA处理人肺癌细胞,细胞增殖被明显抑制的同时,PKCα的基因表达和PKC活性下降,相反,cAMP水平升高,当用0.15mg/L PKC抑制剂Calphostin C处理癌细胞时,也得到了类似的实验结果。
, 百拇医药
反义RNA技术是近年来发展起来的一种研究特异基因功能的新方法。我们采用反义技术构建了表达反义PKCα的人肺癌细胞LTEPa-2,该细胞在特异性抑制了PKCα基因表达和蛋白质水平的基础上,PKC活性也明显下降,但是细胞内PKA活性却明显提高,该现象有力地支持了上述的实验结果。此外,我们曾在人胚肺细胞中过表达PKCα亚类,发现在PKC活性升高的同时,细胞增殖速率加快并且出现转化表型[6,7]。相反,PKA的活性受到了明显抑制(结果未显示)。这也从另一角度辅助证明了上述的实验结论。关于PKC通路与cAMP-PKA通路的拮抗关系,早在1982年,Kaibuchi等[8]发现cAMP能阻止32P标记到淋巴细胞的肌醇磷酸中,Narindrasorasak等[9]用db-cAMP和forskolin处理大鼠骨髓肌成纤维细胞L6时,胞质PKC活性下降,但与PKA抑制剂一起孵育,PKC的下调作用就被抑制,可能一种cAMP影响的物质参与了PKC活性的调节。Nishizuka[10]提出胞内cAMP的提高可作为一种负调控信号抑制了细胞膜上PIP2的水解,抑制了PKC活化所引起的增殖效应。此外,在PKC亚类与cAMP信号通路的关系方面,有实验表明,当用db-cAMP诱导PC12细胞分化过程中,PKCα表达下降,PKCβⅡ升高,PKC总活性降低[11]。8-溴-cAMP诱导成神经细胞瘤细胞(neuroblastoma cell)neuro-2α分化时,PKCα和PKCε转录水平降低,表明cAMP-PKA通路对于不同PKC亚类有不同的调节机制[12]。最近,Kawabe等[13]实验证明了PKC能直接调节腺苷酸环化酶活性,并且依赖于不同的PKC亚类。通过我们的实验表明了人肺癌细胞增殖过程中,PKCα亚类的活化起正调作用,而cAMP则具有负调节作用,进一步阐明了这两条信号通路间显示出的正负调节的拮抗关系。
, 百拇医药
收稿1997-09 修回1998-01
参考文献
[1]Nishizuka Y. Studies and perspectives of protein kinase C. Science, 1986, 233(4761):305
[2]Chomezynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987, 162(1):156
[3]Thomas PS. Hybridization of denatured RNA and all DNA fragments transfered to nitrocellulose. Proc Natl Acad Sci USA, 1980, 77(9):5201
, 百拇医药
[4]Mischak H, Kazanietz MG, Mushinski JF. Phorbol ester-induced myeloid differentiation is mediated by protein kinase Cα and δ and not by protein kinase CβⅡ, ε and η. J Biol Chem, 1993, 268(27):20110
[5]刘 毅,艾兆伟,陈惠黎.视黄酸对人肝癌细胞蛋白激酶的影响.生物化学杂志,1990,6(6):533
[6]王向阳,吴承军,柳惠图.蛋白激酶 Cα亚类真核表达质粒的构建和过表达细胞模型的建立及初步分析.科学通报,1995,40(22):2081
[7]王向阳,胡云英,柳惠图.蛋白激酶 Cα过表达导致正常人胚肺成纤维细胞生长失调的研究.生物化学杂志,1996,12(3):274
, http://www.100md.com
[8]Kaibuchi K, Takai Y, Ogawa Y, et al. Inhibitory action of adenosine 3'5'-monophosphate on phosphatidylinositol turnover: defference in tissue response. Biochem Biophys Res Commun, 1982, 104(1):105
[9]Narindrasorasak S, Brickenden A, Ball E, et al. Regulation of protein kinase C by cyclic adenosine 3'5'-monophosphate and a tumor promoter in skeletal myoblasts. J Biol Chem, 1987, 262(22):10497
[10]Nishizuka Y. The role of protein kinase C in cell surface signal transduction and tumor promotion. Nature (London),1984,308(5961):693
, 百拇医药
[11]Uehara-Kunugi Y, Shimohama S, Tamura H, et al. Different modulation of protein kinase C isozymes in dibutyryl cyclic AMP-differentiated PC12 cells. J Neurochem, 1994, 63(1):125
[12]Wada H, Ohno S, Kubo K, et al. Cell type-specific expression of the genes for the protein kinase C family: down regulation of mRNAs for PKCα and PKCε upon in vitro differentiation of a mouse neuroblastoma cell line neuro 2a. Biochem Biophys Res Commun, 1989, 165(1):533
, 百拇医药
[13]Kawabe Junichi, Iwami G, Ebina T, et al. Differential activation of adenylyl cyclase by protein kinase C isoenzymes. J Biol Chem, 1994, 269(24):16554
STUDIES ON THE RELATIONSHIP BETWEEN PROTEIN KINASE
Cα ISOFORM AND cAMP-PROTEIN KINASE A SYSTEM IN
HUMAN LUNG CANCER LTEPa-2 CELLS
Wang Xiangyang, Liu Huitu△,Hu Yunying
, 百拇医药
(The Key Laboratory of Cell Proliferation and Regulation Biology, Department of Biology,Beijing Normal University, Beijing)
To study the relationship between protein kinase Cα isoform and cAMP-protein kinase A system. Treating human lung cancer cells LTEPa-2 with HMBA(hexamethylene bisacetamide) and PKC inhibitor Calphostin C respectively, counting growth rate and detecting the level of cAMP, analysing the expression of PKCα gene using Dot blot in treated human lung cancer LTEPa-2 cells and assying the activity of PKC and PKA in LTEPa-2 cells expressing antisense PKCα.The results demonstrated that human lung cancer LTEPa-2 cells showed reduced growth rate and decreased expression of PKCα gene after treatment with 5μmol/L HMBA,on the contrary,cAMP level increased.When PKA activity was inhibited in LTEPa-2 cells treated with 0.15mg/L Calphostin C,a specific inhibitor of PKC,cAMP level increased in LTEPa-2 cells with slow growth rate.The PKA activity increased obviously in LTEPa-2 cells expressing antisense PKCα mRNA,which displayed markedly decreased PKCα level(RNA,protein content and enzymatic activiey).The results indicated that an antagonistical relationship between PKCα and cAMP-PKA pathway existed in LTEPa-2 cells.These two signaling systems regulate proliferation and transformation of human lung cancer cells cooperatively.
KEY WORDS Cell proliferation; Protein kinase Cα; cAMP-protein kinase A; HMBA; Calphostin C;Human lung cancer cell
△The Key Laboratory of Cell Proliferation and Regulation Biology, Department of Biology, Beijing Normal University, Beijing 100875, China
* 国家自然科学基金资助课题(No.39200024,39288002), 百拇医药
单位:北京师范大学生物系细胞增殖及调控生物学开放实验室,北京 100875
关键词:细胞增殖;蛋白激酶Cα;环腺苷酸-蛋白激酶A;六甲撑双乙酰胺;蛋白激酶C抑制剂Calphostin;C;人肺癌细胞
解剖学报/980414 摘 要 为了探讨蛋白激酶Cα(PKCα)及其与环腺苷酸-蛋白激酶A(cAMP-PKA)信号系统的相关性,用六甲撑双乙酰胺(hexamethylene bisacetamide, HMBA)和PKC 抑制剂 Calphostin C 分别处理人肺癌细胞LTEPa-2,统计细胞生长百分数,测定cAMP水平。用斑点杂交方法检测PKCα基因表达,并测定表达反义PKCα的人肺癌LTEPa-2细胞中PKC与PKA激酶活性。结果显示:5μmol/L HMBA处理人肺癌LTEPa-2细胞3d后,细胞增殖明显被阻抑,PKCα基因表达下降,cAMP水平升高。0.15mg/L PKC抑制剂Calphostin C导致人肺癌细胞增殖速度减慢时,cAMP水平也升高。在表达反义PKCα的人肺癌LTEPα-2细胞中,当PKCα基因和蛋白表达被阻抑、PKC活性明显降低的同时,PKA活性则显著升高。结果提示:在人肺癌细胞中PKCα亚类和cAMP-PKA通路显示出拮抗关系。PKCα和PKA两套信号系统相互作用,共同调节人肺癌细胞的增殖和转化。
, 百拇医药
蛋白激酶C(protein kinase C, PKC)和依赖于cAMP的蛋白激酶A(protein kinase A, PKA)作为真核细胞中两类主要的蛋白激酶系统,在细胞的增殖和转化中具有重要的调节作用[1]。cAMP-PKA信号通路和肌醇磷脂通路的作用本质与相关性决定于两者所控制的细胞系统;在一些内分泌组织、淋巴瘤细胞,PKC促进cAMP的形成,而在神经胶质瘤细胞、卵巢肉瘤细胞、血小板、嗜中性粒细胞,两套系统又表现出相互拮抗的作用。随着研究工作的深入,PKC家族成员的分子异质性使得PKC各亚类激活的信号传导途径和cAMP-PKA信号系统之间的关系也愈益被人们所关注。为此,我们以人肺癌细胞LTEPa-2为模型,探讨了PKCα亚类与cAMP-PKA信号系统间调节作用的相关性。
材料和方法
1.细胞培养
正常人胚肺细胞(2BS)、人肺癌细胞LTEPa-2及经药物处理的LTEPa-2细胞分别培养在含10%小牛血清的DMEM培养基中,于37℃和5%CO2培养箱中生长。
, 百拇医药
2.细胞生长曲线
细胞以1×104数接种在24孔板,24h后分别加入终浓度为5μmol/L六甲撑双乙酰胺(hexamethylene bisacetamide, HMBA)或0.15mg/L的PKC抑制剂Calphostin C于3个孔中,每天用计数器(coulter counter)计数,连续计数4d,以细胞数为纵坐标,处理时间(d)为横坐标绘制生长曲线。
3.RNA斑点杂交
3.1 RNA的提纯:收集LTEPa-2细胞及经HMBA处理的LTEPa-2细胞,用一步法[2]提取细胞总RNA,分装贮存于-70℃备用。
3.2 探针制备:PKC cDNA(2.28kb/Sall):英国 Imperial Cancer foundation P.J.Parker 博士惠赠;探针标记采用随机引物标记试剂盒进行(美国 Promega 公司)。
, http://www.100md.com
3.3 RNA斑点杂交:基本按Thomas[3]方法,将硝酸纤维素膜浸泡于无RNase的水中后,转入10×SSC浸泡1h后待用。RNA样品用20×SSC梯度稀释后68℃变性15min,点样于膜上,室温晾干后,80℃真空烘烤2h。预杂交4~6h,加入α-32P标记的探针于42℃水浴中杂交18~22h,洗膜后在-70℃与X线胶片曝光,常规显影、定影。
4.cAMP 水平测定
收集细胞后加入5%三氯乙酸至1ml,混悬后放置30min,离心后留取上清,加入0.5ml 1mol/L HCl,加入2倍体积的饱和乙醚,反复抽提5次,然后用HClO4和KOH将溶液pH调至7.0。置70℃蒸干。cAMP含量测定依据试剂盒的说明程序进行(中国医学科学院基础所提供)。cAMP含量以pg/106细胞表示。
5.PKC和PKA活性测定
, 百拇医药
激酶活性测定见文献[4,5]。收集细胞加入裂解液,超声破碎、离心,留取部分上清,测定PKA活性,反应管内含20mmol/L Tris*Cl pH7.5, 5mmol/L MgCl2, 50μg Histon(type Ⅲ),1.5μmol/L cAMP与酶提取液。加入γ-32P-ATP,30℃反应3min,终止反应,点膜,液闪法测定。其余部分上清液通过DEAE-52纤维素柱,初步提纯和测定PKC活性,反应管内含25mmol/L Tris*Cl pH7.5, 5mmol/L MgCl2, 500μmol/L CaCl2, 50μg Histon (type Ⅲ); PS/DG 10μg/0.2μg与酶提取液,加入γ-32P-ATP, 30℃反应5min,终止反应,点膜,液闪法测定,同时测定总蛋白含量。
结 果
1.HMBA对人肺癌LTEPa-2细胞生长,cAMP水平及PKCα基因表达的影响
, 百拇医药
当用5μmol/L HMBA处理LTEPa-2细胞时,可见在处理的不同时间细胞增殖速度受到明显的抑制(图1),并且在作用后的LTEPa-2细胞中cAMP含量明显升高(图2A),同时与增殖密切相关的PKCα基因表达水平也显著下降(图2B)。

图1 HMBA(5μmol/L)处理对LTEPa-2细胞增殖的影响
■.LTEPa-2细胞
◆.LTEPa-2细胞+HMBA(5μmol/L)
Fig.2 The effect of HMBA (5μmol/L)treatment on proliferation of LTEPa-2 cells■.LTEPa-2 cells
, http://www.100md.com
◆.HMBA(5μmol/L)-treated LTEPa-2 cells

图2 HMBA(5μmol/L)处理3d对LTEPa-2细胞中
cAMP水平(A)与PKCα基因表达(B)的影响
A.cAMP水平 B.PKC α基因表达
a.LTEPa-2细胞 b.HMBA(5μmol/L)处理LTEPa-2细胞3d
(a)点印迹杂交结果 (b)点印迹杂交结果薄层扫描定量分析
Fig.2 The effect of HMBA (5μmol/L) treatment for 3 day on
, http://www.100md.com
cAMP level (A) and PKCα gene expression(B)
A.The level of cAMP B.The PKCα gene expression
a.LTEPa-2 cells b.HMBA(5μmol/L)-treated LTEPa-2 cells for 3 day
(a) Dot blot (b)Quantitative analysis of Dot blot by thin-layer scanning
2.PKC抑制剂Calphostin C对人肺癌LTEPa-2细胞中PKC活性和cAMP水平的影响

, http://www.100md.com 图3 Calphostin C(0.15mg/L)处理对LTEPa-2细胞增殖的影响
■.LTEPa-2细胞 ◆.Calphostin C(0.15mg/L)处理的LTEPa-2细胞
Fig.3 The effect of Calphostin C(0.15mg/L) treatment on proliferation of LTEPa-2 cells
■.LTEPa-2 cells ◆.Calphostin C(0.15 mg/L)-treated LTEPa-2 cells
当用PKC特异性抑制剂Calphostin C(0.15mg/L)处理人肺癌LTEPa-2细胞时,细胞增殖明显被抑制(图3)的同时,细胞中总PKC活性明显下降(图4A),而cAMP水平则上升(图4B)。

, http://www.100md.com
图4 Calphostin C(0.15mg/L)处理3d对LTEPa-2细胞中PKC活性(A)与
cAMP水平(B)的影响 A.PKC活性 B.cAMP水平
a.LTEPa-2细胞 b.Calphostin C(0.15mg/L)处理LTEPa-2细胞3d
Fig.4 The effect of Calphostin C(0.15mg/L) treatment for 3 days on PKC activity(A) and cAMP level(B)in LTEPa-2 cells
A.The activity of PKC B.The level of cAMP
a.LTEPa-2 cells b.Calphostin C(0.15mg/L)-treated LTEPa-2 cells for 3 days
, 百拇医药
3.表达反义PKCα mRNA的人肺癌LTEPa-2细胞中PKA活
性的变化
我们运用已建立的表达反义PKCα mRNA的人肺癌细胞(LT.AS4),进一步观察了PKC活性与PKA活性变化的相关性。在LT.AS4细胞中PKCα基因和蛋白水平明显下降和细胞增殖显著被抑制(另文发表)的同时,PKC活性也被阻抑,而PKA活性则明显增强(图5A,B)。


图5 表达反义PKCα的人肺癌LTEPa-2细胞中PKC(A)和PKA(B)的活性
LTEPa-2.人肺癌细胞 LTC.表达空载体LTEPa-2细胞 LT.AS4.表达反义PKCαmRNA的LTEPa-2细胞
, http://www.100md.com
Fig.5 The activity of PKC(A) and PKA(B) in LTEPa-2 cells expressing antisense PKCα mRNA
LTEPa-2:human lung cancer cells LTC:LTEPa-2 cells transfected with vector only LT.AS4:LTEPa-2 cells expressing antisense PKCα mRNA
讨 论
真核细胞内多种信号传导通路相互协调、相互作用构成了一个复杂的调节网络,共同精确地调节细胞的各种生理功能。我们以人肺癌细胞LTEPa-2为实验对象,探讨了PKC和cAMP-PKA系统在细胞增殖中的可能作用及两套系统之间的相关性。用5μmol/L HMBA处理人肺癌细胞,细胞增殖被明显抑制的同时,PKCα的基因表达和PKC活性下降,相反,cAMP水平升高,当用0.15mg/L PKC抑制剂Calphostin C处理癌细胞时,也得到了类似的实验结果。
, 百拇医药
反义RNA技术是近年来发展起来的一种研究特异基因功能的新方法。我们采用反义技术构建了表达反义PKCα的人肺癌细胞LTEPa-2,该细胞在特异性抑制了PKCα基因表达和蛋白质水平的基础上,PKC活性也明显下降,但是细胞内PKA活性却明显提高,该现象有力地支持了上述的实验结果。此外,我们曾在人胚肺细胞中过表达PKCα亚类,发现在PKC活性升高的同时,细胞增殖速率加快并且出现转化表型[6,7]。相反,PKA的活性受到了明显抑制(结果未显示)。这也从另一角度辅助证明了上述的实验结论。关于PKC通路与cAMP-PKA通路的拮抗关系,早在1982年,Kaibuchi等[8]发现cAMP能阻止32P标记到淋巴细胞的肌醇磷酸中,Narindrasorasak等[9]用db-cAMP和forskolin处理大鼠骨髓肌成纤维细胞L6时,胞质PKC活性下降,但与PKA抑制剂一起孵育,PKC的下调作用就被抑制,可能一种cAMP影响的物质参与了PKC活性的调节。Nishizuka[10]提出胞内cAMP的提高可作为一种负调控信号抑制了细胞膜上PIP2的水解,抑制了PKC活化所引起的增殖效应。此外,在PKC亚类与cAMP信号通路的关系方面,有实验表明,当用db-cAMP诱导PC12细胞分化过程中,PKCα表达下降,PKCβⅡ升高,PKC总活性降低[11]。8-溴-cAMP诱导成神经细胞瘤细胞(neuroblastoma cell)neuro-2α分化时,PKCα和PKCε转录水平降低,表明cAMP-PKA通路对于不同PKC亚类有不同的调节机制[12]。最近,Kawabe等[13]实验证明了PKC能直接调节腺苷酸环化酶活性,并且依赖于不同的PKC亚类。通过我们的实验表明了人肺癌细胞增殖过程中,PKCα亚类的活化起正调作用,而cAMP则具有负调节作用,进一步阐明了这两条信号通路间显示出的正负调节的拮抗关系。
, 百拇医药
收稿1997-09 修回1998-01
参考文献
[1]Nishizuka Y. Studies and perspectives of protein kinase C. Science, 1986, 233(4761):305
[2]Chomezynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987, 162(1):156
[3]Thomas PS. Hybridization of denatured RNA and all DNA fragments transfered to nitrocellulose. Proc Natl Acad Sci USA, 1980, 77(9):5201
, 百拇医药
[4]Mischak H, Kazanietz MG, Mushinski JF. Phorbol ester-induced myeloid differentiation is mediated by protein kinase Cα and δ and not by protein kinase CβⅡ, ε and η. J Biol Chem, 1993, 268(27):20110
[5]刘 毅,艾兆伟,陈惠黎.视黄酸对人肝癌细胞蛋白激酶的影响.生物化学杂志,1990,6(6):533
[6]王向阳,吴承军,柳惠图.蛋白激酶 Cα亚类真核表达质粒的构建和过表达细胞模型的建立及初步分析.科学通报,1995,40(22):2081
[7]王向阳,胡云英,柳惠图.蛋白激酶 Cα过表达导致正常人胚肺成纤维细胞生长失调的研究.生物化学杂志,1996,12(3):274
, http://www.100md.com
[8]Kaibuchi K, Takai Y, Ogawa Y, et al. Inhibitory action of adenosine 3'5'-monophosphate on phosphatidylinositol turnover: defference in tissue response. Biochem Biophys Res Commun, 1982, 104(1):105
[9]Narindrasorasak S, Brickenden A, Ball E, et al. Regulation of protein kinase C by cyclic adenosine 3'5'-monophosphate and a tumor promoter in skeletal myoblasts. J Biol Chem, 1987, 262(22):10497
[10]Nishizuka Y. The role of protein kinase C in cell surface signal transduction and tumor promotion. Nature (London),1984,308(5961):693
, 百拇医药
[11]Uehara-Kunugi Y, Shimohama S, Tamura H, et al. Different modulation of protein kinase C isozymes in dibutyryl cyclic AMP-differentiated PC12 cells. J Neurochem, 1994, 63(1):125
[12]Wada H, Ohno S, Kubo K, et al. Cell type-specific expression of the genes for the protein kinase C family: down regulation of mRNAs for PKCα and PKCε upon in vitro differentiation of a mouse neuroblastoma cell line neuro 2a. Biochem Biophys Res Commun, 1989, 165(1):533
, 百拇医药
[13]Kawabe Junichi, Iwami G, Ebina T, et al. Differential activation of adenylyl cyclase by protein kinase C isoenzymes. J Biol Chem, 1994, 269(24):16554
STUDIES ON THE RELATIONSHIP BETWEEN PROTEIN KINASE
Cα ISOFORM AND cAMP-PROTEIN KINASE A SYSTEM IN
HUMAN LUNG CANCER LTEPa-2 CELLS
Wang Xiangyang, Liu Huitu△,Hu Yunying
, 百拇医药
(The Key Laboratory of Cell Proliferation and Regulation Biology, Department of Biology,Beijing Normal University, Beijing)
To study the relationship between protein kinase Cα isoform and cAMP-protein kinase A system. Treating human lung cancer cells LTEPa-2 with HMBA(hexamethylene bisacetamide) and PKC inhibitor Calphostin C respectively, counting growth rate and detecting the level of cAMP, analysing the expression of PKCα gene using Dot blot in treated human lung cancer LTEPa-2 cells and assying the activity of PKC and PKA in LTEPa-2 cells expressing antisense PKCα.The results demonstrated that human lung cancer LTEPa-2 cells showed reduced growth rate and decreased expression of PKCα gene after treatment with 5μmol/L HMBA,on the contrary,cAMP level increased.When PKA activity was inhibited in LTEPa-2 cells treated with 0.15mg/L Calphostin C,a specific inhibitor of PKC,cAMP level increased in LTEPa-2 cells with slow growth rate.The PKA activity increased obviously in LTEPa-2 cells expressing antisense PKCα mRNA,which displayed markedly decreased PKCα level(RNA,protein content and enzymatic activiey).The results indicated that an antagonistical relationship between PKCα and cAMP-PKA pathway existed in LTEPa-2 cells.These two signaling systems regulate proliferation and transformation of human lung cancer cells cooperatively.
KEY WORDS Cell proliferation; Protein kinase Cα; cAMP-protein kinase A; HMBA; Calphostin C;Human lung cancer cell
△The Key Laboratory of Cell Proliferation and Regulation Biology, Department of Biology, Beijing Normal University, Beijing 100875, China
* 国家自然科学基金资助课题(No.39200024,39288002), 百拇医药