在发育过程中小鼠脑N-甲基-D-门冬氨酸受体亚单位蛋白的表达
作者:罗建红 朱丽君 郑 功 沈海清
单位:浙江医科大学医学分子生物学实验室,杭州 310031
关键词:NMDA受体;亚单位;发育;免疫印迹;前脑;小脑
解剖学报/980411 摘 要 为了测定新生小鼠发育过程中脑组织中NMDA受体亚单位蛋白的表达水平,用NMDA受体亚单位特异的抗体,通过引入成年小鼠皮层组织系列稀释的样品作标准,建立了定量的免疫印迹分析法。并对出生后不同日龄(2~35d)新生小鼠前脑和小脑组织中NMDA受体ζ1、ε1和ε2亚单位蛋白进行了测定。结果表明,ζ1、ε1和ε2三个亚单位在大鼠前脑组织中呈相似的增加趋势,只是ε1的表达明显的滞后。而小脑此3种亚单位的表达绝对量均明显低于前脑组织,并且趋势各不相同:ζ1经明显的下降后维持在一定的水平,ε1呈增加趋势,ε2出生后5d即有相当的表达,以后下降,3周后几乎不能测出。上述结果与相应的mRNA半定量分析结果基本一致,并且与大鼠同类研究结果大致吻合。
, 百拇医药
N-甲基-D-门冬氨酸(NMDA)受体在中枢神经系统突触的兴奋性传递中起重要作用,与许多重要的生理功能相关,如突触的可塑性、学习和记忆;同时也介入一些病理过程,如神经细胞兴奋性毒性作用、癫痫的发生以及慢性神经退行性变等。
NMDA受体属配基门控的离子通道,目前认为它是由两个家族的基因所编码的亚单位组成的异五聚体。大鼠的第1个基因家族命名为NR1,其小鼠的同源基因为ζ1,这一家族只有1个基因,但可以产生8个功能各异的剪接变体。第2个基因家族为NR2,共有4个相关的基因,即NR2A、NR2B、NR2C和NR2D,小鼠的同源基因分别为ε1、ε2、ε3和ε4[1~3]。在NMDA受体复合物中NR1是必需的成分,而由不同的NR2亚单位参与组成的NMDA受体通道则具有不同的电生理和药理学特征[2,3]。
研究表明,天然NMDA受体具有不同的功能亚型,决定这种功能多样性的重要基础正是亚单位组成的异质性。这与核酸杂交显示各亚单位的表达具有组织分布特异性及受发育调节的结果相一致[4,5]。我们及另几个研究小组则应用融合蛋白或多肽抗原制备NMDA受体亚单位特异性抗体,对NMDA受体亚单位蛋白的生化特征、组织学分布、发育性表达以及亚单位组成直接进行了研究[6~8]。本研究采用NMDA受体亚单位特异的抗体,对不同发育阶段小鼠脑组织的NMDA受体ζ1、ε1和ε2亚单位蛋白表达水平进行了测定。
, 百拇医药
材料和方法
1. 亚单位特异的抗体
本研究用的NMDA受体亚单位特异的抗ζ1单克隆抗体和抗ε2为自行研制[7]。抗ζ1由相当于NR1A1-561肽段的融合蛋白免疫产生,识别位点于341~561氨基酸顺序之间,能与所有的剪接变体反应。抗ε2则由相当于NR2B的C末端融合蛋白免疫产生。抗ε1免疫兔血清由相当于NR2A的C末端融合蛋白免疫产生(由美国Georgetown大学Wolfe博士惠赠)[8]。因为不同种属之间相应的亚单位蛋白高度同源,这3种抗体能特异地识别大鼠、小鼠、人等种属的同源亚单位[9,10]。
2. 小鼠脑组织细胞膜蛋白样品的制备
NIH种小鼠,断颈处死立即解剖取脑,分离出前脑、大脑皮层和小脑。置脑组织于湿重100倍量的预先冰冷的缓冲液A(10 mol/L Tris-HCl,pH7.4,320 mol/L蔗糖)中,用Kinematica组织匀浆器匀浆2次,每次10s,间隔20s,强度为50;700×g 4℃离心10min,把上清转移至另一离心管;低速离心的上清再经3 7000×g 4℃离心40min,弃上清,沉淀用缓冲液B(10mol/L Tris-acetate,mol/L EDTA,pH7.4)重新匀浆混悬。用Lowry法测定蛋白浓度,-70℃冷冻保藏。取样小鼠为出生后第2、5、8、11、14、21、28和35d共8个年龄组,每个年龄组为5~10个小鼠。
, 百拇医药
3. 十二酰基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫印迹的定量分析
按常规的方法完成SDS-PAGE和分离蛋白的电转移,印迹膜片与上述一抗及HRP标记的二抗相继温浴后,经反复漂洗,与强化化学发光试剂(enhanced chemiluminesence,ECL)温浴1min,印迹膜片用保鲜膜包裹,印迹面朝X线片曝光30~60s,经显影定影显现信号。X线片用UltroScan XL激光光密度仪分析。由于条带密度积分值与信号分子含量之间并不是线性关系,为了定量的准确性,实验引入经系列稀释的成年小鼠脑皮层组织作为样品的相对定量标准,范围为20~0.625μg/孔。该标准曲线数据适合下列非线性回归方程: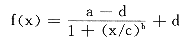
此公式中,a为最大值,b为斜率,c为折点值,d为最小值。通过这一标准可以把样品的密度积分信号转化为定量标准脑皮层组织的相对值,从而使样品之间受体亚单位量有直接的可比性。
, 百拇医药
结果
1. 定量免疫印迹标准曲线的建立
图1为成年小鼠大脑皮层组织与抗NMDA ε2的免疫印迹照片及由此结果数据化后建立的标准曲线。每孔加样量依次为0.625、1.25、2.5、5、10及20 μg。根据每个条带的密度积分值与相应的膜蛋白量作图。同理建立相应的抗ζ1和抗ε1免疫印迹的标准曲线,这些标准曲线分别用于相应的NMDA受体亚单位蛋白ζ1、ε1和ε2的定量。
图1 定量性免疫印迹标准曲线的建立
Fig.1 Standard curve constructed for quantitative immunoblot
, 百拇医药
图2 出生后不同天数小鼠前脑及小脑组织与
抗ζ1、抗ε1及抗ε2的免疫印迹
Fig.2 Immunoblots of forebrain and cerebellum tissues from mice of different postnatal days with anti-ζ1,anti-ε1 or anti-ε2,respectively.
2. 小鼠前脑及小脑组织与抗ζ1、抗ε1和抗ε2的免疫印迹
图3 新生小鼠发育过程中前脑及小脑组织NMDAξ1,ε1及ε2
亚单位蛋白的定量分析(*信号不能被密度仪读出)
, http://www.100md.com
Fig.3 Quantitative analysis of developmental expressions of NMDA ζ1,ε1 and ε2 subunit proteins of mouse forebrain and cerebellum(* under detectable)
图2是一组不同发育阶段(2~35d)小鼠前脑和小脑组织与NMDA受体亚单位抗体抗ζ1、抗ε1和抗ε2的免疫印迹结果。所有前脑组织的加样量为每孔4μg,小脑组织的加样量为每孔8μg,样本与定量标准的免疫印迹实验同时完成。每个年龄组共有5个不同的动物,因而共完成5组上述类似的实验。
3. 小鼠前脑和小脑组织NMDAζ1、ε1及ε2亚单位发育性表达的定量分析
将上述免疫印迹结果的条带经密度扫描仪读取密度积分值并转化为标准的相对含量,以5组实验的均数作出图3,此图定量地反映这3种亚单位蛋白在不同发育阶段的前脑和小脑组织中的表达量和趋势。结果表明,ζ1、ε1和ε2 3个亚单位在大鼠前脑组织中呈相似的增加趋势,4周后均达成年小鼠水平;但是ε1亚单位的表达明显的滞后,2周后才有明显的表达。而小脑此3种亚单位的绝对表达量均明显低于前脑组织,并且趋势各不相同。ζ1经明显的下降后维持在一定的水平,约为成年小鼠前脑的1/5;ε1呈增加趋势,4周后约为成年小鼠前脑的1/10;ε2出生后5d即有相当的表达,以后下降,3周后几乎不能测出。
, http://www.100md.com
讨论
NMDA受体含量通常用该受体通道阻断剂[3H]-MK801结合试验来确定,但这不能反映各亚单位的表达量。核酸杂交可以半定量地分析各亚单位mRNA的表达水平和组织学分布。而我们则采用亚单位特异的抗体直接对亚单位蛋白本身作相对定量分析。免疫印迹是一个经典而又经常采用的蛋白分析方法。近年方法学上的一个重要的改进是更新了显示系统,即用强化的化学发光试剂取代了显色剂,大大地提高了检测的敏感性,而且X线片硬拷贝结果可长期保存。但主要用作定性分析。我们首先报道了引入标准曲线的定量免疫印迹技术[7,11]。方法的原理是将系列稀释的标准样本的光密度值建立为4个参数的标准曲线,这样就可能将待测样品的光密度积分值换算为标准样品的相对值,实现样品信号间的直接可比,有关此方法的可靠性,我们已作了详尽的讨论[11]。
NMDA受体介导了发育过程中突触的可塑性[12,13],同时受体本身的表达也受发育的调制,包括受体总量及功能亚型,显然具有生理意义。例如,药理学研究提示,刚出生时,大鼠大脑皮层主要存在NR1/NR2B受体亚型,之后,逐渐形成含有NR2A亚单位的受体亚型[14]。这与我们的结果提示刚出生时,小鼠前脑主要是ζ1和ε2亚单位,而与ε1的表达明显滞后相一致。另一方面,出生时小脑就含有相当量的ε2亚单位,但约1周后迅速下降,至3周已不能检测出来,而ε1则表现出增加趋势。mRNA半定量的类似研究提示,成年大鼠小脑组织几乎测不出NR2B,主要亚单位是NR1、NR2A和NR2C[15]。这种NMDA受体亚单位不同发育阶段表达的消长意味着组成受体通道复合物亚单位成分的改变及其功能特性的改变,也是一个研究天然受体亚单位组成和各亚单位间分子比的极好模型。
, 百拇医药
收稿1997-12 修回1998-03
参考文献
[1]Ikeda K,Nagasawa M,Mori H,et al.Cloning and expression of the epsilon 4 subunit of the NMDA receptor channel.FEBS Lett,1992,318(1):34
[2]Meguro H,Mori H,Araki K,et al.Functional characterization of a heterometic NMDA receptor channel expressed from cloned cDNAs.Nature,1992,357(6373):70
[3]Monyer H,Sprengel R,Schoepfer R,et al.Heteromeric NMDA receptors:molecular and functional distinction of subtypes.Science,1992,256(5060):1217
, http://www.100md.com
[4]Laurie DJ,Seeburg PH.Ligand affinities at recombinant N-methyl-D-aspartate receptors depend on subunit composition.Eur J Pharmacol,1994,268(3):335
[5]Monyer H,Burnashev N,Laurie DJ,et al.Developmental and regional expression in the rat brain and functional properties of four NMDA receptors.Neuron,1994,12(3):529
[6]Sheng M,Cummings J,Roldan JA,et al.Changing subunit composition of heteromeric NMDA receptors during development of rat cortex.Nature,1994,368(6467):144
, 百拇医药
[7]Luo J,Yuehua W,Yasuda RP,et al.The majority of N-methyl-D-aspartate receptor complexes in adult rat cerabral cortex contain at least three different subunits (NR1/NR2A/NR2B).Mol Pharmacol,1997,51(1):79
[8]Wang Y,Bosy TZ,Yasuda RP,et al.Characterization of NMDA receptor subunit-specific antibodies:Distribution of NR2A and NR2B receptor subunits in rat brain and ontogenic profile in the cerebellum.J Neurochem,1995,65(1):176
[9]Didier M,Xu M,Steve AB,et al.Differential expression and co-assembly of NMDA ζ1 and ε subunits in the mouse cerebellum during postnatal development,Neuroreport, 1995,6(16):2255
, http://www.100md.com
[10]Munir M,Lu L,Wang YH,et al.Pharmacological and immunological characterization of N-methel-D-aspartate receptor in human NT2-N neurons.J Pharmacol Exp Ther,1996,276(2):819
[11]Luo J,Thomas BZ,Wang YH,et al.Ontogeny of NMDA R1 subunit protein expression in five regions of rat brain.Dev Brain Res,1996,92(1):10
[12]Bliss TV,Collingridge GL.A synaptic model of memory:long-term potentiation in the hippocampus,Nature,1993,361(6407):31
, 百拇医药
[13]Williams K,Zappia AM,Pritchett DB,et al.Sensitivity of the N-methyl-D-aspartate receptor to polyamines in controlled by NR2 subunits.Mol Pharmacol,1994,45(5):803
[14]Williams K,Russell SL,Shen YM, et al.Developmental swicth in the expression of NMDA receptors occurs in vivo and in vitro.Neuron,1993,10(2):267
[15]Chazot PL,Coleman SK,Cik M,et al.Molecular characterization of N-methyl-D-aspartate receptors expressed in mammalian cells yields evidence for the coexistence of three subunit types within a discrete receptor molecule.J Biol Chem,1994,269(39):24403
, 百拇医药
DEVELOPMENTAL EXPRESSION OF N-METHYL-D-ASPARTATE
RECEPTOR SUBUNIT PROTEINS IN MOUSE BRAIN
Luo JianhongΔ,Zhu Lijun,Zheng Gong,Shen Haiqing
(Medical Molecular Biology Laboratory,Zhejiang Medical University,Hangzhou)
This study is to determine the levels of NMDA receptor subunit proteins in mouse brain during postnatal development.A semiquantitative immmunoblotting technique has been developed by using NMDA receptor subunit-specific antibodies and adult mouse cortex as a standard.By employing this method,developmental expressions of NMDA receptor subunits ζ1,ε1 and ε2 in mouse forebrain and cerebellum were determined.The results show that all the three subunits have a similar increasing pattern in forebrain,but ε1 expression remarkably delays.On the other hand,these three subunits express in much lower levels in cerebellum than in forebrain,and have different patterns.These results are generally consistent with those from mRNA semiquantitation and those from similar studies in rats.
KEY WORDS NMDA receptor; Subunit; Development; Immunoblot; Forebrain;Cerebellum
△ Medical Molecular Biology Laboratory,Zhejiang Medical University,Hangzhou 310031,China, 百拇医药
单位:浙江医科大学医学分子生物学实验室,杭州 310031
关键词:NMDA受体;亚单位;发育;免疫印迹;前脑;小脑
解剖学报/980411 摘 要 为了测定新生小鼠发育过程中脑组织中NMDA受体亚单位蛋白的表达水平,用NMDA受体亚单位特异的抗体,通过引入成年小鼠皮层组织系列稀释的样品作标准,建立了定量的免疫印迹分析法。并对出生后不同日龄(2~35d)新生小鼠前脑和小脑组织中NMDA受体ζ1、ε1和ε2亚单位蛋白进行了测定。结果表明,ζ1、ε1和ε2三个亚单位在大鼠前脑组织中呈相似的增加趋势,只是ε1的表达明显的滞后。而小脑此3种亚单位的表达绝对量均明显低于前脑组织,并且趋势各不相同:ζ1经明显的下降后维持在一定的水平,ε1呈增加趋势,ε2出生后5d即有相当的表达,以后下降,3周后几乎不能测出。上述结果与相应的mRNA半定量分析结果基本一致,并且与大鼠同类研究结果大致吻合。
, 百拇医药
N-甲基-D-门冬氨酸(NMDA)受体在中枢神经系统突触的兴奋性传递中起重要作用,与许多重要的生理功能相关,如突触的可塑性、学习和记忆;同时也介入一些病理过程,如神经细胞兴奋性毒性作用、癫痫的发生以及慢性神经退行性变等。
NMDA受体属配基门控的离子通道,目前认为它是由两个家族的基因所编码的亚单位组成的异五聚体。大鼠的第1个基因家族命名为NR1,其小鼠的同源基因为ζ1,这一家族只有1个基因,但可以产生8个功能各异的剪接变体。第2个基因家族为NR2,共有4个相关的基因,即NR2A、NR2B、NR2C和NR2D,小鼠的同源基因分别为ε1、ε2、ε3和ε4[1~3]。在NMDA受体复合物中NR1是必需的成分,而由不同的NR2亚单位参与组成的NMDA受体通道则具有不同的电生理和药理学特征[2,3]。
研究表明,天然NMDA受体具有不同的功能亚型,决定这种功能多样性的重要基础正是亚单位组成的异质性。这与核酸杂交显示各亚单位的表达具有组织分布特异性及受发育调节的结果相一致[4,5]。我们及另几个研究小组则应用融合蛋白或多肽抗原制备NMDA受体亚单位特异性抗体,对NMDA受体亚单位蛋白的生化特征、组织学分布、发育性表达以及亚单位组成直接进行了研究[6~8]。本研究采用NMDA受体亚单位特异的抗体,对不同发育阶段小鼠脑组织的NMDA受体ζ1、ε1和ε2亚单位蛋白表达水平进行了测定。
, 百拇医药
材料和方法
1. 亚单位特异的抗体
本研究用的NMDA受体亚单位特异的抗ζ1单克隆抗体和抗ε2为自行研制[7]。抗ζ1由相当于NR1A1-561肽段的融合蛋白免疫产生,识别位点于341~561氨基酸顺序之间,能与所有的剪接变体反应。抗ε2则由相当于NR2B的C末端融合蛋白免疫产生。抗ε1免疫兔血清由相当于NR2A的C末端融合蛋白免疫产生(由美国Georgetown大学Wolfe博士惠赠)[8]。因为不同种属之间相应的亚单位蛋白高度同源,这3种抗体能特异地识别大鼠、小鼠、人等种属的同源亚单位[9,10]。
2. 小鼠脑组织细胞膜蛋白样品的制备
NIH种小鼠,断颈处死立即解剖取脑,分离出前脑、大脑皮层和小脑。置脑组织于湿重100倍量的预先冰冷的缓冲液A(10 mol/L Tris-HCl,pH7.4,320 mol/L蔗糖)中,用Kinematica组织匀浆器匀浆2次,每次10s,间隔20s,强度为50;700×g 4℃离心10min,把上清转移至另一离心管;低速离心的上清再经3 7000×g 4℃离心40min,弃上清,沉淀用缓冲液B(10mol/L Tris-acetate,mol/L EDTA,pH7.4)重新匀浆混悬。用Lowry法测定蛋白浓度,-70℃冷冻保藏。取样小鼠为出生后第2、5、8、11、14、21、28和35d共8个年龄组,每个年龄组为5~10个小鼠。
, 百拇医药
3. 十二酰基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和免疫印迹的定量分析
按常规的方法完成SDS-PAGE和分离蛋白的电转移,印迹膜片与上述一抗及HRP标记的二抗相继温浴后,经反复漂洗,与强化化学发光试剂(enhanced chemiluminesence,ECL)温浴1min,印迹膜片用保鲜膜包裹,印迹面朝X线片曝光30~60s,经显影定影显现信号。X线片用UltroScan XL激光光密度仪分析。由于条带密度积分值与信号分子含量之间并不是线性关系,为了定量的准确性,实验引入经系列稀释的成年小鼠脑皮层组织作为样品的相对定量标准,范围为20~0.625μg/孔。该标准曲线数据适合下列非线性回归方程:
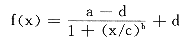
此公式中,a为最大值,b为斜率,c为折点值,d为最小值。通过这一标准可以把样品的密度积分信号转化为定量标准脑皮层组织的相对值,从而使样品之间受体亚单位量有直接的可比性。
, 百拇医药
结果
1. 定量免疫印迹标准曲线的建立
图1为成年小鼠大脑皮层组织与抗NMDA ε2的免疫印迹照片及由此结果数据化后建立的标准曲线。每孔加样量依次为0.625、1.25、2.5、5、10及20 μg。根据每个条带的密度积分值与相应的膜蛋白量作图。同理建立相应的抗ζ1和抗ε1免疫印迹的标准曲线,这些标准曲线分别用于相应的NMDA受体亚单位蛋白ζ1、ε1和ε2的定量。

图1 定量性免疫印迹标准曲线的建立
Fig.1 Standard curve constructed for quantitative immunoblot

, 百拇医药
图2 出生后不同天数小鼠前脑及小脑组织与
抗ζ1、抗ε1及抗ε2的免疫印迹
Fig.2 Immunoblots of forebrain and cerebellum tissues from mice of different postnatal days with anti-ζ1,anti-ε1 or anti-ε2,respectively.
2. 小鼠前脑及小脑组织与抗ζ1、抗ε1和抗ε2的免疫印迹

图3 新生小鼠发育过程中前脑及小脑组织NMDAξ1,ε1及ε2
亚单位蛋白的定量分析(*信号不能被密度仪读出)
, http://www.100md.com
Fig.3 Quantitative analysis of developmental expressions of NMDA ζ1,ε1 and ε2 subunit proteins of mouse forebrain and cerebellum(* under detectable)
图2是一组不同发育阶段(2~35d)小鼠前脑和小脑组织与NMDA受体亚单位抗体抗ζ1、抗ε1和抗ε2的免疫印迹结果。所有前脑组织的加样量为每孔4μg,小脑组织的加样量为每孔8μg,样本与定量标准的免疫印迹实验同时完成。每个年龄组共有5个不同的动物,因而共完成5组上述类似的实验。
3. 小鼠前脑和小脑组织NMDAζ1、ε1及ε2亚单位发育性表达的定量分析
将上述免疫印迹结果的条带经密度扫描仪读取密度积分值并转化为标准的相对含量,以5组实验的均数作出图3,此图定量地反映这3种亚单位蛋白在不同发育阶段的前脑和小脑组织中的表达量和趋势。结果表明,ζ1、ε1和ε2 3个亚单位在大鼠前脑组织中呈相似的增加趋势,4周后均达成年小鼠水平;但是ε1亚单位的表达明显的滞后,2周后才有明显的表达。而小脑此3种亚单位的绝对表达量均明显低于前脑组织,并且趋势各不相同。ζ1经明显的下降后维持在一定的水平,约为成年小鼠前脑的1/5;ε1呈增加趋势,4周后约为成年小鼠前脑的1/10;ε2出生后5d即有相当的表达,以后下降,3周后几乎不能测出。
, http://www.100md.com
讨论
NMDA受体含量通常用该受体通道阻断剂[3H]-MK801结合试验来确定,但这不能反映各亚单位的表达量。核酸杂交可以半定量地分析各亚单位mRNA的表达水平和组织学分布。而我们则采用亚单位特异的抗体直接对亚单位蛋白本身作相对定量分析。免疫印迹是一个经典而又经常采用的蛋白分析方法。近年方法学上的一个重要的改进是更新了显示系统,即用强化的化学发光试剂取代了显色剂,大大地提高了检测的敏感性,而且X线片硬拷贝结果可长期保存。但主要用作定性分析。我们首先报道了引入标准曲线的定量免疫印迹技术[7,11]。方法的原理是将系列稀释的标准样本的光密度值建立为4个参数的标准曲线,这样就可能将待测样品的光密度积分值换算为标准样品的相对值,实现样品信号间的直接可比,有关此方法的可靠性,我们已作了详尽的讨论[11]。
NMDA受体介导了发育过程中突触的可塑性[12,13],同时受体本身的表达也受发育的调制,包括受体总量及功能亚型,显然具有生理意义。例如,药理学研究提示,刚出生时,大鼠大脑皮层主要存在NR1/NR2B受体亚型,之后,逐渐形成含有NR2A亚单位的受体亚型[14]。这与我们的结果提示刚出生时,小鼠前脑主要是ζ1和ε2亚单位,而与ε1的表达明显滞后相一致。另一方面,出生时小脑就含有相当量的ε2亚单位,但约1周后迅速下降,至3周已不能检测出来,而ε1则表现出增加趋势。mRNA半定量的类似研究提示,成年大鼠小脑组织几乎测不出NR2B,主要亚单位是NR1、NR2A和NR2C[15]。这种NMDA受体亚单位不同发育阶段表达的消长意味着组成受体通道复合物亚单位成分的改变及其功能特性的改变,也是一个研究天然受体亚单位组成和各亚单位间分子比的极好模型。
, 百拇医药
收稿1997-12 修回1998-03
参考文献
[1]Ikeda K,Nagasawa M,Mori H,et al.Cloning and expression of the epsilon 4 subunit of the NMDA receptor channel.FEBS Lett,1992,318(1):34
[2]Meguro H,Mori H,Araki K,et al.Functional characterization of a heterometic NMDA receptor channel expressed from cloned cDNAs.Nature,1992,357(6373):70
[3]Monyer H,Sprengel R,Schoepfer R,et al.Heteromeric NMDA receptors:molecular and functional distinction of subtypes.Science,1992,256(5060):1217
, http://www.100md.com
[4]Laurie DJ,Seeburg PH.Ligand affinities at recombinant N-methyl-D-aspartate receptors depend on subunit composition.Eur J Pharmacol,1994,268(3):335
[5]Monyer H,Burnashev N,Laurie DJ,et al.Developmental and regional expression in the rat brain and functional properties of four NMDA receptors.Neuron,1994,12(3):529
[6]Sheng M,Cummings J,Roldan JA,et al.Changing subunit composition of heteromeric NMDA receptors during development of rat cortex.Nature,1994,368(6467):144
, 百拇医药
[7]Luo J,Yuehua W,Yasuda RP,et al.The majority of N-methyl-D-aspartate receptor complexes in adult rat cerabral cortex contain at least three different subunits (NR1/NR2A/NR2B).Mol Pharmacol,1997,51(1):79
[8]Wang Y,Bosy TZ,Yasuda RP,et al.Characterization of NMDA receptor subunit-specific antibodies:Distribution of NR2A and NR2B receptor subunits in rat brain and ontogenic profile in the cerebellum.J Neurochem,1995,65(1):176
[9]Didier M,Xu M,Steve AB,et al.Differential expression and co-assembly of NMDA ζ1 and ε subunits in the mouse cerebellum during postnatal development,Neuroreport, 1995,6(16):2255
, http://www.100md.com
[10]Munir M,Lu L,Wang YH,et al.Pharmacological and immunological characterization of N-methel-D-aspartate receptor in human NT2-N neurons.J Pharmacol Exp Ther,1996,276(2):819
[11]Luo J,Thomas BZ,Wang YH,et al.Ontogeny of NMDA R1 subunit protein expression in five regions of rat brain.Dev Brain Res,1996,92(1):10
[12]Bliss TV,Collingridge GL.A synaptic model of memory:long-term potentiation in the hippocampus,Nature,1993,361(6407):31
, 百拇医药
[13]Williams K,Zappia AM,Pritchett DB,et al.Sensitivity of the N-methyl-D-aspartate receptor to polyamines in controlled by NR2 subunits.Mol Pharmacol,1994,45(5):803
[14]Williams K,Russell SL,Shen YM, et al.Developmental swicth in the expression of NMDA receptors occurs in vivo and in vitro.Neuron,1993,10(2):267
[15]Chazot PL,Coleman SK,Cik M,et al.Molecular characterization of N-methyl-D-aspartate receptors expressed in mammalian cells yields evidence for the coexistence of three subunit types within a discrete receptor molecule.J Biol Chem,1994,269(39):24403
, 百拇医药
DEVELOPMENTAL EXPRESSION OF N-METHYL-D-ASPARTATE
RECEPTOR SUBUNIT PROTEINS IN MOUSE BRAIN
Luo JianhongΔ,Zhu Lijun,Zheng Gong,Shen Haiqing
(Medical Molecular Biology Laboratory,Zhejiang Medical University,Hangzhou)
This study is to determine the levels of NMDA receptor subunit proteins in mouse brain during postnatal development.A semiquantitative immmunoblotting technique has been developed by using NMDA receptor subunit-specific antibodies and adult mouse cortex as a standard.By employing this method,developmental expressions of NMDA receptor subunits ζ1,ε1 and ε2 in mouse forebrain and cerebellum were determined.The results show that all the three subunits have a similar increasing pattern in forebrain,but ε1 expression remarkably delays.On the other hand,these three subunits express in much lower levels in cerebellum than in forebrain,and have different patterns.These results are generally consistent with those from mRNA semiquantitation and those from similar studies in rats.
KEY WORDS NMDA receptor; Subunit; Development; Immunoblot; Forebrain;Cerebellum
△ Medical Molecular Biology Laboratory,Zhejiang Medical University,Hangzhou 310031,China, 百拇医药