牛精子头后部质膜分区的研究
作者:苟克勉*安晓荣**尚丽娟**李迎 张忠诚 陈永福**
单位:苟克勉*安晓荣* *尚丽娟* *李迎 张忠诚 陈永福* * 中国农业大学动物科技学院* *农业生物技术国家重点实验室,北京 100094
关键词:精子;sp18质膜区域;无sp18质膜区域;牛
解剖学报990212
【摘要】 目的 检测牛精子头后部存在的不同质膜区域。 方法 先用钙离子载体A23187诱导精子发生顶体反应,然后用水浴超声波和低速离心法分离得到纯牛精子头。直接用顶体反应后精子和低渗处理的顶体反应后精子头免疫Balb/c母鼠和新西兰公兔,制备抗牛精子抗体,并结合以前制备的抗牛精子sp18单克隆抗体进行间接免疫组织化学分析。 结果 牛精子头后部质膜表面存在两个位置互补的荧光区域,即紧邻赤道板和紧邻尾段的荧光区域:前一区域表面稳定存在的主要是sp18族膜蛋白,后者的膜蛋白在顶体反应和洗涤时易解离。 结论 依据膜蛋白成分的差异,牛精子头后部质膜可以划分为紧邻赤道板的sp18质膜区域(sp18-rich region)和紧邻尾段的无sp18质膜区域(sp18-free region)。
, http://www.100md.com
TWO REGIONS ON POSTERIOR HEAD OF BULL SPERMATOZOA
Gou KemianΔ,An Xiaorong*,Shang Lijuan*,Li Ying,Zhang Zhongcheng,Chen Yongfu*
(College of Animal Science and Technology,* National Laboratory for Agrobiotechnology,China Agricultural University,Beijing)
【Abstract】 Objective To study different domains on posterior head of bull spermatozoa.Methods Acrosome-reacted bovine spermatozoa heads(A23187-induced)were separated from their tails with ultrasonic treatment and centrifugation.Anti-bovine spermatozoa IgG was produced by immunizing Balb/c mice or rabbit with acrosome-reacted bovine spermatozoon or hypotonically treated acrosome-reacted bovine spermatozoa heads.Results Indirect immunofluorescence microscopy showed that there were two complementary fluorescence regions on posterior head of the thawed bovine spermatozoa.One was adjacent to the equatorial segment and the other adjacent to the spermatozoon tail.They had different membrane proteins on two regions.The mAb to sp18 antigen was bound primarily to the region adjacent to the equatorial segment.Conclusion The posterior head of bovine spermatozoa divided into sp18-rich region adjacent to the equatorial segment and sp18-free region adjacent to the tail.There was no effect of ultrasonic treatment on membrance proteins on sp18-rich region and the membrane proteins on sp18-free region were easily to loss during acrosome reaction.
, 百拇医药
【Key words】 Spermatozoa;sp18-rich region;sp18-free region;Bovine
哺乳类精子头从赤道板处分为顶体区(头前部)和顶体后区(头后部)两部分。精子质膜的扩散屏障(barriers to diffusion)将与受精有关的功能性膜蛋白限定在特定的质膜区域[1]。受精时,头后部具有透明质酸酶活性的膜蛋白PH-20协助精子穿透卵丘细胞层[2]后,头前部[3~5]和/或头后部[6]膜蛋白识别透明带ZP3糖蛋白并与透明带发生两次结合过程[7,8],其间,ZP3糖蛋白诱导精子发生顶体反应[9];穿过透明带的顶体反应后精子进而依靠头后部fertilin膜蛋白与卵母细胞质膜发生识别和融合[8,10,11],最终完成受精过程。精子膜蛋白与卵外基质层(卵丘细胞层和透明带)和卵母细胞质膜的相互关系,已经较为清楚,但有一定的种间区别,有待于深入研究。由于已知的精子表面分子的不对称分布与其功能相对应,因此,对精子特殊区域质膜蛋白的认识,可以更好的理解不同区域的膜蛋白在受精时的作用。本研究初步探讨了牛精子头后部质膜的分区,为进一步研究其膜蛋白的功能奠定基础。
, 百拇医药
材料和方法
1.材料
牛鲜精液购自北京市种公牛站,免疫用新西兰公兔购自中国农业大学种兔场;6周龄Balb/c系小鼠购自中国医学科学院,预饲养2周后,进行免疫实验。
2.顶体反应
大量新鲜的牛精液用Brackett-Olphant(BO)液充分洗涤3次(4℃,12 000g,5 min)后,重新用BO液(+10mmol/L咖啡因)悬浮至106/ml,加入钙离子载体4-溴-A23187(Sigma),终浓度为1μmol/L,37.5℃,5%CO2孵育2h后,4℃离心(400g,10min)回收顶体反应后精子。
3.精子头的制备
, 百拇医药
用PBS(pH7.4)将顶体反应后精子重悬至105~106/ml,移至50ml烧杯中,然后将烧杯置于盛水的超声波清洗槽(TP-250超声波清洗机,北京天鹏电子新技术有限公司),水浴超声1~2min,镜检约99%的精子头、尾从颈部断开即可,PBS离心洗涤(4℃,200g,5min)4~5次,得到的沉淀即为精子头。
4.抗体的制备
充分洗涤的顶体反应后牛精子与等量弗氏完全佐剂(Freund adjuvant,Gibco)混匀后免疫4只8周龄Balb/c系母鼠(0.2ml/只,108ml,腹腔免疫);另外用低渗处理的顶体反应后牛精子头(10mmol/L Tris-HCl,(pH7.4)+100mg/L苯*****溶液稀释至105ml后,冰浴轻摇30min;4℃,400g,10min离心回收)与等量弗氏完全佐剂混匀后分别免疫12只8周龄Balb/c系母鼠(0.2ml/只,108ml,腹腔免疫)和4只新西兰公兔(1ml/只,1010ml,皮下免疫)。参照常规方法,4周后用一半体积的相同处理的精子样品(与弗氏不完全佐剂混匀)强化免疫,以后每2周强化免疫1次,连续强化免疫3次后采血,抗血清用饱和硫酸铵沉淀后透析,获得粗提IgG,ELISA方法检测抗体效价。
, http://www.100md.com
5.免疫组织化学定位
解冻牛精液用PBS离心(4℃,400g,5min)洗涤3次,重新稀释(105/ml)并悬浮至含3%BSA的PBST溶液(PBS,0.05% Tween 20)中,室温封闭1h,PBST洗涤3次,精子重悬至1抗溶液中(分别为兔抗牛精子头IgG溶液、鼠抗牛精子(头)IgG或我们以前制备的抗牛精子sp18族膜蛋白单克隆抗体[12]),室温反应1h;PBST和PBS各洗3次并悬浮至PBS溶液中,涂片后用共聚焦显微镜(confocal microscope,Leica)观察。
结 果
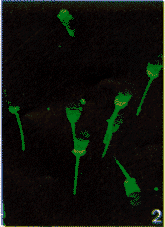
分别用免疫动物的IgG定位抗原发现,其中15只鼠和4只兔的抗体均结合的牛精子头后部紧邻赤道板的质膜区域和尾前段质膜上(图1),表明这两个部位存在相同的抗源,而且非常稳定;另外一只用顶体反应后牛精子免疫鼠的抗体不与上述部位结合,而是特异地与紧邻精子尾段的头后部质膜区域(图2)结合,表明这是一个特殊的区域,该部位正好介于紧邻赤道板的质膜区域和尾段之间。这一结果表明,牛精子头后部质膜成分也存在不对称性分布,依据膜成分的不同,其头后部质膜存在两个不同的区域,即紧邻赤道板和紧邻尾段的两个区域,其中后一区域的质膜蛋白非常特殊,在洗涤和顶体反应过程中极易丢失或者扩散,对进一步的分离和纯化工作带来了一定的难度;相反,前一质膜区域上的膜蛋白较稳定,经过顶体反应和洗涤、水浴超声的处理后,仍然位于质膜表面,可以用本研究介绍的方法进行初步分离。利用我们以前制备的抗牛精子sp18族膜蛋白(包括18,16和14kDa3种成分)的单克隆抗体[12](anti-sp18 mAb)进行该蛋白的定位时发现,sp18族膜蛋白为紧邻赤道板区域的主要膜蛋白(图3)。因此,我们将该部位称为sp18质膜区域(sp18-rich region,图1,3),而将紧邻尾段区域的头后部质膜称为无sp18质膜区域(sp18-free region,图2)。

, http://www.100md.com
图1~3 抗牛精子抗体对牛精子头后部膜蛋白的间接免疫组织化学分析
一抗为:图1.兔抗牛精子头IgG;图2.鼠抗牛精子IgG;图3.抗牛精子sp18单克隆抗体
Fig.1 Localization of the antigens on posterior head of bull sperm by indirect immunofluorescence Fig.1:Rabbit anti-bull acrosome-reacted sperm head IgG;Fig.2:Mouse anti-bull acrosome-reacted sperm IgG;Fig.3:Monoclonal anti-bull sp18 antibody.FITC-conjugated sheep anti-rabbit IgG(A),and sheep anti-mouse IgG(B and C)were used to detect anti-sperm IgG bound on bull sperm membrane.(× 1000,TCS-NT Laser Confocal Microscope,Leica).
, 百拇医药
讨 论
目前,对牛精子头后部蛋白的研究较少,本实验利用A23187诱导顶体反应和低渗溶液处理,去除了头前部质膜蛋白和顶体内容物的影响,并且使一些贮存在其他部位的功能性膜蛋白迁移到头后部质膜上作为免疫原,以便得到针对头后部膜蛋白的抗体,为专门研究这些蛋白的迁移及其功能奠定基础。对于实验动物的精子来说,位于不同质膜区域的功能蛋白在精子穿透卵丘细胞层[2]、识别和结合透明带[3~6,13]、与卵母细胞质膜融合[8,10]等不同阶段中行使作用。这些膜蛋白大都经过了附睾成熟加工[14]和顶体反应时的迁移[1,5],这种加工和迁移机理可能是精子对功能蛋白局部浓度和活性的一种贮存和调节方式。因此,探讨精子表面分子的不对称分布,可以更好的理解不同区域膜蛋白在受精过程中的作用。本研究初步发现牛精子头后部质膜分子也存在不对称分布,而且sp18质膜区域和尾前段储存有相同的膜蛋白(图1);而抗sp18族膜蛋白的单克隆抗体只与sp18质膜区域结合,不与精子尾前段结合(图3),提示这两个部位的膜蛋白又存在差异,可能是立体结构不同,或者单抗的亲和力较低或尾段抗原决定簇不易暴露。
, http://www.100md.com
对豚鼠精子的研究发现,紧邻赤道板区域的功能性蛋白非常稳定,其中PH-20糖蛋白被磷酸肌醇锚定在头后部质膜上[1],顶体反应前,PH-20的侧向迁移受到严格的限制[9],其氨基端肽链具有透明质酸酶的作用,可以消化卵丘细胞层[2,13];一旦发生顶体反应,PH-20快速地迁移到暴露在外的顶体内膜上[8],其羧基肽链可能参与精子与透明带的第2次结合过程[8,13];具有融合功能的fertilin糖蛋白则被其跨膜部分[10]固定在头后部质膜上[8,10,11];与之类似,sp18质膜区域的稳定性也正是sp18膜蛋白参与受精所要求的[14];相反,无sp18质膜区域上的膜蛋白在顶体反应和洗涤过程中容易丢失,对其功能的研究有一定的困难,但是,依据我们的实验观察,外源DNA极易附着到兔精子表面紧邻尾段的质膜区域上(未发表)。虽然无sp18质膜区域的膜蛋白没有功能蛋白必须的稳定性,但其蛋白通道也可能与外源基因进入精子细胞的过程密切相关。本研究对精子头后部质膜区域的划分,为进一步探讨两个质膜区域的膜蛋白功能奠定了基础。
, http://www.100md.com
* 现在军事医学科学院生物工程研究所工作,北京 100071
参考文献
[1]Phelps BM,Primakoff P,Koppel DE,et al.Restricted lateral diffusion of pH-20,a PI anchored sperm membrane protein.Science,1988,240(4860):1780
[2]Lin Y,Mahan K,Lathop WF,et al.A hyaluronidase activity of the sperm plasma membrane protein PH-20 enables sperm to penetrate the cumulus cell layer surrounding the egg.J Cell Biol,1994,125(5):1157
, 百拇医药
[3]Leyton L.Saling P.95kD sperm proteins bind ZP3 and serve as tyrosine kinase substrates in response to zona pellucida.Cell,1989,57(7):1123
[4]Cheng A,Lee T,Palacios M,et al.Sperm-egg recognition in the mouse:characterization of sp56,sperm protein having specific affinity for ZP3.J Cell Biol,1994,125(4):867
[5]Miller DJ,Macek MB,Shur BD.Complementarity between sperm surface β-1,4-galactosyl transferase and egg-coat ZP3 mediates sperm-egg binding. Nature, 1992, 57(6379):589
, 百拇医药
[6]Zhu XL,Naz PK.Fertilization antigen-1:cDNA cloning,testis-specific expression,and immunocontraceptive effects.Proc Natl Acad Sci USA,1997,94(9):4704
[7]Snell WJ,White JM.The molecules of mammalian fertilization. Cell,1996,85(5):629
[8]Myles DG,Primakoff P.Why did the sperm cross the cumulus?To get to the oocyte.Functions of the sperm surface proteins PH-20 and fertilin in arriving at,and fusing with, the egg.Biol Reprod,1997,56(2):320
, 百拇医药
[9]Leton L,Saling P.Evidence that aggregation of mouse sperm receptors by ZP3 triggers the acrosome reaction.J Cell Biol,1989,108(6):2163
[10]Blobel CP,Wolfsberg TG,Turck CW,et al.A potential fusion peptide and an integrin ligand domanin in a protein active in sperm-egg fusion.Nature,1992,356(6366):248
[11]Myles DG.Molecular mechanisms of sperm-egg membrane binding and fusion in mammal.Dev Biol.1993,158(1):35
, http://www.100md.com
[12]Gou KM,Li Y,An XR,et al.Production of anti-bull sperm monoclonal antibody:sp18.In:Proceedings of International Conference on Animal Biotechnology.Beijing:International Academic Publishers,1997:325-328
[13]Hunnicutt GR,Primakoff P,Myles DG.Sperm surface protein PH-20 is bifunctional:One activity is a hyaluronidase and a second,distinct activity is required in secondary sperm-zona binding.Biol Reprod,1996,55(1):80
[14]Gou KM,Shang LJ,An XR,et al.Extraction of sp18 family membrane proteins on posterior head of bull sperm and the effect of anti-sp18 IgG on sperm motility and murine in vitro fertilization.Anim Biotech,1998,9(2):149, 百拇医药(苟克勉*安晓荣**尚丽娟**李迎 张忠诚 陈永福**)
单位:苟克勉*安晓荣* *尚丽娟* *李迎 张忠诚 陈永福* * 中国农业大学动物科技学院* *农业生物技术国家重点实验室,北京 100094
关键词:精子;sp18质膜区域;无sp18质膜区域;牛
解剖学报990212
【摘要】 目的 检测牛精子头后部存在的不同质膜区域。 方法 先用钙离子载体A23187诱导精子发生顶体反应,然后用水浴超声波和低速离心法分离得到纯牛精子头。直接用顶体反应后精子和低渗处理的顶体反应后精子头免疫Balb/c母鼠和新西兰公兔,制备抗牛精子抗体,并结合以前制备的抗牛精子sp18单克隆抗体进行间接免疫组织化学分析。 结果 牛精子头后部质膜表面存在两个位置互补的荧光区域,即紧邻赤道板和紧邻尾段的荧光区域:前一区域表面稳定存在的主要是sp18族膜蛋白,后者的膜蛋白在顶体反应和洗涤时易解离。 结论 依据膜蛋白成分的差异,牛精子头后部质膜可以划分为紧邻赤道板的sp18质膜区域(sp18-rich region)和紧邻尾段的无sp18质膜区域(sp18-free region)。
, http://www.100md.com
TWO REGIONS ON POSTERIOR HEAD OF BULL SPERMATOZOA
Gou KemianΔ,An Xiaorong*,Shang Lijuan*,Li Ying,Zhang Zhongcheng,Chen Yongfu*
(College of Animal Science and Technology,* National Laboratory for Agrobiotechnology,China Agricultural University,Beijing)
【Abstract】 Objective To study different domains on posterior head of bull spermatozoa.Methods Acrosome-reacted bovine spermatozoa heads(A23187-induced)were separated from their tails with ultrasonic treatment and centrifugation.Anti-bovine spermatozoa IgG was produced by immunizing Balb/c mice or rabbit with acrosome-reacted bovine spermatozoon or hypotonically treated acrosome-reacted bovine spermatozoa heads.Results Indirect immunofluorescence microscopy showed that there were two complementary fluorescence regions on posterior head of the thawed bovine spermatozoa.One was adjacent to the equatorial segment and the other adjacent to the spermatozoon tail.They had different membrane proteins on two regions.The mAb to sp18 antigen was bound primarily to the region adjacent to the equatorial segment.Conclusion The posterior head of bovine spermatozoa divided into sp18-rich region adjacent to the equatorial segment and sp18-free region adjacent to the tail.There was no effect of ultrasonic treatment on membrance proteins on sp18-rich region and the membrane proteins on sp18-free region were easily to loss during acrosome reaction.
, 百拇医药
【Key words】 Spermatozoa;sp18-rich region;sp18-free region;Bovine
哺乳类精子头从赤道板处分为顶体区(头前部)和顶体后区(头后部)两部分。精子质膜的扩散屏障(barriers to diffusion)将与受精有关的功能性膜蛋白限定在特定的质膜区域[1]。受精时,头后部具有透明质酸酶活性的膜蛋白PH-20协助精子穿透卵丘细胞层[2]后,头前部[3~5]和/或头后部[6]膜蛋白识别透明带ZP3糖蛋白并与透明带发生两次结合过程[7,8],其间,ZP3糖蛋白诱导精子发生顶体反应[9];穿过透明带的顶体反应后精子进而依靠头后部fertilin膜蛋白与卵母细胞质膜发生识别和融合[8,10,11],最终完成受精过程。精子膜蛋白与卵外基质层(卵丘细胞层和透明带)和卵母细胞质膜的相互关系,已经较为清楚,但有一定的种间区别,有待于深入研究。由于已知的精子表面分子的不对称分布与其功能相对应,因此,对精子特殊区域质膜蛋白的认识,可以更好的理解不同区域的膜蛋白在受精时的作用。本研究初步探讨了牛精子头后部质膜的分区,为进一步研究其膜蛋白的功能奠定基础。
, 百拇医药
材料和方法
1.材料
牛鲜精液购自北京市种公牛站,免疫用新西兰公兔购自中国农业大学种兔场;6周龄Balb/c系小鼠购自中国医学科学院,预饲养2周后,进行免疫实验。
2.顶体反应
大量新鲜的牛精液用Brackett-Olphant(BO)液充分洗涤3次(4℃,12 000g,5 min)后,重新用BO液(+10mmol/L咖啡因)悬浮至106/ml,加入钙离子载体4-溴-A23187(Sigma),终浓度为1μmol/L,37.5℃,5%CO2孵育2h后,4℃离心(400g,10min)回收顶体反应后精子。
3.精子头的制备
, 百拇医药
用PBS(pH7.4)将顶体反应后精子重悬至105~106/ml,移至50ml烧杯中,然后将烧杯置于盛水的超声波清洗槽(TP-250超声波清洗机,北京天鹏电子新技术有限公司),水浴超声1~2min,镜检约99%的精子头、尾从颈部断开即可,PBS离心洗涤(4℃,200g,5min)4~5次,得到的沉淀即为精子头。
4.抗体的制备
充分洗涤的顶体反应后牛精子与等量弗氏完全佐剂(Freund adjuvant,Gibco)混匀后免疫4只8周龄Balb/c系母鼠(0.2ml/只,108ml,腹腔免疫);另外用低渗处理的顶体反应后牛精子头(10mmol/L Tris-HCl,(pH7.4)+100mg/L苯*****溶液稀释至105ml后,冰浴轻摇30min;4℃,400g,10min离心回收)与等量弗氏完全佐剂混匀后分别免疫12只8周龄Balb/c系母鼠(0.2ml/只,108ml,腹腔免疫)和4只新西兰公兔(1ml/只,1010ml,皮下免疫)。参照常规方法,4周后用一半体积的相同处理的精子样品(与弗氏不完全佐剂混匀)强化免疫,以后每2周强化免疫1次,连续强化免疫3次后采血,抗血清用饱和硫酸铵沉淀后透析,获得粗提IgG,ELISA方法检测抗体效价。
, http://www.100md.com
5.免疫组织化学定位
解冻牛精液用PBS离心(4℃,400g,5min)洗涤3次,重新稀释(105/ml)并悬浮至含3%BSA的PBST溶液(PBS,0.05% Tween 20)中,室温封闭1h,PBST洗涤3次,精子重悬至1抗溶液中(分别为兔抗牛精子头IgG溶液、鼠抗牛精子(头)IgG或我们以前制备的抗牛精子sp18族膜蛋白单克隆抗体[12]),室温反应1h;PBST和PBS各洗3次并悬浮至PBS溶液中,涂片后用共聚焦显微镜(confocal microscope,Leica)观察。
结 果
分别用免疫动物的IgG定位抗原发现,其中15只鼠和4只兔的抗体均结合的牛精子头后部紧邻赤道板的质膜区域和尾前段质膜上(图1),表明这两个部位存在相同的抗源,而且非常稳定;另外一只用顶体反应后牛精子免疫鼠的抗体不与上述部位结合,而是特异地与紧邻精子尾段的头后部质膜区域(图2)结合,表明这是一个特殊的区域,该部位正好介于紧邻赤道板的质膜区域和尾段之间。这一结果表明,牛精子头后部质膜成分也存在不对称性分布,依据膜成分的不同,其头后部质膜存在两个不同的区域,即紧邻赤道板和紧邻尾段的两个区域,其中后一区域的质膜蛋白非常特殊,在洗涤和顶体反应过程中极易丢失或者扩散,对进一步的分离和纯化工作带来了一定的难度;相反,前一质膜区域上的膜蛋白较稳定,经过顶体反应和洗涤、水浴超声的处理后,仍然位于质膜表面,可以用本研究介绍的方法进行初步分离。利用我们以前制备的抗牛精子sp18族膜蛋白(包括18,16和14kDa3种成分)的单克隆抗体[12](anti-sp18 mAb)进行该蛋白的定位时发现,sp18族膜蛋白为紧邻赤道板区域的主要膜蛋白(图3)。因此,我们将该部位称为sp18质膜区域(sp18-rich region,图1,3),而将紧邻尾段区域的头后部质膜称为无sp18质膜区域(sp18-free region,图2)。



, http://www.100md.com
图1~3 抗牛精子抗体对牛精子头后部膜蛋白的间接免疫组织化学分析
一抗为:图1.兔抗牛精子头IgG;图2.鼠抗牛精子IgG;图3.抗牛精子sp18单克隆抗体
Fig.1 Localization of the antigens on posterior head of bull sperm by indirect immunofluorescence Fig.1:Rabbit anti-bull acrosome-reacted sperm head IgG;Fig.2:Mouse anti-bull acrosome-reacted sperm IgG;Fig.3:Monoclonal anti-bull sp18 antibody.FITC-conjugated sheep anti-rabbit IgG(A),and sheep anti-mouse IgG(B and C)were used to detect anti-sperm IgG bound on bull sperm membrane.(× 1000,TCS-NT Laser Confocal Microscope,Leica).
, 百拇医药
讨 论
目前,对牛精子头后部蛋白的研究较少,本实验利用A23187诱导顶体反应和低渗溶液处理,去除了头前部质膜蛋白和顶体内容物的影响,并且使一些贮存在其他部位的功能性膜蛋白迁移到头后部质膜上作为免疫原,以便得到针对头后部膜蛋白的抗体,为专门研究这些蛋白的迁移及其功能奠定基础。对于实验动物的精子来说,位于不同质膜区域的功能蛋白在精子穿透卵丘细胞层[2]、识别和结合透明带[3~6,13]、与卵母细胞质膜融合[8,10]等不同阶段中行使作用。这些膜蛋白大都经过了附睾成熟加工[14]和顶体反应时的迁移[1,5],这种加工和迁移机理可能是精子对功能蛋白局部浓度和活性的一种贮存和调节方式。因此,探讨精子表面分子的不对称分布,可以更好的理解不同区域膜蛋白在受精过程中的作用。本研究初步发现牛精子头后部质膜分子也存在不对称分布,而且sp18质膜区域和尾前段储存有相同的膜蛋白(图1);而抗sp18族膜蛋白的单克隆抗体只与sp18质膜区域结合,不与精子尾前段结合(图3),提示这两个部位的膜蛋白又存在差异,可能是立体结构不同,或者单抗的亲和力较低或尾段抗原决定簇不易暴露。
, http://www.100md.com
对豚鼠精子的研究发现,紧邻赤道板区域的功能性蛋白非常稳定,其中PH-20糖蛋白被磷酸肌醇锚定在头后部质膜上[1],顶体反应前,PH-20的侧向迁移受到严格的限制[9],其氨基端肽链具有透明质酸酶的作用,可以消化卵丘细胞层[2,13];一旦发生顶体反应,PH-20快速地迁移到暴露在外的顶体内膜上[8],其羧基肽链可能参与精子与透明带的第2次结合过程[8,13];具有融合功能的fertilin糖蛋白则被其跨膜部分[10]固定在头后部质膜上[8,10,11];与之类似,sp18质膜区域的稳定性也正是sp18膜蛋白参与受精所要求的[14];相反,无sp18质膜区域上的膜蛋白在顶体反应和洗涤过程中容易丢失,对其功能的研究有一定的困难,但是,依据我们的实验观察,外源DNA极易附着到兔精子表面紧邻尾段的质膜区域上(未发表)。虽然无sp18质膜区域的膜蛋白没有功能蛋白必须的稳定性,但其蛋白通道也可能与外源基因进入精子细胞的过程密切相关。本研究对精子头后部质膜区域的划分,为进一步探讨两个质膜区域的膜蛋白功能奠定了基础。
, http://www.100md.com
* 现在军事医学科学院生物工程研究所工作,北京 100071
参考文献
[1]Phelps BM,Primakoff P,Koppel DE,et al.Restricted lateral diffusion of pH-20,a PI anchored sperm membrane protein.Science,1988,240(4860):1780
[2]Lin Y,Mahan K,Lathop WF,et al.A hyaluronidase activity of the sperm plasma membrane protein PH-20 enables sperm to penetrate the cumulus cell layer surrounding the egg.J Cell Biol,1994,125(5):1157
, 百拇医药
[3]Leyton L.Saling P.95kD sperm proteins bind ZP3 and serve as tyrosine kinase substrates in response to zona pellucida.Cell,1989,57(7):1123
[4]Cheng A,Lee T,Palacios M,et al.Sperm-egg recognition in the mouse:characterization of sp56,sperm protein having specific affinity for ZP3.J Cell Biol,1994,125(4):867
[5]Miller DJ,Macek MB,Shur BD.Complementarity between sperm surface β-1,4-galactosyl transferase and egg-coat ZP3 mediates sperm-egg binding. Nature, 1992, 57(6379):589
, 百拇医药
[6]Zhu XL,Naz PK.Fertilization antigen-1:cDNA cloning,testis-specific expression,and immunocontraceptive effects.Proc Natl Acad Sci USA,1997,94(9):4704
[7]Snell WJ,White JM.The molecules of mammalian fertilization. Cell,1996,85(5):629
[8]Myles DG,Primakoff P.Why did the sperm cross the cumulus?To get to the oocyte.Functions of the sperm surface proteins PH-20 and fertilin in arriving at,and fusing with, the egg.Biol Reprod,1997,56(2):320
, 百拇医药
[9]Leton L,Saling P.Evidence that aggregation of mouse sperm receptors by ZP3 triggers the acrosome reaction.J Cell Biol,1989,108(6):2163
[10]Blobel CP,Wolfsberg TG,Turck CW,et al.A potential fusion peptide and an integrin ligand domanin in a protein active in sperm-egg fusion.Nature,1992,356(6366):248
[11]Myles DG.Molecular mechanisms of sperm-egg membrane binding and fusion in mammal.Dev Biol.1993,158(1):35
, http://www.100md.com
[12]Gou KM,Li Y,An XR,et al.Production of anti-bull sperm monoclonal antibody:sp18.In:Proceedings of International Conference on Animal Biotechnology.Beijing:International Academic Publishers,1997:325-328
[13]Hunnicutt GR,Primakoff P,Myles DG.Sperm surface protein PH-20 is bifunctional:One activity is a hyaluronidase and a second,distinct activity is required in secondary sperm-zona binding.Biol Reprod,1996,55(1):80
[14]Gou KM,Shang LJ,An XR,et al.Extraction of sp18 family membrane proteins on posterior head of bull sperm and the effect of anti-sp18 IgG on sperm motility and murine in vitro fertilization.Anim Biotech,1998,9(2):149, 百拇医药(苟克勉*安晓荣**尚丽娟**李迎 张忠诚 陈永福**)