一种小鼠肿瘤相关膜蛋白单抗对DCS细胞生物学行为的影响
作者:段德义 顾蓓 高进 刘玉琴 赵雪梅
单位:段德义 顾蓓 高进 刘玉琴 赵雪梅 中国医学科学院 中国协和医科大学基础医学研究所,北京 100005
关键词:肿瘤;单克隆抗体;瘤细胞生物学行为
解剖学报990219
【摘要】 目的 探讨一种小鼠肿瘤相关膜蛋白在DCS细胞表达的意义。 方法 用该蛋白抗体处理DCS细胞,观察其对细胞生长速度、软琼脂克隆形成能力、粘附性、细胞运动能力、水解酶活性、侵袭性、体内转移率等生物学行为方面的影响。 结果 该抗体能抑制DCS生长速度及克隆形成能力,增强琼脂糖悬滴细胞运动能力,余未见明显作用。 结论 该细胞膜蛋白可能调控小鼠肿瘤细胞增殖能力。
EFFECTS OF A TUMOR CELL MEMBRANE PROTEIN ANTIBODY ON BIOLOGICAL BEHAVIORS OF MOUSE TUMOR CELL
, 百拇医药
Duan Deyi*, Gu Bei, Gao Jin△, Liu Yuqin, Zhao Xuemei
(School of Basic Medicine, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing)
【Abstract】 Objective To investigate the role of a tumor-associated cell membrane protein expressed in newly-established dendritic cell sarcoma(DCS) cell line. Methods After treatment of DCS cell with the rat monoclonal antibody against the protein, cell biological behaviors such as in vitro growth speed, colony-forming efficiency behaviors, adhesiveness, cell motility, lysis, in vitro invasiveness, metastatic potential were observed.Results The antibody can inhibit DCS cell growth in vitro and enhances its motility in agarose droplet, but has no effect on other biological behaviors Conclusion This membrane protein might modulate cell proliferation ability of some mouse tumors in vitro.
, 百拇医药
【Key words】 Tumor; Monoclonal antibody ; Cell biological behaviors
我们利用本室新建细胞系小鼠树突状细胞肉瘤(DCS)细胞免疫Lou/C大鼠,制备了不与小鼠正常组织起交叉反应的单克隆抗体983 D4, 其识别的抗原位于某些小鼠瘤细胞膜,分子量为38和20kD(1)。为了探讨该抗原在瘤细胞表达的意义,本实验观察了其抗体对DCS细胞生长情况、运动性、粘附性、水解酶活性、侵袭性、转移性等方面的影响。
材料和方法
本实验所用细胞DCS在以下项目观察中均分两部分进行,分别用983D4抗体和正常大鼠IgG(均40 mg/L)孵育处理。
1. 细胞生长曲线
每个小培养瓶内加入DCS细胞悬液104/ml,37℃培养,于实验第2、3、4、5、6d分别取2瓶细胞消化计数。
, http://www.100md.com
2. 3H-TdR掺入
96孔板每组各6孔加入DCS细胞悬液104/孔,37℃培养18h,每孔加入1 μCi 3H-TdR继续培养6h,收集细胞测定cpm值。
3. 软琼脂克隆形成能力
用RPMI 1640配制双层半固体琼脂培养基,于12孔培养板加入底层琼脂(0.6%)和上层琼脂(0.3%,含细胞200个/ml),37℃培养12~16d,观察克隆总数。
4. 细胞粘附性测定
6孔板内加入DCS细胞,待长满后备用。在另一6孔板中加入层粘连蛋白(laminin, LN),纤维粘连蛋白(fibronectin, FN)基质(20μg/孔),37℃孵育1h,PBS洗。然后加入DCS细胞(2×105/孔)37℃0.5h,收集未粘附细胞或粘附细胞并计数。
, http://www.100md.com
5. 细胞水解酶活性测定[2]
用615小鼠血浆、牛肌红蛋白、甘油混匀后铺于盖玻片上,乙醇固定、速干,放入6孔板,加入DCS细胞105/孔,37℃培养24h,甲醇固定,考马斯亮蓝染色,光镜观察基质水解情况。
6. 胶体金吞噬轨迹运动实验[2]
盖玻片上蛋白膜基质制备同上,放入6孔板,加入现制备的胶体金溶液,室温1h,弃溶液,10%血清培养液洗,加入DCS细胞105/孔,37℃培养24h,观察细胞清除金颗粒留下的运动轨迹。
7. 琼脂糖悬滴细胞运动实验[3]
将DCS细胞107个加入0.3ml RPMI 1640完全培养液(内含0.2%琼脂糖),滴入24孔板,4℃冷却。再加入预冷的RPMI 1640培养液。测取琼脂糖滴4个方向的直径,37℃培养24、28、72h时再分别测量每个悬滴的直径。
, 百拇医药
8. Boyden小室瘤细胞侵袭性检测[4]
Boyden小室内加满NIH 3T 3条件培养液(趋化因子),其上放置聚乙烯吡咯烷酮膜(铺有matrigel),然后加入DCS细胞(2×105),37℃培养6h。拭去膜上瘤细胞,甲醇固定,HE染色,观察侵袭至膜下面的细胞数。
9. 瘤细胞小鼠体内转移实验
DCS细胞与983 D4单抗或正常大鼠 IgG 37℃下孵育1h。接种于615小鼠右侧腋部皮下(3×106细胞/只)。第10d,尾静脉注射983 D4单抗和正常大鼠 IgG各0.4mg。第26d处死动物,称瘤重,取肺组织常规制片,观察肺转移情况。
结果和讨论
1. 细胞生长速度
, http://www.100md.com
983 D4单抗对DCS细胞生长有轻度抑制作用(图1),其中以第4、5、6d作用表现明显(P<0.05)。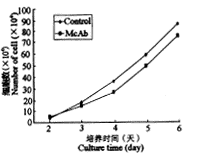
图1 983 D4单抗对细胞生长的影响
Fig. 1 Effects of McAb 983 D4 on cell growth
2.3H-TdR掺入情况
983 D4孔cpm值平均为8 563.56±605.32,对照孔为12 003.90±3 639.94。可见,单抗对DCS细胞生长有轻度抑制作用(P<0.05)。
3. 软琼脂克隆形成能力
单抗组和对照组细胞在琼脂培养基中形成的克隆数目分别为27.00±1.87和42.33±1.11。可见,单抗对克隆形成有一定的抑制作用(P<0.05)。
, http://www.100md.com
4.细胞粘附性测定结果
单抗组和对照组在单层DCS细胞上未粘附细胞分别为7.31×104和5.88×104/ml(P>0.05),在LN基质上粘附细胞数分别为9.63×104和7.13×104/ml(P>0.05),在FN基质上分别为22.5×104和22.12×104/ml(P>0.05)。
5. 细胞水解酶分泌能力检测
盖玻片上蛋白基质考马斯亮蓝染色后表现为均匀蓝色,细胞水解酶分泌表现为蓝色背景下的透亮区(图2)。单抗组和对照组细胞中具有水解能力的细胞分别占33.2%和31.9%(P>0.05)
6. 胶体金吞噬轨迹运动实验
, http://www.100md.com
盖玻片蛋白膜上金颗粒大小均匀,呈黑色。细胞运动后留下没有金颗粒的不规则轨道(吞噬轨迹,图3)。单抗组和对照组细胞中具有这种运动能力的细胞分别占67.5%和69.3%(P>0.05)。
7. 琼脂糖滴运动实验结果
单抗组和对照组DCS细胞运动距离逐渐增大,琼脂滴平均直径分别从开始的1 368μm和1 278μm增加至72h的1 573.0和1 352.5μm,即分别增加35.83%和14.99%(P<0.05)。
8. Boyden室侵袭实验
Boyden室上室细胞穿过膜上matrigel至膜的下室面,其数量反映了细胞侵袭能力的大小。结果表明,单抗组和对照组每1 000μm2细胞数分别为44.7±5.8个和45.9±7.3个(P>0.05)。
, 百拇医药
9. 动物体内实验
单抗组10只动物最后存活6只,中途死亡4只(其肺均未见转移灶形成)。对照组11只动物中途死亡1只。两组动物于第26d处死,其瘤重分别为4.0±2.70g和3.12±1.18g(P>0.05),肺组织转移率均为50%。
图2 DCS细胞对蛋白基质的水解空斑(↑)形成Fig. 2 Transparent lytic opaque formation of DCS cell on protein substrata
图3 DCS细胞在胶体金颗粒上的运动轨迹()Fig. 3 Phagokinetic tracks of DCS cell on colloid gold particle substrata
, http://www.100md.com
综上所述,983 D4单抗可以抑制细胞体外生长速度及软琼脂集落形成能力,增强琼脂糖悬滴细胞运动性能,但对细胞水解酶活性、侵袭性及体内肿瘤生长能力及转移方面均未观察到明显作用。抗体影响细胞生物学行为可能的途径:一是抗体结合抗原后阻断该抗原的某些功能[5],一是抗体结合抗原后,具有配体样功能,即能诱发该抗原的功能[6]。为了能弄清该抗原在细胞活动中的作用,我们构建了DCS细胞的表达文库并用983 D4单抗筛选后得到了1 000bp,1 100bp两个cDNA片段,这为构建其表达载体及反义载体,观察转染后细胞生物学行为的改变,探讨其抗原性质打下了基础。
* 现在首都医科大学神经科学研究所工作,北京 100054
收稿 1998-03 修回 1998-07
参考文献
[1]段德义,赵雪梅,高进,等.DCS细胞肿瘤相关膜蛋白大鼠单克隆抗体的制备及鉴定.中华微生物学和免疫学杂志,1998,18(3):219
, http://www.100md.com
[2]李存玺,顾蓓,高进.癌细胞粘附、位移和水解酶活性综合测定方法的建立.中华病理学杂志,1996,25(5):310
[3]Varani J, Orr W, Ward PA. A comparison of the migration of normal and malignant cells in two assay systems. Am J Pathol, 1978,90(1):159
[4]Albani A, Iwamoto Y, Kleinman HK, et al. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res, 1987,47(5):3239
[5]Vitetta ES, Uhr JW. Monoclonal antibody as agonists: an expanded role for their use in cancer therapy. Cancer Res, 1994,54(20):5301, http://www.100md.com
单位:段德义 顾蓓 高进 刘玉琴 赵雪梅 中国医学科学院 中国协和医科大学基础医学研究所,北京 100005
关键词:肿瘤;单克隆抗体;瘤细胞生物学行为
解剖学报990219
【摘要】 目的 探讨一种小鼠肿瘤相关膜蛋白在DCS细胞表达的意义。 方法 用该蛋白抗体处理DCS细胞,观察其对细胞生长速度、软琼脂克隆形成能力、粘附性、细胞运动能力、水解酶活性、侵袭性、体内转移率等生物学行为方面的影响。 结果 该抗体能抑制DCS生长速度及克隆形成能力,增强琼脂糖悬滴细胞运动能力,余未见明显作用。 结论 该细胞膜蛋白可能调控小鼠肿瘤细胞增殖能力。
EFFECTS OF A TUMOR CELL MEMBRANE PROTEIN ANTIBODY ON BIOLOGICAL BEHAVIORS OF MOUSE TUMOR CELL
, 百拇医药
Duan Deyi*, Gu Bei, Gao Jin△, Liu Yuqin, Zhao Xuemei
(School of Basic Medicine, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing)
【Abstract】 Objective To investigate the role of a tumor-associated cell membrane protein expressed in newly-established dendritic cell sarcoma(DCS) cell line. Methods After treatment of DCS cell with the rat monoclonal antibody against the protein, cell biological behaviors such as in vitro growth speed, colony-forming efficiency behaviors, adhesiveness, cell motility, lysis, in vitro invasiveness, metastatic potential were observed.Results The antibody can inhibit DCS cell growth in vitro and enhances its motility in agarose droplet, but has no effect on other biological behaviors Conclusion This membrane protein might modulate cell proliferation ability of some mouse tumors in vitro.
, 百拇医药
【Key words】 Tumor; Monoclonal antibody ; Cell biological behaviors
我们利用本室新建细胞系小鼠树突状细胞肉瘤(DCS)细胞免疫Lou/C大鼠,制备了不与小鼠正常组织起交叉反应的单克隆抗体983 D4, 其识别的抗原位于某些小鼠瘤细胞膜,分子量为38和20kD(1)。为了探讨该抗原在瘤细胞表达的意义,本实验观察了其抗体对DCS细胞生长情况、运动性、粘附性、水解酶活性、侵袭性、转移性等方面的影响。
材料和方法
本实验所用细胞DCS在以下项目观察中均分两部分进行,分别用983D4抗体和正常大鼠IgG(均40 mg/L)孵育处理。
1. 细胞生长曲线
每个小培养瓶内加入DCS细胞悬液104/ml,37℃培养,于实验第2、3、4、5、6d分别取2瓶细胞消化计数。
, http://www.100md.com
2. 3H-TdR掺入
96孔板每组各6孔加入DCS细胞悬液104/孔,37℃培养18h,每孔加入1 μCi 3H-TdR继续培养6h,收集细胞测定cpm值。
3. 软琼脂克隆形成能力
用RPMI 1640配制双层半固体琼脂培养基,于12孔培养板加入底层琼脂(0.6%)和上层琼脂(0.3%,含细胞200个/ml),37℃培养12~16d,观察克隆总数。
4. 细胞粘附性测定
6孔板内加入DCS细胞,待长满后备用。在另一6孔板中加入层粘连蛋白(laminin, LN),纤维粘连蛋白(fibronectin, FN)基质(20μg/孔),37℃孵育1h,PBS洗。然后加入DCS细胞(2×105/孔)37℃0.5h,收集未粘附细胞或粘附细胞并计数。
, http://www.100md.com
5. 细胞水解酶活性测定[2]
用615小鼠血浆、牛肌红蛋白、甘油混匀后铺于盖玻片上,乙醇固定、速干,放入6孔板,加入DCS细胞105/孔,37℃培养24h,甲醇固定,考马斯亮蓝染色,光镜观察基质水解情况。
6. 胶体金吞噬轨迹运动实验[2]
盖玻片上蛋白膜基质制备同上,放入6孔板,加入现制备的胶体金溶液,室温1h,弃溶液,10%血清培养液洗,加入DCS细胞105/孔,37℃培养24h,观察细胞清除金颗粒留下的运动轨迹。
7. 琼脂糖悬滴细胞运动实验[3]
将DCS细胞107个加入0.3ml RPMI 1640完全培养液(内含0.2%琼脂糖),滴入24孔板,4℃冷却。再加入预冷的RPMI 1640培养液。测取琼脂糖滴4个方向的直径,37℃培养24、28、72h时再分别测量每个悬滴的直径。
, 百拇医药
8. Boyden小室瘤细胞侵袭性检测[4]
Boyden小室内加满NIH 3T 3条件培养液(趋化因子),其上放置聚乙烯吡咯烷酮膜(铺有matrigel),然后加入DCS细胞(2×105),37℃培养6h。拭去膜上瘤细胞,甲醇固定,HE染色,观察侵袭至膜下面的细胞数。
9. 瘤细胞小鼠体内转移实验
DCS细胞与983 D4单抗或正常大鼠 IgG 37℃下孵育1h。接种于615小鼠右侧腋部皮下(3×106细胞/只)。第10d,尾静脉注射983 D4单抗和正常大鼠 IgG各0.4mg。第26d处死动物,称瘤重,取肺组织常规制片,观察肺转移情况。
结果和讨论
1. 细胞生长速度
, http://www.100md.com
983 D4单抗对DCS细胞生长有轻度抑制作用(图1),其中以第4、5、6d作用表现明显(P<0.05)。

图1 983 D4单抗对细胞生长的影响
Fig. 1 Effects of McAb 983 D4 on cell growth
2.3H-TdR掺入情况
983 D4孔cpm值平均为8 563.56±605.32,对照孔为12 003.90±3 639.94。可见,单抗对DCS细胞生长有轻度抑制作用(P<0.05)。
3. 软琼脂克隆形成能力
单抗组和对照组细胞在琼脂培养基中形成的克隆数目分别为27.00±1.87和42.33±1.11。可见,单抗对克隆形成有一定的抑制作用(P<0.05)。
, http://www.100md.com
4.细胞粘附性测定结果
单抗组和对照组在单层DCS细胞上未粘附细胞分别为7.31×104和5.88×104/ml(P>0.05),在LN基质上粘附细胞数分别为9.63×104和7.13×104/ml(P>0.05),在FN基质上分别为22.5×104和22.12×104/ml(P>0.05)。
5. 细胞水解酶分泌能力检测
盖玻片上蛋白基质考马斯亮蓝染色后表现为均匀蓝色,细胞水解酶分泌表现为蓝色背景下的透亮区(图2)。单抗组和对照组细胞中具有水解能力的细胞分别占33.2%和31.9%(P>0.05)
6. 胶体金吞噬轨迹运动实验
, http://www.100md.com
盖玻片蛋白膜上金颗粒大小均匀,呈黑色。细胞运动后留下没有金颗粒的不规则轨道(吞噬轨迹,图3)。单抗组和对照组细胞中具有这种运动能力的细胞分别占67.5%和69.3%(P>0.05)。
7. 琼脂糖滴运动实验结果
单抗组和对照组DCS细胞运动距离逐渐增大,琼脂滴平均直径分别从开始的1 368μm和1 278μm增加至72h的1 573.0和1 352.5μm,即分别增加35.83%和14.99%(P<0.05)。
8. Boyden室侵袭实验
Boyden室上室细胞穿过膜上matrigel至膜的下室面,其数量反映了细胞侵袭能力的大小。结果表明,单抗组和对照组每1 000μm2细胞数分别为44.7±5.8个和45.9±7.3个(P>0.05)。
, 百拇医药
9. 动物体内实验
单抗组10只动物最后存活6只,中途死亡4只(其肺均未见转移灶形成)。对照组11只动物中途死亡1只。两组动物于第26d处死,其瘤重分别为4.0±2.70g和3.12±1.18g(P>0.05),肺组织转移率均为50%。

图2 DCS细胞对蛋白基质的水解空斑(↑)形成Fig. 2 Transparent lytic opaque formation of DCS cell on protein substrata

图3 DCS细胞在胶体金颗粒上的运动轨迹()Fig. 3 Phagokinetic tracks of DCS cell on colloid gold particle substrata
, http://www.100md.com
综上所述,983 D4单抗可以抑制细胞体外生长速度及软琼脂集落形成能力,增强琼脂糖悬滴细胞运动性能,但对细胞水解酶活性、侵袭性及体内肿瘤生长能力及转移方面均未观察到明显作用。抗体影响细胞生物学行为可能的途径:一是抗体结合抗原后阻断该抗原的某些功能[5],一是抗体结合抗原后,具有配体样功能,即能诱发该抗原的功能[6]。为了能弄清该抗原在细胞活动中的作用,我们构建了DCS细胞的表达文库并用983 D4单抗筛选后得到了1 000bp,1 100bp两个cDNA片段,这为构建其表达载体及反义载体,观察转染后细胞生物学行为的改变,探讨其抗原性质打下了基础。
* 现在首都医科大学神经科学研究所工作,北京 100054
收稿 1998-03 修回 1998-07
参考文献
[1]段德义,赵雪梅,高进,等.DCS细胞肿瘤相关膜蛋白大鼠单克隆抗体的制备及鉴定.中华微生物学和免疫学杂志,1998,18(3):219
, http://www.100md.com
[2]李存玺,顾蓓,高进.癌细胞粘附、位移和水解酶活性综合测定方法的建立.中华病理学杂志,1996,25(5):310
[3]Varani J, Orr W, Ward PA. A comparison of the migration of normal and malignant cells in two assay systems. Am J Pathol, 1978,90(1):159
[4]Albani A, Iwamoto Y, Kleinman HK, et al. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res, 1987,47(5):3239
[5]Vitetta ES, Uhr JW. Monoclonal antibody as agonists: an expanded role for their use in cancer therapy. Cancer Res, 1994,54(20):5301, http://www.100md.com