FSH受体的特性和表达的调控*
作者:陈雪雁 陈克铨 陈实平
单位:陈雪雁 陈克铨 陈实平(中国医学科学院 中国协和医科大学基础医学研究所,北京 100005)
关键词:
解剖学报990326 CHARACTERIZATION EXPRESSION AND REGULATION
OF FSH RECEPTOR
卵泡刺激素(FSH)是垂体分泌的一种糖蛋白激素,主要作用是促进和维持正常的性腺发育和生殖功能。FSH的生理功能是通过分布于性腺的特异性受体所介导的。支持细胞(sertoli cell)和颗粒细胞(granulosa cell)分别是FSH作用于睾丸和卵巢的靶细胞。FSH的结构和生理功能虽然已被广泛的研究和阐明,但其作用的分子机制,尤其是在促进配子产生过程中的作用机制尚不清楚。因此,研究FSH受体(FSHR)的分子结构和功能、以及FSHR的基因表达与调控,进而阐明对配子形成的意义,已经成为阐明FSH功能的关键。
, 百拇医药
1. FSHR的生化特征
70年代早期,Means和Vaitukaitis[1]等首先证实大鼠睾丸的曲细精管具有FSH的特异结合位点,与细胞膜相关联。从大鼠和牛睾丸中分离的FSHR具有两种类型的FSH结合位点:一种为高亲和力(KD=7×10-11mol/L)和低结合容量(B0=100fmol/mg),另一种为低亲和力(KD=2.6×10-9mol/L)和高结合容量(B0=630fmol/mg)[2]。低亲合力的成分最终被证明是一种人工假象,在经过纯化的受体分中,只有高亲和力的结合位点存在。
关于FSHR的精确定位问题,放射自显影的研究表明,125I-标记的FSH选择性地定位于支持细胞表面[3]。高渗固定造成曲细精管基底室的细胞收缩后,精原细胞上也可见FSH结合位点,但FSHR的精原细胞定位从未被证实过。最近,利用抗人FSHR的抗体进行的免疫组织化学研究显示颗粒细胞膜和围绕精原细胞的支持细胞基底部有均一着色[4]。睾丸间质中的小血管内皮细胞也有染色,这是否与运输大分子糖蛋白激素至靶细胞有关仍需进一步证实。
, 百拇医药
对从牛睾丸中提纯的FSHR的研究表明,FSHR是一种由寡聚糖蛋白构成的膜受体,4个单体由二硫键连接。FSH与受体的相互作用部分依赖于膜磷脂的存在,通过膜磷脂稳定蛋白构型和介导信号传递;同时也依赖于二硫键的组合,稳定受体构型[5]。
2. FSHR的分子结构
2.1 FSHR的克隆:1989年Vassart[6]研究小组在克隆人促甲状腺激素(TSH)受体时首次报道了FSHR DNA片段的序列。这一片段作为探针已经用于检测FSHR mRNA的合成部位和表达水平。研究者们利用Northern印迹杂交发现在睾丸和卵巢中含有能与FSHR DNA序列杂交的2.6kb和4.5kb的两种主要转录产物[7]。其他组织则为阴性。也有报道认为卵巢mRNA中含有两种FSHR的主要转录产物,7.0kb和2.5kb或5.0kb和2.6kb[8]。
, http://www.100md.com
对FSHR cDNA序列的测定和分析显示,在大部分种属中它是一个2 085个核苷酸的开放阅读框架[9]。曾报道过几种不同的人FSHR序列,它们在一些核苷酸位置上有差异,在某些情况下会导致氨基酸的替代。有些序列的差异是由于测序不准确造成的,另一些则是由于它们分别来源于睾丸和卵巢组织。因此,人们推测这些差异与性别特异性变化有关。现在已经肯定,FSHR cDNA中的核苷酸替代是由于FSHR基因的两个多态性位点造成的[10]。
2.2 FSHR的分子结构:人FSHR蛋白由695个氨基酸组成[11],其中氨基端17个氨基酸为疏水性信号肽。紧接着信号肽的是349个氨基酸组成的亲水性结构域,构成FSHR的细胞外结构。接着是264个氨基酸构成的跨膜区,由7个跨膜的α螺旋组成。胞内区是65个氨基酸组成的羧基末端。
FSHR结构的模式图如下: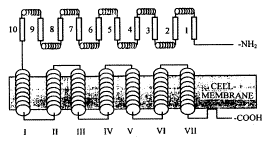
, http://www.100md.com
FSH受体的模式图。膜外区由若干个亮氨酸-精氨酸-精氨酸序列组成。它们形成交替的β片层(阿拉伯数字表示)和α螺旋结构。距膜区由7个跨过细胞膜的疏水段组成(罗马数字表示),其间以细胞内环和细胞外环相连。
Schematic model of the FSH receptor. The extracellular domain consists of several LRRs that are made up of alternating β-sheets and α-helices (indicated by the coils). The transmembrane domain consists of seven hydrophobic segments (Roman numerals) spanning the cell membrane and connected by intra-and extracellular loops. Within the intracellular domain a putative fourth intracellular loop is depicted.
, http://www.100md.com
依据种属不同,由cDNA序列计算出的成熟受体蛋白的分子量在75~76.5kD范围内。
2.2.1 胞外区:FSHR的胞外区表现出一些重要的一级和二级结构特征。它包括至少10个亮氨酸丰富的重复单位(LPR),每个约有24个氨基酸残基[12]。与FSH产生特异结合的位点位于LPR5-LPR10之间。由于它们的两性特征,这些重复区可能具有与激素和跨膜区相互作用的双重性质。FSHR的胞外区中还存在8个保守的半胱氨酸残基,与膜外结构域三级结构的整合有关。此外,这一结构域存在3个保守的N连接的糖基化位点[12]。尽管过去认为FSHR的糖基化方式只可能影响激素的结合,最近的研究证实受体蛋白的正确折迭和与膜的交通也与糖基化有关[13]。
2.2.2 跨膜区:7个α螺旋构成的跨膜结构是G蛋白耦联受体家族的特征性基序(motif),这个家族的每个成员都具有7个疏水性片段(20~25个氨基酸组成)形成的跨膜α螺旋,由胞外环和胞内环交替连接。FSHR在第1和第2个胞外环中(442位和517位)有两个高度保守的半胱氨酸残基,形成分子间二硫桥,稳定蛋白质构型[14]。位于466~468位的保守的氨基酸三联体基序(Glu-Arg-Tyr)与受体和G蛋白的相互作用有关。对FSHR、TSH受体和LH受体跨膜区的比较显示,第2、3、4跨膜区的氨基酸序列高度保守,其他跨膜区保守性低;决定膜蛋白正确插入的脯氨酸残基在第4、6、7跨膜区同源性高;第一胞内环氨基酸序列同源性高;第3胞内环较短,3种受体在这一区同源性低,但其中羧基端的8个氨基酸残基是保守的,可能与激素受体激活G蛋白的相应方式有关。
, 百拇医药
2.2.3 C-末端区:糖蛋白激素受体的胞内区只在氨基末端表现出一些保守性(FSHR的631~659位氨基酸),而且不同种属的C-末端区变异较大。这一区域富含丝氨酸和苏氨酸残基,是潜在的磷酸化位点。这些氨基酸残基的磷酸化具有调节FSHR活性的功能[12]。第4胞内环可能与受体耦联和信号传导的调节有关。
3. FSHR的基因
3.1 FSHR基因的结构:研究者们利用cDNA或基因组探针通过荧光原位杂交和连锁分析已经完成了FSHR基因的染色体作图。人的FSHR基因位于2号染色体短臂2区1带[15]。通过基因组克隆的限制性分析和PCR产物的长度确定,研究者们证实FSHR基因是一个很大的单拷贝基因,在人类长54kb[16]。它包括10个外显子和9个内含子。前9个外显子相对较少,编码胞外结构域氨基端的氨基酸。编码胞外结构域的羧基端,跨膜区和胞内区的基因位于较大的第10外显子中[17]。内含子的长度差别很大,最小的第7内含子长108bp,最大的第1内含子长15kb。
, 百拇医药
3.2 FSHR基因的5’端序列
FSHR基因的表达是高度组织特异性的,且依赖于不同激素的刺激。FSHR mRNA转录水平的调控是与基因启动子区和上游调控序列的结构相关的。RNA酶保护实验和引物延伸分析证实FSHR基因的转录起始位点在人位于-99[18],而大鼠FSHR基因具有两个主要的转录起始位点,分别位于-80和-98[16]。人FSHR基因的转录起始位点在睾丸和卵巢中是相同的,这就排除了通过不同的转录起始位点对基因表达进行性别特异性调节的可能性。
FSHR基因的5’端序列与管家基因的启动子区有类似结构[19]。这些启动子区都有多个转录起始位点,无TATA盒和CCAAT盒等启动子元件,以及高密度GC碱基对。但对比同一家族的TSH受体和LH受体,它的GC碱基对的含量较低。
利用FSHR基因5’端不同长度的DNA片段与报告基因构建融合基因,并转染不同种类的细胞使之表达进行启动子活性的研究,结果发现5’端起始位点前的280bpDNA片段可使基因有最高的转录活性[20],且不具有细胞特异性。DNA构建体增长则转录活性明显降低,提示了上游抑制元件的存在。5’端起始位点前5kb的片段可使其下游的基因只在睾丸或卵巢细胞中选择性表达。启动子区的甲基化可能参与不表达FSHR细胞类型中的基因表达抑制作用。利用甲基化敏感的酶进行的研究显示,大鼠启动子区的甲基化与缺乏FSHRmRNA细胞的转录抑制有关[20]。但是人和小鼠的FSHR基因启动子区不含有CpG岛和甲基化位点(CCGG),说明在这些种属的转录活性调控中,甲基化事件不起主要作用。
, http://www.100md.com
4. FSHR的表达及其调控
4.1 FSHR基因的表达:在睾丸和卵巢中,人们利用Northern杂交分析检测到多种转录产物,除2.5kb的正常转录产物外[19],至少确定还有1种5~7kb的较大的转录产物和1种1.3~1.8kb的较小的转录产物存在[21]。尽管转录产物的长度差异与不同种属和不同实验方法有关,但是至少存在3种FSHR的转录产物提示这是1种非种属特异性的基因表达方式。而且在睾丸和卵巢中,转录产物的形式是相同的。
对FSHR基因表达或配子发生不同阶段的激素调控的研究表明,机体对不同转录产物的调控没有区别。非全长转录产物与全长mRNA的比值是恒定的[7]。目前认为不同的多聚腺苷酸位点和初级转录产物的不同剪接方式是形成长转录产物(5~7kb)和正常转录产物(2.5kb)的原因[22]。不同转录产物的同时表达造成了翻译过程中的竞争作用,以此来调节成熟受体和功能性受体蛋白的表达。
, 百拇医药
4.2 FSHR在睾丸中的表达
4.2.1 FSHR的定位和在发育过程中的表达:FSH结合实验证实FSH特异地与支持细胞膜上的受体结合。除Orth等[23]报道精原细胞也有FSHR外,一般认为生精细胞无FSH特异结合位点。对多种组织进行Northern印迹杂交,发在FSHR只在睾丸中表达。原位杂交实验证实在睾丸中支持细胞是唯一表达FSHR的细胞类型。这些结果说明FSHR的表达局限于性腺,且为细胞特异性。
利用FSHR的单克隆抗体,Vannier等[4]报道FSHR蛋白的表达有极性,分布于支持细胞的基底部,围绕精原细胞。他们发现FSHR也分布于睾丸间质的小血管壁上,可能通过受体介导的内吞作用从血管中将FSH输送至间质细胞(leydig cell)中。但是这种受体样结构是否具有受体活性而进行信号传导尚不清楚。
对发育睾丸中FSHR表达的研究证实,在胎龄28d(f28)的猪睾丸中即出现FSH的高亲和力结合位点[24]。在大鼠中,通过Northern印迹杂交和RT-PCR方法,在f14.5d即可检测出编码胞外区的转录产物,而全长mRNA则在f16.5d检测到[25]。这可能由于两种转录产物的转录起始时间不同。在睾丸中FSHR的出现要早于胚胎循环中较高浓度FSH的出现,而且尽管存在FSHR,胚胎睾丸对FSH的刺激仍缺乏明显的cAMP升高反应[26]。这可能由于在胚胎中信号传导系统发育不成熟或FSHR的耦联方式不同。从生理角度讲,FSHR的这种无反应性可以防止FSH刺激的精子发生过程提前发生。
, 百拇医药
Northern印迹杂交实验观察到,大鼠FSHR mRNA于出生至生后7d不断增加,生后10~20d维持不变, 生后40d开始迅速下降[27]。生后10dFSHR mRNA的增加是每个支持细胞上受体数目的增加和支持细胞增殖的结果,其后的迅速下降则是由于随着睾丸的发育,精母细胞和精子大量产生,造成支持细胞mRNA所占比例减小的缘故。对于每个睾丸所含FSHR mRNA总量,40d和60d的大鼠与年轻大鼠比较并无显著性降低。
4.2.2 在体FSHR表达的调控:在体研究主要是通过垂体切除的动物模型(消除FSH的作用)来进行的。不同种属中,对垂体切除的动物给以不同激素刺激,对FSHR表达的影响是不同的。对于成年鹌鹑(Quail,一种光周期性动物),缺乏FSH会导致FSH结合量的显著下降,提示FSH具有对受体的上调作用[28];而在大鼠中,缺乏FSH导致FSH结合位点的增加,提示了FSH的下调作用。这种下调作用已被Northern印迹实验证实[29]。高剂量的雌激素会导致FSHR mRNA水平的显著下降[30]。
, 百拇医药
在大鼠中,精子发生过程根据曲细精管中生精细胞的形态和组成分为14个期。很多研究发现,FSH对曲细精管的作用不仅与大鼠年龄有关,也与曲细精管的周期有关。Kangasniemi等[31]发现FSH结合量和FSH刺激的cAMP产量均随曲细精管的不同周期而变化。FSH结合量于Ⅹ Ⅲ~Ⅰ期最高,Ⅵ~Ⅶ期最低;FSH刺激的cAMP产量则于Ⅹ Ⅷ~Ⅴ期最高,Ⅶ~Ⅺ期最低。这些结果均提示FSHR的表达具有阶段依赖性的变化。而对于大鼠曲细精管FSHR mRNA水平的阶段依赖性变化的研究却获得不同的结果。Heckert等人给大鼠喂以维生素A缺乏的饮食,便大鼠曲细精管的发育同步于特定的几个期,运用Northern杂交方法分析RNA,发现FSHR mRNA水平于Ⅹ Ⅲ~Ⅱ期最高,Ⅶ~Ⅷ期最低[7]。而Kliesch等[32]利用组织切片原位杂交方法,却发现FSHR mRNA特异杂交信号于Ⅸ~Ⅹ期最强,Ⅺ~Ⅶ期信号强度减低,而Ⅹ Ⅲ~Ⅶ期则无杂交信号。尽管结论不一致,这些结论均提示生精细胞和支持细胞通过阶段依赖性的旁分泌相互作用调节FSHR的表达。
, 百拇医药
4.2.3 离体FSHR表达的调控:大部分对雄性动物FSHR的离体研究是通过未成熟大鼠的支持细胞进行的。这种研究的缺点是体系中缺乏支持细胞和不同生精细胞之间的相互作用。而生精细胞与支持细胞的共培养又非常难于实施。对体外培养的支持细胞给予不同浓度的FSH刺激,4~8h后出现FSH结合量和受体mRNA水平的显著下降;24h后,mRNA水平恢复正常,而FSH结合量仍处于低水平[29]。同时进行的转录Run-on实验表明FSH并不抑制FSHR基因的转录起始。这些结果提示FSH通过cAMP在转录后水平上诱导FSHR mRNA的下调作用。FSH也可能通过影响受体mRNA的稳定性产生上述效应,但目前并无实验证据。
4.3 FSHR在卵巢中的表达
4.3.1 FSHR的定位和在发育过程中的表达:在雌性动物中,FSH的结合位点分布于颗粒细胞中。与雄性动物一样,FSHR在雌性动物中也是严格性腺表达和高度细胞特异性的。最近曾有报道在培养的人平滑肌细胞中发现FSHR蛋白和mRNA[33],但这一发现还有待证实。
, 百拇医药
FSH对于颗粒细胞的分化和卵泡的成熟是必需的。在f20.5d的大鼠卵巢中即可检测到FSHR胞外区的表达;全长转录物出现较晚,在大鼠中均在生后1d才可检测到,生后5d较明显[25]。短转录物和全长转录物的顺序出现可能反映了它们的转录起始时间不同。在大鼠中,生后3d在颗粒细胞中出现高亲和力的FSH结合位点,随后不断增加,直到21d FSHR的表达达到稳定的平台期[34]。从出生到生后3d,卵巢对FSH的刺激不发生反应;生后4~7d,随着全长受体mRNA的出现,卵巢对FSH表现出迅速的cAMP反应[25]。
4.3.2 在体FSHR表达的调控:在未成熟大鼠的卵巢中,FSHR mRNA已定位于小卵泡的颗粒细胞。用孕马血清促性腺激素(PMSG)刺激卵泡生长会导致FSHR mRNA水平和FSH结合位点的显著增加,而用人绒毛膜促性腺激素(hCG)诱导排卵和黄体化却降低FSHR的表达[35]。在垂体切除后给予雌激素的大鼠中,单独使用FSH即可提高FSHR mRNA水平和FSH结合量,诱导卵泡发育和排卵。而利用大剂量的重组FSH诱导排卵却抑制FSH结合和FSHR基因表达。上述结果显示在卵巢中FSH对其受体表达的调节是双相的。低剂量FSH提高FSHR mRNA水平和FSH结合量;而高剂量FSH下调FSHR mRNA水平和FSH结合量。这种双相调节的机制可能是由于不同浓度激素对FSHR基因启动子区调节元件的效应不同或受体mRNA的稳定性改变,但都没有明确证据。
, 百拇医药
对处于动情周期的性成熟大鼠的研究发现,从只有单层颗粒细胞的卵泡开始,FSHR几乎出现在所有的卵泡中。在卵泡成熟过程中,FSHR水平增加,排卵后迅速下降,黄体化后就检测不到FSH结合位点。在牛卵巢中,黄体化后1d仍可检测到低水平的全长转录物,黄体化后3d虽检测不到,但是FSHR胞外区的表达仍然存在[36]。这种不同转录产物的顺序性消失与顺序性出现非常相似。尽管人们长期认为FSHR的表达是在FSH调控下的,但最近对性腺机能减退小鼠的研究却显示,尽管循环中没有FSH,在卵巢中仍有FSHR mRNA的存在[37]。因此,FSH以外的因素也可能参与诱导FSHR表达。
4.3.3 离体FSHR表达的调控:未成熟大鼠的颗粒细胞在体外培养过程中,颗粒细胞所含FSHR呈下降趋势,用FSH处理可维持其表达。雌激素和FSH协同作用,可以提高每一颗粒细胞中受体的数目,但E或FSH单独作用均不改变受体的表达[38]。大剂量FSH在体内抑制FSHR表达的现象,在培养的颗粒细胞中未观察到。这一不同可能由于离体培养缺乏体内参与FSHR表达调节的旁分泌因子,或仅仅因为培养的颗粒细胞不成熟造成的。
, http://www.100md.com
旁分泌因子参与FSHR表达的调节。用表皮生长因子、成纤维生长因子或胰岛素样生长因子-1刺激颗粒细胞,可减弱其对FSH作用的反应,但不影响FSHR的基础表达量;而促性腺激素释放激素(GnRH)则完全抑制了FSH对受体mRNA的诱导作用[38]。其他生长因子,如转移生长因子-β和activin是FSHR表达的强力诱导剂[34,39]。它们通过酪氨酸激酶受体发挥作用,并不直接升高细胞内的cAMP水平,因此,有理由推测FSHR表达的诱导是通过两种不同的信号传导旁路介导的。但转移生长因子-β和activin提高FSHR表达的确切机制仍不清楚。FSH存在时,activin有双相作用,即低剂量时的抑制作用和高剂量时的刺激作用[40]。
5. 小结
从以上的讨论中可以看出,FSHR是糖蛋白激素受体家族的一个独特成员。FSHR的基因表达是高度性腺和细胞特异性的,显示了它对配子发生的重要意义。利用基因工程技术有可能分别产生FSHR活化和FSHR敲除的小鼠,作为进一步阐明FSH作用的模型。FSH在生殖方面的重要作用使得FSHR成为临床上调控生育的一个突出目标。在研究者的不懈努力下,FSHR的研究必将推动不孕症的治疗,并为生育调控提供新思路,造福于人类。
, 百拇医药
* 国家“九五”攀登预选项目资助课题:“人类生殖调控的细胞和分子生物学机制的研究”
参考文献
[1]Means AR. Endocrinology, 1972, 90(1):39
[2]Abou-Issa H. J Biol Chem, 1976,251(11):3326
[3]Orth J. Endocrinology, 1977,101(1):262
[4]Vannier B. Biochemistry, 1996,35(5):1358
[5]Casey PJ. Sciences, 1995,268(5208):221
, 百拇医药
[6]Parmentier M. Science, 1989,246(4937):1620
[7]Heckert LL. Mol Endocrinol, 1991,5(5):670
[8]LaPolt PS. Endocrinology, 1992,130(3):1289
[9]Sprengel R. Mol Endocrinol, 1990,4(4):525
[10]Aittomaki K. Cell, 1995,82(6):959
[11]Albanese C. Mol Cell Endocrinol, 1994,101(1\|2):211
[12]Minegishi T. J Endocrinol, 1994,141(2):369
, 百拇医药
[13]Davis D. Mol Endocrinol, 1995,9(2):159
[14]Gudermann T.J Mol Med, 1995,73(2):51
[15]Montgomery GW. J Mol Endocrinol, 1995,15(3):259
[16]Herckert LL. Mol Endocrinol, 1992,6(1):70
[17]Gromoll J. Genomics, 1996,35(2):308
[18]Dufau ML. J Steroid Biochem Mol Biol, 1995, 53(1\|6):283
[19]Dynan WS. Trends Genet, 1986, 2(6):196
, http://www.100md.com
[20]Gromoll J. Mol Cell Endocrinol, 1994,102(1\|2):93
[21]Sites CK. Endocrinology, 1994,134(1):411
[22]Kelton CA. Mol Cell Endocrinol, 1992,89(1\|2):141
[23]Orth J. Endocrinology,1978,103(5):1944
[24]Huhtaniemi IT. Endocrinology, 1987,65(6):1210
[25]Ranniki AS. Mol Cell Endocrinol, 1995,107(2):199
, 百拇医药
[26]Tsutsui K. Endocrinology, 1985,117(6):2534
[27]Shiraishi K. Zool Sci,1993,10(4):497
[28]Shaughnessy PJ. Mol Cell Endocrinol, 1978, 12(1):9
[29]Themmen AP. Mol Cell Endocrinol, 1991,78(3):R7
[30]Dankbar B. Int J Androl, 1995,18(2):88
[31]Kangasniemi M. J Androl, 1990,11(4):336
[32]Kliesch S. Mol Cell Endocrinol, 1992,84(3):R45
, 百拇医药
[33]Korneyi JL. Eur J Endocrinol, 1996,134(3):225
[34]Dunkel L. Biol Reprod, 1994, 50(4):940
[35]LaPolt PS. Endocrinology, 1992,130(3):1289
[36]Rajapaksha WR. Mol Cell Endocrinol, 1996,120(1):25
[37]Adashi EY. Hum Reprod, 1994,5(5):815
[38]Tilly JL. Endocrinology, 1992,130(3):1296
[39]Nakamura M. J Enodocrinol, 1995,147(1):103
[40]Xiao S. Endocrinology, 1992,131(3):1009
收稿1998-07 修回1998-12, 百拇医药
单位:陈雪雁 陈克铨 陈实平(中国医学科学院 中国协和医科大学基础医学研究所,北京 100005)
关键词:
解剖学报990326 CHARACTERIZATION EXPRESSION AND REGULATION
OF FSH RECEPTOR
卵泡刺激素(FSH)是垂体分泌的一种糖蛋白激素,主要作用是促进和维持正常的性腺发育和生殖功能。FSH的生理功能是通过分布于性腺的特异性受体所介导的。支持细胞(sertoli cell)和颗粒细胞(granulosa cell)分别是FSH作用于睾丸和卵巢的靶细胞。FSH的结构和生理功能虽然已被广泛的研究和阐明,但其作用的分子机制,尤其是在促进配子产生过程中的作用机制尚不清楚。因此,研究FSH受体(FSHR)的分子结构和功能、以及FSHR的基因表达与调控,进而阐明对配子形成的意义,已经成为阐明FSH功能的关键。
, 百拇医药
1. FSHR的生化特征
70年代早期,Means和Vaitukaitis[1]等首先证实大鼠睾丸的曲细精管具有FSH的特异结合位点,与细胞膜相关联。从大鼠和牛睾丸中分离的FSHR具有两种类型的FSH结合位点:一种为高亲和力(KD=7×10-11mol/L)和低结合容量(B0=100fmol/mg),另一种为低亲和力(KD=2.6×10-9mol/L)和高结合容量(B0=630fmol/mg)[2]。低亲合力的成分最终被证明是一种人工假象,在经过纯化的受体分中,只有高亲和力的结合位点存在。
关于FSHR的精确定位问题,放射自显影的研究表明,125I-标记的FSH选择性地定位于支持细胞表面[3]。高渗固定造成曲细精管基底室的细胞收缩后,精原细胞上也可见FSH结合位点,但FSHR的精原细胞定位从未被证实过。最近,利用抗人FSHR的抗体进行的免疫组织化学研究显示颗粒细胞膜和围绕精原细胞的支持细胞基底部有均一着色[4]。睾丸间质中的小血管内皮细胞也有染色,这是否与运输大分子糖蛋白激素至靶细胞有关仍需进一步证实。
, 百拇医药
对从牛睾丸中提纯的FSHR的研究表明,FSHR是一种由寡聚糖蛋白构成的膜受体,4个单体由二硫键连接。FSH与受体的相互作用部分依赖于膜磷脂的存在,通过膜磷脂稳定蛋白构型和介导信号传递;同时也依赖于二硫键的组合,稳定受体构型[5]。
2. FSHR的分子结构
2.1 FSHR的克隆:1989年Vassart[6]研究小组在克隆人促甲状腺激素(TSH)受体时首次报道了FSHR DNA片段的序列。这一片段作为探针已经用于检测FSHR mRNA的合成部位和表达水平。研究者们利用Northern印迹杂交发现在睾丸和卵巢中含有能与FSHR DNA序列杂交的2.6kb和4.5kb的两种主要转录产物[7]。其他组织则为阴性。也有报道认为卵巢mRNA中含有两种FSHR的主要转录产物,7.0kb和2.5kb或5.0kb和2.6kb[8]。
, http://www.100md.com
对FSHR cDNA序列的测定和分析显示,在大部分种属中它是一个2 085个核苷酸的开放阅读框架[9]。曾报道过几种不同的人FSHR序列,它们在一些核苷酸位置上有差异,在某些情况下会导致氨基酸的替代。有些序列的差异是由于测序不准确造成的,另一些则是由于它们分别来源于睾丸和卵巢组织。因此,人们推测这些差异与性别特异性变化有关。现在已经肯定,FSHR cDNA中的核苷酸替代是由于FSHR基因的两个多态性位点造成的[10]。
2.2 FSHR的分子结构:人FSHR蛋白由695个氨基酸组成[11],其中氨基端17个氨基酸为疏水性信号肽。紧接着信号肽的是349个氨基酸组成的亲水性结构域,构成FSHR的细胞外结构。接着是264个氨基酸构成的跨膜区,由7个跨膜的α螺旋组成。胞内区是65个氨基酸组成的羧基末端。
FSHR结构的模式图如下:

, http://www.100md.com
FSH受体的模式图。膜外区由若干个亮氨酸-精氨酸-精氨酸序列组成。它们形成交替的β片层(阿拉伯数字表示)和α螺旋结构。距膜区由7个跨过细胞膜的疏水段组成(罗马数字表示),其间以细胞内环和细胞外环相连。
Schematic model of the FSH receptor. The extracellular domain consists of several LRRs that are made up of alternating β-sheets and α-helices (indicated by the coils). The transmembrane domain consists of seven hydrophobic segments (Roman numerals) spanning the cell membrane and connected by intra-and extracellular loops. Within the intracellular domain a putative fourth intracellular loop is depicted.
, http://www.100md.com
依据种属不同,由cDNA序列计算出的成熟受体蛋白的分子量在75~76.5kD范围内。
2.2.1 胞外区:FSHR的胞外区表现出一些重要的一级和二级结构特征。它包括至少10个亮氨酸丰富的重复单位(LPR),每个约有24个氨基酸残基[12]。与FSH产生特异结合的位点位于LPR5-LPR10之间。由于它们的两性特征,这些重复区可能具有与激素和跨膜区相互作用的双重性质。FSHR的胞外区中还存在8个保守的半胱氨酸残基,与膜外结构域三级结构的整合有关。此外,这一结构域存在3个保守的N连接的糖基化位点[12]。尽管过去认为FSHR的糖基化方式只可能影响激素的结合,最近的研究证实受体蛋白的正确折迭和与膜的交通也与糖基化有关[13]。
2.2.2 跨膜区:7个α螺旋构成的跨膜结构是G蛋白耦联受体家族的特征性基序(motif),这个家族的每个成员都具有7个疏水性片段(20~25个氨基酸组成)形成的跨膜α螺旋,由胞外环和胞内环交替连接。FSHR在第1和第2个胞外环中(442位和517位)有两个高度保守的半胱氨酸残基,形成分子间二硫桥,稳定蛋白质构型[14]。位于466~468位的保守的氨基酸三联体基序(Glu-Arg-Tyr)与受体和G蛋白的相互作用有关。对FSHR、TSH受体和LH受体跨膜区的比较显示,第2、3、4跨膜区的氨基酸序列高度保守,其他跨膜区保守性低;决定膜蛋白正确插入的脯氨酸残基在第4、6、7跨膜区同源性高;第一胞内环氨基酸序列同源性高;第3胞内环较短,3种受体在这一区同源性低,但其中羧基端的8个氨基酸残基是保守的,可能与激素受体激活G蛋白的相应方式有关。
, 百拇医药
2.2.3 C-末端区:糖蛋白激素受体的胞内区只在氨基末端表现出一些保守性(FSHR的631~659位氨基酸),而且不同种属的C-末端区变异较大。这一区域富含丝氨酸和苏氨酸残基,是潜在的磷酸化位点。这些氨基酸残基的磷酸化具有调节FSHR活性的功能[12]。第4胞内环可能与受体耦联和信号传导的调节有关。
3. FSHR的基因
3.1 FSHR基因的结构:研究者们利用cDNA或基因组探针通过荧光原位杂交和连锁分析已经完成了FSHR基因的染色体作图。人的FSHR基因位于2号染色体短臂2区1带[15]。通过基因组克隆的限制性分析和PCR产物的长度确定,研究者们证实FSHR基因是一个很大的单拷贝基因,在人类长54kb[16]。它包括10个外显子和9个内含子。前9个外显子相对较少,编码胞外结构域氨基端的氨基酸。编码胞外结构域的羧基端,跨膜区和胞内区的基因位于较大的第10外显子中[17]。内含子的长度差别很大,最小的第7内含子长108bp,最大的第1内含子长15kb。
, 百拇医药
3.2 FSHR基因的5’端序列
FSHR基因的表达是高度组织特异性的,且依赖于不同激素的刺激。FSHR mRNA转录水平的调控是与基因启动子区和上游调控序列的结构相关的。RNA酶保护实验和引物延伸分析证实FSHR基因的转录起始位点在人位于-99[18],而大鼠FSHR基因具有两个主要的转录起始位点,分别位于-80和-98[16]。人FSHR基因的转录起始位点在睾丸和卵巢中是相同的,这就排除了通过不同的转录起始位点对基因表达进行性别特异性调节的可能性。
FSHR基因的5’端序列与管家基因的启动子区有类似结构[19]。这些启动子区都有多个转录起始位点,无TATA盒和CCAAT盒等启动子元件,以及高密度GC碱基对。但对比同一家族的TSH受体和LH受体,它的GC碱基对的含量较低。
利用FSHR基因5’端不同长度的DNA片段与报告基因构建融合基因,并转染不同种类的细胞使之表达进行启动子活性的研究,结果发现5’端起始位点前的280bpDNA片段可使基因有最高的转录活性[20],且不具有细胞特异性。DNA构建体增长则转录活性明显降低,提示了上游抑制元件的存在。5’端起始位点前5kb的片段可使其下游的基因只在睾丸或卵巢细胞中选择性表达。启动子区的甲基化可能参与不表达FSHR细胞类型中的基因表达抑制作用。利用甲基化敏感的酶进行的研究显示,大鼠启动子区的甲基化与缺乏FSHRmRNA细胞的转录抑制有关[20]。但是人和小鼠的FSHR基因启动子区不含有CpG岛和甲基化位点(CCGG),说明在这些种属的转录活性调控中,甲基化事件不起主要作用。
, http://www.100md.com
4. FSHR的表达及其调控
4.1 FSHR基因的表达:在睾丸和卵巢中,人们利用Northern杂交分析检测到多种转录产物,除2.5kb的正常转录产物外[19],至少确定还有1种5~7kb的较大的转录产物和1种1.3~1.8kb的较小的转录产物存在[21]。尽管转录产物的长度差异与不同种属和不同实验方法有关,但是至少存在3种FSHR的转录产物提示这是1种非种属特异性的基因表达方式。而且在睾丸和卵巢中,转录产物的形式是相同的。
对FSHR基因表达或配子发生不同阶段的激素调控的研究表明,机体对不同转录产物的调控没有区别。非全长转录产物与全长mRNA的比值是恒定的[7]。目前认为不同的多聚腺苷酸位点和初级转录产物的不同剪接方式是形成长转录产物(5~7kb)和正常转录产物(2.5kb)的原因[22]。不同转录产物的同时表达造成了翻译过程中的竞争作用,以此来调节成熟受体和功能性受体蛋白的表达。
, 百拇医药
4.2 FSHR在睾丸中的表达
4.2.1 FSHR的定位和在发育过程中的表达:FSH结合实验证实FSH特异地与支持细胞膜上的受体结合。除Orth等[23]报道精原细胞也有FSHR外,一般认为生精细胞无FSH特异结合位点。对多种组织进行Northern印迹杂交,发在FSHR只在睾丸中表达。原位杂交实验证实在睾丸中支持细胞是唯一表达FSHR的细胞类型。这些结果说明FSHR的表达局限于性腺,且为细胞特异性。
利用FSHR的单克隆抗体,Vannier等[4]报道FSHR蛋白的表达有极性,分布于支持细胞的基底部,围绕精原细胞。他们发现FSHR也分布于睾丸间质的小血管壁上,可能通过受体介导的内吞作用从血管中将FSH输送至间质细胞(leydig cell)中。但是这种受体样结构是否具有受体活性而进行信号传导尚不清楚。
对发育睾丸中FSHR表达的研究证实,在胎龄28d(f28)的猪睾丸中即出现FSH的高亲和力结合位点[24]。在大鼠中,通过Northern印迹杂交和RT-PCR方法,在f14.5d即可检测出编码胞外区的转录产物,而全长mRNA则在f16.5d检测到[25]。这可能由于两种转录产物的转录起始时间不同。在睾丸中FSHR的出现要早于胚胎循环中较高浓度FSH的出现,而且尽管存在FSHR,胚胎睾丸对FSH的刺激仍缺乏明显的cAMP升高反应[26]。这可能由于在胚胎中信号传导系统发育不成熟或FSHR的耦联方式不同。从生理角度讲,FSHR的这种无反应性可以防止FSH刺激的精子发生过程提前发生。
, 百拇医药
Northern印迹杂交实验观察到,大鼠FSHR mRNA于出生至生后7d不断增加,生后10~20d维持不变, 生后40d开始迅速下降[27]。生后10dFSHR mRNA的增加是每个支持细胞上受体数目的增加和支持细胞增殖的结果,其后的迅速下降则是由于随着睾丸的发育,精母细胞和精子大量产生,造成支持细胞mRNA所占比例减小的缘故。对于每个睾丸所含FSHR mRNA总量,40d和60d的大鼠与年轻大鼠比较并无显著性降低。
4.2.2 在体FSHR表达的调控:在体研究主要是通过垂体切除的动物模型(消除FSH的作用)来进行的。不同种属中,对垂体切除的动物给以不同激素刺激,对FSHR表达的影响是不同的。对于成年鹌鹑(Quail,一种光周期性动物),缺乏FSH会导致FSH结合量的显著下降,提示FSH具有对受体的上调作用[28];而在大鼠中,缺乏FSH导致FSH结合位点的增加,提示了FSH的下调作用。这种下调作用已被Northern印迹实验证实[29]。高剂量的雌激素会导致FSHR mRNA水平的显著下降[30]。
, 百拇医药
在大鼠中,精子发生过程根据曲细精管中生精细胞的形态和组成分为14个期。很多研究发现,FSH对曲细精管的作用不仅与大鼠年龄有关,也与曲细精管的周期有关。Kangasniemi等[31]发现FSH结合量和FSH刺激的cAMP产量均随曲细精管的不同周期而变化。FSH结合量于Ⅹ Ⅲ~Ⅰ期最高,Ⅵ~Ⅶ期最低;FSH刺激的cAMP产量则于Ⅹ Ⅷ~Ⅴ期最高,Ⅶ~Ⅺ期最低。这些结果均提示FSHR的表达具有阶段依赖性的变化。而对于大鼠曲细精管FSHR mRNA水平的阶段依赖性变化的研究却获得不同的结果。Heckert等人给大鼠喂以维生素A缺乏的饮食,便大鼠曲细精管的发育同步于特定的几个期,运用Northern杂交方法分析RNA,发现FSHR mRNA水平于Ⅹ Ⅲ~Ⅱ期最高,Ⅶ~Ⅷ期最低[7]。而Kliesch等[32]利用组织切片原位杂交方法,却发现FSHR mRNA特异杂交信号于Ⅸ~Ⅹ期最强,Ⅺ~Ⅶ期信号强度减低,而Ⅹ Ⅲ~Ⅶ期则无杂交信号。尽管结论不一致,这些结论均提示生精细胞和支持细胞通过阶段依赖性的旁分泌相互作用调节FSHR的表达。
, 百拇医药
4.2.3 离体FSHR表达的调控:大部分对雄性动物FSHR的离体研究是通过未成熟大鼠的支持细胞进行的。这种研究的缺点是体系中缺乏支持细胞和不同生精细胞之间的相互作用。而生精细胞与支持细胞的共培养又非常难于实施。对体外培养的支持细胞给予不同浓度的FSH刺激,4~8h后出现FSH结合量和受体mRNA水平的显著下降;24h后,mRNA水平恢复正常,而FSH结合量仍处于低水平[29]。同时进行的转录Run-on实验表明FSH并不抑制FSHR基因的转录起始。这些结果提示FSH通过cAMP在转录后水平上诱导FSHR mRNA的下调作用。FSH也可能通过影响受体mRNA的稳定性产生上述效应,但目前并无实验证据。
4.3 FSHR在卵巢中的表达
4.3.1 FSHR的定位和在发育过程中的表达:在雌性动物中,FSH的结合位点分布于颗粒细胞中。与雄性动物一样,FSHR在雌性动物中也是严格性腺表达和高度细胞特异性的。最近曾有报道在培养的人平滑肌细胞中发现FSHR蛋白和mRNA[33],但这一发现还有待证实。
, 百拇医药
FSH对于颗粒细胞的分化和卵泡的成熟是必需的。在f20.5d的大鼠卵巢中即可检测到FSHR胞外区的表达;全长转录物出现较晚,在大鼠中均在生后1d才可检测到,生后5d较明显[25]。短转录物和全长转录物的顺序出现可能反映了它们的转录起始时间不同。在大鼠中,生后3d在颗粒细胞中出现高亲和力的FSH结合位点,随后不断增加,直到21d FSHR的表达达到稳定的平台期[34]。从出生到生后3d,卵巢对FSH的刺激不发生反应;生后4~7d,随着全长受体mRNA的出现,卵巢对FSH表现出迅速的cAMP反应[25]。
4.3.2 在体FSHR表达的调控:在未成熟大鼠的卵巢中,FSHR mRNA已定位于小卵泡的颗粒细胞。用孕马血清促性腺激素(PMSG)刺激卵泡生长会导致FSHR mRNA水平和FSH结合位点的显著增加,而用人绒毛膜促性腺激素(hCG)诱导排卵和黄体化却降低FSHR的表达[35]。在垂体切除后给予雌激素的大鼠中,单独使用FSH即可提高FSHR mRNA水平和FSH结合量,诱导卵泡发育和排卵。而利用大剂量的重组FSH诱导排卵却抑制FSH结合和FSHR基因表达。上述结果显示在卵巢中FSH对其受体表达的调节是双相的。低剂量FSH提高FSHR mRNA水平和FSH结合量;而高剂量FSH下调FSHR mRNA水平和FSH结合量。这种双相调节的机制可能是由于不同浓度激素对FSHR基因启动子区调节元件的效应不同或受体mRNA的稳定性改变,但都没有明确证据。
, 百拇医药
对处于动情周期的性成熟大鼠的研究发现,从只有单层颗粒细胞的卵泡开始,FSHR几乎出现在所有的卵泡中。在卵泡成熟过程中,FSHR水平增加,排卵后迅速下降,黄体化后就检测不到FSH结合位点。在牛卵巢中,黄体化后1d仍可检测到低水平的全长转录物,黄体化后3d虽检测不到,但是FSHR胞外区的表达仍然存在[36]。这种不同转录产物的顺序性消失与顺序性出现非常相似。尽管人们长期认为FSHR的表达是在FSH调控下的,但最近对性腺机能减退小鼠的研究却显示,尽管循环中没有FSH,在卵巢中仍有FSHR mRNA的存在[37]。因此,FSH以外的因素也可能参与诱导FSHR表达。
4.3.3 离体FSHR表达的调控:未成熟大鼠的颗粒细胞在体外培养过程中,颗粒细胞所含FSHR呈下降趋势,用FSH处理可维持其表达。雌激素和FSH协同作用,可以提高每一颗粒细胞中受体的数目,但E或FSH单独作用均不改变受体的表达[38]。大剂量FSH在体内抑制FSHR表达的现象,在培养的颗粒细胞中未观察到。这一不同可能由于离体培养缺乏体内参与FSHR表达调节的旁分泌因子,或仅仅因为培养的颗粒细胞不成熟造成的。
, http://www.100md.com
旁分泌因子参与FSHR表达的调节。用表皮生长因子、成纤维生长因子或胰岛素样生长因子-1刺激颗粒细胞,可减弱其对FSH作用的反应,但不影响FSHR的基础表达量;而促性腺激素释放激素(GnRH)则完全抑制了FSH对受体mRNA的诱导作用[38]。其他生长因子,如转移生长因子-β和activin是FSHR表达的强力诱导剂[34,39]。它们通过酪氨酸激酶受体发挥作用,并不直接升高细胞内的cAMP水平,因此,有理由推测FSHR表达的诱导是通过两种不同的信号传导旁路介导的。但转移生长因子-β和activin提高FSHR表达的确切机制仍不清楚。FSH存在时,activin有双相作用,即低剂量时的抑制作用和高剂量时的刺激作用[40]。
5. 小结
从以上的讨论中可以看出,FSHR是糖蛋白激素受体家族的一个独特成员。FSHR的基因表达是高度性腺和细胞特异性的,显示了它对配子发生的重要意义。利用基因工程技术有可能分别产生FSHR活化和FSHR敲除的小鼠,作为进一步阐明FSH作用的模型。FSH在生殖方面的重要作用使得FSHR成为临床上调控生育的一个突出目标。在研究者的不懈努力下,FSHR的研究必将推动不孕症的治疗,并为生育调控提供新思路,造福于人类。
, 百拇医药
* 国家“九五”攀登预选项目资助课题:“人类生殖调控的细胞和分子生物学机制的研究”
参考文献
[1]Means AR. Endocrinology, 1972, 90(1):39
[2]Abou-Issa H. J Biol Chem, 1976,251(11):3326
[3]Orth J. Endocrinology, 1977,101(1):262
[4]Vannier B. Biochemistry, 1996,35(5):1358
[5]Casey PJ. Sciences, 1995,268(5208):221
, 百拇医药
[6]Parmentier M. Science, 1989,246(4937):1620
[7]Heckert LL. Mol Endocrinol, 1991,5(5):670
[8]LaPolt PS. Endocrinology, 1992,130(3):1289
[9]Sprengel R. Mol Endocrinol, 1990,4(4):525
[10]Aittomaki K. Cell, 1995,82(6):959
[11]Albanese C. Mol Cell Endocrinol, 1994,101(1\|2):211
[12]Minegishi T. J Endocrinol, 1994,141(2):369
, 百拇医药
[13]Davis D. Mol Endocrinol, 1995,9(2):159
[14]Gudermann T.J Mol Med, 1995,73(2):51
[15]Montgomery GW. J Mol Endocrinol, 1995,15(3):259
[16]Herckert LL. Mol Endocrinol, 1992,6(1):70
[17]Gromoll J. Genomics, 1996,35(2):308
[18]Dufau ML. J Steroid Biochem Mol Biol, 1995, 53(1\|6):283
[19]Dynan WS. Trends Genet, 1986, 2(6):196
, http://www.100md.com
[20]Gromoll J. Mol Cell Endocrinol, 1994,102(1\|2):93
[21]Sites CK. Endocrinology, 1994,134(1):411
[22]Kelton CA. Mol Cell Endocrinol, 1992,89(1\|2):141
[23]Orth J. Endocrinology,1978,103(5):1944
[24]Huhtaniemi IT. Endocrinology, 1987,65(6):1210
[25]Ranniki AS. Mol Cell Endocrinol, 1995,107(2):199
, 百拇医药
[26]Tsutsui K. Endocrinology, 1985,117(6):2534
[27]Shiraishi K. Zool Sci,1993,10(4):497
[28]Shaughnessy PJ. Mol Cell Endocrinol, 1978, 12(1):9
[29]Themmen AP. Mol Cell Endocrinol, 1991,78(3):R7
[30]Dankbar B. Int J Androl, 1995,18(2):88
[31]Kangasniemi M. J Androl, 1990,11(4):336
[32]Kliesch S. Mol Cell Endocrinol, 1992,84(3):R45
, 百拇医药
[33]Korneyi JL. Eur J Endocrinol, 1996,134(3):225
[34]Dunkel L. Biol Reprod, 1994, 50(4):940
[35]LaPolt PS. Endocrinology, 1992,130(3):1289
[36]Rajapaksha WR. Mol Cell Endocrinol, 1996,120(1):25
[37]Adashi EY. Hum Reprod, 1994,5(5):815
[38]Tilly JL. Endocrinology, 1992,130(3):1296
[39]Nakamura M. J Enodocrinol, 1995,147(1):103
[40]Xiao S. Endocrinology, 1992,131(3):1009
收稿1998-07 修回1998-12, 百拇医药