金属硫蛋白与心肌血管内皮细胞的特异结合*
作者:葛淑君 仲崇霞 程时
单位:葛淑君 仲崇霞 程时(北京医科大学生物物理系,北京 100083)
关键词:金属硫蛋白;内皮细胞;特异结合位点;胶体金标记
解剖学报990315
【摘要】 目的 探讨金属硫蛋白(MT)进入细胞的机制。 方法 以胶体金为示踪物,采用离体心脏灌流术,电镜下观察心肌血管内皮细胞对MT的摄入。 结果 心肌血管内皮细胞能特异地摄取MT。 结论 血管内皮细胞表面存在MT特异结合位点,为深入研究该蛋白的生理功能及其应用提供了重要依据。
SPECIFIC BINDING SITES OF METALLOTHIONEIN ON
ENDOTHELIAL CELLS OF SMALL VESSELS
, http://www.100md.com
IN MYOCARDIUM
Ge Shujun, Zhong Chongxia, Cheng ShiΔ
(Department of Biophysics,Beijing Medical University,Beijing)
【Abstract】 Objective To explore the mechanism of metallothionein (MT) entering cells.Methods Using colloidal gold labelling and isolated heart perfusion technique,uptaking process of MT by endothelial cells of small vessels in myocardium was observed by electron microscopy.Results Endothelial cells of the vessels in myocardium are able to specially uptake colloidal gold particles.Conclusion There might be specific binding sites of MT on endothelial cell surface of small vessels in myocardium,which is very important for revealing MT biological function and clinical use.
, 百拇医药
【Key words】 Metallothionein; Endothelial cell; Specific binding site; Colloidal gold labeling
金属硫蛋白(metallothionein,MT)是遍存于生物界的金属结合蛋白。其结构在进化过程中高度保守。在组织再生和发育过程中合成,说明MT参与细胞一些基本生理过程。MT除对重金属中毒有解毒功能及调节微量元素代谢作用外,还具有明显清除自由基及细胞保护作用。我们既往研究表明,经主动脉给予MT,可淬熄动物心脏缺血后再灌注时出现的氧自由基信号[1],淬熄自旋捕集剂α-苯基-N-特丁基萘龙(PBN)捕集的心脏缺血后再灌注时出现的PBN-氧自由基加合物信号[2]。与此同时,MT对缺血后再灌注的心脏损伤有明显的保护功能[3]。由于MT中无疏水氨基酸残基,因此不易穿过生物膜。外源MT如何进入细胞而发挥细胞保护功能是个细胞生物学问题,也涉及到该蛋白的实际应用,迄今国内外对此无报道。本实验用形态学方法,以胶体金颗粒为示踪物,用电镜观察血管内皮细胞对MT的摄入,从而探讨MT在细胞膜表面的受体。
, http://www.100md.com
材料和方法
1. 动物
Wistar大鼠,250~300g,雄性,(北京医科大学实验动物中心提供),随机分为5组,每组4~5只,正常饲养。
2. 试剂
氯金酸(HAuCl4),胰岛素,牛血清白蛋白(bovine serum albunin,BSA)异型双功能交联剂N-羟基琥珀酰亚胺基-3-(2-吡啶基二硫)-丙酸酯[N-succinimidy 1-3-(2-pyridyldithio)propionate,SPDP],购于Sigma化学公司,其余试剂为国产分析纯。金属硫蛋白(由肝中提取)为本室按Vasak方法[4,5]制备及鉴定。
3. 胶体金制备
, 百拇医药
按15nm胶体金颗粒标准制备方法[6]制备。电镜下检测时,可见金颗粒呈单个分散状态,圆形,大小均匀。符合示踪标记要求。
4. MT与BSA、胰岛素与BSA偶联
由于MT分子较小,不能直接用胶体金标记,需预先将MT与分子量较大的非特异蛋白BSA偶联。本实验按Carlsson方法[7],用异型双功能交联剂SPDP对MT与BSA进行分子间偶联。偶联后纯化。经检测,BSA与MT摩尔比为1∶2。再按Ackerman方法[8]用同型双功能交联剂戊二醛交联BSA与MT作为方法学对照。纯化后检测BSA与MT摩尔比为1∶1,再按此法交联胰岛素与BSA。
5. 胶体金标记
按Horisberger等[9]方法用15nm胶体金颗粒标记MT与BSA交联物MT-BSA,胰岛素-BSA及BSA,形成MT-BSA,胰岛素-BSA及BSA。并用免疫斑点印迹方法证明标记成功。
, http://www.100md.com
6. 离体大鼠心脏灌流
用乌拉坦腹腔注射麻醉后,开胸将大鼠心脏取出,悬于Longendorff装置上。以37℃,95%O2-5%CO2平衡的Krebs-Henseleit(K-H)液行主动脉逆行灌流,灌流压控制在90cmH2O。
7. 实验分组
心脏用95%O2-5%CO2平衡的K-H液预灌流10min后,随机分为以下5组,每组4~5只心脏。
7.1 实验组:将SPDP偶联的MT-BSA及戊二醛偶联的MT-BSA分别加入K-H灌流液进行心脏灌流30min。
7.2 阳性对照组:将胰岛素-BSA加入灌流液并灌流30min。
, http://www.100md.com
7.3 阴性对照组:将BSA加入灌流液,灌流30min。
7.4 特异结合部位封闭组:用10倍于MT-BSA中MT浓度的未标记MT预灌流30min,再用MT-BSA灌流30min。
7.5 非特异结合部位封闭组:用大剂量BSA预灌流30min后,再用MT-BSA灌流30min。
上述灌流结束后,用K-H液再灌流10min。切取左心室近心尖部,常规制备电镜超薄切片标本。LKB-4型超薄切片机切片,铅盐与铀盐双染后,透射电镜观察。
结果
在实验组心脏,可见心肌小血管及毛细血管内皮细胞表面有金颗粒附着(图1)。灌流SPDP偶联的MT-BSA,内皮细胞表面附着的金颗粒数量更多些。金颗粒多散在分布,也有三、五成簇地存在于细胞表面。有些金颗粒正被摄入;还有些已被包裹在内皮细胞的吞饮泡内(图1,2,5)。在阳性对照组心脏,也可见到金颗粒附着在内皮细胞表面,这是胰岛素与内皮细胞表面相应受体的特异结合(图2)。然而,在阴性对照组心脏,偶见金颗粒在内皮细胞表面附着(图3)。用较大剂量MT预灌流,再灌以MT-BSA的心脏,内皮细胞附着的金颗粒同样稀少(图4)。但是若预先用较大剂量BSA灌流,再用MT-BSA灌流30min,则在细胞表面能见到与实验组同样多的金颗粒(图5)。
, 百拇医药
讨论
1. SPDP为异型双功能交联剂,根据加入被偶联蛋白的数量可得不同摩尔比例的两种蛋白偶联物。在本实验中,用SPDP偶联的MT-BSA中MT与BSA的摩尔比为2∶1。用戊二醛偶联的MT-BSA中MT与BSA摩尔比为1∶1。电镜下可见用SPDA偶联的MT-BSA灌流心脏,其中血管内皮细胞表面附着的金颗粒较多,而用戊二醛偶联的MT-BSA灌流后金颗粒较少。这表明本实验方法的可靠性。用MT-BSA灌流后血管内皮细胞表面有多量金颗粒附着,而用BSA灌注后几乎未见金颗粒,说明内皮细胞对MT-BSA的结合与MT有关。如果预先用较大量MT灌流后再灌流MT-BSA,则未见金颗粒;但是较大剂量BSA的预灌流却不起封闭作用,说明MT与内皮细胞结合是特异的。本实验还选用了内皮细胞上已知存在受体、分子量与MT相近的胰岛素作为实验的方法学对照,以同样的方法偶联、标记(胰岛素-BSA),用胰岛素-BSA灌注心脏后的阳性结果(细胞表面有多量金颗粒)与MT-BSA灌注心脏后的阳性结果是一致的,进一步说明本实验所采用方法的可靠性。提示内皮细胞表面可能存在MT特异结合位点。最近已有研究表明在脑星形胶质细胞上也可能存在MT特异结合位点[10]。
, 百拇医药
2. 对MT的研究已有40年的历史。对该蛋白的化学及生物化学方面已积累了相当多的资料,但其生理机能仍在研究中。MT是个富含巯基与金属的低分子量非酶蛋白[11,12]。在哺乳动物,1个MT分子中有20个处于还原态的巯基与7个二价金属原子(主要是锌和镉,肝MT主要含锌,肾MT主要含镉),因此MT是个富含巯基与金属的蛋白。内皮细胞覆盖着血管腔面,因此易于受到机械、化学和生物学方面的损伤。血中氧化修饰的低密度脂蛋白、氧化型固醇类毒物都是伤及血管内皮的重要物质。然而,内皮细胞的自我修复功能对于维持血管壁完整性及维持血液循环起重要作用。被内皮细胞摄入的MT可以贡献锌元素以保持细胞生长、修复等一切需锌过程的进行。MT也可供给大量巯基以起到抗氧应激、维持细胞内氧化-还原稳态的作用[13,14]。血管内皮细胞表面MT特异结合位点的发现为深入研究该蛋白的生理功能提供了依据。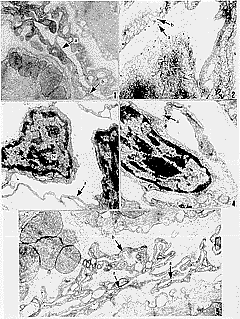
图版说明
, 百拇医药
图1 MT-BSA离体大鼠心脏灌流后,心肌血管内皮细胞表面粘附多量金颗粒(a)。有些金颗粒正被摄入或位于吞饮小泡内(b) ×20 000
图2 胰岛素-BSA离体大鼠心脏灌注后,心肌血管内皮细胞表面(a)及吞饮小泡内(b)有多量金颗粒 ×40 000
图3 BSA离体大鼠心脏灌流后,心肌血管内皮细胞上偶见金颗粒(a)。N为血管内皮细胞核 ×20 000
图4 未标记MT预灌注离体大鼠心脏30min后,再用MT-BSA灌注,心肌血管内皮细胞上偶见金颗粒(a)。N为血管内皮细胞核 ×20 000
图5 未标记BSA预灌注离体大鼠心脏30min后,再用MT-BSA灌注,心肌血管内皮细胞表面(a)及吞饮小泡内(b)有多量金颗粒 ×20 000
, 百拇医药
Explanation of figures
Fig.1 After isolated rat heart was perfused with MT-BSA,many colloidal gold particles adhering to endothelial cell surface of a small vessel were observed(a).Some particles were being uptaken of lying in the pinosomes(b). ×20 000
Fig.2 Isolated rat heart was perfused with insulin-BSA.There are many colloidal gold particles which adhering on the surface(a) and in the pinosomes(b). ×40 000
, 百拇医药
Fig.3 Isolated rat heart was perfused with BSA.Only a few of colloidal gold particles adhering to the surface of an endothelial cell were observed(a),N,nucleus. ×20 000
Fig.4 Isolated rat heart was perfused with non-labelled MT for 30min,and then perfusion with gold labelled MT-BSA was performed.Only a few of colloidal gold particles adhering to the surface of an endothelial cell were observed(a).N,nucleus. ×20 000
, 百拇医药
Fig.5 Isolated rat heart was perfused with non-labelled BSA for 30min, and then perfusion with gold labeled MT-BSA was performed.Many colloidal gold particles adhering to endothelial cell surface were observed(a), some particles were being uptaken of lying in the pinosome(b). ×20 000
* 国家自然科学基金资助课题(No.39470344)
△ Department of Biophysics,Beijing Medical University,Beijing 100083,China
, http://www.100md.com
参考文献
[1]杨泽泉,李曰民,程时等.金属硫蛋白对犬心肌缺血/再灌注损伤的保护作用(ESR及心肌细胞超微结构立体定量分析).中华胸心血管杂志,1997,13(2):247
[2]程时,常英姿,王冬焱等.金属硫蛋白对心脏缺血再灌注自由基信号的淬熄作用.中华医学杂志,1992,72(12):749
[3]程时,刘智,卫之湄等.金属硫蛋白对大鼠心肌缺血后再灌注损伤的影响——电镜形态计量学.北京医科大学学报,1989,21(2):101
[4]Vasak M.Stand isolation procedure for metallothionein.In:Riodan JF,Vallee BL,eds.Methods in Enzymology,Vol 205.New York:Academic Press,1991:41-44
, 百拇医药
[5]Vasak M.Criteria of purity for metallothionein.In:Riodan JF,Vallee BL,eds,Methods in Enzymology,Vol 205.New York: Academic Press,1991:44-47
[6]Roth J.The colloidal gold marker system for light and electron microscopic cytochemistry.In:immunocytochemistry.New York:Academic Press,1983:220-223
[7]Carlsson J,Drevin H,Axen R.Protein thiolation and reversible protein-protein conjugation.Biochem J,1978,173(3):723
, 百拇医药
[8]Ackerman GA,Wolken KW.Histochemical evidence for the differential surface labeling,uptake,and intracellular transport of colloidal gold-labeled insulin complex by normal human blood.J Histochem Cytochem,1989,29(10):1137
[9]Horisberger M,Rosset J.Colloidal gold,an useful marker for transmission and scanning electron microscopy.J Histochem Cytochem,1977,25(4):295
[10]Refaey HE,Ebadi M,Kuszynski CA,et al.Identification of metallothionein receptors in human astrocytes.Neurosci Lett,1997,231(3):131
, 百拇医药
[11]Vallee BL,Maret W.The functional potential and potential function of metallothionein.A personal perspective.In:Suzuki KT,Imura N,Kimura M,eds.Metallothionein Ⅲ,Basel:Birkhauser Verlag,1993:1-27
[12]Kagi JHR.Evolution,structure and chemical activity of class I metallothionein. A overview.In:Suzuki KT,Imure N,Kimura M,eds,Metallothionein Ⅲ,Basel: Brikhauser Verlag,1993:29-55
[13]Elliott SJ,Koliward SK.Oxidant stress and endothelial membrane transport.Free Rad Biol Med,1995,19(2):649
[14]Vallee BL.Implication and inferences of metallothionein structure.In:Kagi JHR,Kojima Y,eds.Metallothionein Ⅱ,Basal:Birkhauser Verlay,1987:5-16
收稿1998-05 修回1998-12, http://www.100md.com
单位:葛淑君 仲崇霞 程时(北京医科大学生物物理系,北京 100083)
关键词:金属硫蛋白;内皮细胞;特异结合位点;胶体金标记
解剖学报990315
【摘要】 目的 探讨金属硫蛋白(MT)进入细胞的机制。 方法 以胶体金为示踪物,采用离体心脏灌流术,电镜下观察心肌血管内皮细胞对MT的摄入。 结果 心肌血管内皮细胞能特异地摄取MT。 结论 血管内皮细胞表面存在MT特异结合位点,为深入研究该蛋白的生理功能及其应用提供了重要依据。
SPECIFIC BINDING SITES OF METALLOTHIONEIN ON
ENDOTHELIAL CELLS OF SMALL VESSELS
, http://www.100md.com
IN MYOCARDIUM
Ge Shujun, Zhong Chongxia, Cheng ShiΔ
(Department of Biophysics,Beijing Medical University,Beijing)
【Abstract】 Objective To explore the mechanism of metallothionein (MT) entering cells.Methods Using colloidal gold labelling and isolated heart perfusion technique,uptaking process of MT by endothelial cells of small vessels in myocardium was observed by electron microscopy.Results Endothelial cells of the vessels in myocardium are able to specially uptake colloidal gold particles.Conclusion There might be specific binding sites of MT on endothelial cell surface of small vessels in myocardium,which is very important for revealing MT biological function and clinical use.
, 百拇医药
【Key words】 Metallothionein; Endothelial cell; Specific binding site; Colloidal gold labeling
金属硫蛋白(metallothionein,MT)是遍存于生物界的金属结合蛋白。其结构在进化过程中高度保守。在组织再生和发育过程中合成,说明MT参与细胞一些基本生理过程。MT除对重金属中毒有解毒功能及调节微量元素代谢作用外,还具有明显清除自由基及细胞保护作用。我们既往研究表明,经主动脉给予MT,可淬熄动物心脏缺血后再灌注时出现的氧自由基信号[1],淬熄自旋捕集剂α-苯基-N-特丁基萘龙(PBN)捕集的心脏缺血后再灌注时出现的PBN-氧自由基加合物信号[2]。与此同时,MT对缺血后再灌注的心脏损伤有明显的保护功能[3]。由于MT中无疏水氨基酸残基,因此不易穿过生物膜。外源MT如何进入细胞而发挥细胞保护功能是个细胞生物学问题,也涉及到该蛋白的实际应用,迄今国内外对此无报道。本实验用形态学方法,以胶体金颗粒为示踪物,用电镜观察血管内皮细胞对MT的摄入,从而探讨MT在细胞膜表面的受体。
, http://www.100md.com
材料和方法
1. 动物
Wistar大鼠,250~300g,雄性,(北京医科大学实验动物中心提供),随机分为5组,每组4~5只,正常饲养。
2. 试剂
氯金酸(HAuCl4),胰岛素,牛血清白蛋白(bovine serum albunin,BSA)异型双功能交联剂N-羟基琥珀酰亚胺基-3-(2-吡啶基二硫)-丙酸酯[N-succinimidy 1-3-(2-pyridyldithio)propionate,SPDP],购于Sigma化学公司,其余试剂为国产分析纯。金属硫蛋白(由肝中提取)为本室按Vasak方法[4,5]制备及鉴定。
3. 胶体金制备
, 百拇医药
按15nm胶体金颗粒标准制备方法[6]制备。电镜下检测时,可见金颗粒呈单个分散状态,圆形,大小均匀。符合示踪标记要求。
4. MT与BSA、胰岛素与BSA偶联
由于MT分子较小,不能直接用胶体金标记,需预先将MT与分子量较大的非特异蛋白BSA偶联。本实验按Carlsson方法[7],用异型双功能交联剂SPDP对MT与BSA进行分子间偶联。偶联后纯化。经检测,BSA与MT摩尔比为1∶2。再按Ackerman方法[8]用同型双功能交联剂戊二醛交联BSA与MT作为方法学对照。纯化后检测BSA与MT摩尔比为1∶1,再按此法交联胰岛素与BSA。
5. 胶体金标记
按Horisberger等[9]方法用15nm胶体金颗粒标记MT与BSA交联物MT-BSA,胰岛素-BSA及BSA,形成MT-BSA,胰岛素-BSA及BSA。并用免疫斑点印迹方法证明标记成功。
, http://www.100md.com
6. 离体大鼠心脏灌流
用乌拉坦腹腔注射麻醉后,开胸将大鼠心脏取出,悬于Longendorff装置上。以37℃,95%O2-5%CO2平衡的Krebs-Henseleit(K-H)液行主动脉逆行灌流,灌流压控制在90cmH2O。
7. 实验分组
心脏用95%O2-5%CO2平衡的K-H液预灌流10min后,随机分为以下5组,每组4~5只心脏。
7.1 实验组:将SPDP偶联的MT-BSA及戊二醛偶联的MT-BSA分别加入K-H灌流液进行心脏灌流30min。
7.2 阳性对照组:将胰岛素-BSA加入灌流液并灌流30min。
, http://www.100md.com
7.3 阴性对照组:将BSA加入灌流液,灌流30min。
7.4 特异结合部位封闭组:用10倍于MT-BSA中MT浓度的未标记MT预灌流30min,再用MT-BSA灌流30min。
7.5 非特异结合部位封闭组:用大剂量BSA预灌流30min后,再用MT-BSA灌流30min。
上述灌流结束后,用K-H液再灌流10min。切取左心室近心尖部,常规制备电镜超薄切片标本。LKB-4型超薄切片机切片,铅盐与铀盐双染后,透射电镜观察。
结果
在实验组心脏,可见心肌小血管及毛细血管内皮细胞表面有金颗粒附着(图1)。灌流SPDP偶联的MT-BSA,内皮细胞表面附着的金颗粒数量更多些。金颗粒多散在分布,也有三、五成簇地存在于细胞表面。有些金颗粒正被摄入;还有些已被包裹在内皮细胞的吞饮泡内(图1,2,5)。在阳性对照组心脏,也可见到金颗粒附着在内皮细胞表面,这是胰岛素与内皮细胞表面相应受体的特异结合(图2)。然而,在阴性对照组心脏,偶见金颗粒在内皮细胞表面附着(图3)。用较大剂量MT预灌流,再灌以MT-BSA的心脏,内皮细胞附着的金颗粒同样稀少(图4)。但是若预先用较大剂量BSA灌流,再用MT-BSA灌流30min,则在细胞表面能见到与实验组同样多的金颗粒(图5)。
, 百拇医药
讨论
1. SPDP为异型双功能交联剂,根据加入被偶联蛋白的数量可得不同摩尔比例的两种蛋白偶联物。在本实验中,用SPDP偶联的MT-BSA中MT与BSA的摩尔比为2∶1。用戊二醛偶联的MT-BSA中MT与BSA摩尔比为1∶1。电镜下可见用SPDA偶联的MT-BSA灌流心脏,其中血管内皮细胞表面附着的金颗粒较多,而用戊二醛偶联的MT-BSA灌流后金颗粒较少。这表明本实验方法的可靠性。用MT-BSA灌流后血管内皮细胞表面有多量金颗粒附着,而用BSA灌注后几乎未见金颗粒,说明内皮细胞对MT-BSA的结合与MT有关。如果预先用较大量MT灌流后再灌流MT-BSA,则未见金颗粒;但是较大剂量BSA的预灌流却不起封闭作用,说明MT与内皮细胞结合是特异的。本实验还选用了内皮细胞上已知存在受体、分子量与MT相近的胰岛素作为实验的方法学对照,以同样的方法偶联、标记(胰岛素-BSA),用胰岛素-BSA灌注心脏后的阳性结果(细胞表面有多量金颗粒)与MT-BSA灌注心脏后的阳性结果是一致的,进一步说明本实验所采用方法的可靠性。提示内皮细胞表面可能存在MT特异结合位点。最近已有研究表明在脑星形胶质细胞上也可能存在MT特异结合位点[10]。
, 百拇医药
2. 对MT的研究已有40年的历史。对该蛋白的化学及生物化学方面已积累了相当多的资料,但其生理机能仍在研究中。MT是个富含巯基与金属的低分子量非酶蛋白[11,12]。在哺乳动物,1个MT分子中有20个处于还原态的巯基与7个二价金属原子(主要是锌和镉,肝MT主要含锌,肾MT主要含镉),因此MT是个富含巯基与金属的蛋白。内皮细胞覆盖着血管腔面,因此易于受到机械、化学和生物学方面的损伤。血中氧化修饰的低密度脂蛋白、氧化型固醇类毒物都是伤及血管内皮的重要物质。然而,内皮细胞的自我修复功能对于维持血管壁完整性及维持血液循环起重要作用。被内皮细胞摄入的MT可以贡献锌元素以保持细胞生长、修复等一切需锌过程的进行。MT也可供给大量巯基以起到抗氧应激、维持细胞内氧化-还原稳态的作用[13,14]。血管内皮细胞表面MT特异结合位点的发现为深入研究该蛋白的生理功能提供了依据。

图版说明
, 百拇医药
图1 MT-BSA离体大鼠心脏灌流后,心肌血管内皮细胞表面粘附多量金颗粒(a)。有些金颗粒正被摄入或位于吞饮小泡内(b) ×20 000
图2 胰岛素-BSA离体大鼠心脏灌注后,心肌血管内皮细胞表面(a)及吞饮小泡内(b)有多量金颗粒 ×40 000
图3 BSA离体大鼠心脏灌流后,心肌血管内皮细胞上偶见金颗粒(a)。N为血管内皮细胞核 ×20 000
图4 未标记MT预灌注离体大鼠心脏30min后,再用MT-BSA灌注,心肌血管内皮细胞上偶见金颗粒(a)。N为血管内皮细胞核 ×20 000
图5 未标记BSA预灌注离体大鼠心脏30min后,再用MT-BSA灌注,心肌血管内皮细胞表面(a)及吞饮小泡内(b)有多量金颗粒 ×20 000
, 百拇医药
Explanation of figures
Fig.1 After isolated rat heart was perfused with MT-BSA,many colloidal gold particles adhering to endothelial cell surface of a small vessel were observed(a).Some particles were being uptaken of lying in the pinosomes(b). ×20 000
Fig.2 Isolated rat heart was perfused with insulin-BSA.There are many colloidal gold particles which adhering on the surface(a) and in the pinosomes(b). ×40 000
, 百拇医药
Fig.3 Isolated rat heart was perfused with BSA.Only a few of colloidal gold particles adhering to the surface of an endothelial cell were observed(a),N,nucleus. ×20 000
Fig.4 Isolated rat heart was perfused with non-labelled MT for 30min,and then perfusion with gold labelled MT-BSA was performed.Only a few of colloidal gold particles adhering to the surface of an endothelial cell were observed(a).N,nucleus. ×20 000
, 百拇医药
Fig.5 Isolated rat heart was perfused with non-labelled BSA for 30min, and then perfusion with gold labeled MT-BSA was performed.Many colloidal gold particles adhering to endothelial cell surface were observed(a), some particles were being uptaken of lying in the pinosome(b). ×20 000
* 国家自然科学基金资助课题(No.39470344)
△ Department of Biophysics,Beijing Medical University,Beijing 100083,China
, http://www.100md.com
参考文献
[1]杨泽泉,李曰民,程时等.金属硫蛋白对犬心肌缺血/再灌注损伤的保护作用(ESR及心肌细胞超微结构立体定量分析).中华胸心血管杂志,1997,13(2):247
[2]程时,常英姿,王冬焱等.金属硫蛋白对心脏缺血再灌注自由基信号的淬熄作用.中华医学杂志,1992,72(12):749
[3]程时,刘智,卫之湄等.金属硫蛋白对大鼠心肌缺血后再灌注损伤的影响——电镜形态计量学.北京医科大学学报,1989,21(2):101
[4]Vasak M.Stand isolation procedure for metallothionein.In:Riodan JF,Vallee BL,eds.Methods in Enzymology,Vol 205.New York:Academic Press,1991:41-44
, 百拇医药
[5]Vasak M.Criteria of purity for metallothionein.In:Riodan JF,Vallee BL,eds,Methods in Enzymology,Vol 205.New York: Academic Press,1991:44-47
[6]Roth J.The colloidal gold marker system for light and electron microscopic cytochemistry.In:immunocytochemistry.New York:Academic Press,1983:220-223
[7]Carlsson J,Drevin H,Axen R.Protein thiolation and reversible protein-protein conjugation.Biochem J,1978,173(3):723
, 百拇医药
[8]Ackerman GA,Wolken KW.Histochemical evidence for the differential surface labeling,uptake,and intracellular transport of colloidal gold-labeled insulin complex by normal human blood.J Histochem Cytochem,1989,29(10):1137
[9]Horisberger M,Rosset J.Colloidal gold,an useful marker for transmission and scanning electron microscopy.J Histochem Cytochem,1977,25(4):295
[10]Refaey HE,Ebadi M,Kuszynski CA,et al.Identification of metallothionein receptors in human astrocytes.Neurosci Lett,1997,231(3):131
, 百拇医药
[11]Vallee BL,Maret W.The functional potential and potential function of metallothionein.A personal perspective.In:Suzuki KT,Imura N,Kimura M,eds.Metallothionein Ⅲ,Basel:Birkhauser Verlag,1993:1-27
[12]Kagi JHR.Evolution,structure and chemical activity of class I metallothionein. A overview.In:Suzuki KT,Imure N,Kimura M,eds,Metallothionein Ⅲ,Basel: Brikhauser Verlag,1993:29-55
[13]Elliott SJ,Koliward SK.Oxidant stress and endothelial membrane transport.Free Rad Biol Med,1995,19(2):649
[14]Vallee BL.Implication and inferences of metallothionein structure.In:Kagi JHR,Kojima Y,eds.Metallothionein Ⅱ,Basal:Birkhauser Verlay,1987:5-16
收稿1998-05 修回1998-12, http://www.100md.com