基底前脑NOS神经元移植至成年鼠海马内的发育
作者:燕启江 姚志彬 周丽华 陈以慈
单位:燕启江 姚志彬 周丽华 陈以慈(中山医科大学人体解剖学教研室 脑研究室,广州 510089)
关键词:一氧化氮合酶;移植;海马;基底前脑;大鼠;;
解剖学报990307
【摘要】 目的 研究基底前脑NOS神经元移植至成年鼠海马内后,NOS的发育变化规律,同时观察移植物与宿主海马间发生联系的情况。 方法 将大鼠14~16d胚胎的基底前脑移植到单侧穹隆海马伞切断的成年大鼠海马内,动物在移植后存活5、7、14、30、60、90、150和180d分别取脑,经NADPH-d法和尼氏染色观察。 结果 在移植后第7d时NADPH-d阳性染色才出现在NOS阳性神经元内,随着移植物成活时间的延长,NOS阳性神经元逐渐生长在30d时已发育成熟,而且30d时可见其与宿主海马发生联系,直到180d仍有良好的联系。 结论 移植物的NOS阳性神经元在海马的发育有一定的规律。移植物可以在海马内长期存活并可以和宿主脑整合生长,表明移植物可能有功能。
, http://www.100md.com
DEVELOPMENT OF NOS NEURONS OF BASAL FOREBRAIN
TRANSPLANTED INTO THE HIPPOCAMPUS
OF ADULT RATS
Yan Qijiang, Yao Zhibin△, Zhou Lihua, Chen Yici
(Department of Anatomy, Division of Brain Research, Sun Yat-sen University of Medical Sciences, Guangzhou)
【Abstract】 Objective To explore the developmental regularity of basal forebrain NOS neurons after transplanted into host hippocampus of adult rats, and observe the graft integrated with host hippocampus. Method The basal forebrain cell suspensions were prepared from tissue obtained from 14-16 day old rat embryos. The cell suspensions were injected into the hippocampus of rat which had received unilateral transection of fimbria-fornix before one week. 5,7,14,30,60,90,150 and 180 days after grafting, the rats were perfused and postfixed, cut section. A series of every second and third sections were used for NOS enzyme histochemistry and Nissl histochemistry. Results The results indicated that grafts could well survive in the hippocampal. NOS was detected in grafted neurons at 7 days after transplantation. Along with survival time, NOS-positive neurons matured at 30 days.30 until 180 days after implantation, NOS positive fibers had expended from the neurons in the grafts into the lesioned hippocampus and dentate gyrus of the host. Conclusion Grafted NOS positive neurons have some growth regularity in host hippocampus. The grafts can long time survive and become integrated with the host brain, indicating that they may be functional in hippocammpus.
, 百拇医药
【Key words】 Nitric oxide synthase; Transplantation; Hippocampus; Basal forebrain; Rat
神经系统的NO在生理条件下可调节脑血流量,调制痛觉,既可发挥神经递质的作用,又可作为神经调质促进递质的释放[1],并参与突触可朔性[2],导向轴突生长[3]。在长时程增强和长时程抑制,学习与记忆和神经发育中也发挥重要作用[4]。由于NO性质活泼半衰期短,故研究中多用观察NOS的变化来了解NO的作用[5],基底前脑(BF)是NOS阳性神经元较集中的主要脑区之一,基底前脑的内侧隔核和斜角带核内的NOS阳性神经元绝大部分都是胆碱能神经元[6],用基底前脑胆碱能神经元移植以治疗学习记忆减退已是较为常用的研究方法,但是NOS阳性神经元在此移植后的生长发育规律以及可能的作用尚不清楚,本实验对这一问题进行了研究。
, http://www.100md.com
材料和方法
1. 实验动物
雄性SD大鼠40只,3~5个月龄,体重250~350g,分为8个时间组,分别在单侧穹窿海马伞(fornix-fimbria,FF)损伤术1周后进行移植。移植后动物分别经5、7、14、30、60、90、150和180d存活,灌注后取脑,共分8组,每组5只动物。
2.穹隆海马伞(FF)切断术
动物经腹腔注射麻醉后,置于鼠脑立体定位仪上,参考Paxon和Watson的大白鼠脑立体定位图谱,在前囟后2 mm,中线左侧1 mm处,用自制手钻打开颅骨。将双刃刀先置于前囟后2 mm,中线左侧1 mm的脑表面,接着降刀4.1 mm,并向外移1 mm,向内移0.5 mm,然后再降刀1 mm,并向外移1.5 mm,依次切断胼胝体缘,扣带回,背侧穹隆,穹隆及海马伞。
, 百拇医药
3. 细胞悬液制备
在细胞培养室内,无菌操作下打开孕鼠腹腔,从子宫远角端逐一取出胚胎,14~16d胚胎头臀长12~16 mm,将胚胎放入加有基础培养液的培养皿内,断头,分离出隔及斜角带区的组织,用0.125%胰蛋白酶消化组织块,制成单个神经元悬浮液,用200目77 μm钢网过滤,以除去悬浮液中的小血管及小束结缔组织,然后取1 μl细胞悬液加入台盼蓝作活细胞百分比计数。细胞悬液内细胞密度为3~4万个/μl,活细胞率为85%~97%。
4. 移植手术
FF损伤后1周,将细胞悬液移植入损伤侧海马内,共3点,每点移植坐标分别为(1)前囟后(A)=+3.0mm,中线左侧(L)=2.0mm,硬膜下(V)=3.5mm;(2)A=+4.5,L=3.5mm,V=3.6mm;(3)A=+6.0mm,L=3.7mm,V=3.7mm。每点移植4μl。
, http://www.100md.com
5.组织切片制备
移植动物在深麻醉下,经左心室主动脉插管,冷多聚甲醛磷酸缓冲液(pH7.4)内含15%(v/v)的饱和苦味酸固定液,350 ml灌注固定,后固定2h。再转入30%蔗糖磷酸缓冲液中,4℃下过夜直至其沉底。冰冻切片机切片,厚40 μm,连续取4套切片,取其中两套做Nissl和NOS染色。
6. NOS染色和Nissl染色
6.1 NADPH-d组织化学染色:NADPH-d染色孵育液为:(1)0.1 mol/L磷酸缓冲液(pH8.0);(2)1 mmol/L 氯化硝基四氮唑蓝(NBT);(3)1.2 mmol/L β-NADPH-d(Sigma);(4)0.1% Triton X-100。临用前配制。组织切片用漂浮法孵育,入孵育液前用0.1 mol/L PB(pH7.4)洗2次,各5 min。在孵育液中37℃反应1h,用0.1 mol/L PB(pH7.4)终止反应。裱片,梯度酒精脱水,二甲苯透明,中性树胶封片。
, http://www.100md.com
6.2 Nissl法染色:组织玻片入0.25%焦油紫染液(每30 ml0.25%焦油紫水溶液加10%醋酸5滴)反应3~5 min。95%酒精分色,无水酒精脱水,二甲苯透明,中性树胶封片。
结 果
从取材时观察和镜下所见,移植物的穹窿海马伞已被完全切断。移植物的存活部位基本与3个移植位点一致,分别位于背侧海马、齿状回门区和腹侧海马。Nissl染色是确定移植物的部位和区分移植物与宿主界线的最好的方法之一。尤其是移植的早期。Nissl染色可见移植物都生长在海马和齿状回内,NADPH-d染色也可大致显示出整个移植物的位置(图1,2)。NADPH-d染色显示移植物成活到第7d前都无NOS的表达,直到第7d才有NOS的表达。移植物内NOS神经元的染色和形态特征从一开始表达就与宿主海马及齿状回原有的NOS阳性神经元明显不同。原有NOS神经元呈中等或弱阳性,染色淡,核明显呈空泡状,绝大部分突起少或无。而移植物内NOS神经元在第7d一开始染色时就表现为细胞核较大,胞浆较少或很少,细胞突起长,染色深,突起上具有许多神经膨体(varicosity),膨体的大小不等,无规律性,此时NOS阳性神经元明显小于宿主海马、隔区和斜角带核区的NOS细胞(图3)。存活14d移植组,NOS阳性神经元体积增大,胞浆增多,但细胞核仍大于细胞浆的量,突起伸展的更长,染色深,纤维及突起上的膨体已有明显的周期性——膨体的大小相似,间隔距离相似。成活30d移植物内NOS神经元发育较成熟。NOS神经元胞质多,强阳性,深染,突起长,分支较多,粗细均匀,周期性膨体较多。此时移植物内NOS神经元的大小和形态与宿主隔区和斜角带核区的NOS阳性神经元基本一样(图4~6)。移植物存活60d后,直到180d实验结束时,移植物内NOS阳性神经元都表现为细胞形态成熟,胞体饱满,染色均匀,突起很长,无膨体,突起上可见到二至三级分支(图7)。从移植物成活30d后就可见到所有移植物中NOS阳性神经元均以双极神经元为多见,多极神经元较少,少量为双毛刷状神经元(bitufted),大部分NOS阳性神经元为大、中型神经元,少量为小型神经元(附表)。
, http://www.100md.com
附表 基底前脑NOS阳性神经元移植后的发育
Table The development of basal forebrain NOS neurons after implantation 分组(d)groups
(days)
移植物内NOS阳性神经元的形态特征
the feature of NOS neurons in grafting area
5
无NADPH-d的阳性染色
no NADPH-d stain
7
, 百拇医药
NOS神经元细胞体小,核大,胞质少,突起较长,突起上膨体大小不规则
small soma, big nucleus, less plasma, more process, irregular varicosity of NOS neuron
14
细胞体增大,胞质增多,突起增多增长,膨体多略有规则
the size of soma, plasma and process of the NOS neurons were increase gradully, varicosity become regular
30
NOS神经元发育成熟,形态与宿主基底前脑的一样,膨体规则,部分突起延伸入海马
, http://www.100md.com
the NOS neurons mature, shape as same as host basal forebrain, varicosity regular, some neurons extend their process into hippocampus
60
移植物内纤维丰富,无膨体,其他特征与30d组相同
abundant fibres, no varicosity, the others same as 30 days
90
与60d组特征相同
the same as 60 days
150
, http://www.100md.com
与60d组特征相同
the same as 60 days
180
NOS神经元细胞形态好,纤维丰富,仍可见突起生长入宿主脑
the NOS neurons shape well, abundant fibres, still have some NOS neurons extend their process into hippocampus
移植物在海马和齿状回内常聚集成团块生长,成活时间越长移植物与宿主脑的界线越不清楚(图8,9),表明随着成活时间的延长移植物与宿主脑的整合越好。移植物成活到30d时,已可见到部分移植物中NOS阳性神经元纤长的阳性突起明显的生长到宿主海马排列有序的锥体层内(图4),或是生长到排列有序的齿状回颗粒层。在有些移植动物,移植物生长在齿状回内下部——移植物的下端游离或部分在海马裂,而NOS阳性神经元纤长的纤维生长方向极具特征,均朝向齿状回内部和海马,几乎见不到纤维向丘脑部或中间游离缘生长(图5,6)。在各个存活时间组,均可见到移植物中NOS阳性神经元的分布有一特征性现象,即NOS阳性神经元多数位于移植物与宿主脑组织交界区,如果移植物中央有阳性NOS神经元,也都是3~5个聚集成团,散在的NOS阳性神经元较少见,尤其是在短于2个月组的移植物中,这种特征更明显。除存活7d和14d两时间组外,其余各时间组,移植物中NOS阳性神经元的突起,均有部分可追踪进入宿主的海马及齿状回。但未追踪到宿主NOS阳性神经元的突起延伸入移植物。
, 百拇医药
讨 论
1. 移植后NOS阳性神经元发育表达的意义
从附表NOS神经元的发育规律来看,移植物内NOS神经元在第7d和第14d胞体较小、胞核较大及膨体不规则,而到30d时已发育为胞核正常膨体规则,其大小和形态与宿主基底前脑NOS阳性的神经元一样,表明移植物的NOS神经元在30d时已发育成熟。移植物NOS阳性神经元从第7d表达NOS开始一直到14d时,主要分布于突起,突起长而且多,突起及散在纤维上有较多大小不等的不规则膨体,但移植物NOS阳性神经元胞体小,细胞核大,阳性胞质少。这种现象表明移植物神经元在发育早期阶段是以纤维的生长,以及寻找适应的投射靶区建立突触联系为目的。而且NOS也参与了这一功能活动,因为有研究发现NO在突触的形成中发挥一定的作用[7]。该现象符合Edelman和Gally[8]的观点,即在神经系统发育中NO在突触连接形成中发挥作用,这些NOS阳性神经元和纤维可能在发育中发挥了一定程度的“通路寻找者(pathfinding)”的作用[9]。
, 百拇医药
神经膨体形成的原因可能是,NOS阳性产物主要分布在核膜,内质网膜及线粒体膜上等[10]。线粒体和内质网是细胞内的供能单位,移植物NOS阳性突起上早期的不规则膨体可能就是线粒体及内质网等所在部位,它们在这些部位合成和释放能量以及合成各种结构蛋白的功能很活跃,数量多,较集中,故表现为被NOS染色的膨大膨体。随着NOS阳性神经元的发育成熟和功能稳定,神经膨体也逐渐由不规则到规则直至消失。
2. 移植物NOS神经元与宿主建立联系的特征和意义
移植的神经组织至少通过两种途径良性的影响宿主动物的神经活性及其行为:(1)移植物对宿主的营养作用。最初移植物可以急性分泌一些神经因子,长期存活的移植物还可以作为一个泵,缓慢地弥漫地释放一些宿主脑缺乏的具有神经活性的化学性质物质,激素或神经介质等,移植物的营养作用不仅可以部分阻止损伤脑细胞继续死亡,还可以恢复或再建立宿主脑的功能。本研究结果表明,基底前脑神经元移植到宿主海马后直到6个月均良好成活。NOS阳性神经元从移植后7d到6个月都有稳定表达,提示NO这种神经活性介质可以在移植物内长期稳定地产生,从而对宿主脑不断地发挥作用。据研究一氧化氮可以通过自身所具有的气体弥散功能,从产生部位向周围直接扩散,无须转运机制,直接穿透细胞膜,在胞内直接发挥作用[11]。同时基底前脑的神经元移植到其靶区海马后,移植物与海马的靶性依赖关系迅速建立起来。宿主海马的靶性微环境及各种神经营养因子对移植物内NOS阳性神经元表达一氧化氮合酶具有诱导和促进作用。这种诱导和促进作用从移植物NOS阳性神经元的分布特征可以证明:移植物NOS阳性神经元大多位于靠近移植物的边界区,移植物中央区很少,因为靠近边界区其与宿主的联系距离短,易于受到各种营养的诱导作用。移植物中央NOS阳性神经元少的原因之一是受到宿主靶区的营养和诱导较少。在齿状回下部生长的移植物NOS阳性神经元纤维向海马和齿状回生长而不向游离缘生长的现象,更进一步的体现了移植物与宿主靶区的相互诱导作用。(2) 宿主功能的完全恢复必须依赖移植物与宿主脑整合,包括移植物重支配靶器官,移植物与宿主脑建立相互纤维联系等[12,13]。本研究中移植物成活1个月之后,各时间组移植物中NOS阳性神经元的突起,均有部分可追踪进入宿主的海马及齿状回,与海马的锥体细胞及齿状回颗粒层细胞发生联系,在一些部位NOS阳性纤维已长入宿主海马结构较远的距离。这表明,移植物和宿主脑已有良好的整合,基底前脑移植物能使宿主去基底前脑NOS纤维传入的海马重新获得NO能的部分神经支配。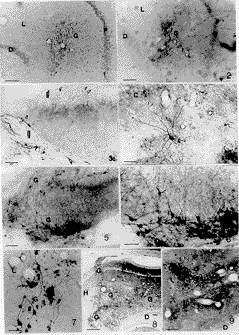
, 百拇医药
图 版 说 明
图1,2存活30d同一移植物(G)位于CA1、CA2和齿状回分子层内,两种染色示移植物与宿主脑整合生长良好,无胶质增生现象,NOS神经元形态较完整。D.齿状回颗粒层,P.海马锥体层,L.海马腔隙分子层,图1 Nissl染色,图2 NADPH-d染色。标尺示100 μm
图3 存活7d移植物(g)位于齿状回内,NOS阳性神经元胞体小、突起长、膨体(Δ)大小不等且无规律。d.齿状回 标尺示150 μm
图4 存活30d移植物位于齿状回内,NOS阳性神经元纤维明显生长入海马CA3(C)锥体层,纤维末梢有规则的串珠样膨体,箭头示海马原有NOS阳性神经元。标尺示200 μm
图5 移植物位于齿状回内下方和海马裂内,存活30d。G.移植物 D.宿主齿状回 标尺示100 μm
, 百拇医药
图6 图5的放大,移植物NOS阳性神经元纤维均朝向宿主齿状回。标尺示200 μm
图7 海马腔隙分子层(L)内存活60d移植物(G),NOS阳性神经元生长良好,箭头示含铁血黄素。标尺示200 μm
图8 存活150d移植物(G)位于海马和齿状回内,NOS染色。H.宿主 D.齿状回 P.锥体层 标尺示40 μm
图9 海马CA2锥体层(P)和腔隙分子层(L)内存活180d移植物(G),移植物内细胞形态好,纤维丰富,部分纤维已生长入海马锥体层。标尺示100 μm
Explanation of figures
Fig.1,2 Same graft(G) among CA1,CA2 and stratum moleculare of dentate gyras 30 days after implantation. Two different stains show that graft and host brain growth well together, no glia overgrowth. D,dorsal stratum granulosum gyrus dentatus.P,stratum pyramidale. L,stratum lacunosum moleculare.Fig.1 Nissl stained. Fig.2 NADPH-d stained. Bar=100 μm
, 百拇医药
Fig.3 Graft(g) in dentate gyrus 7days after implantation, NOS positive neurons have small soma, big nucleus, long process, irregular varicosity(△). d,dentate gyrus Bar=150 μm
Fig.4 Graft in dentate gyrus 30 days after implantation, NOS positive fibers had expended into the CA3(C) pyramidal layer of Hippocampus. Regular string varicosity in end of fibers. arrow show the NOS positive neuron of host hippocampus.Bar=200 μm
, http://www.100md.com Fig.5 Graft in dentate gyrus and fissura hippocampi 30 days after implantation. G, graft D,dentate gyrus Bar=100 μm
Fig.6 Amplify Fig.5, Almost all the NOS positive fibers expended into dentate gyrus. Bar=200 μm
Fig.7 Graft(G) in lacuromolecular layer(L) of hippocampus 60 days after implantation, NOS positive neurons growth well. arrow show hemosiderin. Bar=200μm
Fig.8 Graft in hippocampus and dentate gyrus 150 days after implantation, H, host G,graft. D,stratum granulosum gyrus dentatus P,stratum pyramidale. Bar=40 μm
, http://www.100md.com
Fig.9 Graft(G) in CA3 stratum pyramidale (P) and stratum lacunosum moleculare(L) 180 days after implantation. NOS neurons shape well in graft, a lot of fibers. Some fiber had growthed into hippocampal stratum pyramidale.Bar=100 μm
△ Department of Anatomy, Division of Brain Research, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China
参考文献
[1]Lonart G, Cassels KL, Ichuson KM. Nitric oxide induce calcium-dependent[H3] dopamine release from striatal slice. J Neurosci Res, 1993,35(2):192
, 百拇医药
[2]Bohme GA, Bon C, Lemaire M, et al. Altered synaptic plasticity and memory of formation in nitric oxide synthase inhibitor-treated rats. Proc Natl Acad Sci USA, 1993,90(20):9191
[3]Wu WT. Expression of nitric-oxide synthase(NOS) in injured CNS neurons as shown by NADPH diaphorase histochemistry. Exp Neurol,1993,120(2):153
[4]Muller U.Inhibition of nitric oxide synthase impairs a distinct form of long-term memory in the honeybee. Apis mollifera, Neuron, 1996,16(3):541
, 百拇医药
[5]Bredt DS, Hwang PM, Snyder SH. Localization of nitric oxide synthase indicating a neural role for nitric oxide. Nature, 1990,347(6295):768
[6]姚志彬,袁群芳,顾耀铭,等.一氧化氮合成酶阳性神经元在大鼠前脑的分布.解剖学杂志,1995,18(4):328
[7]Truman JW, De Vente J, Ball EE. Nitric oxide sensitive guanylate cyclase activity is associated with the maturation phase of neuronal development in insects. Development, 1996,122(12):3949
[8]Edelman GM, Gally JA. Nitric oxide:linking space and time in the brain. Proc Natl Acad Sci USA, 1992,89(24):11651
, 百拇医药
[9]Bredt DS, Snyder SH. Transient nitric oxide synthase neurons in embryonic cerebral cortical plate, sensory ganglia and olfactory epithelium. Neuron,1994,13(2):301
[10]Wolf G, Wukdig S, Schuzel G. Nitric-oxide synthase in rat brain is predominantly located at neuronal endoplasmic reticulum:an electron microscopic demonstration of NADPH-diaphorase activity. Neurosci Let,1992,147(1):63
[11]Bredt DS, Snyder SH. Nitric oxide, a physiological messenger molecule. Annu Rev Biochem, 1994,63(1):175
, http://www.100md.com
[12]Bjorklund A, Lindall O. Mechanisms of action of intracerebral neural implants:studied on nigral and striatal grafts to the lesioned striatum. Trends Neurosci,1987,10(12):509
[13]Nillsson OG, Kalen P, Rosengren E, et al. Acetylcholine release from intrahippocampal septal grafts is under control of the host brain. Proc Natl Acad Sci USA,1990,87(7):2647
收稿1998-07 修回1998-03, 百拇医药
单位:燕启江 姚志彬 周丽华 陈以慈(中山医科大学人体解剖学教研室 脑研究室,广州 510089)
关键词:一氧化氮合酶;移植;海马;基底前脑;大鼠;;
解剖学报990307
【摘要】 目的 研究基底前脑NOS神经元移植至成年鼠海马内后,NOS的发育变化规律,同时观察移植物与宿主海马间发生联系的情况。 方法 将大鼠14~16d胚胎的基底前脑移植到单侧穹隆海马伞切断的成年大鼠海马内,动物在移植后存活5、7、14、30、60、90、150和180d分别取脑,经NADPH-d法和尼氏染色观察。 结果 在移植后第7d时NADPH-d阳性染色才出现在NOS阳性神经元内,随着移植物成活时间的延长,NOS阳性神经元逐渐生长在30d时已发育成熟,而且30d时可见其与宿主海马发生联系,直到180d仍有良好的联系。 结论 移植物的NOS阳性神经元在海马的发育有一定的规律。移植物可以在海马内长期存活并可以和宿主脑整合生长,表明移植物可能有功能。
, http://www.100md.com
DEVELOPMENT OF NOS NEURONS OF BASAL FOREBRAIN
TRANSPLANTED INTO THE HIPPOCAMPUS
OF ADULT RATS
Yan Qijiang, Yao Zhibin△, Zhou Lihua, Chen Yici
(Department of Anatomy, Division of Brain Research, Sun Yat-sen University of Medical Sciences, Guangzhou)
【Abstract】 Objective To explore the developmental regularity of basal forebrain NOS neurons after transplanted into host hippocampus of adult rats, and observe the graft integrated with host hippocampus. Method The basal forebrain cell suspensions were prepared from tissue obtained from 14-16 day old rat embryos. The cell suspensions were injected into the hippocampus of rat which had received unilateral transection of fimbria-fornix before one week. 5,7,14,30,60,90,150 and 180 days after grafting, the rats were perfused and postfixed, cut section. A series of every second and third sections were used for NOS enzyme histochemistry and Nissl histochemistry. Results The results indicated that grafts could well survive in the hippocampal. NOS was detected in grafted neurons at 7 days after transplantation. Along with survival time, NOS-positive neurons matured at 30 days.30 until 180 days after implantation, NOS positive fibers had expended from the neurons in the grafts into the lesioned hippocampus and dentate gyrus of the host. Conclusion Grafted NOS positive neurons have some growth regularity in host hippocampus. The grafts can long time survive and become integrated with the host brain, indicating that they may be functional in hippocammpus.
, 百拇医药
【Key words】 Nitric oxide synthase; Transplantation; Hippocampus; Basal forebrain; Rat
神经系统的NO在生理条件下可调节脑血流量,调制痛觉,既可发挥神经递质的作用,又可作为神经调质促进递质的释放[1],并参与突触可朔性[2],导向轴突生长[3]。在长时程增强和长时程抑制,学习与记忆和神经发育中也发挥重要作用[4]。由于NO性质活泼半衰期短,故研究中多用观察NOS的变化来了解NO的作用[5],基底前脑(BF)是NOS阳性神经元较集中的主要脑区之一,基底前脑的内侧隔核和斜角带核内的NOS阳性神经元绝大部分都是胆碱能神经元[6],用基底前脑胆碱能神经元移植以治疗学习记忆减退已是较为常用的研究方法,但是NOS阳性神经元在此移植后的生长发育规律以及可能的作用尚不清楚,本实验对这一问题进行了研究。
, http://www.100md.com
材料和方法
1. 实验动物
雄性SD大鼠40只,3~5个月龄,体重250~350g,分为8个时间组,分别在单侧穹窿海马伞(fornix-fimbria,FF)损伤术1周后进行移植。移植后动物分别经5、7、14、30、60、90、150和180d存活,灌注后取脑,共分8组,每组5只动物。
2.穹隆海马伞(FF)切断术
动物经腹腔注射麻醉后,置于鼠脑立体定位仪上,参考Paxon和Watson的大白鼠脑立体定位图谱,在前囟后2 mm,中线左侧1 mm处,用自制手钻打开颅骨。将双刃刀先置于前囟后2 mm,中线左侧1 mm的脑表面,接着降刀4.1 mm,并向外移1 mm,向内移0.5 mm,然后再降刀1 mm,并向外移1.5 mm,依次切断胼胝体缘,扣带回,背侧穹隆,穹隆及海马伞。
, 百拇医药
3. 细胞悬液制备
在细胞培养室内,无菌操作下打开孕鼠腹腔,从子宫远角端逐一取出胚胎,14~16d胚胎头臀长12~16 mm,将胚胎放入加有基础培养液的培养皿内,断头,分离出隔及斜角带区的组织,用0.125%胰蛋白酶消化组织块,制成单个神经元悬浮液,用200目77 μm钢网过滤,以除去悬浮液中的小血管及小束结缔组织,然后取1 μl细胞悬液加入台盼蓝作活细胞百分比计数。细胞悬液内细胞密度为3~4万个/μl,活细胞率为85%~97%。
4. 移植手术
FF损伤后1周,将细胞悬液移植入损伤侧海马内,共3点,每点移植坐标分别为(1)前囟后(A)=+3.0mm,中线左侧(L)=2.0mm,硬膜下(V)=3.5mm;(2)A=+4.5,L=3.5mm,V=3.6mm;(3)A=+6.0mm,L=3.7mm,V=3.7mm。每点移植4μl。
, http://www.100md.com
5.组织切片制备
移植动物在深麻醉下,经左心室主动脉插管,冷多聚甲醛磷酸缓冲液(pH7.4)内含15%(v/v)的饱和苦味酸固定液,350 ml灌注固定,后固定2h。再转入30%蔗糖磷酸缓冲液中,4℃下过夜直至其沉底。冰冻切片机切片,厚40 μm,连续取4套切片,取其中两套做Nissl和NOS染色。
6. NOS染色和Nissl染色
6.1 NADPH-d组织化学染色:NADPH-d染色孵育液为:(1)0.1 mol/L磷酸缓冲液(pH8.0);(2)1 mmol/L 氯化硝基四氮唑蓝(NBT);(3)1.2 mmol/L β-NADPH-d(Sigma);(4)0.1% Triton X-100。临用前配制。组织切片用漂浮法孵育,入孵育液前用0.1 mol/L PB(pH7.4)洗2次,各5 min。在孵育液中37℃反应1h,用0.1 mol/L PB(pH7.4)终止反应。裱片,梯度酒精脱水,二甲苯透明,中性树胶封片。
, http://www.100md.com
6.2 Nissl法染色:组织玻片入0.25%焦油紫染液(每30 ml0.25%焦油紫水溶液加10%醋酸5滴)反应3~5 min。95%酒精分色,无水酒精脱水,二甲苯透明,中性树胶封片。
结 果
从取材时观察和镜下所见,移植物的穹窿海马伞已被完全切断。移植物的存活部位基本与3个移植位点一致,分别位于背侧海马、齿状回门区和腹侧海马。Nissl染色是确定移植物的部位和区分移植物与宿主界线的最好的方法之一。尤其是移植的早期。Nissl染色可见移植物都生长在海马和齿状回内,NADPH-d染色也可大致显示出整个移植物的位置(图1,2)。NADPH-d染色显示移植物成活到第7d前都无NOS的表达,直到第7d才有NOS的表达。移植物内NOS神经元的染色和形态特征从一开始表达就与宿主海马及齿状回原有的NOS阳性神经元明显不同。原有NOS神经元呈中等或弱阳性,染色淡,核明显呈空泡状,绝大部分突起少或无。而移植物内NOS神经元在第7d一开始染色时就表现为细胞核较大,胞浆较少或很少,细胞突起长,染色深,突起上具有许多神经膨体(varicosity),膨体的大小不等,无规律性,此时NOS阳性神经元明显小于宿主海马、隔区和斜角带核区的NOS细胞(图3)。存活14d移植组,NOS阳性神经元体积增大,胞浆增多,但细胞核仍大于细胞浆的量,突起伸展的更长,染色深,纤维及突起上的膨体已有明显的周期性——膨体的大小相似,间隔距离相似。成活30d移植物内NOS神经元发育较成熟。NOS神经元胞质多,强阳性,深染,突起长,分支较多,粗细均匀,周期性膨体较多。此时移植物内NOS神经元的大小和形态与宿主隔区和斜角带核区的NOS阳性神经元基本一样(图4~6)。移植物存活60d后,直到180d实验结束时,移植物内NOS阳性神经元都表现为细胞形态成熟,胞体饱满,染色均匀,突起很长,无膨体,突起上可见到二至三级分支(图7)。从移植物成活30d后就可见到所有移植物中NOS阳性神经元均以双极神经元为多见,多极神经元较少,少量为双毛刷状神经元(bitufted),大部分NOS阳性神经元为大、中型神经元,少量为小型神经元(附表)。
, http://www.100md.com
附表 基底前脑NOS阳性神经元移植后的发育
Table The development of basal forebrain NOS neurons after implantation 分组(d)groups
(days)
移植物内NOS阳性神经元的形态特征
the feature of NOS neurons in grafting area
5
无NADPH-d的阳性染色
no NADPH-d stain
7
, 百拇医药
NOS神经元细胞体小,核大,胞质少,突起较长,突起上膨体大小不规则
small soma, big nucleus, less plasma, more process, irregular varicosity of NOS neuron
14
细胞体增大,胞质增多,突起增多增长,膨体多略有规则
the size of soma, plasma and process of the NOS neurons were increase gradully, varicosity become regular
30
NOS神经元发育成熟,形态与宿主基底前脑的一样,膨体规则,部分突起延伸入海马
, http://www.100md.com
the NOS neurons mature, shape as same as host basal forebrain, varicosity regular, some neurons extend their process into hippocampus
60
移植物内纤维丰富,无膨体,其他特征与30d组相同
abundant fibres, no varicosity, the others same as 30 days
90
与60d组特征相同
the same as 60 days
150
, http://www.100md.com
与60d组特征相同
the same as 60 days
180
NOS神经元细胞形态好,纤维丰富,仍可见突起生长入宿主脑
the NOS neurons shape well, abundant fibres, still have some NOS neurons extend their process into hippocampus
移植物在海马和齿状回内常聚集成团块生长,成活时间越长移植物与宿主脑的界线越不清楚(图8,9),表明随着成活时间的延长移植物与宿主脑的整合越好。移植物成活到30d时,已可见到部分移植物中NOS阳性神经元纤长的阳性突起明显的生长到宿主海马排列有序的锥体层内(图4),或是生长到排列有序的齿状回颗粒层。在有些移植动物,移植物生长在齿状回内下部——移植物的下端游离或部分在海马裂,而NOS阳性神经元纤长的纤维生长方向极具特征,均朝向齿状回内部和海马,几乎见不到纤维向丘脑部或中间游离缘生长(图5,6)。在各个存活时间组,均可见到移植物中NOS阳性神经元的分布有一特征性现象,即NOS阳性神经元多数位于移植物与宿主脑组织交界区,如果移植物中央有阳性NOS神经元,也都是3~5个聚集成团,散在的NOS阳性神经元较少见,尤其是在短于2个月组的移植物中,这种特征更明显。除存活7d和14d两时间组外,其余各时间组,移植物中NOS阳性神经元的突起,均有部分可追踪进入宿主的海马及齿状回。但未追踪到宿主NOS阳性神经元的突起延伸入移植物。
, 百拇医药
讨 论
1. 移植后NOS阳性神经元发育表达的意义
从附表NOS神经元的发育规律来看,移植物内NOS神经元在第7d和第14d胞体较小、胞核较大及膨体不规则,而到30d时已发育为胞核正常膨体规则,其大小和形态与宿主基底前脑NOS阳性的神经元一样,表明移植物的NOS神经元在30d时已发育成熟。移植物NOS阳性神经元从第7d表达NOS开始一直到14d时,主要分布于突起,突起长而且多,突起及散在纤维上有较多大小不等的不规则膨体,但移植物NOS阳性神经元胞体小,细胞核大,阳性胞质少。这种现象表明移植物神经元在发育早期阶段是以纤维的生长,以及寻找适应的投射靶区建立突触联系为目的。而且NOS也参与了这一功能活动,因为有研究发现NO在突触的形成中发挥一定的作用[7]。该现象符合Edelman和Gally[8]的观点,即在神经系统发育中NO在突触连接形成中发挥作用,这些NOS阳性神经元和纤维可能在发育中发挥了一定程度的“通路寻找者(pathfinding)”的作用[9]。
, 百拇医药
神经膨体形成的原因可能是,NOS阳性产物主要分布在核膜,内质网膜及线粒体膜上等[10]。线粒体和内质网是细胞内的供能单位,移植物NOS阳性突起上早期的不规则膨体可能就是线粒体及内质网等所在部位,它们在这些部位合成和释放能量以及合成各种结构蛋白的功能很活跃,数量多,较集中,故表现为被NOS染色的膨大膨体。随着NOS阳性神经元的发育成熟和功能稳定,神经膨体也逐渐由不规则到规则直至消失。
2. 移植物NOS神经元与宿主建立联系的特征和意义
移植的神经组织至少通过两种途径良性的影响宿主动物的神经活性及其行为:(1)移植物对宿主的营养作用。最初移植物可以急性分泌一些神经因子,长期存活的移植物还可以作为一个泵,缓慢地弥漫地释放一些宿主脑缺乏的具有神经活性的化学性质物质,激素或神经介质等,移植物的营养作用不仅可以部分阻止损伤脑细胞继续死亡,还可以恢复或再建立宿主脑的功能。本研究结果表明,基底前脑神经元移植到宿主海马后直到6个月均良好成活。NOS阳性神经元从移植后7d到6个月都有稳定表达,提示NO这种神经活性介质可以在移植物内长期稳定地产生,从而对宿主脑不断地发挥作用。据研究一氧化氮可以通过自身所具有的气体弥散功能,从产生部位向周围直接扩散,无须转运机制,直接穿透细胞膜,在胞内直接发挥作用[11]。同时基底前脑的神经元移植到其靶区海马后,移植物与海马的靶性依赖关系迅速建立起来。宿主海马的靶性微环境及各种神经营养因子对移植物内NOS阳性神经元表达一氧化氮合酶具有诱导和促进作用。这种诱导和促进作用从移植物NOS阳性神经元的分布特征可以证明:移植物NOS阳性神经元大多位于靠近移植物的边界区,移植物中央区很少,因为靠近边界区其与宿主的联系距离短,易于受到各种营养的诱导作用。移植物中央NOS阳性神经元少的原因之一是受到宿主靶区的营养和诱导较少。在齿状回下部生长的移植物NOS阳性神经元纤维向海马和齿状回生长而不向游离缘生长的现象,更进一步的体现了移植物与宿主靶区的相互诱导作用。(2) 宿主功能的完全恢复必须依赖移植物与宿主脑整合,包括移植物重支配靶器官,移植物与宿主脑建立相互纤维联系等[12,13]。本研究中移植物成活1个月之后,各时间组移植物中NOS阳性神经元的突起,均有部分可追踪进入宿主的海马及齿状回,与海马的锥体细胞及齿状回颗粒层细胞发生联系,在一些部位NOS阳性纤维已长入宿主海马结构较远的距离。这表明,移植物和宿主脑已有良好的整合,基底前脑移植物能使宿主去基底前脑NOS纤维传入的海马重新获得NO能的部分神经支配。

, 百拇医药
图 版 说 明
图1,2存活30d同一移植物(G)位于CA1、CA2和齿状回分子层内,两种染色示移植物与宿主脑整合生长良好,无胶质增生现象,NOS神经元形态较完整。D.齿状回颗粒层,P.海马锥体层,L.海马腔隙分子层,图1 Nissl染色,图2 NADPH-d染色。标尺示100 μm
图3 存活7d移植物(g)位于齿状回内,NOS阳性神经元胞体小、突起长、膨体(Δ)大小不等且无规律。d.齿状回 标尺示150 μm
图4 存活30d移植物位于齿状回内,NOS阳性神经元纤维明显生长入海马CA3(C)锥体层,纤维末梢有规则的串珠样膨体,箭头示海马原有NOS阳性神经元。标尺示200 μm
图5 移植物位于齿状回内下方和海马裂内,存活30d。G.移植物 D.宿主齿状回 标尺示100 μm
, 百拇医药
图6 图5的放大,移植物NOS阳性神经元纤维均朝向宿主齿状回。标尺示200 μm
图7 海马腔隙分子层(L)内存活60d移植物(G),NOS阳性神经元生长良好,箭头示含铁血黄素。标尺示200 μm
图8 存活150d移植物(G)位于海马和齿状回内,NOS染色。H.宿主 D.齿状回 P.锥体层 标尺示40 μm
图9 海马CA2锥体层(P)和腔隙分子层(L)内存活180d移植物(G),移植物内细胞形态好,纤维丰富,部分纤维已生长入海马锥体层。标尺示100 μm
Explanation of figures
Fig.1,2 Same graft(G) among CA1,CA2 and stratum moleculare of dentate gyras 30 days after implantation. Two different stains show that graft and host brain growth well together, no glia overgrowth. D,dorsal stratum granulosum gyrus dentatus.P,stratum pyramidale. L,stratum lacunosum moleculare.Fig.1 Nissl stained. Fig.2 NADPH-d stained. Bar=100 μm
, 百拇医药
Fig.3 Graft(g) in dentate gyrus 7days after implantation, NOS positive neurons have small soma, big nucleus, long process, irregular varicosity(△). d,dentate gyrus Bar=150 μm
Fig.4 Graft in dentate gyrus 30 days after implantation, NOS positive fibers had expended into the CA3(C) pyramidal layer of Hippocampus. Regular string varicosity in end of fibers. arrow show the NOS positive neuron of host hippocampus.Bar=200 μm
, http://www.100md.com Fig.5 Graft in dentate gyrus and fissura hippocampi 30 days after implantation. G, graft D,dentate gyrus Bar=100 μm
Fig.6 Amplify Fig.5, Almost all the NOS positive fibers expended into dentate gyrus. Bar=200 μm
Fig.7 Graft(G) in lacuromolecular layer(L) of hippocampus 60 days after implantation, NOS positive neurons growth well. arrow show hemosiderin. Bar=200μm
Fig.8 Graft in hippocampus and dentate gyrus 150 days after implantation, H, host G,graft. D,stratum granulosum gyrus dentatus P,stratum pyramidale. Bar=40 μm
, http://www.100md.com
Fig.9 Graft(G) in CA3 stratum pyramidale (P) and stratum lacunosum moleculare(L) 180 days after implantation. NOS neurons shape well in graft, a lot of fibers. Some fiber had growthed into hippocampal stratum pyramidale.Bar=100 μm
△ Department of Anatomy, Division of Brain Research, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China
参考文献
[1]Lonart G, Cassels KL, Ichuson KM. Nitric oxide induce calcium-dependent[H3] dopamine release from striatal slice. J Neurosci Res, 1993,35(2):192
, 百拇医药
[2]Bohme GA, Bon C, Lemaire M, et al. Altered synaptic plasticity and memory of formation in nitric oxide synthase inhibitor-treated rats. Proc Natl Acad Sci USA, 1993,90(20):9191
[3]Wu WT. Expression of nitric-oxide synthase(NOS) in injured CNS neurons as shown by NADPH diaphorase histochemistry. Exp Neurol,1993,120(2):153
[4]Muller U.Inhibition of nitric oxide synthase impairs a distinct form of long-term memory in the honeybee. Apis mollifera, Neuron, 1996,16(3):541
, 百拇医药
[5]Bredt DS, Hwang PM, Snyder SH. Localization of nitric oxide synthase indicating a neural role for nitric oxide. Nature, 1990,347(6295):768
[6]姚志彬,袁群芳,顾耀铭,等.一氧化氮合成酶阳性神经元在大鼠前脑的分布.解剖学杂志,1995,18(4):328
[7]Truman JW, De Vente J, Ball EE. Nitric oxide sensitive guanylate cyclase activity is associated with the maturation phase of neuronal development in insects. Development, 1996,122(12):3949
[8]Edelman GM, Gally JA. Nitric oxide:linking space and time in the brain. Proc Natl Acad Sci USA, 1992,89(24):11651
, 百拇医药
[9]Bredt DS, Snyder SH. Transient nitric oxide synthase neurons in embryonic cerebral cortical plate, sensory ganglia and olfactory epithelium. Neuron,1994,13(2):301
[10]Wolf G, Wukdig S, Schuzel G. Nitric-oxide synthase in rat brain is predominantly located at neuronal endoplasmic reticulum:an electron microscopic demonstration of NADPH-diaphorase activity. Neurosci Let,1992,147(1):63
[11]Bredt DS, Snyder SH. Nitric oxide, a physiological messenger molecule. Annu Rev Biochem, 1994,63(1):175
, http://www.100md.com
[12]Bjorklund A, Lindall O. Mechanisms of action of intracerebral neural implants:studied on nigral and striatal grafts to the lesioned striatum. Trends Neurosci,1987,10(12):509
[13]Nillsson OG, Kalen P, Rosengren E, et al. Acetylcholine release from intrahippocampal septal grafts is under control of the host brain. Proc Natl Acad Sci USA,1990,87(7):2647
收稿1998-07 修回1998-03, 百拇医药