妊娠早期小鼠子宫内膜层粘连蛋白定位、定量及对胚泡植入的作用*
作者:李英 吕丹瑜 毕振伍 刘斌
单位:北京医科大学组织学胚胎学系,北京 100083
关键词:层粘连蛋白;胚泡;植入;免疫荧光;免疫组织化学;图像分析;小鼠
解剖学报990421 【摘 要】 目的 研究妊娠早期小鼠子宫内膜层粘连蛋白(laminin,LN)定位和定量变化及其对胚泡着床的作用。方法 应用间接免疫荧光法、免疫组织化学ABC技术及图像分析法进行LN定位和定量测定;利用子宫内注射LN抗体的方法探讨LN对小鼠胚泡植入的作用。 结果 动情期及妊娠早期小鼠子宫内膜内源性LN在上皮和腺基膜及血管内皮基膜均有表达,并随着植入的发生基膜的LN表达减弱,而内膜上皮中LN免疫染色逐渐增强;外源性LN对小鼠胚泡粘附与植入子宫内膜不产生明显影响,层粘连蛋白抗体明显抑制小鼠胚泡着床。 结论 动情期及妊娠早期小鼠子宫内膜的层粘连蛋白主要存在于基膜,胚泡植入期间内膜上皮细胞内LN的含量增加;LN在促进小鼠胚泡粘附与植入子宫内膜过程中起重要作用。
, 百拇医药
LOCALIZATION AND QUANTITATION OF LAMININ
IN MOUSE ENDOMETRIUM DURING EARLY PREGNANCY
AND ITS ROLE ON BLASTOCYST IMPLANTATION
Li Ying△, L Danyu, Bi Zhenwu, Liu Bin
Danyu, Bi Zhenwu, Liu Bin
(Department of Histology and Embryology, Beijing Medical University, Beijing)
【Abstract】 Objective To study the localization and quantitation of laminin(LN) in mouse endometrium during early pregnancy and its role on blastocyst implantation. Methods LN in mouse endometrium was shown and measured with indirect immunofluorescence techniques, immunohistochemical ABC method and image analysis system. The effect of LN on the implantation was studied by using LN-antibody intra-uterine injection.Results The expression of endogenous LN was found in the basement membrane of epithelium, glands and blood vessels in uterine endometrium of both estrus and early pregnancy. And its was faint that LN present in basement membrane as the implantation occurs, but the LN immunostaining in the epithelial cells of endometrium was stronger. The exogenous LN has no obvious influence on blastocyst attachment and implantation. LN-antibody intra-uterine injection showed significant repressing effect on mouse blastocyst implantation. Conclusions The LN mainly distributed in basement membrane of endometrium during estrus and early pregnancy in mouse.LN content in the epithelial cells was increased during the implantation. LN in mouse endometrium may play an important role in the process promoting blastocyst attachment and implantation.
, 百拇医药
【Key words】 Laminin; Blastocyst; Implantation; Immunofluorescence; Immunohistochemistry; Image analysis; mouse
人类和哺乳类动物胚胎着床是个很复杂的过程,受多种因素影响和调控,其中包括可溶性分子,如雌激素、孕激素、前列腺素及宫腔内多种酶和K+、Na+、Ca2+等离子。近年来研究发现,一些不溶性的细胞外大分子如细胞粘附因子中纤维粘连蛋白、层粘连蛋白、胶原蛋白、血纤维蛋白和XIII因子等在胚胎着床及发育过程中也起着很重要的作用。
1979年,Timple和Martin[1]首次提出,细胞外基质中存在着一种重要的非胶原糖蛋白,分子量为950 000,并命名为层粘连蛋白(laminin,LN)。研究证明,LN具有多种生物学活性,如促进细胞粘着、铺展、移动,调节细胞的增殖与分化[2]及肿瘤细胞的转移过程[3]。1991年,Carnegie[4]在大鼠胚泡体外培养研究中,证实LN与FN(纤维粘连蛋白)的存在对胚泡粘附及内细胞团生长均起促进作用。目前有关子宫内源性LN的研究较少,尚无对LN进行定量分析的报道,本研究应用间接免疫荧光法、免疫组织化学ABC技术及图像分析法,探讨了动情期与妊娠早期小鼠子宫内膜LN的表达,及LN抗体对胚泡着床的抑制作用,为研究胚泡着床机理提供形态学依据。
, 百拇医药
材料和方法
1.主要试剂
LN源于小鼠EHS(Engelbreth-Holm-Swarm)瘤,LN与LN多克隆抗体(兔抗小鼠)均由北京医科大学细胞生物学系制备提供。ABC药盒购于美国Vector公司。异硫氰酸荧光素(FITC)标记的羊抗兔IgG购于北京中山生物制品有限公司。冷冻保护剂PVA(polyvinyl alcohol type Ⅱ)的主要成分是聚乙烯醇,由本实验室自制。
2.动物
选用成年雌性昆明小鼠共62只,体重25~35g,其中35只用于内源性LN实验,其余27只用作外源性LN实验。雌、雄小鼠按2∶1合笼,次日清晨检查,发现阴栓为妊娠第1d(D1)。
3.子宫内膜LN免疫组织化学定位
, 百拇医药
为证实LN在小鼠子宫内膜的确切定位我们采用了以下两种方法进行比较和观察。
3.1 免疫荧光方法:取动情期及妊娠D1~D6小鼠子宫角中部各2~3段,每段0.3~0.5cm,部分组织块立即放入预冷(-160℃)的异戊烷内30~45s,再存入液氮内;或将子宫组织放在冷冻包埋剂PVA中,直接投入液氮内存放。将上述组织用Leitz1720型恒冷箱切片机制成冷冻切片,厚6μm。一抗为兔抗小鼠LN抗体(1∶1 000稀释),在4℃冰箱中孵育20h。二抗为FITC标记的羊抗兔IgG(1∶5稀释),37℃温箱中孵育45min,甘油-PBS封片后,Olympus荧光显微镜下观察,摄片。
3.2 免疫组织化学ABC法:取上述部分子宫组织,用4%多聚甲醛固定过夜,石蜡包埋,制成6μm厚的石蜡切片,贴在预先涂好防脱片剂的载玻片上,37℃烤箱内烘干后进行ABC法免疫组织化学染色,用上述一抗(1∶800稀释),在4℃中孵育24h,二抗为生物素标记的羊抗兔IgG抗体(1∶200稀释),室温孵育1h,ABC复合物室温孵育30min,H2O2-DAB显色。
, 百拇医药
方法特异性对照均采用PBS替代第一抗体,其余步骤相同。
4.植入前后小鼠子宫内膜LN原位定量
小鼠动情期子宫与妊娠D1~D6子宫各取5例,冰冻切片后进行上述免疫组织化学染色,方法特异性对照仍采用PBS替代第一抗体,用Q-550IW图象分析系统(Leica公司)测定每天子宫内膜LN的相对含量。在光学显微镜下,沿着内膜上皮和基膜每例随机测5个单位面积,各组LN的相对含量以 ±s
±s 表示,各组间用ANOVA、继以Newman-Kculs检验进行统计学处理。
表示,各组间用ANOVA、继以Newman-Kculs检验进行统计学处理。
5. 小鼠子宫内抗体注射
将妊娠小鼠随机分为4组:注射层粘连蛋白组(LN组,6只);注射层粘连蛋白抗体组(LN-Ab组,8只);生理盐水对照组(NS组,8只)和空白对照组(正常妊娠非手术组,5只)。其中LN组,LN-Ab组和NS组动物于妊娠第4d(D4)上午分别在双侧子宫角注射LN13.4 μg(溶于10μl超纯水中)、LN-Ab原液10μl(效价1:6 400)和生理盐水10μl,空白对照组妊娠后未作任何处理。于妊娠第9d剖腹观察统计胚胎着床数并在解剖镜下检测双侧卵巢黄体数目,计算妊娠率(妊娠率=胚胎着床数÷黄体数×100%),结果进行统计学处理。
, 百拇医药
结 果
1. 内源性LN在子宫内膜的免疫组织化学定位
用免疫荧光方法显示,在动情期与D1、D2小鼠子宫内膜的上皮基膜、子宫腺基膜及血管内皮基膜中均有层粘连蛋白表达,呈强阳性(图1,2),内膜上皮胞浆LN反应呈弱阳性,细胞核阴性,血管内皮细胞与腺上皮均为阴性。ABC法所示小鼠动情期及妊娠早期子宫内膜LN的反应物质为深棕色,其分布结果与免疫荧光结果一致(图3)(本实验过程中需经胰蛋白酶消化,此标本的上皮细胞已脱落,故胞浆中LN未显示出)。D3基膜的层连蛋白免疫染色减弱,D4~D5更弱,并呈现基膜断裂现象,此时子宫内膜上皮中可见强阳性层粘连蛋白免疫反应产物(图4)。方法特异性对照LN反应均为阴性。
2.植入前、后小鼠子宫内膜LN相对含量变化
植入前、后小鼠子宫内膜LN免疫染色物质的相对含量检测结果(表1):妊娠D1~D2小鼠子宫内膜上皮和基膜LN的含量与动情期相似,没有统计学意义(P>0.05)。从妊娠D3起LN含量开始增加,直到D5达到高峰(P<0.05),此时正置胚泡植入时刻。D6内膜上皮和基膜LN含量比D5明显下降(P<0.05)。
, 百拇医药
表1 胚泡植入前、后小鼠子宫内膜LN免疫染色物质相对含量变化
Table 1 The immunostaining substance quantitation of LN in the mouse endometrium
before and after blastocysts implantation 组别
group
动物处理
treatment
of animal
动物数
number of
, 百拇医药
animal
测量面积数
number of
measured area
单位面积LN(均值±标准误)
LN/unit area
( ±s
±s )
)
control
estrus
5
, 百拇医药
5
0.1772±0.0103
D1
Day 1 of pregnancy
5
5
0.1977±0.0093*
D2
Day 1 of pregnancy
5
5
0.1857±0.0135*
, 百拇医药
D3
Day 3 of pregnancy
5
5
0.6308±0.1786**
D4
Day 4 of pregnancy
5
5
0.5178±0.1969**
D5
Day 5 of pregnancy
, http://www.100md.com
5
5
0.7138±0.1587**
D6
Day 6 of pregnancy
5
5
0.1734±0.0139***
与对照组比较,*P>0.05,**P<0.05,与D5组比较,***P<0.05
Compared with control, *P>0.05,**P<0.05;compared with group D5, ***P<0.05
, http://www.100md.com
3.外源性LN和LN-Ab对小鼠胚胎植入的作用(表2)
从表2可以看出,空白对照组的平均胚泡着床数和妊娠率分别为12.80±1.53和82.83%±3.46%(n=5),生理盐水组为10.50±1.39和68.87%±6.63%(n=8),后者略低于前者,说明手术创伤对着床数及妊娠率均产生一定的影响,但无统计学意义(P>0.05)。LN组孕卵着床数和妊娠率分别为10.50±1.55和82.25%±2.86%(n=6),和生理盐水组相比其着床数相等,着床率虽略有升高(与空白对照组相当),但两者间无显著性差异(P>0.05);注入LN-Ab组的小鼠平均着床数和妊娠率分别为0.25±0.17和2.1%±1.46%(n=8),均较生理盐水组大幅度下降,除其中两只小鼠各有1个胚胎发生着床外,其余6只小鼠的胚胎着床过程完全被抑制,两组间作统计学比较有极显著性差异(P<0.001),表明LN-Ab有明显抑制小鼠胚泡植入着床的效应。
表2 外源性LN和LN-Ab对小鼠胚泡植入的作用
, 百拇医药
Table 2 Effect of exogenous laminin and against laminin antibody on blastocyst implantation in mouse 组别
group
动物数
number of
animal
剂 量
dose of
reagent
黄体数
(均值±标准误)
, http://www.100md.com
number of corpus luteum
( ±s
±s )
)
着床数
(均值±标准误)
number of implantation
( ±s
±s )
)
妊娠率(%)
, 百拇医药
(均值±标准误)
rate of pregnancy(%)
( ±s
±s )
)
control
5
No treatment
15.4±0.71
12.80±1.53
82.83±3.46
, 百拇医药 N S
8
NS 10.0μl
15.0±1.21
10.50±1.39*
68.87±6.63*
LN
6
LN13.4 μg(10μl)
12.83±1.14
10.50±1.55**
, http://www.100md.com
82.25±2.86**
LN-Ab
8
LN-Ab 10.0μl
2.5±0.86
0.25±0.17***
2.1±1.46***
与对照组比较,*P>0.05,与NS组比较,**P>0.05,***P<0.001
Compared with control, *P>0.05;compared with group NS, **P>0.05,***P<0.001讨 论
, 百拇医药
着床是胚泡在子宫内膜的粘附、侵入和子宫内膜对胚泡包埋的过程,是两者共同作用的结果,但着床机理目前尚不清楚。近年研究表明,子宫内膜和滋养层的细胞粘附分子对胚泡着床起重要作用[5]。层粘连蛋白(LN)作为细胞外基质中的粘附分子之一,能促使小鼠胚泡在体外粘附与生长的作用国外已有报道[4][6],我们的实验结果与国外报道一致[7]。本实验观察的外源性LN对小鼠胚泡在体内粘附与着床的作用中,发现外源性LN在小鼠子宫内对胚泡粘附与植入的作用不明显,表明在植入期间子宫内膜可能有足够的LN,以介导胚泡的粘附和植入。LN抗体明显抑制小鼠胚泡着床,表明子宫内膜的LN与LN抗体结合后失去了介导胚泡粘附于子宫内膜的作用,而使胚泡着床数减少,妊娠率下降(表2),这在国内外未见报道。我们进一步研究发现胚泡的滋养层细胞及内细胞团均有LN表达,提示对植入的发生也有重要意义[8]。曾国庆等[9]最近研究表明,人工合成LN的两种活性肽段cYIGSR与RGDS对小鼠胚泡着床有明显的抑制作用,可能由于这两种人工合成的活性肽段与对LN子宫内膜表面LN受体的竞争结合所致。
, http://www.100md.com
子宫内膜与胚胎发育变化同步是胚泡粘附与着床成功的必要条件。本实验采用免疫荧光和ABC两种免疫定位方法加以比较,均证实动情期、妊娠早期小鼠子宫内膜上皮基膜、腺上皮基膜以及血管内皮基膜中有大量的LN存在。LN定位于基膜中,这与其他学者[10]研究结果相同。本研究结果提示,从动情期开始子宫内膜就准备好胚泡粘附及着床所需要的LN(FN及胶原蛋白)等细胞粘附因子,在植入之前,LN或许已释放到子宫腔内,而不贮存在基膜中,以利于胚泡的粘附,故本实验中发现植入前基膜中LN有减弱的现象。另外,在小鼠妊娠D5植入时,我们还见到有的基膜不完整,其原因可能是基膜中原有的LN降解,以利于胚泡的侵入。在以往子宫内膜免疫组织化学研究中,未见有LN存在于上皮细胞中的报道。我们的研究结果除了证明LN在动情期及妊娠早期小鼠子宫内膜基膜中存在,并随着植入的发生而减弱;还在植入时子宫内膜上皮细胞胞浆内显示了LN阳性反应颗粒,并随着植入的发生逐渐增强。同时,在对子宫内膜LN在胚泡植入过程中的定量分析发现,虽然植入时基膜中的LN减弱,但上皮中的含量是增加的,在植入时(D5)子宫内膜的LN总量达到高峰(表1),植入后又降到妊娠时(D1和D2)的水平。以上研究结果从形态学上证明,LN在促进胚泡着床过程中起重要作用。
, 百拇医药
感谢我校细胞生物学系周柔丽教授的支持和指教。
图版说明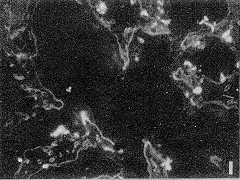

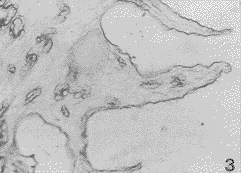

图1 动情期小鼠于宫内膜冰冻切片LN兔疫荧光染色,内膜上皮和血管内皮基膜均呈LN阳性 ×200
图2 妊娠D1小鼠于宫内膜冰冻切片LN免疫荧光染色,内膜上皮基膜、腺基膜和血管内皮基膜LN均呈线状强荧光反应,内膜上皮呈弱阳性调 ×200
图3 妊娠D1小鼠子宫内膜石蜡切片LN免疫组织化学染色,内膜上皮基膜、腺基膜和血管内皮基膜LN均呈强阳性反应。内膜上皮脱落 ×200
, http://www.100md.com
图4 妊娠D5小鼠子宫内膜石蜡切片LN免疫组织化学染色:内膜上皮细胞中LN呈强阳性,上皮基膜反应弱 ×200
Explanation of figures
Fig. 1 Photomicrograph of frozen section from the mouse endometrium of estrus with immunofluorescence staining. Positive LN fluorescenceshowed on the basement membrane of epithelium and blood vessels. × 200
Fig. 2 Photomicrograph of frozen section froiii the mouse endometrium of pregnancy D1 with immunofluorescence staining. Strong LN fluorescence showed on the basement rnembrane of epithelium, gland and blood vessels , but the epithelium was weak. × 200
, 百拇医药
Fig. 3 Photomicrograph of paraffin section from the mouse endometrium of pregnancy D1. Strong LN immunostaining showed on the basement niembrane of epithelium, gland and blood vessels. The epithelial cells had dropped. lmmunohistochemical staining. ×200
Fig. 4 Photomicrograph of paraffin section from the mouse endometrium of pregnancy DS. Strong LN immunostaining showedon the epitheliurn. but the basement membrane was weak. Immunohistochemical staining. × 200
, 百拇医药
*国家自然科学基金资助课题(No.39370371)
△ Department of Histology and Embryology, Beijing Medical University, Beijing 100083, China.
参考文献
1 Timple R, Rohde H, Gehron P, et al. Laminin-a glycoprotein from basement membranes. J Biol Chem, 1979,254(19):9933
2 周柔丽.层粘连蛋白——一种分子结构独特、生物学功能复杂的基膜糖蛋白.国外医学(分子生物学分册),1985,7(1):13
3 周柔丽,高素英,王苏,等.层粘连蛋白促进实体瘤粘着及3H-TdR掺入.生物化学杂志,1987,3(3):261
, 百拇医药
4 Canegie J A. Immunolocalization of fibronectin and laminin within rat blastocyst cultured under serum-free conditions. J Reprod Fert, 1991,91(2):423
5 张炜,周剑萍,张俊慧.细胞粘附分子与胚泡着床的关系.生殖与避孕,1998,18(4):201
6 Armant D R, Kaplan H A, Lennarz W J. Fibronectin and laminin promote in vitro attachment and outgrowth of mouse blastocysts. Dev Biol, 1986,116(2):519
7 李英,吕丹瑜,刘斌,等.层粘连蛋白及其抗体对小鼠胚泡体外粘附、铺展和生长的作用.北京医科大学学报(待发表)
, http://www.100md.com
8 李英,吕丹瑜,刘斌,等.层粘连蛋白在小鼠胚胎早期发育期间的表达与分布.北京医科大学学报(待发表)
9 曾国庆,蒋广泰.层粘连蛋白活性肽段对小鼠胚泡着床的影响,动物学报,1997,43(2):221
10 Magro C, Grasso S. Expression of cytokeratins, vimentin and basement membrane components in human fetal male Müllerian duct and perimullerian mesenchyme. Acta Histochem, 1995,97(1):13
收稿1998-10 修回1999-03, http://www.100md.com
单位:北京医科大学组织学胚胎学系,北京 100083
关键词:层粘连蛋白;胚泡;植入;免疫荧光;免疫组织化学;图像分析;小鼠
解剖学报990421 【摘 要】 目的 研究妊娠早期小鼠子宫内膜层粘连蛋白(laminin,LN)定位和定量变化及其对胚泡着床的作用。方法 应用间接免疫荧光法、免疫组织化学ABC技术及图像分析法进行LN定位和定量测定;利用子宫内注射LN抗体的方法探讨LN对小鼠胚泡植入的作用。 结果 动情期及妊娠早期小鼠子宫内膜内源性LN在上皮和腺基膜及血管内皮基膜均有表达,并随着植入的发生基膜的LN表达减弱,而内膜上皮中LN免疫染色逐渐增强;外源性LN对小鼠胚泡粘附与植入子宫内膜不产生明显影响,层粘连蛋白抗体明显抑制小鼠胚泡着床。 结论 动情期及妊娠早期小鼠子宫内膜的层粘连蛋白主要存在于基膜,胚泡植入期间内膜上皮细胞内LN的含量增加;LN在促进小鼠胚泡粘附与植入子宫内膜过程中起重要作用。
, 百拇医药
LOCALIZATION AND QUANTITATION OF LAMININ
IN MOUSE ENDOMETRIUM DURING EARLY PREGNANCY
AND ITS ROLE ON BLASTOCYST IMPLANTATION
Li Ying△, L
 Danyu, Bi Zhenwu, Liu Bin
Danyu, Bi Zhenwu, Liu Bin(Department of Histology and Embryology, Beijing Medical University, Beijing)
【Abstract】 Objective To study the localization and quantitation of laminin(LN) in mouse endometrium during early pregnancy and its role on blastocyst implantation. Methods LN in mouse endometrium was shown and measured with indirect immunofluorescence techniques, immunohistochemical ABC method and image analysis system. The effect of LN on the implantation was studied by using LN-antibody intra-uterine injection.Results The expression of endogenous LN was found in the basement membrane of epithelium, glands and blood vessels in uterine endometrium of both estrus and early pregnancy. And its was faint that LN present in basement membrane as the implantation occurs, but the LN immunostaining in the epithelial cells of endometrium was stronger. The exogenous LN has no obvious influence on blastocyst attachment and implantation. LN-antibody intra-uterine injection showed significant repressing effect on mouse blastocyst implantation. Conclusions The LN mainly distributed in basement membrane of endometrium during estrus and early pregnancy in mouse.LN content in the epithelial cells was increased during the implantation. LN in mouse endometrium may play an important role in the process promoting blastocyst attachment and implantation.
, 百拇医药
【Key words】 Laminin; Blastocyst; Implantation; Immunofluorescence; Immunohistochemistry; Image analysis; mouse
人类和哺乳类动物胚胎着床是个很复杂的过程,受多种因素影响和调控,其中包括可溶性分子,如雌激素、孕激素、前列腺素及宫腔内多种酶和K+、Na+、Ca2+等离子。近年来研究发现,一些不溶性的细胞外大分子如细胞粘附因子中纤维粘连蛋白、层粘连蛋白、胶原蛋白、血纤维蛋白和XIII因子等在胚胎着床及发育过程中也起着很重要的作用。
1979年,Timple和Martin[1]首次提出,细胞外基质中存在着一种重要的非胶原糖蛋白,分子量为950 000,并命名为层粘连蛋白(laminin,LN)。研究证明,LN具有多种生物学活性,如促进细胞粘着、铺展、移动,调节细胞的增殖与分化[2]及肿瘤细胞的转移过程[3]。1991年,Carnegie[4]在大鼠胚泡体外培养研究中,证实LN与FN(纤维粘连蛋白)的存在对胚泡粘附及内细胞团生长均起促进作用。目前有关子宫内源性LN的研究较少,尚无对LN进行定量分析的报道,本研究应用间接免疫荧光法、免疫组织化学ABC技术及图像分析法,探讨了动情期与妊娠早期小鼠子宫内膜LN的表达,及LN抗体对胚泡着床的抑制作用,为研究胚泡着床机理提供形态学依据。
, 百拇医药
材料和方法
1.主要试剂
LN源于小鼠EHS(Engelbreth-Holm-Swarm)瘤,LN与LN多克隆抗体(兔抗小鼠)均由北京医科大学细胞生物学系制备提供。ABC药盒购于美国Vector公司。异硫氰酸荧光素(FITC)标记的羊抗兔IgG购于北京中山生物制品有限公司。冷冻保护剂PVA(polyvinyl alcohol type Ⅱ)的主要成分是聚乙烯醇,由本实验室自制。
2.动物
选用成年雌性昆明小鼠共62只,体重25~35g,其中35只用于内源性LN实验,其余27只用作外源性LN实验。雌、雄小鼠按2∶1合笼,次日清晨检查,发现阴栓为妊娠第1d(D1)。
3.子宫内膜LN免疫组织化学定位
, 百拇医药
为证实LN在小鼠子宫内膜的确切定位我们采用了以下两种方法进行比较和观察。
3.1 免疫荧光方法:取动情期及妊娠D1~D6小鼠子宫角中部各2~3段,每段0.3~0.5cm,部分组织块立即放入预冷(-160℃)的异戊烷内30~45s,再存入液氮内;或将子宫组织放在冷冻包埋剂PVA中,直接投入液氮内存放。将上述组织用Leitz1720型恒冷箱切片机制成冷冻切片,厚6μm。一抗为兔抗小鼠LN抗体(1∶1 000稀释),在4℃冰箱中孵育20h。二抗为FITC标记的羊抗兔IgG(1∶5稀释),37℃温箱中孵育45min,甘油-PBS封片后,Olympus荧光显微镜下观察,摄片。
3.2 免疫组织化学ABC法:取上述部分子宫组织,用4%多聚甲醛固定过夜,石蜡包埋,制成6μm厚的石蜡切片,贴在预先涂好防脱片剂的载玻片上,37℃烤箱内烘干后进行ABC法免疫组织化学染色,用上述一抗(1∶800稀释),在4℃中孵育24h,二抗为生物素标记的羊抗兔IgG抗体(1∶200稀释),室温孵育1h,ABC复合物室温孵育30min,H2O2-DAB显色。
, 百拇医药
方法特异性对照均采用PBS替代第一抗体,其余步骤相同。
4.植入前后小鼠子宫内膜LN原位定量
小鼠动情期子宫与妊娠D1~D6子宫各取5例,冰冻切片后进行上述免疫组织化学染色,方法特异性对照仍采用PBS替代第一抗体,用Q-550IW图象分析系统(Leica公司)测定每天子宫内膜LN的相对含量。在光学显微镜下,沿着内膜上皮和基膜每例随机测5个单位面积,各组LN的相对含量以
 ±s
±s 表示,各组间用ANOVA、继以Newman-Kculs检验进行统计学处理。
表示,各组间用ANOVA、继以Newman-Kculs检验进行统计学处理。5. 小鼠子宫内抗体注射
将妊娠小鼠随机分为4组:注射层粘连蛋白组(LN组,6只);注射层粘连蛋白抗体组(LN-Ab组,8只);生理盐水对照组(NS组,8只)和空白对照组(正常妊娠非手术组,5只)。其中LN组,LN-Ab组和NS组动物于妊娠第4d(D4)上午分别在双侧子宫角注射LN13.4 μg(溶于10μl超纯水中)、LN-Ab原液10μl(效价1:6 400)和生理盐水10μl,空白对照组妊娠后未作任何处理。于妊娠第9d剖腹观察统计胚胎着床数并在解剖镜下检测双侧卵巢黄体数目,计算妊娠率(妊娠率=胚胎着床数÷黄体数×100%),结果进行统计学处理。
, 百拇医药
结 果
1. 内源性LN在子宫内膜的免疫组织化学定位
用免疫荧光方法显示,在动情期与D1、D2小鼠子宫内膜的上皮基膜、子宫腺基膜及血管内皮基膜中均有层粘连蛋白表达,呈强阳性(图1,2),内膜上皮胞浆LN反应呈弱阳性,细胞核阴性,血管内皮细胞与腺上皮均为阴性。ABC法所示小鼠动情期及妊娠早期子宫内膜LN的反应物质为深棕色,其分布结果与免疫荧光结果一致(图3)(本实验过程中需经胰蛋白酶消化,此标本的上皮细胞已脱落,故胞浆中LN未显示出)。D3基膜的层连蛋白免疫染色减弱,D4~D5更弱,并呈现基膜断裂现象,此时子宫内膜上皮中可见强阳性层粘连蛋白免疫反应产物(图4)。方法特异性对照LN反应均为阴性。
2.植入前、后小鼠子宫内膜LN相对含量变化
植入前、后小鼠子宫内膜LN免疫染色物质的相对含量检测结果(表1):妊娠D1~D2小鼠子宫内膜上皮和基膜LN的含量与动情期相似,没有统计学意义(P>0.05)。从妊娠D3起LN含量开始增加,直到D5达到高峰(P<0.05),此时正置胚泡植入时刻。D6内膜上皮和基膜LN含量比D5明显下降(P<0.05)。
, 百拇医药
表1 胚泡植入前、后小鼠子宫内膜LN免疫染色物质相对含量变化
Table 1 The immunostaining substance quantitation of LN in the mouse endometrium
before and after blastocysts implantation 组别
group
动物处理
treatment
of animal
动物数
number of
, 百拇医药
animal
测量面积数
number of
measured area
单位面积LN(均值±标准误)
LN/unit area
(
 ±s
±s )
)control
estrus
5
, 百拇医药
5
0.1772±0.0103
D1
Day 1 of pregnancy
5
5
0.1977±0.0093*
D2
Day 1 of pregnancy
5
5
0.1857±0.0135*
, 百拇医药
D3
Day 3 of pregnancy
5
5
0.6308±0.1786**
D4
Day 4 of pregnancy
5
5
0.5178±0.1969**
D5
Day 5 of pregnancy
, http://www.100md.com
5
5
0.7138±0.1587**
D6
Day 6 of pregnancy
5
5
0.1734±0.0139***
与对照组比较,*P>0.05,**P<0.05,与D5组比较,***P<0.05
Compared with control, *P>0.05,**P<0.05;compared with group D5, ***P<0.05
, http://www.100md.com
3.外源性LN和LN-Ab对小鼠胚胎植入的作用(表2)
从表2可以看出,空白对照组的平均胚泡着床数和妊娠率分别为12.80±1.53和82.83%±3.46%(n=5),生理盐水组为10.50±1.39和68.87%±6.63%(n=8),后者略低于前者,说明手术创伤对着床数及妊娠率均产生一定的影响,但无统计学意义(P>0.05)。LN组孕卵着床数和妊娠率分别为10.50±1.55和82.25%±2.86%(n=6),和生理盐水组相比其着床数相等,着床率虽略有升高(与空白对照组相当),但两者间无显著性差异(P>0.05);注入LN-Ab组的小鼠平均着床数和妊娠率分别为0.25±0.17和2.1%±1.46%(n=8),均较生理盐水组大幅度下降,除其中两只小鼠各有1个胚胎发生着床外,其余6只小鼠的胚胎着床过程完全被抑制,两组间作统计学比较有极显著性差异(P<0.001),表明LN-Ab有明显抑制小鼠胚泡植入着床的效应。
表2 外源性LN和LN-Ab对小鼠胚泡植入的作用
, 百拇医药
Table 2 Effect of exogenous laminin and against laminin antibody on blastocyst implantation in mouse 组别
group
动物数
number of
animal
剂 量
dose of
reagent
黄体数
(均值±标准误)
, http://www.100md.com
number of corpus luteum
(
 ±s
±s )
)着床数
(均值±标准误)
number of implantation
(
 ±s
±s )
)妊娠率(%)
, 百拇医药
(均值±标准误)
rate of pregnancy(%)
(
 ±s
±s )
)control
5
No treatment
15.4±0.71
12.80±1.53
82.83±3.46
, 百拇医药 N S
8
NS 10.0μl
15.0±1.21
10.50±1.39*
68.87±6.63*
LN
6
LN13.4 μg(10μl)
12.83±1.14
10.50±1.55**
, http://www.100md.com
82.25±2.86**
LN-Ab
8
LN-Ab 10.0μl
2.5±0.86
0.25±0.17***
2.1±1.46***
与对照组比较,*P>0.05,与NS组比较,**P>0.05,***P<0.001
Compared with control, *P>0.05;compared with group NS, **P>0.05,***P<0.001讨 论
, 百拇医药
着床是胚泡在子宫内膜的粘附、侵入和子宫内膜对胚泡包埋的过程,是两者共同作用的结果,但着床机理目前尚不清楚。近年研究表明,子宫内膜和滋养层的细胞粘附分子对胚泡着床起重要作用[5]。层粘连蛋白(LN)作为细胞外基质中的粘附分子之一,能促使小鼠胚泡在体外粘附与生长的作用国外已有报道[4][6],我们的实验结果与国外报道一致[7]。本实验观察的外源性LN对小鼠胚泡在体内粘附与着床的作用中,发现外源性LN在小鼠子宫内对胚泡粘附与植入的作用不明显,表明在植入期间子宫内膜可能有足够的LN,以介导胚泡的粘附和植入。LN抗体明显抑制小鼠胚泡着床,表明子宫内膜的LN与LN抗体结合后失去了介导胚泡粘附于子宫内膜的作用,而使胚泡着床数减少,妊娠率下降(表2),这在国内外未见报道。我们进一步研究发现胚泡的滋养层细胞及内细胞团均有LN表达,提示对植入的发生也有重要意义[8]。曾国庆等[9]最近研究表明,人工合成LN的两种活性肽段cYIGSR与RGDS对小鼠胚泡着床有明显的抑制作用,可能由于这两种人工合成的活性肽段与对LN子宫内膜表面LN受体的竞争结合所致。
, http://www.100md.com
子宫内膜与胚胎发育变化同步是胚泡粘附与着床成功的必要条件。本实验采用免疫荧光和ABC两种免疫定位方法加以比较,均证实动情期、妊娠早期小鼠子宫内膜上皮基膜、腺上皮基膜以及血管内皮基膜中有大量的LN存在。LN定位于基膜中,这与其他学者[10]研究结果相同。本研究结果提示,从动情期开始子宫内膜就准备好胚泡粘附及着床所需要的LN(FN及胶原蛋白)等细胞粘附因子,在植入之前,LN或许已释放到子宫腔内,而不贮存在基膜中,以利于胚泡的粘附,故本实验中发现植入前基膜中LN有减弱的现象。另外,在小鼠妊娠D5植入时,我们还见到有的基膜不完整,其原因可能是基膜中原有的LN降解,以利于胚泡的侵入。在以往子宫内膜免疫组织化学研究中,未见有LN存在于上皮细胞中的报道。我们的研究结果除了证明LN在动情期及妊娠早期小鼠子宫内膜基膜中存在,并随着植入的发生而减弱;还在植入时子宫内膜上皮细胞胞浆内显示了LN阳性反应颗粒,并随着植入的发生逐渐增强。同时,在对子宫内膜LN在胚泡植入过程中的定量分析发现,虽然植入时基膜中的LN减弱,但上皮中的含量是增加的,在植入时(D5)子宫内膜的LN总量达到高峰(表1),植入后又降到妊娠时(D1和D2)的水平。以上研究结果从形态学上证明,LN在促进胚泡着床过程中起重要作用。
, 百拇医药
感谢我校细胞生物学系周柔丽教授的支持和指教。
图版说明




图1 动情期小鼠于宫内膜冰冻切片LN兔疫荧光染色,内膜上皮和血管内皮基膜均呈LN阳性 ×200
图2 妊娠D1小鼠于宫内膜冰冻切片LN免疫荧光染色,内膜上皮基膜、腺基膜和血管内皮基膜LN均呈线状强荧光反应,内膜上皮呈弱阳性调 ×200
图3 妊娠D1小鼠子宫内膜石蜡切片LN免疫组织化学染色,内膜上皮基膜、腺基膜和血管内皮基膜LN均呈强阳性反应。内膜上皮脱落 ×200
, http://www.100md.com
图4 妊娠D5小鼠子宫内膜石蜡切片LN免疫组织化学染色:内膜上皮细胞中LN呈强阳性,上皮基膜反应弱 ×200
Explanation of figures
Fig. 1 Photomicrograph of frozen section from the mouse endometrium of estrus with immunofluorescence staining. Positive LN fluorescenceshowed on the basement membrane of epithelium and blood vessels. × 200
Fig. 2 Photomicrograph of frozen section froiii the mouse endometrium of pregnancy D1 with immunofluorescence staining. Strong LN fluorescence showed on the basement rnembrane of epithelium, gland and blood vessels , but the epithelium was weak. × 200
, 百拇医药
Fig. 3 Photomicrograph of paraffin section from the mouse endometrium of pregnancy D1. Strong LN immunostaining showed on the basement niembrane of epithelium, gland and blood vessels. The epithelial cells had dropped. lmmunohistochemical staining. ×200
Fig. 4 Photomicrograph of paraffin section from the mouse endometrium of pregnancy DS. Strong LN immunostaining showedon the epitheliurn. but the basement membrane was weak. Immunohistochemical staining. × 200
, 百拇医药
*国家自然科学基金资助课题(No.39370371)
△ Department of Histology and Embryology, Beijing Medical University, Beijing 100083, China.
参考文献
1 Timple R, Rohde H, Gehron P, et al. Laminin-a glycoprotein from basement membranes. J Biol Chem, 1979,254(19):9933
2 周柔丽.层粘连蛋白——一种分子结构独特、生物学功能复杂的基膜糖蛋白.国外医学(分子生物学分册),1985,7(1):13
3 周柔丽,高素英,王苏,等.层粘连蛋白促进实体瘤粘着及3H-TdR掺入.生物化学杂志,1987,3(3):261
, 百拇医药
4 Canegie J A. Immunolocalization of fibronectin and laminin within rat blastocyst cultured under serum-free conditions. J Reprod Fert, 1991,91(2):423
5 张炜,周剑萍,张俊慧.细胞粘附分子与胚泡着床的关系.生殖与避孕,1998,18(4):201
6 Armant D R, Kaplan H A, Lennarz W J. Fibronectin and laminin promote in vitro attachment and outgrowth of mouse blastocysts. Dev Biol, 1986,116(2):519
7 李英,吕丹瑜,刘斌,等.层粘连蛋白及其抗体对小鼠胚泡体外粘附、铺展和生长的作用.北京医科大学学报(待发表)
, http://www.100md.com
8 李英,吕丹瑜,刘斌,等.层粘连蛋白在小鼠胚胎早期发育期间的表达与分布.北京医科大学学报(待发表)
9 曾国庆,蒋广泰.层粘连蛋白活性肽段对小鼠胚泡着床的影响,动物学报,1997,43(2):221
10 Magro C, Grasso S. Expression of cytokeratins, vimentin and basement membrane components in human fetal male Müllerian duct and perimullerian mesenchyme. Acta Histochem, 1995,97(1):13
收稿1998-10 修回1999-03, http://www.100md.com