ATP活化的小鼠巨噬细胞通讯功能的研究*
作者:吕桂芝 张志谦 林仲翔
单位:北京医科大学临床肿瘤学院肿瘤防治研究所,北京 100034
关键词:ATP;巨噬细胞;活化作用;间隙连接通讯功能;连接蛋白;纽蛋白;微丝蛋白
解剖学报990413 【摘要】 目的 探索间隙连接通讯功能、间隙连接蛋白CX43表达、微丝、纽蛋白在巨噬细胞活化过程中所起的重要作用。 方法 ATP作用于由小鼠腹腔获取的巨噬细胞(Mφ),用MTT法检测ATP对巨噬细胞的活化作用,用罗氏黄(Ly)荧光染料示踪术检测ATP对小鼠腹腔巨噬细胞间隙连接通讯功能的影响,用免疫荧光技术检测ATP作用下的Mφ连接蛋白Cx43的表达和粘着斑-纽蛋白表达的影响,用罗丹明-鬼笔环肽-F-actin专一标记技术,观察ATP作用下的Mφ微丝蛋白(F-actin)的变化。 结果 (1)ATP对Mφ有明显的活化作用;(2)ATP上调Mφ的间隙连接通讯功能;(3)ATP增强连接蛋白Cx43的表达;(4)ATP增强粘着斑主要粘着蛋白-纽蛋白的表达;(5)ATP改善Mφ微丝束的组装。 结论 在ATP促进Mφ的活化过程中,间隙连接通讯功能、连接蛋白、纽蛋白、微丝蛋白都参与了Mφ活化过程中信号传导的调节作用。
, 百拇医药
INVESTIGATION OF COMMUNICATED FUNCTION ON ATP
ACTIVATED MACROPHAGES
Lü Guizhi△, Zhang Zhiqian, Lin Zhongxiang
(Beijing Institute for Cancer Research, School of Oncology, Beijing Medical University, Beijing)
【Abstract】 Objective In order to investigate the major effects of gap junctional intercellular communication(GJIC),connexin(CX43) and cytoskeleton protein(vinculin and F-actin) expression in ATP activated Mφ process. Methods Mouse peritoneal macrophages (Mφ)were used in this work. Experimental group (Mφ) was added with ATP into peritoneal Mφ solution, control group was used with peritoneal Mφ solution. Two group's Mφ cells were seeded in 96 well tissue culture plate or glass slide respectively and cultured in CO2 incubator 37℃ for 15', activity of Mφ cells were examined by using MTT method. Expression of CX43 was demonstrated by using immunofluorescent cytochemistry method, GJIC was assessed by examining transfer of lucifer yellow dye after loading in the medium, microfilament cytoskeleton was studied by using double staining with rhodamine-phalloidin for F-actin and immunofluorescence for vinculin. Results It was found that (1) ATP stimulated Mφ cells obviously.(2) Increase of GJIC was observed in ATP-stimulated Mφ cells.(3) CX43 expression of ATP-stimulated Mφ cells was increased. (4) Improved of organization of vinculin positive adhesion plaques was observed in ATP-stimulated Mφ cells.(5) The ATP-stimulated Mφ cells displayed reorganization of F-actin from dot-like structure of controlled group to well-assembled filamentous stress fibre structure. Conclusion These results indicated that activative Mφ cells by ATP stimulation was correlated closely with GJIC, CX43 expression and cytoskeleton reorganization.
, 百拇医药
【Key words】 ATP; Macrophages cells; Activated; GJIC; CX43; Vinculin; F-actin
活化的巨噬细胞(Mφ)在机体免疫体系中发挥着重要作用[1],研究Mφ的活化,对了解其生理功能和提高机体的免疫水平都有重要理论意义和应用价值。我们曾报道ATP可促进巨噬细胞吞噬功能[2],现我们又研究了ATP对Mφ的活化作用,以及连接蛋白CX43表达、间隙连接通讯功能、纽蛋白和微丝蛋白共同参与Mφ活化过程的调节作用。
材料和方法
1.腹腔巨噬细胞(Mφ)的制备
将昆明种小白鼠(18~22g)雌雄不拘,断头处死,由腹腔注射5ml Eagle液,揉搓腹部2min,吸出含Mφ的腹腔液,调整腹腔液的细胞浓度为105/ml,实验组加入0.23g/L ATP,对照组不加ATP,把细胞分别接种于96孔板(每组5个孔,每孔细胞数为10 000)和24 cm的塑料皿内(铺或不铺盖片),每皿细胞数为1.5×105。经37℃CO2孵育箱15min,待细胞贴壁后用PBS吹打清洗3次,把未贴壁和贴壁不牢的细胞去掉(巨噬细胞粘附作用强,镜检和染核证实,用此法获取纯化的Mφ为90%以上,偶见小淋巴细胞和嗜中性白细胞),分别进行MTT法检测ATP对Mφ的活化作用,罗氏黄荧光染料示踪实验检测活化的Mφ的通讯功能,免疫荧光方法检测CX43蛋白、纽蛋白的表达,并进行微丝蛋白(F-actin)标记实验。
, 百拇医药
2.MTT法测定Mφ的活性
把接种于96孔板的两组细胞在37℃温箱内孵育15min后,细胞贴壁,去上清,用PBS用力吹打清洗3次(镜检细胞纯度为90%以上),每孔(每组5孔)加入20μl MTT(5g/L PBS),在37℃温箱内孵育2h,PBS洗后,每孔加入150μl二甲基亚砜(DMSO)溶解染料结晶后在酶标仪(美国Bio-Rad)540nm波长处测定吸收度A值,进行t检验,求P值。
3.罗氏黄荧光染料示踪技术[3]-细胞间隙连接通讯功能
把两组细胞(24cm培养皿内)贴壁后,去上清,分别经PBS吹打清洗后,再分别加入0.05%PBS+的Lucifer yellow(Ly, Sigma)荧光染料,3min后在荧光显微镜下观察Ly在Mφ的传输情况,代表Mφ的间隙连接通讯功能。(细胞间隙连接通道允许<1 000道尔顿的大分子通过,Ly染料分子量<1 000道尔顿,能通过细胞膜进入细胞,以表示Mφ的间隙连接通讯功能)。
, 百拇医药
4.连接蛋白CX43的免疫荧光检测
把两组细胞盖片经PBS用力冲洗3次后,经2%甲醛固定3min后,在摇床上用0.5%Triton X-100/PBS洗涤30min(间换3次),孵育于兔抗CX43抗体(1∶2 000)37℃,1h,0.5% Triton X-100/PBS抽提30min,再与标记异硫氰荧光黄的羊抗兔IgG(Jackson Co)反应1h,5% Triton X-100/PBS洗后,0.9%NaCl洗3次,再用染核的荧光染料(Dapi)复染核,60%甘油封固,Olympus BH-2型荧光显微镜观察。Kadak TMA×400胶片拍照。
5.纽蛋白(vinculin)和微丝(F-actin)蛋白双染技术
两组细胞盖片经过PBS冲洗、固定(同上),先后经一抗(鼠抗vinculin 1∶50 PBS)和二抗(FITC-羊抗鼠IgG 1∶50 PBS,Jackson),以0.5% Triton X-100/PBS洗涤后,再经PBS清洗,用罗丹明-鬼笔环肽(rhodamine-phalloidin,Mol prob)染F-actin15 min,经PBS、0.9%NaCl洗后,再经0.9%NaCl Dapi复染核,60%甘油封固,观察、摄片同上。
, 百拇医药
结 果
1.ATP对小鼠巨噬细胞的活化作用
把96孔板内的两组细胞经MTT染色后在酶标仪540nm波长测得两组细胞甲潜光谱吸收度A值(均值)。经t检验,求P值<0.01,差异特别显著,详见附表,说明ATP对小鼠Mφ细胞有明显的活化作用。
附表 ATP对小鼠腹腔Mφ的激活作用
Table Effect of ATP stimulated mouse peritoneal Mφ 组别 groups
对照组 control
实验组 experiment ±s
±s
, 百拇医药
0.29±0.09
0.93±0.31
n=5
P<0.01
2.ATP上调了Mφ的通讯功能(gap junction intercellular communication GJIC)
对照组的Mφ经注入Ly荧光染料后,Mφ内不显示Ly荧光染料,表示Mφ无GJIC(图1),实验组的Mφ内显示充满Ly的荧光染料,表示ATP上调Mφ的通讯功能(图2)。
3.ATP提高了Mφ CX43的表达
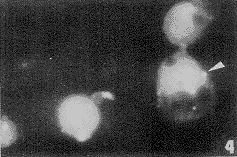
对照组的Mφ不显示CX43的免疫荧光,表明静止的Mφ不表达CX43(图3)。经ATP处理的Mφ边缘有较大的荧光点,表明ATP活化了的Mφ CX43高表达(图4)。
, 百拇医药
4.ATP增强了粘着斑的主要粘着蛋白-纽蛋白的表达
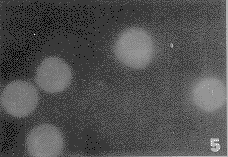
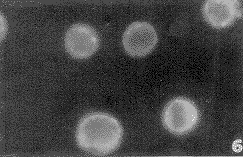
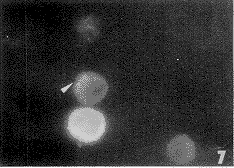
对照组的Mφ边缘内面有个别少数的荧光点(图5),经ATP处理的Mφ膜内面有较多的纽蛋白荧光点,表明ATP增强了Mφ的纽蛋白表达(图6)。
5.ATP改善了Mφ的微丝组装
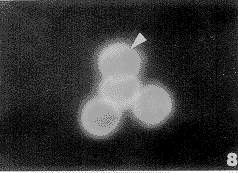
对照组的小鼠腹腔巨噬细胞微丝蛋白(F-actin)呈点状排列在Mφ的胞膜内面(图7),经ATP处理的Mφ微丝束在胞膜内面呈环状排列(图8),表明ATP改善了Mφ的微丝组装。讨 论
巨噬细胞在机体内行使很多功能,但这些功能只有在巨噬细胞活化的状态下才能发挥出来,ATP活化了的巨噬细胞,为提高机体的免疫功能和防御能力打下了良好的基础。间隙连接是细胞之间(同种细胞或异种细胞)交流信息分子的唯一通道结构,癌细胞间隙连接通讯功能丧失,可能是间隙连接结构减少或连接通道关闭。近来发现,间隙连接通讯功能受连接基因(connexin CX)调控,人肺细胞CX43表达,GJIC功能上调,高转移肺癌PG细胞CX43低表达,GJIC功能丧失。巨噬细胞是一种游走性细胞,存在半连接通道结构[4](half gap junctions),在细胞与细胞接触时形成连接通道结构,交换信息维持细胞之间的暂时联系[4]。我们的实验结果证实,CX43表达与GJIC功能的一致性,ATP活化的Mφ CX43高表达,GJIC功能上调,未经ATP活化的Mφ CX43弱表达,GJIC低下,提示CX43表达和GJIC功能共同参与Mφ活化的调节作用。
, http://www.100md.com
纽蛋白(vinculin)是细胞膜内面粘着斑中的主要粘着蛋白,一端通过其他粘附分子与细胞外基质相连,另一端与细胞内的微丝骨架相接,在细胞的粘附和信号传导中起重要作用[5],巨噬细胞吞噬功能和粘附作用与纽蛋白表达正相关[2]。活化了的巨噬细胞纽蛋白表达的增强,提示纽蛋白在Mφ活化过程中具有信号传导的调节作用,与其他粘附分子、talin、α-actinin、integrin在Mφ活化过程中的关系如何?我们将进一步研究。细胞的粘附或信号传导需微丝骨架的迅速重组[6],巨噬细胞的吞噬功能和粘附作用与微丝束组装正相关[2],ATP活化了的巨噬细胞微丝束组装的改善,是结构和功能统一的表现,与纽蛋白、连接蛋白和间隙连接通讯功能呈正相关性,共同协调参与Mφ活化的信号调节作用。


, 百拇医药
图版说明
图1 未经ATP处理的小鼠腹腔巨噬细胞(Mφ),罗氏黄荧光染料不进入巨噬细胞,表明巨噬细胞中无GJIC ×98
图2 ATP处理的巨噬细胞罗氏黄荧光染料进入巨噬细胞内,表明有GJIC ×98
图3 未经ATP处理的巨噬细胞CX43连接蛋白不表达 ×1210
图4 ATP处理的巨噬细胞CX43连接蛋白表达(箭头所示) ×1210
图5 未经ATP处理的巨噬细胞纽蛋白呈弱阳性反应 ×1210
图6 ATP处理的巨噬细胞纽蛋白表达增强(箭头所示) ×1210
图7 未经ATP处理的巨噬细胞F-actin肌动蛋白呈点状 ×1210
, http://www.100md.com
图8 ATP处理的巨噬细胞F-actin组装改善(箭头所示) ×1210
Explanation of figures
Fig.1 Untreated control Mφ, lucifer yellow dye negative in Mφ cells. ×98
Fig.2 ATP-treated Mφ, lucifer yellow dye positive in Mφ cells. ×98
Fig.3 Untreated control Mφ, CX43 immunofluorescence negative. ×1210
Fig.4 ATP treated Mφ cells, CX43 immunofluorescence positive. (↑)×1210
, 百拇医药
Fig.5 Un treated Mφ cells,vinculin immunofluorescence was negative reaction. ×1210
Fig.6 ATP treated Mφ cells vinculin immunofluorescence showing adhesion plaques. (↑)×1210
Fig.7 Untreated Mφ cells, Rhodamine-phallodin fluorescence staining showing actin-bodies. ×1210
Fig.8 ATP treated Mφ cells, Rhodamine-phallidin fluorescence staining of F-actin stress fibres(↑). ×1210
, http://www.100md.com
* 国家自然科学基金资助课题(No.39770380)和北京市自然科学基金资助课题(No.7962002)
△ Department of Cell Biology, Beijing Institute for Cancer Research, Beijing 100034,China
参考文献
1 董钟云,张友会.巨噬细胞毒功能的调变-霉菌毒素 FusarinC对巨噬细胞活化的影响.中国免疫学杂志,1986,2(6):321
2 吕桂芝,林仲翔,周立新,等.三磷酸腺苷对巨噬细胞吞噬功能和微丝束重组的影响.解剖学报,1996,27(1):61
3 EL-Fouly MH, Trosko JE, Chang CC. Scrape-Loading and dye transfer, A rapid and simple technique to study gap junction intercellular. Exp Cell Res,1987,168(2):422
, 百拇医药
4 Beyer EC, Steinberg TH. Evidence that the gap junctional protein connexin-CX43 is the ATP induced pore of mouse macrophages. J Biol Chem,1991,266(13):7971
5 林仲翔,张文军.细胞粘合分子受体研究进展和抗癌应用前景.科学通报,1998,42(24):2577
6 Schafer DA, Cooper JA. Control of actin assembly at filament ends. Annn Rev Cell Dev Biol, 1995,11(4):497
7 Takayama H, Katsumot T, Takagi A. Ultrastructural studies on the phagocytosis of the mouse macrophages and the effects of cytochalasin B, colchicine and pH conditions on their morphology, 1975,24(3):145.
收稿1998-07 修回1998-12, 百拇医药
单位:北京医科大学临床肿瘤学院肿瘤防治研究所,北京 100034
关键词:ATP;巨噬细胞;活化作用;间隙连接通讯功能;连接蛋白;纽蛋白;微丝蛋白
解剖学报990413 【摘要】 目的 探索间隙连接通讯功能、间隙连接蛋白CX43表达、微丝、纽蛋白在巨噬细胞活化过程中所起的重要作用。 方法 ATP作用于由小鼠腹腔获取的巨噬细胞(Mφ),用MTT法检测ATP对巨噬细胞的活化作用,用罗氏黄(Ly)荧光染料示踪术检测ATP对小鼠腹腔巨噬细胞间隙连接通讯功能的影响,用免疫荧光技术检测ATP作用下的Mφ连接蛋白Cx43的表达和粘着斑-纽蛋白表达的影响,用罗丹明-鬼笔环肽-F-actin专一标记技术,观察ATP作用下的Mφ微丝蛋白(F-actin)的变化。 结果 (1)ATP对Mφ有明显的活化作用;(2)ATP上调Mφ的间隙连接通讯功能;(3)ATP增强连接蛋白Cx43的表达;(4)ATP增强粘着斑主要粘着蛋白-纽蛋白的表达;(5)ATP改善Mφ微丝束的组装。 结论 在ATP促进Mφ的活化过程中,间隙连接通讯功能、连接蛋白、纽蛋白、微丝蛋白都参与了Mφ活化过程中信号传导的调节作用。
, 百拇医药
INVESTIGATION OF COMMUNICATED FUNCTION ON ATP
ACTIVATED MACROPHAGES
Lü Guizhi△, Zhang Zhiqian, Lin Zhongxiang
(Beijing Institute for Cancer Research, School of Oncology, Beijing Medical University, Beijing)
【Abstract】 Objective In order to investigate the major effects of gap junctional intercellular communication(GJIC),connexin(CX43) and cytoskeleton protein(vinculin and F-actin) expression in ATP activated Mφ process. Methods Mouse peritoneal macrophages (Mφ)were used in this work. Experimental group (Mφ) was added with ATP into peritoneal Mφ solution, control group was used with peritoneal Mφ solution. Two group's Mφ cells were seeded in 96 well tissue culture plate or glass slide respectively and cultured in CO2 incubator 37℃ for 15', activity of Mφ cells were examined by using MTT method. Expression of CX43 was demonstrated by using immunofluorescent cytochemistry method, GJIC was assessed by examining transfer of lucifer yellow dye after loading in the medium, microfilament cytoskeleton was studied by using double staining with rhodamine-phalloidin for F-actin and immunofluorescence for vinculin. Results It was found that (1) ATP stimulated Mφ cells obviously.(2) Increase of GJIC was observed in ATP-stimulated Mφ cells.(3) CX43 expression of ATP-stimulated Mφ cells was increased. (4) Improved of organization of vinculin positive adhesion plaques was observed in ATP-stimulated Mφ cells.(5) The ATP-stimulated Mφ cells displayed reorganization of F-actin from dot-like structure of controlled group to well-assembled filamentous stress fibre structure. Conclusion These results indicated that activative Mφ cells by ATP stimulation was correlated closely with GJIC, CX43 expression and cytoskeleton reorganization.
, 百拇医药
【Key words】 ATP; Macrophages cells; Activated; GJIC; CX43; Vinculin; F-actin
活化的巨噬细胞(Mφ)在机体免疫体系中发挥着重要作用[1],研究Mφ的活化,对了解其生理功能和提高机体的免疫水平都有重要理论意义和应用价值。我们曾报道ATP可促进巨噬细胞吞噬功能[2],现我们又研究了ATP对Mφ的活化作用,以及连接蛋白CX43表达、间隙连接通讯功能、纽蛋白和微丝蛋白共同参与Mφ活化过程的调节作用。
材料和方法
1.腹腔巨噬细胞(Mφ)的制备
将昆明种小白鼠(18~22g)雌雄不拘,断头处死,由腹腔注射5ml Eagle液,揉搓腹部2min,吸出含Mφ的腹腔液,调整腹腔液的细胞浓度为105/ml,实验组加入0.23g/L ATP,对照组不加ATP,把细胞分别接种于96孔板(每组5个孔,每孔细胞数为10 000)和24 cm的塑料皿内(铺或不铺盖片),每皿细胞数为1.5×105。经37℃CO2孵育箱15min,待细胞贴壁后用PBS吹打清洗3次,把未贴壁和贴壁不牢的细胞去掉(巨噬细胞粘附作用强,镜检和染核证实,用此法获取纯化的Mφ为90%以上,偶见小淋巴细胞和嗜中性白细胞),分别进行MTT法检测ATP对Mφ的活化作用,罗氏黄荧光染料示踪实验检测活化的Mφ的通讯功能,免疫荧光方法检测CX43蛋白、纽蛋白的表达,并进行微丝蛋白(F-actin)标记实验。
, 百拇医药
2.MTT法测定Mφ的活性
把接种于96孔板的两组细胞在37℃温箱内孵育15min后,细胞贴壁,去上清,用PBS用力吹打清洗3次(镜检细胞纯度为90%以上),每孔(每组5孔)加入20μl MTT(5g/L PBS),在37℃温箱内孵育2h,PBS洗后,每孔加入150μl二甲基亚砜(DMSO)溶解染料结晶后在酶标仪(美国Bio-Rad)540nm波长处测定吸收度A值,进行t检验,求P值。
3.罗氏黄荧光染料示踪技术[3]-细胞间隙连接通讯功能
把两组细胞(24cm培养皿内)贴壁后,去上清,分别经PBS吹打清洗后,再分别加入0.05%PBS+的Lucifer yellow(Ly, Sigma)荧光染料,3min后在荧光显微镜下观察Ly在Mφ的传输情况,代表Mφ的间隙连接通讯功能。(细胞间隙连接通道允许<1 000道尔顿的大分子通过,Ly染料分子量<1 000道尔顿,能通过细胞膜进入细胞,以表示Mφ的间隙连接通讯功能)。
, 百拇医药
4.连接蛋白CX43的免疫荧光检测
把两组细胞盖片经PBS用力冲洗3次后,经2%甲醛固定3min后,在摇床上用0.5%Triton X-100/PBS洗涤30min(间换3次),孵育于兔抗CX43抗体(1∶2 000)37℃,1h,0.5% Triton X-100/PBS抽提30min,再与标记异硫氰荧光黄的羊抗兔IgG(Jackson Co)反应1h,5% Triton X-100/PBS洗后,0.9%NaCl洗3次,再用染核的荧光染料(Dapi)复染核,60%甘油封固,Olympus BH-2型荧光显微镜观察。Kadak TMA×400胶片拍照。
5.纽蛋白(vinculin)和微丝(F-actin)蛋白双染技术
两组细胞盖片经过PBS冲洗、固定(同上),先后经一抗(鼠抗vinculin 1∶50 PBS)和二抗(FITC-羊抗鼠IgG 1∶50 PBS,Jackson),以0.5% Triton X-100/PBS洗涤后,再经PBS清洗,用罗丹明-鬼笔环肽(rhodamine-phalloidin,Mol prob)染F-actin15 min,经PBS、0.9%NaCl洗后,再经0.9%NaCl Dapi复染核,60%甘油封固,观察、摄片同上。
, 百拇医药
结 果
1.ATP对小鼠巨噬细胞的活化作用
把96孔板内的两组细胞经MTT染色后在酶标仪540nm波长测得两组细胞甲潜光谱吸收度A值(均值)。经t检验,求P值<0.01,差异特别显著,详见附表,说明ATP对小鼠Mφ细胞有明显的活化作用。
附表 ATP对小鼠腹腔Mφ的激活作用
Table Effect of ATP stimulated mouse peritoneal Mφ 组别 groups
对照组 control
实验组 experiment
 ±s
±s, 百拇医药
0.29±0.09
0.93±0.31
n=5
P<0.01
2.ATP上调了Mφ的通讯功能(gap junction intercellular communication GJIC)
对照组的Mφ经注入Ly荧光染料后,Mφ内不显示Ly荧光染料,表示Mφ无GJIC(图1),实验组的Mφ内显示充满Ly的荧光染料,表示ATP上调Mφ的通讯功能(图2)。
3.ATP提高了Mφ CX43的表达
对照组的Mφ不显示CX43的免疫荧光,表明静止的Mφ不表达CX43(图3)。经ATP处理的Mφ边缘有较大的荧光点,表明ATP活化了的Mφ CX43高表达(图4)。
, 百拇医药
4.ATP增强了粘着斑的主要粘着蛋白-纽蛋白的表达
对照组的Mφ边缘内面有个别少数的荧光点(图5),经ATP处理的Mφ膜内面有较多的纽蛋白荧光点,表明ATP增强了Mφ的纽蛋白表达(图6)。
5.ATP改善了Mφ的微丝组装
对照组的小鼠腹腔巨噬细胞微丝蛋白(F-actin)呈点状排列在Mφ的胞膜内面(图7),经ATP处理的Mφ微丝束在胞膜内面呈环状排列(图8),表明ATP改善了Mφ的微丝组装。讨 论
巨噬细胞在机体内行使很多功能,但这些功能只有在巨噬细胞活化的状态下才能发挥出来,ATP活化了的巨噬细胞,为提高机体的免疫功能和防御能力打下了良好的基础。间隙连接是细胞之间(同种细胞或异种细胞)交流信息分子的唯一通道结构,癌细胞间隙连接通讯功能丧失,可能是间隙连接结构减少或连接通道关闭。近来发现,间隙连接通讯功能受连接基因(connexin CX)调控,人肺细胞CX43表达,GJIC功能上调,高转移肺癌PG细胞CX43低表达,GJIC功能丧失。巨噬细胞是一种游走性细胞,存在半连接通道结构[4](half gap junctions),在细胞与细胞接触时形成连接通道结构,交换信息维持细胞之间的暂时联系[4]。我们的实验结果证实,CX43表达与GJIC功能的一致性,ATP活化的Mφ CX43高表达,GJIC功能上调,未经ATP活化的Mφ CX43弱表达,GJIC低下,提示CX43表达和GJIC功能共同参与Mφ活化的调节作用。
, http://www.100md.com
纽蛋白(vinculin)是细胞膜内面粘着斑中的主要粘着蛋白,一端通过其他粘附分子与细胞外基质相连,另一端与细胞内的微丝骨架相接,在细胞的粘附和信号传导中起重要作用[5],巨噬细胞吞噬功能和粘附作用与纽蛋白表达正相关[2]。活化了的巨噬细胞纽蛋白表达的增强,提示纽蛋白在Mφ活化过程中具有信号传导的调节作用,与其他粘附分子、talin、α-actinin、integrin在Mφ活化过程中的关系如何?我们将进一步研究。细胞的粘附或信号传导需微丝骨架的迅速重组[6],巨噬细胞的吞噬功能和粘附作用与微丝束组装正相关[2],ATP活化了的巨噬细胞微丝束组装的改善,是结构和功能统一的表现,与纽蛋白、连接蛋白和间隙连接通讯功能呈正相关性,共同协调参与Mφ活化的信号调节作用。








, 百拇医药
图版说明
图1 未经ATP处理的小鼠腹腔巨噬细胞(Mφ),罗氏黄荧光染料不进入巨噬细胞,表明巨噬细胞中无GJIC ×98
图2 ATP处理的巨噬细胞罗氏黄荧光染料进入巨噬细胞内,表明有GJIC ×98
图3 未经ATP处理的巨噬细胞CX43连接蛋白不表达 ×1210
图4 ATP处理的巨噬细胞CX43连接蛋白表达(箭头所示) ×1210
图5 未经ATP处理的巨噬细胞纽蛋白呈弱阳性反应 ×1210
图6 ATP处理的巨噬细胞纽蛋白表达增强(箭头所示) ×1210
图7 未经ATP处理的巨噬细胞F-actin肌动蛋白呈点状 ×1210
, http://www.100md.com
图8 ATP处理的巨噬细胞F-actin组装改善(箭头所示) ×1210
Explanation of figures
Fig.1 Untreated control Mφ, lucifer yellow dye negative in Mφ cells. ×98
Fig.2 ATP-treated Mφ, lucifer yellow dye positive in Mφ cells. ×98
Fig.3 Untreated control Mφ, CX43 immunofluorescence negative. ×1210
Fig.4 ATP treated Mφ cells, CX43 immunofluorescence positive. (↑)×1210
, 百拇医药
Fig.5 Un treated Mφ cells,vinculin immunofluorescence was negative reaction. ×1210
Fig.6 ATP treated Mφ cells vinculin immunofluorescence showing adhesion plaques. (↑)×1210
Fig.7 Untreated Mφ cells, Rhodamine-phallodin fluorescence staining showing actin-bodies. ×1210
Fig.8 ATP treated Mφ cells, Rhodamine-phallidin fluorescence staining of F-actin stress fibres(↑). ×1210
, http://www.100md.com
* 国家自然科学基金资助课题(No.39770380)和北京市自然科学基金资助课题(No.7962002)
△ Department of Cell Biology, Beijing Institute for Cancer Research, Beijing 100034,China
参考文献
1 董钟云,张友会.巨噬细胞毒功能的调变-霉菌毒素 FusarinC对巨噬细胞活化的影响.中国免疫学杂志,1986,2(6):321
2 吕桂芝,林仲翔,周立新,等.三磷酸腺苷对巨噬细胞吞噬功能和微丝束重组的影响.解剖学报,1996,27(1):61
3 EL-Fouly MH, Trosko JE, Chang CC. Scrape-Loading and dye transfer, A rapid and simple technique to study gap junction intercellular. Exp Cell Res,1987,168(2):422
, 百拇医药
4 Beyer EC, Steinberg TH. Evidence that the gap junctional protein connexin-CX43 is the ATP induced pore of mouse macrophages. J Biol Chem,1991,266(13):7971
5 林仲翔,张文军.细胞粘合分子受体研究进展和抗癌应用前景.科学通报,1998,42(24):2577
6 Schafer DA, Cooper JA. Control of actin assembly at filament ends. Annn Rev Cell Dev Biol, 1995,11(4):497
7 Takayama H, Katsumot T, Takagi A. Ultrastructural studies on the phagocytosis of the mouse macrophages and the effects of cytochalasin B, colchicine and pH conditions on their morphology, 1975,24(3):145.
收稿1998-07 修回1998-12, 百拇医药