大鼠脑缺血区非特异性酯酶阳性细胞的分布和定量研究
作者:雷万龙 刘勇 姚志彬 袁群芳 凌凤东
单位:雷万龙 姚志彬 袁群芳(中山医科大学解剖学教研室,广州 510089);刘勇 凌凤东(西安医科大学解剖学教研室,西安)
关键词:非特异性酯酶;脑缺血-再灌流;酶组织化学;大鼠
解剖学报990409 【摘要】 目的 探查非特异性酯酶阳性细胞的变化和与脑缺血的病理联系。 方法 用酶组织化学方法对40只SD大鼠脑局部缺血/再灌流损伤区非特异性酯酶阳性细胞的分布和数量进行了观查。 结果 脑缺血区非特异性酯酶阳性细胞的数量增加发生于脑缺血1h再灌流2h,随后逐渐增加,在脑缺血1h再灌流16h达到高峰。阳性细胞的增加显示明显的时间依赖关系。阳性细胞主要位于小血管和微血管的壁内及其周围。在缺血侧基底节区非特异性酯酶阳性细胞比皮质缺血区多。 结论 非特异性酯酶阳性细胞对脑缺血刺激反应敏感,在缺血侧基底节区,其反应更为强烈,此因素可能是基底节区易发生中风的原因之一。
, 百拇医药
A STUDY OF QUANTITATION AND DISTRIBUTION OF NONSPECIFIC
ESTERASE POSITIVE CELLS IN ISCHEMIC BRAIN IN RATS
Lei WanlongΔ, Liu Yong*, Yao Zhibin, Yuan Qunfang,Ling Fengdong*
(Department of Anatomy, Sun Yat-sen University of Medical Sciences, Guangzhou.
*Department of Anatomy, Xi'an Medical University, Xi'an)
, http://www.100md.com
【Abstract】 Objective To study the relationship of the profile and distribution of nonspecific esterase positive cells with cerebral ischemica.Metholds We explored the distribution and the number of nonspecific esterase positive cells in the ischemic brain of 40 SD (Sprague-dawley) rats by using enzyme-histochemical methods.Results The nonspecific esterase positive cells were mainly located in the walls of small vessels and microvasculatures and around them, the cells were increased in ischemic brain at 1 hour ischemia/2 hour reperfusion, and they peaked at 1 hour ischemia/16 hour reperfusion, and the nonspecific esterase positive cells in ischemic basal ganglia were more than that in ischemic cortex.Conclusion Cerebral ischemia induced the positive cell infiltration and basal ganglia may be more susceptible to ischemia than cortex.
, http://www.100md.com
【Key words】 Nonspecific-esterase; Enzyme-histochemistry; Brain ischemia-reperfusion; Rat
非特异性酯酶是单核细胞和单核细胞源性的巨噬细胞的一种特异性酶标记。具有免疫活性的血管周小胶质细胞是骨髓源性的,为中枢神经系统内主要的抗原提呈细胞,之所以称其为血管周小胶质细胞,是因其形态学定位于血管基膜以外[1]。因此,不同于血管周细胞,该细胞定位于血管基膜内,实际在脑实质以外[2]。单核/巨噬细胞和小胶质细胞均涉及到脑缺血的病理过程,而且三者均为非特异性酯酶阳性细胞。非特异性酯酶染色显示,大量的单核/巨噬细胞聚集于脑缺血区内[3]。光镜和电镜研究证实,激活的小胶质细胞显示非特异性酯酶强阳性反应,而分支状小胶质细胞则阴性。并由此认为前者来源于血液单核细胞[4]。研究发现脑缺血区既有单核/巨噬细胞的浸润,又有小胶质细胞的激活和增生[5]。但是,有关脑缺血区非特异性酯酶阳性细胞的形态、分布和数量变化的详尽研究报道,所见甚少。本实验的目的旨在补充这方面的资料。
, 百拇医药
材料和方法
1.实验动物及分组
选用雄性SD大鼠40只,3~4月龄,体重200~250g,由西安医科大学实验动物中心提供。分为对照组及缺血1h再灌流0h、2h、4h、8h和16h共6组(n=6)。4只用于TTC和Evans蓝染色实验,以证实脑缺血模型的可靠性。
2.缺血模型制做及制片
脑局部缺血/再灌流模型按照Barone等[6]方法,其中有些步骤进行了修改。主要步骤为:用20%乌拉坦(urethan)(0.6ml/100g鼠重)对实验大鼠腹腔注射麻醉,从颞区入颅,暴露右侧大脑中动脉主干,用无创伤缝合线在嗅静脉上方悬吊大脑中动脉主干,使其距脑表面约1~2mm,悬吊1h,抽出缝线,开始上述不同时间的再灌流,依次缝合颞肌和皮肤。
, 百拇医药 大鼠脑缺血/再灌流之后,在麻醉下开胸,用生理盐水200ml从左心室冲洗、用4%多聚甲醛(0.1mol/L PBS配制,pH 7.4)400ml灌流固定和开颅取脑。脑缺血中央区冷冻切片,片厚16μm,贴在载片上,作酶组织化学染色。
3.酶组织化学染色和定量
切片于室温晾干后入固定液(Na2HPO4 20mg, KH2PO4 100mg,30%福尔马林25ml,100%丙酮45ml)室温30min,0.1mol/L PBS(pH7.6)洗3次。入反应液[0.2mol/L PBS(pH7.6)6ml,三蒸水24ml,作用液0.6ml(α-醋酸萘酯1g,100%丙酮50ml,三蒸水50ml),快蓝B盐30mg]于室温30min,0.1mol/L PBS洗3次。常规脱水、透明和封片。阴性对照片在反应液中免去快蓝B盐。
, 百拇医药 每个样本取6张切片(隔5取1)进行染色。光镜观察,在相同的光强度和放大倍数下,用C6型网格目镜尺在每一张切片的缺血区随机取6个视野,对阳性细胞进行计数,数据以 ±s表示,SAS软件统计处理,Q检验判断结果。
±s表示,SAS软件统计处理,Q检验判断结果。
结 果
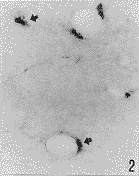
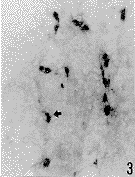
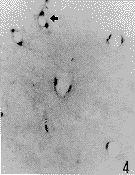
光镜观察显示,正常对照组有少数非特异性酯酶阳性细胞,呈蓝黑色,沿血管的走行分布,主要位于小血管和微血管壁内及其周围(图1)。脑实质内可见少数阳性细胞散在分布。在实验组,阳性细胞呈圆形或卵圆形,没有明显的突起(图2,3),主要分布于脑缺血边缘区。损伤侧基底节区比皮质缺血区明显增多。计数统计结果显示,在缺血1h再灌流2h后,皮质缺血区阳性细胞明显增多,与对照组相比差异明显(P<0.05)(附表,图2),随再灌流时间延长逐渐增加,在脑缺血1h再灌流16h后达到最高峰,与其他实验组相比有显著性差异(P<0.01)(附表,图3)。在损伤侧基底节区,在脑缺血1h阳性细胞即增加(附表,图4),并随再灌流时间延长而增加。在脑缺血1h再灌流2、4、8h,基底节区非特异性酯酶阳性细胞比皮质缺血区显著增多(附表,图5,6)。
, 百拇医药
附表 皮质缺血区和损伤侧基底节区非特异性酯酶阳性细胞的计数和比较
Table The number and comparison of nonspecific estarase positive cells in the ischemic cortex and basal ganglia n=6 检测区域
measure area
对照组
control
Ⅰ1h/R0h组
Ⅰ 1h/R0h
Ⅰ1h/R2h组
Ⅰ 1h/R2h
, 百拇医药
Ⅰ1h/R4h组
Ⅰ 1h/R4h
Ⅰ1h/R8h组
Ⅰ 1h/R8h
Ⅰ1h/R16h组
Ⅰ 1h/R16h
皮质缺血区 (ischemic cortex)
3.6±0.9
4.3±0.8
6.3±1.2*
9.5±0.8*
, 百拇医药
10.3±1.5*
15.7±2.5**△
缺血侧基底节区(ischemic basal ganglia)
5.8±0.7
10.1±1.3*▲
12.3±2.0*▲▲
13.7±0.8**▲
14.5±2.7**▲
13.1±1.9**
, 百拇医药
注:表中数为 ±s(0.25mm2) Ⅰ.缺血 R.再灌流 与对照组相比,*P<0.05,**P<0.01;实验组间相比,△P<0.01;与皮质区比较,▲P<0.05,▲▲P<0.01
±s(0.25mm2) Ⅰ.缺血 R.再灌流 与对照组相比,*P<0.05,**P<0.01;实验组间相比,△P<0.01;与皮质区比较,▲P<0.05,▲▲P<0.01
Note:The numbers in the table are ±s(0.25mm2);Ⅰ,Ischemica R,Reperfusion; *P<0.05,**P<0.01,compared with control;△P<0.01,comparison among differently experimental groups;▲P<0.05,▲▲P<0.01,comparied with ischemic cortex.讨 论
±s(0.25mm2);Ⅰ,Ischemica R,Reperfusion; *P<0.05,**P<0.01,compared with control;△P<0.01,comparison among differently experimental groups;▲P<0.05,▲▲P<0.01,comparied with ischemic cortex.讨 论
, http://www.100md.com
用酶组织化学染色方法研究非特异酯酶阳性细胞与脑缺血的关系,结果证实脑缺血区阳性细胞增加。以往的研究证实,血液的单核细胞及其衍生的巨噬细胞显示强烈的非特异性酯酶活性。本实验观察了非特异性酯酶阳性细胞的形态和分布,该细胞呈圆形或卵圆形,未见明显的突起,多数位于小血管和微血管的壁内及血管周围,仅少部分散在分布于脑实质。对照组亦见阳性细胞存在于血管壁。据此推断,脑缺血区聚集的阳性细胞可能为血液单核细胞及其衍生的巨噬细胞和激活的血管周小胶质细胞。白细胞和单核/巨噬细胞与脑缺血和脑中风的联系,已经研究了半个多世纪[7]。众多研究证实,缺血区单核/巨噬细胞聚集增加。Garcia等[8]发现单核/巨噬细胞在缺血区的聚集发生在缺血之后7~16d,但Sornas等[9]报道是在3~7d,而Giulian等[3]证实为16h。直到最近,Birdsall等[10]发现大量单核/巨噬细胞在心脏梗塞区聚集发生于再灌流60min之后。我们的结果与Birdsall的结果基本一致,都观察到单核/巨噬细胞的早期浸润。单核/巨噬细胞聚集的部位,各实验室的报道基本一致,即早期在梗塞的边缘区,后期浸润到中央区。我们观察到大量阳性细胞聚集于血管壁内和血管周围,其部位相当于以往报道的血管周单核/巨噬细胞和血管周激活的小胶质[11]。但阳性细胞与血管基膜的关系,有待观察。
, http://www.100md.com
小胶质细胞与脑缺血的关系已有研究报道[4],并对其部位进行了特定的研究,认为阿米巴小胶质细胞比单核细胞源性的巨噬细胞距损伤部位远[12]。研究证实阿米巴小胶质细胞和反应性小胶质细胞,显示非特异性酯酶强阳性反应[4]。所以,本实验观察到的非特异性酯酶阳性细胞既有来源于血液的单核/巨噬细胞,又有小胶质细胞。
基底动脉环和大脑后动脉的分支,在基底节区形成密集的动脉网。同时,该区域血管的起始处内径小,呈直角发出,而且在基底节内蜿蜒行程。基底节区血管壁的代谢具有老龄血管的特征,表现为ATP酶和葡萄糖-6-磷酸脱氢酶活性低[13],并认为是基底节区易发生中风的原因。本实验观察到缺血侧基底节区非特异性酯酶阳性细胞比皮质缺血区明显增多,而且阳性细胞浸润发生的时间也较皮质缺血区早;同时观察到基底节区血管内皮细胞粘附分子的表达比皮质区明显增加(未发表资料)。这些因素可能与基底节区易发生中风有关。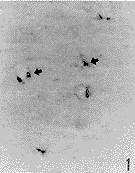

, 百拇医药
图版说明
图1 箭头所示为对照组大脑皮质非特异性酯酶阳性细胞 ×100
图2 脑缺血lh再灌流2h,皮质缺血区非特异性酯酶阳性细胞(箭头示阳性细胞位于脑实质和血管壁内)×200
图3 脑缺血1h再灌流16h,皮质缺血区非特异性酯酶阳性细胞(箭头示阳性细胞位于脑实质)×100
图4 脑缺血lh再灌流0h,缺血侧基底节区非恃异性酯酶阳性细胞(箭头示阳性细胞位于血管壁内)×100
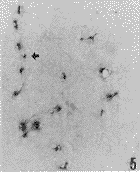
图5 脑缺血1h再灌流8h,缺血侧基底节区非特异性酯酶阳性细胞(箭头示阳性细胞随血管分布) ×100
图6 脑缺血1h再灌流16h,缺血侧基底节区非特异性酯酶阳性细胞(箭头示阳性细胞随血管分布) ×100
, http://www.100md.com
Explanation of figures
Fig. 1 Arrow shows nonspecific esterase positive cells in control cerebral cortex. ×100
Fig. 2 Nonspecific esterase positive cells in ischemic cerebral cortex at 1 hour ischemia and 2 hour reperfusion. Arrows show positive cells incerebral parenchyma and the wall of vessels. ×200
Fig. 3 Nonspecific esterase positive cells in ischemic cerebral cortex at I hour ischemia and 16 hour reperfusion. Arrows show positive cells incerebral parenchyrna. ×100
, 百拇医药
Fig. 4 Nonspecific esterase positive cells in ischemic basal ganglia at 1 hour ischemia. Arrows show positive cells in the wall of vessels.×200
Fig. 5 Nonspecific esterase positive cells in ischemic basal ganglia at 1 hour ischemia and & hour reperfusion. Arrows show positive cells distri-bution with vessels. ×100
Fig. 6 Nonspecific esterase positive cells in ischeinic basal ganglia at 1 hour ischemia and 16 hour reperfusion. Arrows show positive cells disiribution with vessels. ×100
, 百拇医药
△ Department of Anatomy, Sun Yat-sen University of Medical Sciences, Guangzhou 510089,China
参考文献
1 Stensaas LJ. Pericytes and perivascular microglial cells in the basal forebrain of the neonatal rabbit. Cell Tissue Res,1975,158(3)517
2 Graeber MB, Streit WJ, Kreutzberg GW. Identify of ED2-positive perivascular cells in rat brain. J Neurosci Res,1989,22(1):103
, http://www.100md.com 3 Giulian D, Robertson C. Inhibition of mononuclear phagocytes reduces ischemic injury in the spinal cord. Ann Neurol,1990,27(1):33
4 Ling EA, Kaur C, Wong WC. Light and electron microscopic demonstration of non-specific esterase in amoeboid microglial cells in the corpus callosum in postnatal rats: a cytochemical link to monocytes. J Anat, 1982,135(2):385
5 Kato H, Kogure K, Liu XH, et al. Progressive expression of immunomolecules on activated microglia and invading leukocytes following focal cerebral ischemia in the rat. Brain Res, 1996,734(2):203
, 百拇医药
6 Barone FC, Schmidt DB, Hillegass LM, et al. Reperfusion increases neutrophils and leukotriene B4 receptor binding in rat focal ischemia. Stroke,1993,23(9):1337
7 Kochanek PM, Hallenbeck JM. Polymorphonuclear leukocytes and monocytes/macrophages in the pathogenesis of cerebral ischemia and stroke. Stroke,1992,23(9):1367
8 Garcia JH, Kamijyo Y. Evolution of histopathological changes after occlusion of a middle cerebral artery in primates. J Neuropathol Exp Neurol,1974,33(3):408
, 百拇医药
9 Sornas R, Ostlund H, Muller R. Cerebrospinal fluid cytology after stroke. Arch Neurol,1972,26(3):489
10 Birdsall HH, Green DM, Trial J, et al. Complement C5a,TGF-β 1 and MCP-1, in sequence, Induce migration of monocytes into ischemic canine myocardium within the first one to five hours after reperfusion. Circulation, 1997,95(3):684
11 Liu Y, Jacobowitz DM, Barone F, et al. Quantitation of perivascular monocytes and macrophages around cerebral blood vessels of hypertensive and aged rats. J Cerebr Blood Flow Metab,1994,14(2):348
, 百拇医药
12 Giulian D. Ameboid microglia as effectors of inflammation in central nervous system. J Neurosci Res,1987,18(1):155
13 Rieke GK, Cannon MS. A histochemical study of cerebral cortical vessels and ganglionic vessels of the caudatoputamen in aging normotensive rats. Stroke,1985,16(2):285
收稿1998-06 修回1999-03, 百拇医药
单位:雷万龙 姚志彬 袁群芳(中山医科大学解剖学教研室,广州 510089);刘勇 凌凤东(西安医科大学解剖学教研室,西安)
关键词:非特异性酯酶;脑缺血-再灌流;酶组织化学;大鼠
解剖学报990409 【摘要】 目的 探查非特异性酯酶阳性细胞的变化和与脑缺血的病理联系。 方法 用酶组织化学方法对40只SD大鼠脑局部缺血/再灌流损伤区非特异性酯酶阳性细胞的分布和数量进行了观查。 结果 脑缺血区非特异性酯酶阳性细胞的数量增加发生于脑缺血1h再灌流2h,随后逐渐增加,在脑缺血1h再灌流16h达到高峰。阳性细胞的增加显示明显的时间依赖关系。阳性细胞主要位于小血管和微血管的壁内及其周围。在缺血侧基底节区非特异性酯酶阳性细胞比皮质缺血区多。 结论 非特异性酯酶阳性细胞对脑缺血刺激反应敏感,在缺血侧基底节区,其反应更为强烈,此因素可能是基底节区易发生中风的原因之一。
, 百拇医药
A STUDY OF QUANTITATION AND DISTRIBUTION OF NONSPECIFIC
ESTERASE POSITIVE CELLS IN ISCHEMIC BRAIN IN RATS
Lei WanlongΔ, Liu Yong*, Yao Zhibin, Yuan Qunfang,Ling Fengdong*
(Department of Anatomy, Sun Yat-sen University of Medical Sciences, Guangzhou.
*Department of Anatomy, Xi'an Medical University, Xi'an)
, http://www.100md.com
【Abstract】 Objective To study the relationship of the profile and distribution of nonspecific esterase positive cells with cerebral ischemica.Metholds We explored the distribution and the number of nonspecific esterase positive cells in the ischemic brain of 40 SD (Sprague-dawley) rats by using enzyme-histochemical methods.Results The nonspecific esterase positive cells were mainly located in the walls of small vessels and microvasculatures and around them, the cells were increased in ischemic brain at 1 hour ischemia/2 hour reperfusion, and they peaked at 1 hour ischemia/16 hour reperfusion, and the nonspecific esterase positive cells in ischemic basal ganglia were more than that in ischemic cortex.Conclusion Cerebral ischemia induced the positive cell infiltration and basal ganglia may be more susceptible to ischemia than cortex.
, http://www.100md.com
【Key words】 Nonspecific-esterase; Enzyme-histochemistry; Brain ischemia-reperfusion; Rat
非特异性酯酶是单核细胞和单核细胞源性的巨噬细胞的一种特异性酶标记。具有免疫活性的血管周小胶质细胞是骨髓源性的,为中枢神经系统内主要的抗原提呈细胞,之所以称其为血管周小胶质细胞,是因其形态学定位于血管基膜以外[1]。因此,不同于血管周细胞,该细胞定位于血管基膜内,实际在脑实质以外[2]。单核/巨噬细胞和小胶质细胞均涉及到脑缺血的病理过程,而且三者均为非特异性酯酶阳性细胞。非特异性酯酶染色显示,大量的单核/巨噬细胞聚集于脑缺血区内[3]。光镜和电镜研究证实,激活的小胶质细胞显示非特异性酯酶强阳性反应,而分支状小胶质细胞则阴性。并由此认为前者来源于血液单核细胞[4]。研究发现脑缺血区既有单核/巨噬细胞的浸润,又有小胶质细胞的激活和增生[5]。但是,有关脑缺血区非特异性酯酶阳性细胞的形态、分布和数量变化的详尽研究报道,所见甚少。本实验的目的旨在补充这方面的资料。
, 百拇医药
材料和方法
1.实验动物及分组
选用雄性SD大鼠40只,3~4月龄,体重200~250g,由西安医科大学实验动物中心提供。分为对照组及缺血1h再灌流0h、2h、4h、8h和16h共6组(n=6)。4只用于TTC和Evans蓝染色实验,以证实脑缺血模型的可靠性。
2.缺血模型制做及制片
脑局部缺血/再灌流模型按照Barone等[6]方法,其中有些步骤进行了修改。主要步骤为:用20%乌拉坦(urethan)(0.6ml/100g鼠重)对实验大鼠腹腔注射麻醉,从颞区入颅,暴露右侧大脑中动脉主干,用无创伤缝合线在嗅静脉上方悬吊大脑中动脉主干,使其距脑表面约1~2mm,悬吊1h,抽出缝线,开始上述不同时间的再灌流,依次缝合颞肌和皮肤。
, 百拇医药 大鼠脑缺血/再灌流之后,在麻醉下开胸,用生理盐水200ml从左心室冲洗、用4%多聚甲醛(0.1mol/L PBS配制,pH 7.4)400ml灌流固定和开颅取脑。脑缺血中央区冷冻切片,片厚16μm,贴在载片上,作酶组织化学染色。
3.酶组织化学染色和定量
切片于室温晾干后入固定液(Na2HPO4 20mg, KH2PO4 100mg,30%福尔马林25ml,100%丙酮45ml)室温30min,0.1mol/L PBS(pH7.6)洗3次。入反应液[0.2mol/L PBS(pH7.6)6ml,三蒸水24ml,作用液0.6ml(α-醋酸萘酯1g,100%丙酮50ml,三蒸水50ml),快蓝B盐30mg]于室温30min,0.1mol/L PBS洗3次。常规脱水、透明和封片。阴性对照片在反应液中免去快蓝B盐。
, 百拇医药 每个样本取6张切片(隔5取1)进行染色。光镜观察,在相同的光强度和放大倍数下,用C6型网格目镜尺在每一张切片的缺血区随机取6个视野,对阳性细胞进行计数,数据以
 ±s表示,SAS软件统计处理,Q检验判断结果。
±s表示,SAS软件统计处理,Q检验判断结果。结 果
光镜观察显示,正常对照组有少数非特异性酯酶阳性细胞,呈蓝黑色,沿血管的走行分布,主要位于小血管和微血管壁内及其周围(图1)。脑实质内可见少数阳性细胞散在分布。在实验组,阳性细胞呈圆形或卵圆形,没有明显的突起(图2,3),主要分布于脑缺血边缘区。损伤侧基底节区比皮质缺血区明显增多。计数统计结果显示,在缺血1h再灌流2h后,皮质缺血区阳性细胞明显增多,与对照组相比差异明显(P<0.05)(附表,图2),随再灌流时间延长逐渐增加,在脑缺血1h再灌流16h后达到最高峰,与其他实验组相比有显著性差异(P<0.01)(附表,图3)。在损伤侧基底节区,在脑缺血1h阳性细胞即增加(附表,图4),并随再灌流时间延长而增加。在脑缺血1h再灌流2、4、8h,基底节区非特异性酯酶阳性细胞比皮质缺血区显著增多(附表,图5,6)。
, 百拇医药
附表 皮质缺血区和损伤侧基底节区非特异性酯酶阳性细胞的计数和比较
Table The number and comparison of nonspecific estarase positive cells in the ischemic cortex and basal ganglia n=6 检测区域
measure area
对照组
control
Ⅰ1h/R0h组
Ⅰ 1h/R0h
Ⅰ1h/R2h组
Ⅰ 1h/R2h
, 百拇医药
Ⅰ1h/R4h组
Ⅰ 1h/R4h
Ⅰ1h/R8h组
Ⅰ 1h/R8h
Ⅰ1h/R16h组
Ⅰ 1h/R16h
皮质缺血区 (ischemic cortex)
3.6±0.9
4.3±0.8
6.3±1.2*
9.5±0.8*
, 百拇医药
10.3±1.5*
15.7±2.5**△
缺血侧基底节区(ischemic basal ganglia)
5.8±0.7
10.1±1.3*▲
12.3±2.0*▲▲
13.7±0.8**▲
14.5±2.7**▲
13.1±1.9**
, 百拇医药
注:表中数为
 ±s(0.25mm2) Ⅰ.缺血 R.再灌流 与对照组相比,*P<0.05,**P<0.01;实验组间相比,△P<0.01;与皮质区比较,▲P<0.05,▲▲P<0.01
±s(0.25mm2) Ⅰ.缺血 R.再灌流 与对照组相比,*P<0.05,**P<0.01;实验组间相比,△P<0.01;与皮质区比较,▲P<0.05,▲▲P<0.01Note:The numbers in the table are
 ±s(0.25mm2);Ⅰ,Ischemica R,Reperfusion; *P<0.05,**P<0.01,compared with control;△P<0.01,comparison among differently experimental groups;▲P<0.05,▲▲P<0.01,comparied with ischemic cortex.讨 论
±s(0.25mm2);Ⅰ,Ischemica R,Reperfusion; *P<0.05,**P<0.01,compared with control;△P<0.01,comparison among differently experimental groups;▲P<0.05,▲▲P<0.01,comparied with ischemic cortex.讨 论, http://www.100md.com
用酶组织化学染色方法研究非特异酯酶阳性细胞与脑缺血的关系,结果证实脑缺血区阳性细胞增加。以往的研究证实,血液的单核细胞及其衍生的巨噬细胞显示强烈的非特异性酯酶活性。本实验观察了非特异性酯酶阳性细胞的形态和分布,该细胞呈圆形或卵圆形,未见明显的突起,多数位于小血管和微血管的壁内及血管周围,仅少部分散在分布于脑实质。对照组亦见阳性细胞存在于血管壁。据此推断,脑缺血区聚集的阳性细胞可能为血液单核细胞及其衍生的巨噬细胞和激活的血管周小胶质细胞。白细胞和单核/巨噬细胞与脑缺血和脑中风的联系,已经研究了半个多世纪[7]。众多研究证实,缺血区单核/巨噬细胞聚集增加。Garcia等[8]发现单核/巨噬细胞在缺血区的聚集发生在缺血之后7~16d,但Sornas等[9]报道是在3~7d,而Giulian等[3]证实为16h。直到最近,Birdsall等[10]发现大量单核/巨噬细胞在心脏梗塞区聚集发生于再灌流60min之后。我们的结果与Birdsall的结果基本一致,都观察到单核/巨噬细胞的早期浸润。单核/巨噬细胞聚集的部位,各实验室的报道基本一致,即早期在梗塞的边缘区,后期浸润到中央区。我们观察到大量阳性细胞聚集于血管壁内和血管周围,其部位相当于以往报道的血管周单核/巨噬细胞和血管周激活的小胶质[11]。但阳性细胞与血管基膜的关系,有待观察。
, http://www.100md.com
小胶质细胞与脑缺血的关系已有研究报道[4],并对其部位进行了特定的研究,认为阿米巴小胶质细胞比单核细胞源性的巨噬细胞距损伤部位远[12]。研究证实阿米巴小胶质细胞和反应性小胶质细胞,显示非特异性酯酶强阳性反应[4]。所以,本实验观察到的非特异性酯酶阳性细胞既有来源于血液的单核/巨噬细胞,又有小胶质细胞。
基底动脉环和大脑后动脉的分支,在基底节区形成密集的动脉网。同时,该区域血管的起始处内径小,呈直角发出,而且在基底节内蜿蜒行程。基底节区血管壁的代谢具有老龄血管的特征,表现为ATP酶和葡萄糖-6-磷酸脱氢酶活性低[13],并认为是基底节区易发生中风的原因。本实验观察到缺血侧基底节区非特异性酯酶阳性细胞比皮质缺血区明显增多,而且阳性细胞浸润发生的时间也较皮质缺血区早;同时观察到基底节区血管内皮细胞粘附分子的表达比皮质区明显增加(未发表资料)。这些因素可能与基底节区易发生中风有关。






, 百拇医药
图版说明
图1 箭头所示为对照组大脑皮质非特异性酯酶阳性细胞 ×100
图2 脑缺血lh再灌流2h,皮质缺血区非特异性酯酶阳性细胞(箭头示阳性细胞位于脑实质和血管壁内)×200
图3 脑缺血1h再灌流16h,皮质缺血区非特异性酯酶阳性细胞(箭头示阳性细胞位于脑实质)×100
图4 脑缺血lh再灌流0h,缺血侧基底节区非恃异性酯酶阳性细胞(箭头示阳性细胞位于血管壁内)×100
图5 脑缺血1h再灌流8h,缺血侧基底节区非特异性酯酶阳性细胞(箭头示阳性细胞随血管分布) ×100
图6 脑缺血1h再灌流16h,缺血侧基底节区非特异性酯酶阳性细胞(箭头示阳性细胞随血管分布) ×100
, http://www.100md.com
Explanation of figures
Fig. 1 Arrow shows nonspecific esterase positive cells in control cerebral cortex. ×100
Fig. 2 Nonspecific esterase positive cells in ischemic cerebral cortex at 1 hour ischemia and 2 hour reperfusion. Arrows show positive cells incerebral parenchyma and the wall of vessels. ×200
Fig. 3 Nonspecific esterase positive cells in ischemic cerebral cortex at I hour ischemia and 16 hour reperfusion. Arrows show positive cells incerebral parenchyrna. ×100
, 百拇医药
Fig. 4 Nonspecific esterase positive cells in ischemic basal ganglia at 1 hour ischemia. Arrows show positive cells in the wall of vessels.×200
Fig. 5 Nonspecific esterase positive cells in ischemic basal ganglia at 1 hour ischemia and & hour reperfusion. Arrows show positive cells distri-bution with vessels. ×100
Fig. 6 Nonspecific esterase positive cells in ischeinic basal ganglia at 1 hour ischemia and 16 hour reperfusion. Arrows show positive cells disiribution with vessels. ×100
, 百拇医药
△ Department of Anatomy, Sun Yat-sen University of Medical Sciences, Guangzhou 510089,China
参考文献
1 Stensaas LJ. Pericytes and perivascular microglial cells in the basal forebrain of the neonatal rabbit. Cell Tissue Res,1975,158(3)517
2 Graeber MB, Streit WJ, Kreutzberg GW. Identify of ED2-positive perivascular cells in rat brain. J Neurosci Res,1989,22(1):103
, http://www.100md.com 3 Giulian D, Robertson C. Inhibition of mononuclear phagocytes reduces ischemic injury in the spinal cord. Ann Neurol,1990,27(1):33
4 Ling EA, Kaur C, Wong WC. Light and electron microscopic demonstration of non-specific esterase in amoeboid microglial cells in the corpus callosum in postnatal rats: a cytochemical link to monocytes. J Anat, 1982,135(2):385
5 Kato H, Kogure K, Liu XH, et al. Progressive expression of immunomolecules on activated microglia and invading leukocytes following focal cerebral ischemia in the rat. Brain Res, 1996,734(2):203
, 百拇医药
6 Barone FC, Schmidt DB, Hillegass LM, et al. Reperfusion increases neutrophils and leukotriene B4 receptor binding in rat focal ischemia. Stroke,1993,23(9):1337
7 Kochanek PM, Hallenbeck JM. Polymorphonuclear leukocytes and monocytes/macrophages in the pathogenesis of cerebral ischemia and stroke. Stroke,1992,23(9):1367
8 Garcia JH, Kamijyo Y. Evolution of histopathological changes after occlusion of a middle cerebral artery in primates. J Neuropathol Exp Neurol,1974,33(3):408
, 百拇医药
9 Sornas R, Ostlund H, Muller R. Cerebrospinal fluid cytology after stroke. Arch Neurol,1972,26(3):489
10 Birdsall HH, Green DM, Trial J, et al. Complement C5a,TGF-β 1 and MCP-1, in sequence, Induce migration of monocytes into ischemic canine myocardium within the first one to five hours after reperfusion. Circulation, 1997,95(3):684
11 Liu Y, Jacobowitz DM, Barone F, et al. Quantitation of perivascular monocytes and macrophages around cerebral blood vessels of hypertensive and aged rats. J Cerebr Blood Flow Metab,1994,14(2):348
, 百拇医药
12 Giulian D. Ameboid microglia as effectors of inflammation in central nervous system. J Neurosci Res,1987,18(1):155
13 Rieke GK, Cannon MS. A histochemical study of cerebral cortical vessels and ganglionic vessels of the caudatoputamen in aging normotensive rats. Stroke,1985,16(2):285
收稿1998-06 修回1999-03, 百拇医药