肝纤维化启动期大鼠血清对肝星形细胞TGF-β1表达的影响
作者:蒙一纯 丁霞 贲长恩 郭顺根 王泰玲
单位:蒙一纯(北京中医药大学组织学胚胎学教研室,北京 100029);丁霞(北京中医药大学组织学胚胎学教研室,北京 100029);贲长恩(北京中医药大学组织学胚胎学教研室,北京 100029);郭顺根(北京中医药大学组织学胚胎学教研室,北京 100029);王泰玲(北京中日友好医院病理科,北京 100029)
关键词:肝星形细胞;转化生长因子-β1;肝纤维化;血清
解剖学报000316 【摘要】 目的 研究大鼠血清与肝星形细胞表达TGF-β1的关系,为临床的早期诊断和中医药治疗肝纤维化提供新的思路。 方法 制备正常大鼠血清、免疫性肝纤维化大鼠血清和益气活血复方药物血清,培养肝星形细胞(HSC),激光共聚焦显微镜定量分析其TGF-β1的表达。 结果 (1)造模3周时大鼠血清使培养的HSC中TGF-β1表达显著增强,正常鼠血清、造模5周和7周(即纤维化形成后)血清没有此作用;(2)添加益气活血药物血清可使造模3周鼠血清刺激HSC高水平表达的TGF-β1作用消失。 结论 (1)造模3周鼠血清中含有强烈的刺激HSC激活的物质;(2)活血化淤方剂的作用靶点是血液中的活性物质,通过拮抗血液中HSC活化物质达到抗纤维化的作用。研究大鼠血清与肝星形细胞表达TGF-β1的关系,为临床的早期诊断和中医药治疗肝纤维化提供新的思路。 方法 制备正常大鼠血清、免疫性肝纤维化大鼠血清和益气活血复方药物血清,培养肝星形细胞(HSC),激光共聚焦显微镜定量分析其TGF-β1的表达。 结果 (1)造模3周时大鼠血清使培养的HSC中TGF-β1表达显著增强,正常鼠血清、造模5周和7周(即纤维化形成后)血清没有此作用;(2)添加益气活血药物血清可使造模3周鼠血清刺激HSC高水平表达的TGF-β1作用消失。 结论 (1)造模3周鼠血清中含有强烈的刺激HSC激活的物质;(2)活血化淤方剂的作用靶点是血液中的活性物质,通过拮抗血液中HSC活化物质达到抗纤维化的作用。
, http://www.100md.com
【中图分类号】 R575.2 【文献标识码】 A 【文章编号】 0529-1356(2000)03-257
INITIAL FIBROTIC SERUM AFFECT ON TGF-β1 EXPRESSION
IN HSC DURING LIVER FIBROGENESIS OF RAT
MENG Yi-chun DING Xia BEN Chang-en WANG Tai-ling
Department of Histology and Embyology, Beijing University of Traditional Chinese Medicine,Beijing 100029,China
Chian-Japan Friendship Hospital,Beijing 100029,China
, 百拇医药
【Abstract】 Objective To study initial fibrotic serum effect on TGF-β1 expression in HSC and the mechanism of anti-liver fibrosis by the chinese herb studied. Methods Hepatic stellate cells were cultured respectively in DMEM media with normal rat sera, hepatic fibrogenic rat sera induced by porcine serum for 3 weeks, 5 weeks and 7 weeks, and the sera containing Yiqi Huoxue agents.TGF-β1 expression was quantified by laser common focus microscope. Results TGF-β1 expression was prodominantly increased by cultured HSC in the DMEM media plus the 3 weeks model rat sera, TGF-β1 expression was scarce in the DMEM media plus the model rat sera for 5 and 7 weeks. TGF-β1 expression decreased obviously to zero in the DMEM media together with 3 weeks model rat sera and pharmacological sera. Conclussion There is a strong stimulating substance in the 3 weeks rat serum for TGF-β1 expression in HSC.The prescription of Yiqi Huoxue may have an effect on anti-liver fibrosis through inhibiting the stimulating substance of TGF-β1 expression in the serum.
, 百拇医药
【Key words】 HSC;TGF-β1;Liver fibrosis;Serum
肝纤维化的基本病理改变主要是细胞外基质(ECM),尤其是胶原蛋白在肝内的过度增生和沉积。最近研究表明,在肝脏中ECM的构成异常将直接影响肝细胞的形态和肝细胞功能。探讨肝脏ECM过度增生的生物学机制是肝脏病研究中的新热点[1]。本实验室多年从事中药“益气活血”方剂抗器官纤维化的实验研究[2],证实益气活血方剂对纤维化有明显预防和治疗作用。尽管Gressner[3]提出了纤维化发生过程中单核细胞和纤维形成细胞旁分泌和自分泌细胞因子在器官纤维化中起重要作用,但尚不能从整体、器官、细胞和分子的不同层次提供对纤维化完整的认识。本研究制备正常大鼠血清,免疫性肝纤维化大鼠模型的不同造模时期病理血清和益气活血复方药物血清,培养肝星形细胞(hepatic stellate cells ,HSC),观察其TGF-β1的表达,并研究了纤维化模型血清在肝纤维化形成中的作用,进而探讨了益气活血方剂治疗器官纤维化的部分机制。
, 百拇医药
材料和方法
1. 动物模型的制备
建立免疫肝纤维化模型参照于世瀛的方法[2];新鲜猪血经0.4%枸橼酸钠抗凝,离心1 500r/min×10min制备血清,过滤除菌,分装后置-40℃保存备用。Wistar雄性大鼠40只,体重140~160g,购自于中国医学科学院动物所。动物分为正常组、造模组和药物血清组;造模组动物分成3、5、7周3组。以上各组动物均为8只。造模组大鼠腹腔注射猪血清,0.5ml/只、每周2次。用苦味酸-天狼猩红染色方法观察模型动物肝Ⅰ型和Ⅲ型胶原的变化。
2. 药物制备
益气活血方剂;丹参、赤芍、灸黄芪、柴胡等组成,购于北京同仁堂药店。中药水煎剂含生药3.5kg/L。
3. 鼠血清的制备
, 百拇医药
3.1 正常大鼠和造模大鼠血清:大鼠乙醚麻醉,无菌条件下腹主动脉取血10ml,4℃静置2h,离心1 500r/min×10min制备血清,经56℃60min灭活,-40℃冻存备用。
3.2 药物血清:正常大鼠禁食12h,连续两次灌服益气活血方剂,8ml/kg,两次给药间隔1h。2次给药后2h取血[4],血清制备和保存方法同上。
4. HSC的分离和培养
HSC分离参照陈爽[5]方法并改良。用雄性健康大鼠,水合氯醛腹腔注射麻醉0.4g/kg。腹部消毒后切开。剥离门静脉后迅速插管,及时剪断下腔静脉。37℃前灌流液200ml,10ml/min,冲洗肝脏血液。灌注链霉蛋白酶(Pronase-E为Merck产品)1.25g/L,37℃,8~12ml/min;胶原酶(Ⅳ Collagenas系Sigma产品)0.15g/L循环灌注20min。将液化的肝脏放入含胶原酶、链霉蛋白酶和DNA酶(DNase系Sigma产品)三角烧瓶中震荡消化20min,200目双层尼龙网过滤,离心2 250r/min×7min。D-Hank液洗涤2次。离心1 000r/min×2min,取其悬浮细胞。用终浓度18%的Nycodenz(Sigma)作为密度梯度离心介质,上被覆一层D-Hank液,离心4 600r/min×20min,收集界面处细胞。DMEM洗1次,培养液为内含20%胎牛血清(Hyclon)的DMEM(Gibico),调细胞密度到106/ml。采用维生素A自发荧光和免疫组织化学方法进行HSC的鉴定。Desmin 为Dako产品,效价1∶400。
, 百拇医药
HSC培养在内置0.5×0.5mm盖玻片的12孔培养板中,pH为7.2,HSC密度106/ml,每孔0.5ml。37℃,5%CO2鹅卵箱培养48h,HSC均匀、牢固生长在盖片上。吸出培养液,用无血清DMEM洗涤,每孔加1%胎牛血清DMEM 0.5ml,在此基础上将培养细胞分为正常鼠血清组、模型血清组、药物血清治疗组。(1)正常鼠血清组:加10%正常鼠血清DMEM 0.5ml;(2)模型血清组:分别加入含3、5和7周造模大鼠血清10%DMEM 0.5ml;(3)药物血清治疗组:加造模3、5和7周病理血清组基础上,加入含10%药物大鼠血清DMEM 0.5ml。HSC 继续培养48h,用0.025的戊二醛,4℃,固定5min。
5. TGF-β1免疫组织化学染色
采用免疫组织化学荧光染色二步法。一抗:TGF-β1多克隆抗体为Santa Cruz产品,效价1∶400。二抗IgG-FITC为Santa Cruz产品,效价1∶100。阴性对照用10%牛血清/PBS,阳性对照采用Vimentin。
, 百拇医药
6. 观察方法
采用美国MERIDIAN ACAS575型激光扫描共聚焦显微系统进行观察分析,单染样本检测分析软件,蓝光激发(波长488nm),阻挡滤片为530/30Bp。功率100mV,扫描强度20%,Pihhole 800μm,PTM1 为39.2,Samplepoint 为3%。每组随机10个HSC进行观察、储存、然后进行统计学分析。
结 果
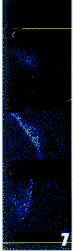
1. 苦味酸-天狼猩红染色切片,偏振光显微镜下Ⅰ型胶原纤维呈强双折射为红色或黄色的粗纤维,Ⅲ型胶原呈弱双折射为绿色的细纤维。正常组和3周模型组肝脏汇管区和各级静脉周围有橘黄色的Ⅰ型胶原,在肝窦周有染成黄绿的、纤细的Ⅲ型胶原。5周模型组和7周模型组汇管区、中央静脉周围和窦周Ⅰ型胶原明显增多,染成亮红色。在5周组有不完整的纤维桥存在。7周组中央静脉之间和门管区之间形成了纤维索桥。成功建立了猪血清免疫大鼠肝纤维化模型(图1~3)。
, 百拇医药
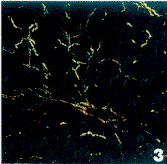
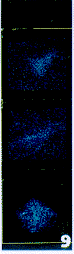
2. 鉴定分离的HSC,维生素A自发荧光呈绿色和Desmin染色呈棕黄,HSC纯度为99%。(图4,5)。
3. 在激光扫描共聚焦显微镜下,3周造模血清组培养的HSC呈很强的TGF-β1荧光,正常鼠血清组和5周造模血清组培养的TGF-β1荧光较弱(图6~9),7周造模血清组和添加药物鼠血清组的TGF-β1荧光极弱,在荧光激发下瞬间淬灭。
附表 由激光共聚焦显微镜分析各组得到的平均光密度值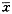 ±s
±s
Table Observing TGF-β10D(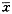 ±s) by LCFM in
±s) by LCFM in
several serum groups
, http://www.100md.com
正常血清组
normal
3周血清组
3 weeks
5周血清组
5 weeks
7周血清组
7 weeks
无药血清组
36.9±8.7
196.5±55.7
38.8±6.5
, 百拇医药
0
serum with- out drug
加药血清组
0
0
0
0
serum with drug
根据附表参数可得图1: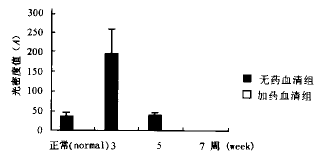
图1 大鼠血清刺激HSC后,各组表达
TGF-β1荧光强度分布图。
, 百拇医药
Fig.1 Distribution of TGF-β1 influence after HSC
were cultured by normal rat sera and fibrotic model sera.
正常大鼠血清可使HSC表达低水平的TGF-β1。在造模3周时血清可强烈刺激HSC高水平表达TGF-β1。在形成肝纤维化时期血清即5周造模血清培养的HSC表达TGF-β1的能力迅速降低。随着纤维化的程度加重,假小叶的出现,第7周造模大鼠血清培养的HSC表达TGF-β1趋近于零。药物血清添加组HSC不表达TGF-β1。荧光强度显著性检验表明:造模3周血清组与正常和5周血清组比较,加药物3周血清组与未加药物3周血清组比较P值均小于0.01,有显著性差异。
讨 论
HSC又称贮脂细胞FSC(fat-storing cell)或Ito细胞,是肝脏非实质细胞中兼有肌细胞、成纤维细胞及脂肪细胞性质的细胞。在肝纤维化的发生过程中,胶原的生成主要来自于HSC[6]。纤维发生中HSC分泌和应答大量的细胞因子。其中TGF-β1在纤维发生因子中扮演了最重要的角色[7]。TGF-β1可直接刺激HSC对胶原、纤维连结蛋白、蛋白多糖合成及基质基因的表达[8]。并促进ECM蛋白掺入基质中[9]。TGF-β1还抑制ECM降解。TGF-β1促进分泌蛋白激酶抑制剂(纤溶酶活动因子抑制因子、TIMPα),进而减少了纤溶酶原活动因子、胶原酶、弹性蛋白酶和Transin分泌及合成[10]。
, http://www.100md.com
迄今为止,普遍认为对HSC激活的调控是由细胞因子的自分泌和旁分泌方式进行的。激活的HSC分泌TGF-β1并表达TGF-β1受体,通过自分泌环调节自身的生物学活性[3]。HSC同时受控于不同细胞的旁分泌细胞因子并对其进行应答。我们的研究结果表明:肝纤维化发生的启动期,造模3周血清中含有强烈的刺激HSC激活的物质。用造模3周血清培养HSC 2dTGF-β1明显增强,说明对HSC形态和功能的调控除了旁分泌和自分泌外,机体的神经、内分泌和免疫系统可能参与了远程调控作用。而随着肝纤维化程度逐渐严重,即造模5周和7周病理血清使HSC合成TGF-β1的能力逐渐消失,该结果说明机体具有自我完善和自我修复调节机制,提示在纤维化形成后机体血清中产生了抑制血清中使HSC激活的物质。
本室在多年从事中药抗纤维化的研究中,证实益气活血药物血清可以抑制纤维化模型血清诱导的HSC Ⅰ型胶原的表达[11],并减少内皮细胞基膜Ⅳ型胶原的沉积,改善器官微循环,预防和治疗肝纤维化[2]。上述事实说明益气活血方剂抗肝纤维化发生有着共同的调控机制,该共同调控机制的途径是什么?以及益气活血方剂的作用靶点在哪里,一直困扰着我们的研究工作。我们的研究结果表明:益气活血药物血清可使造模3周组血清高水平表达的TGF-β1降低为零值,说明益气活血方剂可作用于血液中使HSC激活的活性物质,通过对这种活性物质的调控,“益气活血”达到抗纤维化的效果。
, http://www.100md.com
在不同的器官纤维化模型中血小板衍化生长因子(PDGF)作为一个很重要的间质细胞分裂原可在肾纤维化中起重要作用[18]。在慢性自发的肺纤维化中肺巨噬细胞过度释放PDGF是纤维细胞增殖的重要基础[13]。提示PDGF有可能作用到TGF-β1的表达,该表达是益气活血方对纤维化治疗的细胞学和分子生物学基础。根据PDGF对HSC具有增殖和促进TGF-β1合成作用[14],我们推测造模3周组中使HSC表达TGF-β1的物质可能与PDGF有关,相应的工作正在进行中。





, 百拇医药
图版说明
图2 正常组大鼠肝脏天狼猩红染色×200
图3 3周模型组大鼠肝脏天狼猩红染色×200
图4 5周模型组大鼠肝脏天狼猩红染色×200
图5 分离后的HSC维生素A自发荧光×400
图6 分离后的HSC Desmin免疫组织化学染色×400
图7 正常大鼠血清培养HSC TGF-β1的表达。
图8 3周模型组大鼠血清培养HSC TGF-β1的表达。
图9 5周模型组大鼠血清培养HSC TGF-β1的表达。
, 百拇医药
图10 3周模型组大鼠血清培养HSC TGF-β1的表达mt2-1地形图。
Explanation of figures
Fig.2 Hepatic tissue in the normal rat was stained by sirius red-polarization ×200
Fig.3 Hepatic tissue was stained by sirius red-polarization in the model rat for 3 weeks ×200
Fig.4 Hepatic tissue was stained by sirius red-polarization in the model rat for 5 weeks ×200
, 百拇医药
Fig.5 Influence of Vitamin A in HSC ×400
Fig.6 Positive Desmin in HSC ×400
Fig.7 TGF-β1 expression in HSC cultured by normal rat sera.
Fig.8 TGF-β1 expression in HSC cultured by model sera for 3 weeks.
Fig.9 TGF-β1 expression in HSC culured by model sera for 5 weeks.
Fig.10 TGF-β1 distribution in HSC cultured by model sera for 3 weeks.
, 百拇医药
【作者简介】 蒙一纯(1955年—),男,贵州人,在读博士,副教授
通讯作者(To whom correspondence should be addressed)
参考文献
[1]H J F Hodgson C M.What keeps hepatocytes on the straight and narrow?Maintaining differentiated function in the liver[J].Gut,1999,44(3):443-446.
[2]于世瀛,贲长恩,王德福.活血化瘀方药抗大鼠肝纤维化的形态学和血清定量研究[J].中西医结合杂志,1996,6(2):21~23.
[3]Gressner AM.The cell biology of liver fibrogenesis-an imbalance of proliferation,growth arrest and apoptosis of myofibroblasts[J].Cell Tissue Res,1998,292(3):447-452.
, 百拇医药
[4]蒙一纯,丁霞,贲长恩,等.中药血清药理学应用研究展望[J].北京中医药大学学报,1999,22(4):42~44.
[5]陈爽,贲长恩,杨美娟等.Kupffer细胞对原代培养贮脂细胞激活的调节作用[J].解剖学杂志,1998,21(4):293~294.
[6]Senoo H,Hata R-Ⅰ,Nagai Y.Stellate cells(vitamin A-storing cells)are the primary site of collagen synthesis in nonparenchymal cells in the liver[J].Biomed Res,1984,5(6):451-458.
[7]Lopez-Casillas F,Wrana J,Massague J.Betaglycan presents ligand to the TGF-β1 signalling receptor[J].Cell,1993,73(7):1435-1444.
, 百拇医药
[8]Pinzani M,Gentillini A,Calligiury A.Transforming growth factor beta-1 regulates platelet derived growth-factor receptor beta-subunit in human fat storing cells[J].Hepatology,1995,21(2):232-239.
[9]Gressner AM,Althaus M.Effects of murine recombinant interferon-gamma on rat liver fat-storing cell proliferation,cluster formation and proteoglycan synthesis[J].Biochem Pharmacol,1990,40(9):1953-1962.
[10]Mallat A,Fouassier L,Preaux AM.Growth inhibitory properties of endothelin-1 in human hepatic myofibroblastic Ito cells.An endothelin B receptor mediated pathway[J].J Clin Invest,1995,96(1)42-49.
, 百拇医药
[11]蒙一纯,丁霞,贲长恩,等.益气活血方对HSC的Ⅰ型胶原的表达影响的研究[J].中国组织化学和细胞化学杂志,2000,9(1):5~8.
[12]Isbruck RA,Peterson TC.Platelet-derived growth factor and pentoxifylline modulation of collagen synthesis in myofibroblasts[J].Toxicod Appl Pharmacol,1998,149(1):120-126.
[13]Prescott SM,Zimmerman GA,McIntyre TM.Platelet activating factor[J].J Biol Chem,1990,265(29):17381-17384.
[14]Davis BH,Rapp UR,Davidason NO.Retnoic acid and TGF-β1 differentially inhibit PDGF-induced Ito cell activation[J].Biochem J,1991,278(1):43-47.
【收稿日期】1999-09-10 【修稿日期】1999-12-25, http://www.100md.com
单位:蒙一纯(北京中医药大学组织学胚胎学教研室,北京 100029);丁霞(北京中医药大学组织学胚胎学教研室,北京 100029);贲长恩(北京中医药大学组织学胚胎学教研室,北京 100029);郭顺根(北京中医药大学组织学胚胎学教研室,北京 100029);王泰玲(北京中日友好医院病理科,北京 100029)
关键词:肝星形细胞;转化生长因子-β1;肝纤维化;血清
解剖学报000316 【摘要】 目的 研究大鼠血清与肝星形细胞表达TGF-β1的关系,为临床的早期诊断和中医药治疗肝纤维化提供新的思路。 方法 制备正常大鼠血清、免疫性肝纤维化大鼠血清和益气活血复方药物血清,培养肝星形细胞(HSC),激光共聚焦显微镜定量分析其TGF-β1的表达。 结果 (1)造模3周时大鼠血清使培养的HSC中TGF-β1表达显著增强,正常鼠血清、造模5周和7周(即纤维化形成后)血清没有此作用;(2)添加益气活血药物血清可使造模3周鼠血清刺激HSC高水平表达的TGF-β1作用消失。 结论 (1)造模3周鼠血清中含有强烈的刺激HSC激活的物质;(2)活血化淤方剂的作用靶点是血液中的活性物质,通过拮抗血液中HSC活化物质达到抗纤维化的作用。研究大鼠血清与肝星形细胞表达TGF-β1的关系,为临床的早期诊断和中医药治疗肝纤维化提供新的思路。 方法 制备正常大鼠血清、免疫性肝纤维化大鼠血清和益气活血复方药物血清,培养肝星形细胞(HSC),激光共聚焦显微镜定量分析其TGF-β1的表达。 结果 (1)造模3周时大鼠血清使培养的HSC中TGF-β1表达显著增强,正常鼠血清、造模5周和7周(即纤维化形成后)血清没有此作用;(2)添加益气活血药物血清可使造模3周鼠血清刺激HSC高水平表达的TGF-β1作用消失。 结论 (1)造模3周鼠血清中含有强烈的刺激HSC激活的物质;(2)活血化淤方剂的作用靶点是血液中的活性物质,通过拮抗血液中HSC活化物质达到抗纤维化的作用。
, http://www.100md.com
【中图分类号】 R575.2 【文献标识码】 A 【文章编号】 0529-1356(2000)03-257
INITIAL FIBROTIC SERUM AFFECT ON TGF-β1 EXPRESSION
IN HSC DURING LIVER FIBROGENESIS OF RAT
MENG Yi-chun DING Xia BEN Chang-en WANG Tai-ling
Department of Histology and Embyology, Beijing University of Traditional Chinese Medicine,Beijing 100029,China
Chian-Japan Friendship Hospital,Beijing 100029,China
, 百拇医药
【Abstract】 Objective To study initial fibrotic serum effect on TGF-β1 expression in HSC and the mechanism of anti-liver fibrosis by the chinese herb studied. Methods Hepatic stellate cells were cultured respectively in DMEM media with normal rat sera, hepatic fibrogenic rat sera induced by porcine serum for 3 weeks, 5 weeks and 7 weeks, and the sera containing Yiqi Huoxue agents.TGF-β1 expression was quantified by laser common focus microscope. Results TGF-β1 expression was prodominantly increased by cultured HSC in the DMEM media plus the 3 weeks model rat sera, TGF-β1 expression was scarce in the DMEM media plus the model rat sera for 5 and 7 weeks. TGF-β1 expression decreased obviously to zero in the DMEM media together with 3 weeks model rat sera and pharmacological sera. Conclussion There is a strong stimulating substance in the 3 weeks rat serum for TGF-β1 expression in HSC.The prescription of Yiqi Huoxue may have an effect on anti-liver fibrosis through inhibiting the stimulating substance of TGF-β1 expression in the serum.
, 百拇医药
【Key words】 HSC;TGF-β1;Liver fibrosis;Serum
肝纤维化的基本病理改变主要是细胞外基质(ECM),尤其是胶原蛋白在肝内的过度增生和沉积。最近研究表明,在肝脏中ECM的构成异常将直接影响肝细胞的形态和肝细胞功能。探讨肝脏ECM过度增生的生物学机制是肝脏病研究中的新热点[1]。本实验室多年从事中药“益气活血”方剂抗器官纤维化的实验研究[2],证实益气活血方剂对纤维化有明显预防和治疗作用。尽管Gressner[3]提出了纤维化发生过程中单核细胞和纤维形成细胞旁分泌和自分泌细胞因子在器官纤维化中起重要作用,但尚不能从整体、器官、细胞和分子的不同层次提供对纤维化完整的认识。本研究制备正常大鼠血清,免疫性肝纤维化大鼠模型的不同造模时期病理血清和益气活血复方药物血清,培养肝星形细胞(hepatic stellate cells ,HSC),观察其TGF-β1的表达,并研究了纤维化模型血清在肝纤维化形成中的作用,进而探讨了益气活血方剂治疗器官纤维化的部分机制。
, 百拇医药
材料和方法
1. 动物模型的制备
建立免疫肝纤维化模型参照于世瀛的方法[2];新鲜猪血经0.4%枸橼酸钠抗凝,离心1 500r/min×10min制备血清,过滤除菌,分装后置-40℃保存备用。Wistar雄性大鼠40只,体重140~160g,购自于中国医学科学院动物所。动物分为正常组、造模组和药物血清组;造模组动物分成3、5、7周3组。以上各组动物均为8只。造模组大鼠腹腔注射猪血清,0.5ml/只、每周2次。用苦味酸-天狼猩红染色方法观察模型动物肝Ⅰ型和Ⅲ型胶原的变化。
2. 药物制备
益气活血方剂;丹参、赤芍、灸黄芪、柴胡等组成,购于北京同仁堂药店。中药水煎剂含生药3.5kg/L。
3. 鼠血清的制备
, 百拇医药
3.1 正常大鼠和造模大鼠血清:大鼠乙醚麻醉,无菌条件下腹主动脉取血10ml,4℃静置2h,离心1 500r/min×10min制备血清,经56℃60min灭活,-40℃冻存备用。
3.2 药物血清:正常大鼠禁食12h,连续两次灌服益气活血方剂,8ml/kg,两次给药间隔1h。2次给药后2h取血[4],血清制备和保存方法同上。
4. HSC的分离和培养
HSC分离参照陈爽[5]方法并改良。用雄性健康大鼠,水合氯醛腹腔注射麻醉0.4g/kg。腹部消毒后切开。剥离门静脉后迅速插管,及时剪断下腔静脉。37℃前灌流液200ml,10ml/min,冲洗肝脏血液。灌注链霉蛋白酶(Pronase-E为Merck产品)1.25g/L,37℃,8~12ml/min;胶原酶(Ⅳ Collagenas系Sigma产品)0.15g/L循环灌注20min。将液化的肝脏放入含胶原酶、链霉蛋白酶和DNA酶(DNase系Sigma产品)三角烧瓶中震荡消化20min,200目双层尼龙网过滤,离心2 250r/min×7min。D-Hank液洗涤2次。离心1 000r/min×2min,取其悬浮细胞。用终浓度18%的Nycodenz(Sigma)作为密度梯度离心介质,上被覆一层D-Hank液,离心4 600r/min×20min,收集界面处细胞。DMEM洗1次,培养液为内含20%胎牛血清(Hyclon)的DMEM(Gibico),调细胞密度到106/ml。采用维生素A自发荧光和免疫组织化学方法进行HSC的鉴定。Desmin 为Dako产品,效价1∶400。
, 百拇医药
HSC培养在内置0.5×0.5mm盖玻片的12孔培养板中,pH为7.2,HSC密度106/ml,每孔0.5ml。37℃,5%CO2鹅卵箱培养48h,HSC均匀、牢固生长在盖片上。吸出培养液,用无血清DMEM洗涤,每孔加1%胎牛血清DMEM 0.5ml,在此基础上将培养细胞分为正常鼠血清组、模型血清组、药物血清治疗组。(1)正常鼠血清组:加10%正常鼠血清DMEM 0.5ml;(2)模型血清组:分别加入含3、5和7周造模大鼠血清10%DMEM 0.5ml;(3)药物血清治疗组:加造模3、5和7周病理血清组基础上,加入含10%药物大鼠血清DMEM 0.5ml。HSC 继续培养48h,用0.025的戊二醛,4℃,固定5min。
5. TGF-β1免疫组织化学染色
采用免疫组织化学荧光染色二步法。一抗:TGF-β1多克隆抗体为Santa Cruz产品,效价1∶400。二抗IgG-FITC为Santa Cruz产品,效价1∶100。阴性对照用10%牛血清/PBS,阳性对照采用Vimentin。
, 百拇医药
6. 观察方法
采用美国MERIDIAN ACAS575型激光扫描共聚焦显微系统进行观察分析,单染样本检测分析软件,蓝光激发(波长488nm),阻挡滤片为530/30Bp。功率100mV,扫描强度20%,Pihhole 800μm,PTM1 为39.2,Samplepoint 为3%。每组随机10个HSC进行观察、储存、然后进行统计学分析。
结 果
1. 苦味酸-天狼猩红染色切片,偏振光显微镜下Ⅰ型胶原纤维呈强双折射为红色或黄色的粗纤维,Ⅲ型胶原呈弱双折射为绿色的细纤维。正常组和3周模型组肝脏汇管区和各级静脉周围有橘黄色的Ⅰ型胶原,在肝窦周有染成黄绿的、纤细的Ⅲ型胶原。5周模型组和7周模型组汇管区、中央静脉周围和窦周Ⅰ型胶原明显增多,染成亮红色。在5周组有不完整的纤维桥存在。7周组中央静脉之间和门管区之间形成了纤维索桥。成功建立了猪血清免疫大鼠肝纤维化模型(图1~3)。
, 百拇医药
2. 鉴定分离的HSC,维生素A自发荧光呈绿色和Desmin染色呈棕黄,HSC纯度为99%。(图4,5)。
3. 在激光扫描共聚焦显微镜下,3周造模血清组培养的HSC呈很强的TGF-β1荧光,正常鼠血清组和5周造模血清组培养的TGF-β1荧光较弱(图6~9),7周造模血清组和添加药物鼠血清组的TGF-β1荧光极弱,在荧光激发下瞬间淬灭。
附表 由激光共聚焦显微镜分析各组得到的平均光密度值
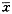 ±s
±sTable Observing TGF-β10D(
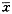 ±s) by LCFM in
±s) by LCFM inseveral serum groups
, http://www.100md.com
正常血清组
normal
3周血清组
3 weeks
5周血清组
5 weeks
7周血清组
7 weeks
无药血清组
36.9±8.7
196.5±55.7
38.8±6.5
, 百拇医药
0
serum with- out drug
加药血清组
0
0
0
0
serum with drug
根据附表参数可得图1:

图1 大鼠血清刺激HSC后,各组表达
TGF-β1荧光强度分布图。
, 百拇医药
Fig.1 Distribution of TGF-β1 influence after HSC
were cultured by normal rat sera and fibrotic model sera.
正常大鼠血清可使HSC表达低水平的TGF-β1。在造模3周时血清可强烈刺激HSC高水平表达TGF-β1。在形成肝纤维化时期血清即5周造模血清培养的HSC表达TGF-β1的能力迅速降低。随着纤维化的程度加重,假小叶的出现,第7周造模大鼠血清培养的HSC表达TGF-β1趋近于零。药物血清添加组HSC不表达TGF-β1。荧光强度显著性检验表明:造模3周血清组与正常和5周血清组比较,加药物3周血清组与未加药物3周血清组比较P值均小于0.01,有显著性差异。
讨 论
HSC又称贮脂细胞FSC(fat-storing cell)或Ito细胞,是肝脏非实质细胞中兼有肌细胞、成纤维细胞及脂肪细胞性质的细胞。在肝纤维化的发生过程中,胶原的生成主要来自于HSC[6]。纤维发生中HSC分泌和应答大量的细胞因子。其中TGF-β1在纤维发生因子中扮演了最重要的角色[7]。TGF-β1可直接刺激HSC对胶原、纤维连结蛋白、蛋白多糖合成及基质基因的表达[8]。并促进ECM蛋白掺入基质中[9]。TGF-β1还抑制ECM降解。TGF-β1促进分泌蛋白激酶抑制剂(纤溶酶活动因子抑制因子、TIMPα),进而减少了纤溶酶原活动因子、胶原酶、弹性蛋白酶和Transin分泌及合成[10]。
, http://www.100md.com
迄今为止,普遍认为对HSC激活的调控是由细胞因子的自分泌和旁分泌方式进行的。激活的HSC分泌TGF-β1并表达TGF-β1受体,通过自分泌环调节自身的生物学活性[3]。HSC同时受控于不同细胞的旁分泌细胞因子并对其进行应答。我们的研究结果表明:肝纤维化发生的启动期,造模3周血清中含有强烈的刺激HSC激活的物质。用造模3周血清培养HSC 2dTGF-β1明显增强,说明对HSC形态和功能的调控除了旁分泌和自分泌外,机体的神经、内分泌和免疫系统可能参与了远程调控作用。而随着肝纤维化程度逐渐严重,即造模5周和7周病理血清使HSC合成TGF-β1的能力逐渐消失,该结果说明机体具有自我完善和自我修复调节机制,提示在纤维化形成后机体血清中产生了抑制血清中使HSC激活的物质。
本室在多年从事中药抗纤维化的研究中,证实益气活血药物血清可以抑制纤维化模型血清诱导的HSC Ⅰ型胶原的表达[11],并减少内皮细胞基膜Ⅳ型胶原的沉积,改善器官微循环,预防和治疗肝纤维化[2]。上述事实说明益气活血方剂抗肝纤维化发生有着共同的调控机制,该共同调控机制的途径是什么?以及益气活血方剂的作用靶点在哪里,一直困扰着我们的研究工作。我们的研究结果表明:益气活血药物血清可使造模3周组血清高水平表达的TGF-β1降低为零值,说明益气活血方剂可作用于血液中使HSC激活的活性物质,通过对这种活性物质的调控,“益气活血”达到抗纤维化的效果。
, http://www.100md.com
在不同的器官纤维化模型中血小板衍化生长因子(PDGF)作为一个很重要的间质细胞分裂原可在肾纤维化中起重要作用[18]。在慢性自发的肺纤维化中肺巨噬细胞过度释放PDGF是纤维细胞增殖的重要基础[13]。提示PDGF有可能作用到TGF-β1的表达,该表达是益气活血方对纤维化治疗的细胞学和分子生物学基础。根据PDGF对HSC具有增殖和促进TGF-β1合成作用[14],我们推测造模3周组中使HSC表达TGF-β1的物质可能与PDGF有关,相应的工作正在进行中。









, 百拇医药
图版说明
图2 正常组大鼠肝脏天狼猩红染色×200
图3 3周模型组大鼠肝脏天狼猩红染色×200
图4 5周模型组大鼠肝脏天狼猩红染色×200
图5 分离后的HSC维生素A自发荧光×400
图6 分离后的HSC Desmin免疫组织化学染色×400
图7 正常大鼠血清培养HSC TGF-β1的表达。
图8 3周模型组大鼠血清培养HSC TGF-β1的表达。
图9 5周模型组大鼠血清培养HSC TGF-β1的表达。
, 百拇医药
图10 3周模型组大鼠血清培养HSC TGF-β1的表达mt2-1地形图。
Explanation of figures
Fig.2 Hepatic tissue in the normal rat was stained by sirius red-polarization ×200
Fig.3 Hepatic tissue was stained by sirius red-polarization in the model rat for 3 weeks ×200
Fig.4 Hepatic tissue was stained by sirius red-polarization in the model rat for 5 weeks ×200
, 百拇医药
Fig.5 Influence of Vitamin A in HSC ×400
Fig.6 Positive Desmin in HSC ×400
Fig.7 TGF-β1 expression in HSC cultured by normal rat sera.
Fig.8 TGF-β1 expression in HSC cultured by model sera for 3 weeks.
Fig.9 TGF-β1 expression in HSC culured by model sera for 5 weeks.
Fig.10 TGF-β1 distribution in HSC cultured by model sera for 3 weeks.
, 百拇医药
【作者简介】 蒙一纯(1955年—),男,贵州人,在读博士,副教授
通讯作者(To whom correspondence should be addressed)
参考文献
[1]H J F Hodgson C M.What keeps hepatocytes on the straight and narrow?Maintaining differentiated function in the liver[J].Gut,1999,44(3):443-446.
[2]于世瀛,贲长恩,王德福.活血化瘀方药抗大鼠肝纤维化的形态学和血清定量研究[J].中西医结合杂志,1996,6(2):21~23.
[3]Gressner AM.The cell biology of liver fibrogenesis-an imbalance of proliferation,growth arrest and apoptosis of myofibroblasts[J].Cell Tissue Res,1998,292(3):447-452.
, 百拇医药
[4]蒙一纯,丁霞,贲长恩,等.中药血清药理学应用研究展望[J].北京中医药大学学报,1999,22(4):42~44.
[5]陈爽,贲长恩,杨美娟等.Kupffer细胞对原代培养贮脂细胞激活的调节作用[J].解剖学杂志,1998,21(4):293~294.
[6]Senoo H,Hata R-Ⅰ,Nagai Y.Stellate cells(vitamin A-storing cells)are the primary site of collagen synthesis in nonparenchymal cells in the liver[J].Biomed Res,1984,5(6):451-458.
[7]Lopez-Casillas F,Wrana J,Massague J.Betaglycan presents ligand to the TGF-β1 signalling receptor[J].Cell,1993,73(7):1435-1444.
, 百拇医药
[8]Pinzani M,Gentillini A,Calligiury A.Transforming growth factor beta-1 regulates platelet derived growth-factor receptor beta-subunit in human fat storing cells[J].Hepatology,1995,21(2):232-239.
[9]Gressner AM,Althaus M.Effects of murine recombinant interferon-gamma on rat liver fat-storing cell proliferation,cluster formation and proteoglycan synthesis[J].Biochem Pharmacol,1990,40(9):1953-1962.
[10]Mallat A,Fouassier L,Preaux AM.Growth inhibitory properties of endothelin-1 in human hepatic myofibroblastic Ito cells.An endothelin B receptor mediated pathway[J].J Clin Invest,1995,96(1)42-49.
, 百拇医药
[11]蒙一纯,丁霞,贲长恩,等.益气活血方对HSC的Ⅰ型胶原的表达影响的研究[J].中国组织化学和细胞化学杂志,2000,9(1):5~8.
[12]Isbruck RA,Peterson TC.Platelet-derived growth factor and pentoxifylline modulation of collagen synthesis in myofibroblasts[J].Toxicod Appl Pharmacol,1998,149(1):120-126.
[13]Prescott SM,Zimmerman GA,McIntyre TM.Platelet activating factor[J].J Biol Chem,1990,265(29):17381-17384.
[14]Davis BH,Rapp UR,Davidason NO.Retnoic acid and TGF-β1 differentially inhibit PDGF-induced Ito cell activation[J].Biochem J,1991,278(1):43-47.
【收稿日期】1999-09-10 【修稿日期】1999-12-25, http://www.100md.com