大鼠肝大部切除后热休克处理对热休克蛋白和磷酸酶的影响
作者:夏民 卢爱灵 李效阳 赵绪永 李永辉 徐存拴
单位:夏民(河南师范大学生物系,新乡 453002);卢爱灵(河南师范大学生物系,新乡 453002);李效阳(河南师范大学生物系,新乡 453002);赵绪永(河南师范大学生物系,新乡 453002);李永辉(河南师范大学生物系,新乡 453002);徐存拴(河南师范大学生物系,新乡 453002)
关键词:肝再生;热休克;保持性热休克蛋白70;诱导性热休克蛋白68;碱性磷酸酶;酸性磷酸酶;大鼠
解剖学报000312 【摘要】 目的 研究热休克蛋白(Hsc70/Hsp68)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)在肝再生过程中的生物学作用,检测这些大分子在大鼠肝大部切除后热休克处理下的动态变化。 方法 用组织化学、免疫组织化学、Western印迹、酶的原位复性电泳、体视学分析、比色分析等方法。 结果 肝切除和热休克联合处理(PH-HS)后的0~144h恢复期间,ACP有3个高活性期(12、36和96h),AKP有2个高活性期(12和36h),Hsc70/Hsp68有2个高表达期(16和48h);PH-HS后ACP和AKP活性增强与140~180kD的酶活性增加有关。与只进行热休克(HS)(44℃,30min)处理或与只进行2/3肝切除(PH)后恢复期间Hsc70/Hsp68含量和磷酸酶活性动态变化的比较表明,PH-HS对Hsc70/Hsp68含量和磷酸酶活性的影响可持续120h;PH-HS中的PH能略微降低ACP和AKP活性,减少HS诱导肝细胞合成Hsc70/Hsp68的量;PH-HS中的HS处理能抑制PH诱导的Hsc70/Hsp68表达和推迟ACP活性高峰出现的时间。 结论 ACP、AKP和Hsc70/Hsp68均在肝细胞的HS反应和肝再生中起作用,其中,ACP可能在启动肝再生中起重要作用,AKP和Hsc70/Hsp68可能在DNA合成和细胞分裂中起重要作用。
, 百拇医药
【中图分类号】 Q28 【文献标识码】 A 【文章编号】 0529-1356(2000)03-239
ANALYSIS OF THE EFFECT OF HEAT SHOCK AFTER
RAT PARTIAL EPATECTOMY ON Hsc70/Hsp68
EXPRESSION AND PHOSPHATASE ACTIVITLES
XIA Min, LU Ai-ling, LI Xiao-yang, ZHAO Xu-yong, LI Yong-hui, XU Cun-shuan
(Biology Department, Henan Normal University, Xinxiang 453002, China)
, http://www.100md.com
【Abstract】 Objective We tried to probe the biological function of ACP, AKP and Hsc70/Hsp68 in liver regeneration treated by heat shock(44℃, 30min, recover 8 hours)after 2/3 hepatectomy (PH-HS). Methods By histochemistry, immunohistochemistry, Western-blot,non-denatured electrophoresis, sterology and colorimetry, we detected the location and content of the conserved heat shock protein70/induced heat shock protein 68 and location and activity of the acid and alkaline phosphatases(ACP and AKP). Results ACP has three high activity-stages(12,36 and 96h), AKP has two high activity-stages(12 and 36h), and Hsc70/Hsp68 has two high expression-stages (12 and 48 h) during 0-144 h recovery time after PH-HS. The enhanced ACP and AKP activity comes from 140-180 kD phosphatases after PH-HS. Comparison of kinetics of Hsc70/Hsp68 content and ACP and AKP activity after PH-HS with that after heat shock(HS) treatment(44℃, 30min) and 2/3 hepatectomy(PH) respectively shows that the effect of PH-HS on Hsc70/Hsp68 content and phosphatase activity lasts 120 h; The PH in PH-HS can reduce ACP and AKP activity and Hsc70/Hsp68 expression. The HS in PH-HS can change the time of ACP and AKP enhancing activity and inhibit expression of the Hsc70/Hsp68 induced by PH. Conclusion ACP, AKP and Hsc70/Hsp68 play an important role in heat shock response of liver cells and liver regeneration, but ACP is more important in originating liver regeneration, while AKP and Hsc70/Hsp68 probably exert the effect in DNA synthesis and cell division.
, http://www.100md.com
【Key words】 Liver regeneration; Heat shock(HS); Conserved heat shock protein 70/induced heat shock protein 68(Hsc70/Hsp68); ACP; AKP; Rat
肝再生是一种受到机体和细胞本身精细调控的细胞去分化、增殖和再分化过程[1]。而且也受外界因素(包括热休克处理)的影响[2]。已有实验证明,同一种或不同种刺激按适当间隔时间连续2次或多次刺激机体和/或细胞时,前1次刺激会影响细胞对以后刺激的反应,下1次刺激也会改变细胞对以前刺激的反应,无论是热休克处理还是肝大部分切除都会引起机体和细胞发生抵抗和适应反应,这两种刺激联合使用对肝再生有何影响是值得研究的问题[3~6]。本实验研究了2/3肝切除(2/3 hepatectomy)和热休克(heat shock)联合处理(PH-HS)对肝再生过程中ACP、AKP和热休克蛋白(Hsc70/Hsp68)的影响,结果如下:
, 百拇医药
材料和方法
1.实验动物和化学药品及试剂
成年SD纯系大白鼠,由河南师范大学生物系实验动物房提供,雌雄各半,体重200~250g。
明胶(Sigma)、Hsc70/Hsp68的一级抗体(StressGen,产品编号SPA-820,为鼠源性单克隆抗体,其制备抗原是人Hsc72/Hsp70,但亦能与人、灵长目动物、兔、大鼠和牛的Hsp70/Hsc70N端1~180氨基酸区域特异结合)、二级抗体(华美生物工程公司产品,为山羊抗鼠IgG-AP)、过氧化物酶标记链霉卵白素(SP,华美生物工程公司),实验所用的化学试剂至少为分析纯。
2. 2/3肝切除-热休克处理(PH-HS)及样品制备
将大白鼠随机分组(每组至少3只),乙醚麻醉,按Higgins方法切除2/3肝(即切除第1、2、3肝叶),于室温恢复4h,接着,置于44±0.5℃的电热鼓风恒温箱内(加有湿盒)30min,然后于室温分别恢复2、4、6、8、10、12、16、20、24、36、48、72、96和144 h后,脊椎脱臼处死,摘除眼球放血,(1)用于组织化学和免疫组织化学分析时,直接切取脏脏备用;(2)用于制备匀浆液时,用肝门静脉灌注法[7]将肝叶中的血液洗净后,取下置于加有冰冷生理盐水的培养皿中剪碎,在4℃、40mmol/L NaCl、20mmol/L Tris-HCl、pH7.5的缓冲液(材料湿重∶缓冲液=1∶5)中匀浆,12 000g离心10 min,取上清液,分装,-85℃保存备用。
, http://www.100md.com
3.ACP和AKP的组织化学
将肝脏切成5×5×3mm小块,置液氮中速冻后用冰冻切片机连续切片(厚8μm),用4℃冷丙酮固定20 min,以Gomori铅法显示ACP,其中,样品在保温液中保温(37℃)40 min;以Gomori钙-钴法显示AKP,其中,样品在保湿液中保湿(37 ℃)1h;用不加β-甘油磷酸钠的作用液做阴性对照。
4.ACP和AKP活性的比色测定
取0.1ml匀浆液,加入0.4ml缓冲液(测定AKP活性时,用0.25mol/L MgCl2、0.2mol/LTris-HCl、pH7.5;测定ACP活性时,用0.35mol/L枸橼酸-NaOH-HCl,pH5)和0.4ml 10mmol/L β-甘油磷酸钠(空白对照加0.4 ml生理盐水)混匀,37℃保温30 min后,再加入0.1 ml50%三氯乙酸(空白对照在加入匀浆液的同时,加入0.1 ml50%三氯乙酸)混匀,加2 ml三蒸水和3 ml定磷试剂(3mol/L H2SO4∶H2O∶2.5%钼酸铵∶10%抗坏血酸=1∶2∶1∶1)混匀后,于45℃恒温水溶锅内保温25 min,取出冷至室温后,于660 nm处测定吸光值,从标准曲线上求出磷含量。
, 百拇医药
5. Hsc70/Hsp68的免疫组织化学
取同一肝叶的同一部位于10%福尔马林中固定24h,常规石蜡制片(厚6μm),连续切片,每隔60μm取1片,每只动物取4片做免疫组织化学染色,其中,在1∶500稀释的一抗中于4℃过夜,在1∶200稀释的二抗中于37℃保温1h;用1∶200稀释的过氧化物酶标记的链霉卵白素(SP)法染色(37 ℃保温1h,用PBS代替一抗作阴性对照,未热休克肝作正常对照),用微波炉(92~98℃)对切片进行10 min抗原修复,DAB系统显色,苏木精复染。
6. 蛋白质浓度测定、聚丙烯酰胺凝胶电泳和磷酸酶的原位复性电泳
按Neuhoff等[8]方法测定匀浆液的蛋白质浓度;按Laemmli等[9]方法进行聚丙烯酰胺凝胶电泳(SDS-PAGE)和显色,检测总蛋白种类;按夏民等[10]方法进行ACP和AKP的原位复性电泳和显色。上述电泳的上样量均为每槽75μg总蛋白。
, 百拇医药
7.Western印迹
按Towbin等[11]方法,将SDS-PAGE凝胶板上的蛋白质转移至硝酸纤维素膜上(电压500V,转移36h),将载有蛋白质的硝酸纤维素膜以PBS/0.2% Tween 20封闭30min,弃去PBS/Tween 20,加入一抗(1∶500)稀释,37℃保温1h,每10min摇动1次,然后,用PBS洗去未结合一抗,加入二抗(1∶1 000稀释),37℃保温1h,每10min摇动1次,之后,用PBS洗去未结合二抗,以DAB显色。
8.体视学方法定量分析Hsc70/Hsp68
按Weibel法[12],每只动物取5张切片在10×10(物镜)、10×40(物镜)下分别计数阳性细胞的落点数Pxi和测试视野落点数Pri,以公式Vv=∑Pxi/∑Pri,分别计算各组动物阳性细胞的体密度(其中,∑Pxi和∑Pri分别为每组动物阳性肝细胞总落点数和测试视野总落点数),以方差分析作统计学处理。
, 百拇医药
结 果
1.PH-HS后肝再生过程中ACP分布及活性变化
1.1 用酶的组织化学方法测得的ACP分布及活性变化:结果表明,ACP主要存在于溶酶体中,细胞核中难以检出ACP活性。虽然溶酶体在肝细胞质内均有分布,但以核膜周围的细胞质中分布最多,因此,这个区域的ACP活性最强;位于肝小叶中心区域细胞的ACP活性较周缘区强,而且从整体来看,它在肝小叶内略呈分带现象(图1)。
1.2 用比色法定量测得的ACP活性:PH-HS后2~12h酶活性逐渐增强,至12h达活性高峰;PH-HS后16h,酶出现低活性期;PH-HS后24~36h,酶活性逐渐增强,至36h时达最强;PH-HS后48h,酶出现第2次低活性期;PH-HS后96~120h,酶活性逐渐增强,至120h时,酶活性又一次达到高峰(图2)。
1.3 用酶的原位复性电泳技术测得的ACP种类和活性变化,PH-HS后16h,140~160kD酶活性减弱;PH-HS后24~36h,140~180kD的酶活性逐渐增强,其中PH-HS后36h,180kD的酶活性达到高峰;PH-HS后48h,140~180kD酶活性几乎消失;PH-HS后72h,140~180kD酶活性显著增强,以后,酶活性逐渐减弱至对照水平(图3)。
, http://www.100md.com
恢复时间(recovery time)(h)
图3 PH-HS后的肝再生过程中ACP种类及活性变化(用酶的原位复性电泳技术分析)
c.对照;8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.3 Category and activity of acid phosphatases(ACP) during liver regeneration after PH-HS (by non-denatured electrophoresis)
c, control; 8,12,16,24,36,48,72,96,144 show recovery times(h) after PH-HS
2.PH-HS后的肝再生过程中AKP分布及活性变化
, http://www.100md.com
2.1 用酶的组织化学方法测得的AKP分布及活性变化:AKP主要分布于细胞膜上(显色后呈黑灰色),少量分布于细胞质(显色后呈灰色)。PH-HS后48h,AKP在肝小叶中呈现明显的区域性分布,即以肝小叶为单位,外带、中带、内带的酶活性依次减弱(图4)。
2.2 用比色法定量测得的AKP活性:PH-HS后4~12h,酶活性逐渐增强,至12h时达活性高峰;PH-HS后16~24h,酶活性保持较高水平,但酶活性低于12和36h水平;PH-HS后36h,酶活性达到本组实验的最高峰;36h后,酶活性基本呈逐渐下降趋势(图10)。
2.3 用酶的原位复性电泳技术测得的AKP种类和活性变化:PH-HS后8~12h,140和160kD酶活性逐渐增强;PH-HS后16h时,酶活性下降到接近于对照;PH-HS后24~36h,140~160kD酶活性又逐渐增强,至PH-HS后36h,140~180kD的酶活性最强,至PH-HS后48h,140~180 kD的酶活性几乎完全消失;PH-HS后72h,140~180kD的酶活性急剧增加,以后(PH-HS后72~144h),酶活性逐渐下降到对照水平(图5)。
, 百拇医药
3.PH-HS后的肝再生过程中Hsc70/Hsp68的动态变化
3.1 用免疫组织化学方法测得的Hsc70/Hsp68分布及动态变化:Hsc70/Hsp68主要存在于肝细胞质,被染成黄色,而经苏木精复染的细胞核呈蓝色;阳性细胞位于肝小叶中央静脉周围,呈局灶状发布,其中,PH-HS后12和24h,Hsc70/Hsp68呈局灶状分布于肝小叶;PH-HS后16h,Hsc70/Hsp68几乎分布于整个肝小叶;36h以后(PH-HS后36~144h),含Hsc70/Hsp68的细胞逐渐减少至与对照相似(图6)。
3.2 用体视学方法测得的Hsc70/Hsp68的含量变化:PH-HS后16h,Hsc70/Hsp68的含量最高;PH-HS后48h,Hsc70/Hsp68再一次出现较高表达(图2和附表)。
3.3 用Western印迹测得的Hsc70/Hsp68含量:PH-HS后8~16、38~48h,Hsc70/Hsp68单体的量逐渐增加;PH-HS后24、72~144h,Hsc70/Hsp68单体量减少;PH-HS后8~12h和72~144h,Hsc70/Hsp68六聚体逐渐减少;PH-HS后24~48h,Hsc70/Hsp68几乎不以六聚体形式存在(图7)。
, 百拇医药
恢复时间(recovery time)(h)
图5 PH-HS后的肝再生过程中AKP种类及活性变化(用酶的原位复性电泳技术分析)
c.对照:8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.5 Category and activity of alkaline phosphatases(AKP) during liver regeneration after PH-HS
(by non-denatured electrophoresis)
c,control; 8,12,16,24,36,48,72,96,144 show recovery time(h) after PH-HS
, 百拇医药
附表 PH-HS后的肝再生过程中Hsc70/Hsp68体视学密度表
Table Steredensity table of Hsc70/Hsp68 during liver regeneration after PH-HS 组别(groups)
144
96
72
24
8
36
12
48
24
, 百拇医药
16(0.088±0.011)
0.080**
0.087**
0.076**
0.075**
0.067**
0.060**
0.059**
0.037**
0.032**
24(0.056±0.010)
0.048**
, http://www.100md.com
0.055**
0.044**
0.043**
0.035**
0.028**
0.037**
0.005
0.019
48(0.051±0.009)
0.043**
0.050**
0.039**
, http://www.100md.com
0.038**
0.023
0.027**
0.032
0.004
12(0.029±0.007)
0.021
0.028**
0.017
0.016
0.008
0.005
, http://www.100md.com
0.010
36(0.028±0.007)
0.020
0.027**
0.016
0.015
0.007
0.004
8(0.021±0.006)
0.013
0.020
0.009
, 百拇医药
0.008
0.001
4(0.013±0.003)
0.005
0.012
0.010
0.001
72(0.012±0.005)
0.004
0.011
0.001
96(0.010±0.003)
, http://www.100md.com
0.002
0.001
144(0.008±0.001)
0.001
2(0.007±0.001)
注:表中2、4、8、12、16、24、36、48、96、144指PH-HS后恢复时间(h);括号内的数字为相应时间点阳性细胞体密度(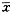 ±s);表内数字为相应两组比较的Q值。**示P<0.01 2,4,8,12,16,24,36,48,96,144 in the table show recovery time(h) after PH-HS; Numbers in the brackets are stereodensitys of relevant cells; the data in the table are value Q** shows P<0.01.
±s);表内数字为相应两组比较的Q值。**示P<0.01 2,4,8,12,16,24,36,48,96,144 in the table show recovery time(h) after PH-HS; Numbers in the brackets are stereodensitys of relevant cells; the data in the table are value Q** shows P<0.01. 
, 百拇医药
恢复时间(recovery time)(h)
图7 PH-HS后的肝再生过程中Hsc70/Hsp68的动态变化(用Westen印迹分析)
c.对照;8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.7 Change of Hsc70/Hsp68 content during liver regeneration after PH-HS(by westerm-blot analysis)
c,control;8,12,16,24,36,48,72,96,144 show recovery time(h) after PH-HS
4.HS、PH和PH-HS对ACP活性影响的比较
, http://www.100md.com
将PH-HS后的肝再生期间ACP活性变化与只切除2/3肝(PH)和只热休克(44℃,30 min)处理(HS)后恢复和/或肝再生期间ACP活性变化进行比较表明,3种处理均能提高ACP总活性,但提高的ACP总活性幅度不同,其中,PH>PH-HS>HS;在HS后的恢复期间(0~144h),ACP有1个活性高峰期(48h),在PH后的肝再生期间(0~144h),ACP有2个活性高峰(4和48h),而在PH-HS后的肝再生期间(0~144h),ACP有3个活性高峰(12、36和96h),其中,PH后的第1个活性高峰(4h)比PH-HS后的第1个活性高峰(12h)提前8h,PH后的第2个活性高峰(48h)比PH-HS后的第2个活性高峰(36h)推迟12h(图8)。
5.HS、PH和PH-HS对AKP活性影响的比较
将PH-HS后的肝再生期间AKP活性变化与只切除2/3肝(PH)和只热休克(46℃,30min)处理(HS)后恢复和/或肝再生期间AKP活性变化进行比较表明,3种处理均能提高AKP总活性,但提高的AKP总活性幅度不同,其中,PH>PH-HS>HS;在HS后的恢复期间(0~144h),AKP有1个活性高峰期(48h),在PH后的肝再生期间(0~144h),AKP有2个活性高峰(12和96h),而在PH-HS后的肝再生期间(0~144h),AKP有2个活性高峰(12和36h)和1个次活性高峰(72h)。其中,PH后的第1个活性高峰(16h)比PH-HS后的第1个活性高峰(12h)推迟4h,PH后的第2个活性高峰(96h)比PH-HS后的第2个活性高峰(36h)推迟60h(图9)。
, 百拇医药
6.HS、PH和PH-HS对Hsc70/Hsp68表达量影响的比较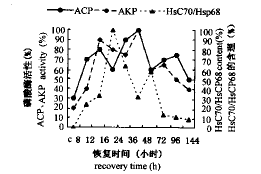
图2 HS、PH和PH-HS后的恢复和/或肝再生
期间ACP和AKP的活性、Hsc70/Hsp68的含量变化
Fig.2 Change of ACP, AKP activity and Hsc70/Hsp68
content during recovery and/or liver
regeneration after HS, PH and HS-hs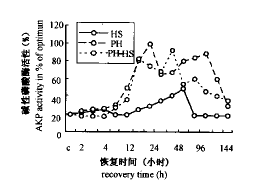
, 百拇医药
图9 HS、PH和PH-HS后的恢复和/或
肝再生期间AKP的活性变化
Fig.9 Change of AKP activity during recovery and/or
liver regeneration after HS,PH and PH-HS
图8 HS、PH和PH-HS后的恢复
和/或肝再生期间ACP的活性变化
Fig.8 Change of ACP activity during recovery
, http://www.100md.com and/or liver regeneration after HS, PH and PH-HS
图10 HS、PH和PH-HS后的恢复和/或肝
再生期间Hsc70/Hsp68的含量变化
Fig.10 Change of Hsc70/Hsp68 content during recovery
and/or liver regeneration after HS, PH and PH-HS
将PH-HS后的肝再生期间Hsc70/Hsp68含量变化与只切除2/3肝(PH)和只热休克(44℃,30min)处理(HS)后恢复和/或肝再生期间Hsc70/Hsp68含量变化进行比较表明,3种处理均能提高Hsc70/Hsp68总含量,但提高的Hsc70/Hsp68总含量幅度不同,其中,HS>PH>PH-HS;在HS后的恢复期间(0~144h),Hsc70/Hsp68有3个含量高峰期(6、8~12、48h),而在PH后的肝再生期间(0~144h),Hsc70/Hsp68有2个含量高峰(12和96h);PH-HS后的肝再生期间(0~144h),Hsc70/Hsp68有2个(16和48h)含量高峰(图10)。
, 百拇医药
7.PH-HS后的肝再生期间ACP和AKP活性及Hsc70/Hsp68含量变化的比较
在PH-HS后的肝再生期间(0~144h),ACP和AKP的活性变化趋势相同,且在12和36h各出现1个活性高峰、72~96h出现1个次活性高峰;Hsc70/Hsp68的2个含量高峰(16和48h)期基本上是ACP和AKP的最低活性时间(图2)
讨 论
热休克会导致细胞的结构和功能受损,并诱导肝细胞进行结构和功能修复及恢复的一系列热休克反应[13],2/3肝切除后的肝再生期间,涉及到肝细胞分裂启动、细胞增殖和组织、器官结构和功能恢复等一系列与细胞分裂启动、细胞脱分化、分裂和再分化有关的生理、生化过程[2]。分析PH-HS后Hsc70/Hsp68含量和ACP、AKP活性变化(图2)显示,12h时的ACP、AKP活性高峰和Hsc70/Hsp68含量高峰可能参与原有肝细胞的结构与功能清除(包括降解变性蛋白和某些非变性蛋白、受损结构和某些非受损结构)、修复、恢复和肝细胞DNA合成,36h时的ACP、AKP活性高峰可能涉及功能蛋白的合成、细胞分裂及新的细胞周期启动。ACP主要分布于细胞核周围的细胞质里,可能通过某种机制参与细胞内信息传导、DNA复制和核膜解体;AKP主要分布于细胞膜下,可能通过某种机制参与细胞的信息传导和胞质分裂[10]。图3和图5中不同分子量磷酸酶的具体作用,有待进一步研究。
, http://www.100md.com
比较HS、PH和PH-HS后0~144h期间Hsc70/Hsp68含量和ACP、AKP活性变化表明,3种处理均可提高ACP、AKP活性和Hsc70/Hsp68含量,其中,经PH和HS连续处理后,ACP、AKP总活性和Hsc70/Hsp68总含量低于PH单独处理,Hsc70/Hsp68总含量低于PH和HS单独处理。其原因可能是PH的预处理增加了细胞的抗逆性和修复能力;另一方面,HS处理又影响了肝再生中的细胞生理、代谢过程,导致ACP和AKP总活性较PH低和Hsc70/Hsp68总含量较HS低;PH-HS连续处理后,ACP和AKP活性及Hsc70/Hsp68含量变化的另一个特点是,Hsc70/Hsp68含量高峰期(16和48h)基本是ACP和AKP的低活性期,而这个时间(16和48h)正好是PH后DNA开始合成时间和细胞分裂结束时间[12],与Hsc70/Hsp68在细胞结构建立方面的作用一致[13]。HS后的恢复和PH后的肝再生均涉及到ACP、AKP和Hsc70/Hsp68的作用,但在两组处理中,它们的作用途径显示部分不重叠性。本研究测得的PH-HS后磷酸酶活性低于PH、PH-HS后Hsc70/Hsp68总表达量低于HS,结果与已知的PH后肝再生期间涉及到的细胞生理、生化活动较多,需要较多的磷酸酶参与[2],而HS后主要是细胞结构和功能的修复和恢复,需要较少的磷酸酶参与[14],以及两种处理共同作用会产生协同和干扰双重效应相一致。
, http://www.100md.com
在PH-HS后的肝再生过程中,ACP活性变化主要与140~160kD的酶活性变化有关;而AKP的活性变化主要与140~180kD的酶活性变化有关,每种磷酸酶的性质和作用有待进一步研究。


图版说明
图1 PH-HS后的肝再生过程中ACP分布及活性变化(用酶组织化学方法分析)
C.对照;L4.切除2/3肝后恢复4h;Hn(n+4)切除2/3肝后恢复4h后,进行热休克,n指热休克后恢复时间4、8、12、20、32、44、92、140(h),n+4代表切除2/3肝恢复总时间8、16、24、36、48、96、144(h)(图4,6同此)
, http://www.100md.com
图4 PH-HS后的肝再生过程中AKP分布及活性变化
图6 PH-HS后的肝再生过程中Hsc70/Hsp68分布及含量变化(用免疫组织学方法分析)箭头所指为阳性细胞
Explanation of figures
Fig.1 Location and activity of acid phosphatases(ACP)during liver regeneration after PH-HS(by enzymal histochemical method)
C. control; L4. recovery 4 hours after 2/3 hepatectomy; Hn(n+4). Heat shock treatment after L4,n.Recovery time(4,8,12,20,32,44,92,140h) after heat shock treatment; n+4. Total time(8,12,16,24,36,48,96,144h) after 2/3 hepatectomy(Fig.4、6 is the same)
, 百拇医药
Fig.4 Category and activity of acid phosphatases (ACP) during liver regeneration after PH-HS(by non-denatured electrophoresis)
Fig.6 Location and content of Hsc70/Hsp68 during liver regeneration after PH-Hs( by immunohistochemistry) Arrow represents positive cell
【基金项目】中法先进技术项目[国科生字(1996)134号]
【作者简介】 夏民(1965—),男(汉族),山东省人,硕士,讲师
通讯作者(To whom correspondence should be addressed)
, 百拇医药
参考文献
[1]朱继红,成令忠,钟翠平,等.应用流式细胞分光光度法对大鼠肝大部切除后肝细胞增殖周期动态的研究[J].解剖学报,1988,19(4):433~437.
[2]Michalopoulos GK, DeFrances MC.Liver regeneration. Science[J],1997,275(2):60-65.
[3]Pelham HRB. Speculations on the functions of the major heat shock and glucose regulated proteins[J]. Cell, 1986,46(3):959-962.
[4]Xu CS, Fracella F, Rensing L, et al. Stress response of lysosmal cysteine proteinases in rat C6 glioma cells[J]. Comp Biochem Physiol,1997,117B(2):169-174.
, http://www.100md.com
[5]Pechan PM. Heat shock proteins and cell proliferation[J]. FEBS,1991,280(1):1-4.
[6]Rutherford SL, Zuker CS. Protein folding and the regulation of signaling pathways[J]. Cell,1994,79(7):1129-1134.
[7]周家兴,夏民.胶原酶灌注法分离哺乳动物肝主质细胞研究[J].河南师范大学学报(自然科学版),1990,27(1):96~99.
[8]Neuhoff V, Philip P, Zimmer K, et al. A simple, versatile, sensitive and volume-independent method for quantitative protein determination which is independent of other external influences[J]. Physiol Chem,1979,360(1):1657-1660.
, 百拇医药
[9]Laemmli UK. (J) Cleavage of structural proteins in the assembly of the head of bacteriophase T4[J]. Nature,1970,227(1):680-683.
[10]夏民,常蕴华,李永辉,等.大鼠再生肝酪氨酸碱性磷酸酶活性变化及功能研究[J].动物学报,1997,43(增刊):113~117.
[11]Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from phlyacrylamide gels to nitrocellulose sheets:procedure and some applications[J]. Proc Natl Acad Sci,1979,76(1):4350-4353
, 百拇医药
[12]Weibel ER, Kistler GS, Scherle W. Practical stereologic methods for morphometric cytology. Cell Biol[J], 1966,30(1):23-26
[13]李效阳,张顺利,卢爱灵,等.大鼠肝脏热休克反应中Hsp70表达的免疫组织化学研究[J].河南科学,1998,25(4):59~63.
[14]Ang D, Liberek K, Showyra D, et al.[J] Biological role and regulation of the universally conserved heat shock proteins. Biol Chem,1991,266(36):24233-24235.
【收稿日期】1999-02-09 【修稿日期】1999-07-01, 百拇医药
单位:夏民(河南师范大学生物系,新乡 453002);卢爱灵(河南师范大学生物系,新乡 453002);李效阳(河南师范大学生物系,新乡 453002);赵绪永(河南师范大学生物系,新乡 453002);李永辉(河南师范大学生物系,新乡 453002);徐存拴(河南师范大学生物系,新乡 453002)
关键词:肝再生;热休克;保持性热休克蛋白70;诱导性热休克蛋白68;碱性磷酸酶;酸性磷酸酶;大鼠
解剖学报000312 【摘要】 目的 研究热休克蛋白(Hsc70/Hsp68)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)在肝再生过程中的生物学作用,检测这些大分子在大鼠肝大部切除后热休克处理下的动态变化。 方法 用组织化学、免疫组织化学、Western印迹、酶的原位复性电泳、体视学分析、比色分析等方法。 结果 肝切除和热休克联合处理(PH-HS)后的0~144h恢复期间,ACP有3个高活性期(12、36和96h),AKP有2个高活性期(12和36h),Hsc70/Hsp68有2个高表达期(16和48h);PH-HS后ACP和AKP活性增强与140~180kD的酶活性增加有关。与只进行热休克(HS)(44℃,30min)处理或与只进行2/3肝切除(PH)后恢复期间Hsc70/Hsp68含量和磷酸酶活性动态变化的比较表明,PH-HS对Hsc70/Hsp68含量和磷酸酶活性的影响可持续120h;PH-HS中的PH能略微降低ACP和AKP活性,减少HS诱导肝细胞合成Hsc70/Hsp68的量;PH-HS中的HS处理能抑制PH诱导的Hsc70/Hsp68表达和推迟ACP活性高峰出现的时间。 结论 ACP、AKP和Hsc70/Hsp68均在肝细胞的HS反应和肝再生中起作用,其中,ACP可能在启动肝再生中起重要作用,AKP和Hsc70/Hsp68可能在DNA合成和细胞分裂中起重要作用。
, 百拇医药
【中图分类号】 Q28 【文献标识码】 A 【文章编号】 0529-1356(2000)03-239
ANALYSIS OF THE EFFECT OF HEAT SHOCK AFTER
RAT PARTIAL EPATECTOMY ON Hsc70/Hsp68
EXPRESSION AND PHOSPHATASE ACTIVITLES
XIA Min, LU Ai-ling, LI Xiao-yang, ZHAO Xu-yong, LI Yong-hui, XU Cun-shuan
(Biology Department, Henan Normal University, Xinxiang 453002, China)
, http://www.100md.com
【Abstract】 Objective We tried to probe the biological function of ACP, AKP and Hsc70/Hsp68 in liver regeneration treated by heat shock(44℃, 30min, recover 8 hours)after 2/3 hepatectomy (PH-HS). Methods By histochemistry, immunohistochemistry, Western-blot,non-denatured electrophoresis, sterology and colorimetry, we detected the location and content of the conserved heat shock protein70/induced heat shock protein 68 and location and activity of the acid and alkaline phosphatases(ACP and AKP). Results ACP has three high activity-stages(12,36 and 96h), AKP has two high activity-stages(12 and 36h), and Hsc70/Hsp68 has two high expression-stages (12 and 48 h) during 0-144 h recovery time after PH-HS. The enhanced ACP and AKP activity comes from 140-180 kD phosphatases after PH-HS. Comparison of kinetics of Hsc70/Hsp68 content and ACP and AKP activity after PH-HS with that after heat shock(HS) treatment(44℃, 30min) and 2/3 hepatectomy(PH) respectively shows that the effect of PH-HS on Hsc70/Hsp68 content and phosphatase activity lasts 120 h; The PH in PH-HS can reduce ACP and AKP activity and Hsc70/Hsp68 expression. The HS in PH-HS can change the time of ACP and AKP enhancing activity and inhibit expression of the Hsc70/Hsp68 induced by PH. Conclusion ACP, AKP and Hsc70/Hsp68 play an important role in heat shock response of liver cells and liver regeneration, but ACP is more important in originating liver regeneration, while AKP and Hsc70/Hsp68 probably exert the effect in DNA synthesis and cell division.
, http://www.100md.com
【Key words】 Liver regeneration; Heat shock(HS); Conserved heat shock protein 70/induced heat shock protein 68(Hsc70/Hsp68); ACP; AKP; Rat
肝再生是一种受到机体和细胞本身精细调控的细胞去分化、增殖和再分化过程[1]。而且也受外界因素(包括热休克处理)的影响[2]。已有实验证明,同一种或不同种刺激按适当间隔时间连续2次或多次刺激机体和/或细胞时,前1次刺激会影响细胞对以后刺激的反应,下1次刺激也会改变细胞对以前刺激的反应,无论是热休克处理还是肝大部分切除都会引起机体和细胞发生抵抗和适应反应,这两种刺激联合使用对肝再生有何影响是值得研究的问题[3~6]。本实验研究了2/3肝切除(2/3 hepatectomy)和热休克(heat shock)联合处理(PH-HS)对肝再生过程中ACP、AKP和热休克蛋白(Hsc70/Hsp68)的影响,结果如下:
, 百拇医药
材料和方法
1.实验动物和化学药品及试剂
成年SD纯系大白鼠,由河南师范大学生物系实验动物房提供,雌雄各半,体重200~250g。
明胶(Sigma)、Hsc70/Hsp68的一级抗体(StressGen,产品编号SPA-820,为鼠源性单克隆抗体,其制备抗原是人Hsc72/Hsp70,但亦能与人、灵长目动物、兔、大鼠和牛的Hsp70/Hsc70N端1~180氨基酸区域特异结合)、二级抗体(华美生物工程公司产品,为山羊抗鼠IgG-AP)、过氧化物酶标记链霉卵白素(SP,华美生物工程公司),实验所用的化学试剂至少为分析纯。
2. 2/3肝切除-热休克处理(PH-HS)及样品制备
将大白鼠随机分组(每组至少3只),乙醚麻醉,按Higgins方法切除2/3肝(即切除第1、2、3肝叶),于室温恢复4h,接着,置于44±0.5℃的电热鼓风恒温箱内(加有湿盒)30min,然后于室温分别恢复2、4、6、8、10、12、16、20、24、36、48、72、96和144 h后,脊椎脱臼处死,摘除眼球放血,(1)用于组织化学和免疫组织化学分析时,直接切取脏脏备用;(2)用于制备匀浆液时,用肝门静脉灌注法[7]将肝叶中的血液洗净后,取下置于加有冰冷生理盐水的培养皿中剪碎,在4℃、40mmol/L NaCl、20mmol/L Tris-HCl、pH7.5的缓冲液(材料湿重∶缓冲液=1∶5)中匀浆,12 000g离心10 min,取上清液,分装,-85℃保存备用。
, http://www.100md.com
3.ACP和AKP的组织化学
将肝脏切成5×5×3mm小块,置液氮中速冻后用冰冻切片机连续切片(厚8μm),用4℃冷丙酮固定20 min,以Gomori铅法显示ACP,其中,样品在保温液中保温(37℃)40 min;以Gomori钙-钴法显示AKP,其中,样品在保湿液中保湿(37 ℃)1h;用不加β-甘油磷酸钠的作用液做阴性对照。
4.ACP和AKP活性的比色测定
取0.1ml匀浆液,加入0.4ml缓冲液(测定AKP活性时,用0.25mol/L MgCl2、0.2mol/LTris-HCl、pH7.5;测定ACP活性时,用0.35mol/L枸橼酸-NaOH-HCl,pH5)和0.4ml 10mmol/L β-甘油磷酸钠(空白对照加0.4 ml生理盐水)混匀,37℃保温30 min后,再加入0.1 ml50%三氯乙酸(空白对照在加入匀浆液的同时,加入0.1 ml50%三氯乙酸)混匀,加2 ml三蒸水和3 ml定磷试剂(3mol/L H2SO4∶H2O∶2.5%钼酸铵∶10%抗坏血酸=1∶2∶1∶1)混匀后,于45℃恒温水溶锅内保温25 min,取出冷至室温后,于660 nm处测定吸光值,从标准曲线上求出磷含量。
, 百拇医药
5. Hsc70/Hsp68的免疫组织化学
取同一肝叶的同一部位于10%福尔马林中固定24h,常规石蜡制片(厚6μm),连续切片,每隔60μm取1片,每只动物取4片做免疫组织化学染色,其中,在1∶500稀释的一抗中于4℃过夜,在1∶200稀释的二抗中于37℃保温1h;用1∶200稀释的过氧化物酶标记的链霉卵白素(SP)法染色(37 ℃保温1h,用PBS代替一抗作阴性对照,未热休克肝作正常对照),用微波炉(92~98℃)对切片进行10 min抗原修复,DAB系统显色,苏木精复染。
6. 蛋白质浓度测定、聚丙烯酰胺凝胶电泳和磷酸酶的原位复性电泳
按Neuhoff等[8]方法测定匀浆液的蛋白质浓度;按Laemmli等[9]方法进行聚丙烯酰胺凝胶电泳(SDS-PAGE)和显色,检测总蛋白种类;按夏民等[10]方法进行ACP和AKP的原位复性电泳和显色。上述电泳的上样量均为每槽75μg总蛋白。
, 百拇医药
7.Western印迹
按Towbin等[11]方法,将SDS-PAGE凝胶板上的蛋白质转移至硝酸纤维素膜上(电压500V,转移36h),将载有蛋白质的硝酸纤维素膜以PBS/0.2% Tween 20封闭30min,弃去PBS/Tween 20,加入一抗(1∶500)稀释,37℃保温1h,每10min摇动1次,然后,用PBS洗去未结合一抗,加入二抗(1∶1 000稀释),37℃保温1h,每10min摇动1次,之后,用PBS洗去未结合二抗,以DAB显色。
8.体视学方法定量分析Hsc70/Hsp68
按Weibel法[12],每只动物取5张切片在10×10(物镜)、10×40(物镜)下分别计数阳性细胞的落点数Pxi和测试视野落点数Pri,以公式Vv=∑Pxi/∑Pri,分别计算各组动物阳性细胞的体密度(其中,∑Pxi和∑Pri分别为每组动物阳性肝细胞总落点数和测试视野总落点数),以方差分析作统计学处理。
, 百拇医药
结 果
1.PH-HS后肝再生过程中ACP分布及活性变化
1.1 用酶的组织化学方法测得的ACP分布及活性变化:结果表明,ACP主要存在于溶酶体中,细胞核中难以检出ACP活性。虽然溶酶体在肝细胞质内均有分布,但以核膜周围的细胞质中分布最多,因此,这个区域的ACP活性最强;位于肝小叶中心区域细胞的ACP活性较周缘区强,而且从整体来看,它在肝小叶内略呈分带现象(图1)。
1.2 用比色法定量测得的ACP活性:PH-HS后2~12h酶活性逐渐增强,至12h达活性高峰;PH-HS后16h,酶出现低活性期;PH-HS后24~36h,酶活性逐渐增强,至36h时达最强;PH-HS后48h,酶出现第2次低活性期;PH-HS后96~120h,酶活性逐渐增强,至120h时,酶活性又一次达到高峰(图2)。
1.3 用酶的原位复性电泳技术测得的ACP种类和活性变化,PH-HS后16h,140~160kD酶活性减弱;PH-HS后24~36h,140~180kD的酶活性逐渐增强,其中PH-HS后36h,180kD的酶活性达到高峰;PH-HS后48h,140~180kD酶活性几乎消失;PH-HS后72h,140~180kD酶活性显著增强,以后,酶活性逐渐减弱至对照水平(图3)。

, http://www.100md.com
恢复时间(recovery time)(h)
图3 PH-HS后的肝再生过程中ACP种类及活性变化(用酶的原位复性电泳技术分析)
c.对照;8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.3 Category and activity of acid phosphatases(ACP) during liver regeneration after PH-HS (by non-denatured electrophoresis)
c, control; 8,12,16,24,36,48,72,96,144 show recovery times(h) after PH-HS
2.PH-HS后的肝再生过程中AKP分布及活性变化
, http://www.100md.com
2.1 用酶的组织化学方法测得的AKP分布及活性变化:AKP主要分布于细胞膜上(显色后呈黑灰色),少量分布于细胞质(显色后呈灰色)。PH-HS后48h,AKP在肝小叶中呈现明显的区域性分布,即以肝小叶为单位,外带、中带、内带的酶活性依次减弱(图4)。
2.2 用比色法定量测得的AKP活性:PH-HS后4~12h,酶活性逐渐增强,至12h时达活性高峰;PH-HS后16~24h,酶活性保持较高水平,但酶活性低于12和36h水平;PH-HS后36h,酶活性达到本组实验的最高峰;36h后,酶活性基本呈逐渐下降趋势(图10)。
2.3 用酶的原位复性电泳技术测得的AKP种类和活性变化:PH-HS后8~12h,140和160kD酶活性逐渐增强;PH-HS后16h时,酶活性下降到接近于对照;PH-HS后24~36h,140~160kD酶活性又逐渐增强,至PH-HS后36h,140~180kD的酶活性最强,至PH-HS后48h,140~180 kD的酶活性几乎完全消失;PH-HS后72h,140~180kD的酶活性急剧增加,以后(PH-HS后72~144h),酶活性逐渐下降到对照水平(图5)。
, 百拇医药
3.PH-HS后的肝再生过程中Hsc70/Hsp68的动态变化
3.1 用免疫组织化学方法测得的Hsc70/Hsp68分布及动态变化:Hsc70/Hsp68主要存在于肝细胞质,被染成黄色,而经苏木精复染的细胞核呈蓝色;阳性细胞位于肝小叶中央静脉周围,呈局灶状发布,其中,PH-HS后12和24h,Hsc70/Hsp68呈局灶状分布于肝小叶;PH-HS后16h,Hsc70/Hsp68几乎分布于整个肝小叶;36h以后(PH-HS后36~144h),含Hsc70/Hsp68的细胞逐渐减少至与对照相似(图6)。
3.2 用体视学方法测得的Hsc70/Hsp68的含量变化:PH-HS后16h,Hsc70/Hsp68的含量最高;PH-HS后48h,Hsc70/Hsp68再一次出现较高表达(图2和附表)。
3.3 用Western印迹测得的Hsc70/Hsp68含量:PH-HS后8~16、38~48h,Hsc70/Hsp68单体的量逐渐增加;PH-HS后24、72~144h,Hsc70/Hsp68单体量减少;PH-HS后8~12h和72~144h,Hsc70/Hsp68六聚体逐渐减少;PH-HS后24~48h,Hsc70/Hsp68几乎不以六聚体形式存在(图7)。

, 百拇医药
恢复时间(recovery time)(h)
图5 PH-HS后的肝再生过程中AKP种类及活性变化(用酶的原位复性电泳技术分析)
c.对照:8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.5 Category and activity of alkaline phosphatases(AKP) during liver regeneration after PH-HS
(by non-denatured electrophoresis)
c,control; 8,12,16,24,36,48,72,96,144 show recovery time(h) after PH-HS
, 百拇医药
附表 PH-HS后的肝再生过程中Hsc70/Hsp68体视学密度表
Table Steredensity table of Hsc70/Hsp68 during liver regeneration after PH-HS 组别(groups)
144
96
72
24
8
36
12
48
24
, 百拇医药
16(0.088±0.011)
0.080**
0.087**
0.076**
0.075**
0.067**
0.060**
0.059**
0.037**
0.032**
24(0.056±0.010)
0.048**
, http://www.100md.com
0.055**
0.044**
0.043**
0.035**
0.028**
0.037**
0.005
0.019
48(0.051±0.009)
0.043**
0.050**
0.039**
, http://www.100md.com
0.038**
0.023
0.027**
0.032
0.004
12(0.029±0.007)
0.021
0.028**
0.017
0.016
0.008
0.005
, http://www.100md.com
0.010
36(0.028±0.007)
0.020
0.027**
0.016
0.015
0.007
0.004
8(0.021±0.006)
0.013
0.020
0.009
, 百拇医药
0.008
0.001
4(0.013±0.003)
0.005
0.012
0.010
0.001
72(0.012±0.005)
0.004
0.011
0.001
96(0.010±0.003)
, http://www.100md.com
0.002
0.001
144(0.008±0.001)
0.001
2(0.007±0.001)
注:表中2、4、8、12、16、24、36、48、96、144指PH-HS后恢复时间(h);括号内的数字为相应时间点阳性细胞体密度(
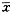 ±s);表内数字为相应两组比较的Q值。**示P<0.01 2,4,8,12,16,24,36,48,96,144 in the table show recovery time(h) after PH-HS; Numbers in the brackets are stereodensitys of relevant cells; the data in the table are value Q** shows P<0.01.
±s);表内数字为相应两组比较的Q值。**示P<0.01 2,4,8,12,16,24,36,48,96,144 in the table show recovery time(h) after PH-HS; Numbers in the brackets are stereodensitys of relevant cells; the data in the table are value Q** shows P<0.01. 
, 百拇医药
恢复时间(recovery time)(h)
图7 PH-HS后的肝再生过程中Hsc70/Hsp68的动态变化(用Westen印迹分析)
c.对照;8、12、16、24、36、48、72、96、144为PH-HS后恢复时间(h)。
Fig.7 Change of Hsc70/Hsp68 content during liver regeneration after PH-HS(by westerm-blot analysis)
c,control;8,12,16,24,36,48,72,96,144 show recovery time(h) after PH-HS
4.HS、PH和PH-HS对ACP活性影响的比较
, http://www.100md.com
将PH-HS后的肝再生期间ACP活性变化与只切除2/3肝(PH)和只热休克(44℃,30 min)处理(HS)后恢复和/或肝再生期间ACP活性变化进行比较表明,3种处理均能提高ACP总活性,但提高的ACP总活性幅度不同,其中,PH>PH-HS>HS;在HS后的恢复期间(0~144h),ACP有1个活性高峰期(48h),在PH后的肝再生期间(0~144h),ACP有2个活性高峰(4和48h),而在PH-HS后的肝再生期间(0~144h),ACP有3个活性高峰(12、36和96h),其中,PH后的第1个活性高峰(4h)比PH-HS后的第1个活性高峰(12h)提前8h,PH后的第2个活性高峰(48h)比PH-HS后的第2个活性高峰(36h)推迟12h(图8)。
5.HS、PH和PH-HS对AKP活性影响的比较
将PH-HS后的肝再生期间AKP活性变化与只切除2/3肝(PH)和只热休克(46℃,30min)处理(HS)后恢复和/或肝再生期间AKP活性变化进行比较表明,3种处理均能提高AKP总活性,但提高的AKP总活性幅度不同,其中,PH>PH-HS>HS;在HS后的恢复期间(0~144h),AKP有1个活性高峰期(48h),在PH后的肝再生期间(0~144h),AKP有2个活性高峰(12和96h),而在PH-HS后的肝再生期间(0~144h),AKP有2个活性高峰(12和36h)和1个次活性高峰(72h)。其中,PH后的第1个活性高峰(16h)比PH-HS后的第1个活性高峰(12h)推迟4h,PH后的第2个活性高峰(96h)比PH-HS后的第2个活性高峰(36h)推迟60h(图9)。
, 百拇医药
6.HS、PH和PH-HS对Hsc70/Hsp68表达量影响的比较

图2 HS、PH和PH-HS后的恢复和/或肝再生
期间ACP和AKP的活性、Hsc70/Hsp68的含量变化
Fig.2 Change of ACP, AKP activity and Hsc70/Hsp68
content during recovery and/or liver
regeneration after HS, PH and HS-hs

, 百拇医药
图9 HS、PH和PH-HS后的恢复和/或
肝再生期间AKP的活性变化
Fig.9 Change of AKP activity during recovery and/or
liver regeneration after HS,PH and PH-HS

图8 HS、PH和PH-HS后的恢复
和/或肝再生期间ACP的活性变化
Fig.8 Change of ACP activity during recovery
, http://www.100md.com and/or liver regeneration after HS, PH and PH-HS

图10 HS、PH和PH-HS后的恢复和/或肝
再生期间Hsc70/Hsp68的含量变化
Fig.10 Change of Hsc70/Hsp68 content during recovery
and/or liver regeneration after HS, PH and PH-HS
将PH-HS后的肝再生期间Hsc70/Hsp68含量变化与只切除2/3肝(PH)和只热休克(44℃,30min)处理(HS)后恢复和/或肝再生期间Hsc70/Hsp68含量变化进行比较表明,3种处理均能提高Hsc70/Hsp68总含量,但提高的Hsc70/Hsp68总含量幅度不同,其中,HS>PH>PH-HS;在HS后的恢复期间(0~144h),Hsc70/Hsp68有3个含量高峰期(6、8~12、48h),而在PH后的肝再生期间(0~144h),Hsc70/Hsp68有2个含量高峰(12和96h);PH-HS后的肝再生期间(0~144h),Hsc70/Hsp68有2个(16和48h)含量高峰(图10)。
, 百拇医药
7.PH-HS后的肝再生期间ACP和AKP活性及Hsc70/Hsp68含量变化的比较
在PH-HS后的肝再生期间(0~144h),ACP和AKP的活性变化趋势相同,且在12和36h各出现1个活性高峰、72~96h出现1个次活性高峰;Hsc70/Hsp68的2个含量高峰(16和48h)期基本上是ACP和AKP的最低活性时间(图2)
讨 论
热休克会导致细胞的结构和功能受损,并诱导肝细胞进行结构和功能修复及恢复的一系列热休克反应[13],2/3肝切除后的肝再生期间,涉及到肝细胞分裂启动、细胞增殖和组织、器官结构和功能恢复等一系列与细胞分裂启动、细胞脱分化、分裂和再分化有关的生理、生化过程[2]。分析PH-HS后Hsc70/Hsp68含量和ACP、AKP活性变化(图2)显示,12h时的ACP、AKP活性高峰和Hsc70/Hsp68含量高峰可能参与原有肝细胞的结构与功能清除(包括降解变性蛋白和某些非变性蛋白、受损结构和某些非受损结构)、修复、恢复和肝细胞DNA合成,36h时的ACP、AKP活性高峰可能涉及功能蛋白的合成、细胞分裂及新的细胞周期启动。ACP主要分布于细胞核周围的细胞质里,可能通过某种机制参与细胞内信息传导、DNA复制和核膜解体;AKP主要分布于细胞膜下,可能通过某种机制参与细胞的信息传导和胞质分裂[10]。图3和图5中不同分子量磷酸酶的具体作用,有待进一步研究。
, http://www.100md.com
比较HS、PH和PH-HS后0~144h期间Hsc70/Hsp68含量和ACP、AKP活性变化表明,3种处理均可提高ACP、AKP活性和Hsc70/Hsp68含量,其中,经PH和HS连续处理后,ACP、AKP总活性和Hsc70/Hsp68总含量低于PH单独处理,Hsc70/Hsp68总含量低于PH和HS单独处理。其原因可能是PH的预处理增加了细胞的抗逆性和修复能力;另一方面,HS处理又影响了肝再生中的细胞生理、代谢过程,导致ACP和AKP总活性较PH低和Hsc70/Hsp68总含量较HS低;PH-HS连续处理后,ACP和AKP活性及Hsc70/Hsp68含量变化的另一个特点是,Hsc70/Hsp68含量高峰期(16和48h)基本是ACP和AKP的低活性期,而这个时间(16和48h)正好是PH后DNA开始合成时间和细胞分裂结束时间[12],与Hsc70/Hsp68在细胞结构建立方面的作用一致[13]。HS后的恢复和PH后的肝再生均涉及到ACP、AKP和Hsc70/Hsp68的作用,但在两组处理中,它们的作用途径显示部分不重叠性。本研究测得的PH-HS后磷酸酶活性低于PH、PH-HS后Hsc70/Hsp68总表达量低于HS,结果与已知的PH后肝再生期间涉及到的细胞生理、生化活动较多,需要较多的磷酸酶参与[2],而HS后主要是细胞结构和功能的修复和恢复,需要较少的磷酸酶参与[14],以及两种处理共同作用会产生协同和干扰双重效应相一致。
, http://www.100md.com
在PH-HS后的肝再生过程中,ACP活性变化主要与140~160kD的酶活性变化有关;而AKP的活性变化主要与140~180kD的酶活性变化有关,每种磷酸酶的性质和作用有待进一步研究。



图版说明
图1 PH-HS后的肝再生过程中ACP分布及活性变化(用酶组织化学方法分析)
C.对照;L4.切除2/3肝后恢复4h;Hn(n+4)切除2/3肝后恢复4h后,进行热休克,n指热休克后恢复时间4、8、12、20、32、44、92、140(h),n+4代表切除2/3肝恢复总时间8、16、24、36、48、96、144(h)(图4,6同此)
, http://www.100md.com
图4 PH-HS后的肝再生过程中AKP分布及活性变化
图6 PH-HS后的肝再生过程中Hsc70/Hsp68分布及含量变化(用免疫组织学方法分析)箭头所指为阳性细胞
Explanation of figures
Fig.1 Location and activity of acid phosphatases(ACP)during liver regeneration after PH-HS(by enzymal histochemical method)
C. control; L4. recovery 4 hours after 2/3 hepatectomy; Hn(n+4). Heat shock treatment after L4,n.Recovery time(4,8,12,20,32,44,92,140h) after heat shock treatment; n+4. Total time(8,12,16,24,36,48,96,144h) after 2/3 hepatectomy(Fig.4、6 is the same)
, 百拇医药
Fig.4 Category and activity of acid phosphatases (ACP) during liver regeneration after PH-HS(by non-denatured electrophoresis)
Fig.6 Location and content of Hsc70/Hsp68 during liver regeneration after PH-Hs( by immunohistochemistry) Arrow represents positive cell
【基金项目】中法先进技术项目[国科生字(1996)134号]
【作者简介】 夏民(1965—),男(汉族),山东省人,硕士,讲师
通讯作者(To whom correspondence should be addressed)
, 百拇医药
参考文献
[1]朱继红,成令忠,钟翠平,等.应用流式细胞分光光度法对大鼠肝大部切除后肝细胞增殖周期动态的研究[J].解剖学报,1988,19(4):433~437.
[2]Michalopoulos GK, DeFrances MC.Liver regeneration. Science[J],1997,275(2):60-65.
[3]Pelham HRB. Speculations on the functions of the major heat shock and glucose regulated proteins[J]. Cell, 1986,46(3):959-962.
[4]Xu CS, Fracella F, Rensing L, et al. Stress response of lysosmal cysteine proteinases in rat C6 glioma cells[J]. Comp Biochem Physiol,1997,117B(2):169-174.
, http://www.100md.com
[5]Pechan PM. Heat shock proteins and cell proliferation[J]. FEBS,1991,280(1):1-4.
[6]Rutherford SL, Zuker CS. Protein folding and the regulation of signaling pathways[J]. Cell,1994,79(7):1129-1134.
[7]周家兴,夏民.胶原酶灌注法分离哺乳动物肝主质细胞研究[J].河南师范大学学报(自然科学版),1990,27(1):96~99.
[8]Neuhoff V, Philip P, Zimmer K, et al. A simple, versatile, sensitive and volume-independent method for quantitative protein determination which is independent of other external influences[J]. Physiol Chem,1979,360(1):1657-1660.
, 百拇医药
[9]Laemmli UK. (J) Cleavage of structural proteins in the assembly of the head of bacteriophase T4[J]. Nature,1970,227(1):680-683.
[10]夏民,常蕴华,李永辉,等.大鼠再生肝酪氨酸碱性磷酸酶活性变化及功能研究[J].动物学报,1997,43(增刊):113~117.
[11]Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from phlyacrylamide gels to nitrocellulose sheets:procedure and some applications[J]. Proc Natl Acad Sci,1979,76(1):4350-4353
, 百拇医药
[12]Weibel ER, Kistler GS, Scherle W. Practical stereologic methods for morphometric cytology. Cell Biol[J], 1966,30(1):23-26
[13]李效阳,张顺利,卢爱灵,等.大鼠肝脏热休克反应中Hsp70表达的免疫组织化学研究[J].河南科学,1998,25(4):59~63.
[14]Ang D, Liberek K, Showyra D, et al.[J] Biological role and regulation of the universally conserved heat shock proteins. Biol Chem,1991,266(36):24233-24235.
【收稿日期】1999-02-09 【修稿日期】1999-07-01, 百拇医药