影响大鼠胚胎多巴胺能神经元原代培养因素的研究
作者:陈立南 徐群渊 吕捷 张进禄
单位:陈立南(北京医科大学解剖学系,北京 100083);徐群渊(首都医科大学北京神经科学研究所,北京 100054);吕捷(首都医科大学北京神经科学研究所,北京 100054);张进禄(首都医科大学北京神经科学研究所,北京 100054)
关键词:原代神经细胞培养;多巴胺能神经元;多聚左旋赖氨酸;免疫组织化学;Matrigel
解剖学报000405 【摘要】 目的 试图通过方法改进获得高纯度原代多巴胺能神经元,并研究Matrigel及多聚左旋赖氨酸(poly-l-lysine,PLL)等不同基质对于大鼠胚胎13d中脑黑质神经元突起生长的不同作用。 方法 无菌技术取得孕13d SD大鼠胚胎,采用改进的取材方法,得到胎鼠腹侧中脑细胞,以较高密度(1×105/cm2)分别种入由Matrigel及PLL作为基质的塑料培养皿中。体外培养5d后,对培养物进行TH免疫细胞化学染色,测量TH免疫反应突起的长度并计算TH免疫反应神经元占细胞总数的比例。 结果和结论 1.采用改进的方法,能够得到高纯度的多巴胺能神经元(多巴胺神经元占培养细胞总数的比例为15%);2.与PLL相比,Matrigel能有效地促进多巴胺能神经元突起的生长,但不能特异地促进中脑培养细胞的存活。
, 百拇医药
【中图分类号】 Q421;Q8134.1+1 【文献标识码】 A 【文章编号】 0529-1356(2000)04-307
STUDY OF FACTORS AFFECTING PRIMARY CULTURE
OF DOPAMINERGIC NEURONS IN RAT FETUS
CHEN Li-nan
(Department of Anatomy,Beijing Medical University,Beijing 100083,China)
XU Qun-yuan Lü Jie ZHANG Jin-lu
(Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing 100054,China)
, 百拇医药
【Abstract】 Objective
In order to obtain high purity of primary culture of dopaminergic neurons in rat fetus,we tried to modify the culture procedure.Using improved techniques,we compared the growth status of dopaminergic neurons cultured on Matrigel and PLL(Poly-L-Lysine)substrates. Methods The DA neurons were obtained from the ventral mesencephalon of SD rat embryos(E13) by using a different dissecting method and then plated in plastic dishes coated with Matrigel and PLL substrates in high density (1×105/cm2).After cultured for 5 days in vitro,TH immunocytochemical staining was performed and length of TH immunoreactive neurites was measured. Results and Conclusions 1.Cultured dopaminergic neurons in high-purity(dopaminergic neuron/all neuron=15%) could be got by using this improved culture method.2. Matrigel substrate promoted neurites outgrowth of cultured neurons more potently than PLL substrate,but did not increase the survival of the neurons.
, 百拇医药
【Key words】 Primary neural cell culture; Dopaminergic neuron; Poly-L-lysine; Immunocytochemistry; Matrigel
为探讨帕金森病的发病机理及治疗方法,常需在单细胞水平了解黑质多巴胺能神经元的生理生化特性及其对各种毒物、药物的反应。因此,高纯度、高质量、稳定地进行原代黑质多巴胺能神经元培养,是进行这一领域研究的关键技术。
大鼠胚胎黑质多巴胺能神经元的原代培养有相当难度。据报道,在胚胎中脑原代细胞培养中所得到的多巴胺能神经元所占的比例一般较低,多为0.5%~2%[1,2](仅有一个实验室报道达到了17%[3]);另外,这些体外培养神经元的形态和功能与体内有较大差异。这些都会影响体外实验结果的准确性。
产生上述现象可能与多种原因有关。首先,大多数作者使用的取材方法是取下整个胚胎中脑或中脑腹侧,从而不可避免地混有大量不含多巴胺能神经元的组织。其次,原代培养黑质多巴胺能神经元与培养的海马、大脑皮质神经元不同,较容易死亡[4]。有报告说,胚胎黑质细胞在分散过程中即可造成30%的多巴胺能神经元死亡,接种后24h内死亡最多,为接种时存活的多巴胺神经元的60%,其后死亡进程延缓,第3d为87%[5]。尽管不同作者所报告的数字略有差异,但第3d死亡数至少要达50%以上[6],第8d则超过75%[7]。另外,多聚左旋赖氨酸虽然常被用作体外培养的基质,但并不是细胞外基质的成分,其作用仅仅是通过改善培养皿的电荷状况及吸附培养液中的某些血清成分,以促进细胞贴附[8],从而造成神经元的生长形态及功能的不稳定性。
, 百拇医药
为此,我们在本实验中,拟从取材部位、细胞接种液和培养基质3方面对黑质多巴胺能神经元的技术进行改进,旨在能够获得较高纯度及较高质量的原代黑质多巴胺能神经元培养物。
材料和方法
1. 收集3T3成纤维细胞系条件培养液
在玻璃培养瓶中,以含胎牛血清10%(Gibco),青霉素105IU/L,链霉素100mg/L,葡萄糖4.5g/L的DMEM(Gibco)培养3T3成纤维细胞系。换液时,收集旧培养液,2 000×g离心5min。取上清,储存于4℃,用作黑质神经元原代培养接种液中的添加剂。
2. 铺敷生长基质
2.1 Poly-L-Lysine:在35mm塑料培养皿(Nunc,USA)中加入50mg/L的PLL 0.5ml(Sigma,MW=70~150kD),室温作用12~24h后,吸去多余液体,用无菌去离子水彻底冲洗3次,置于37℃培养箱(Heraeus,Germany)中待用。
, 百拇医药
2.2 Matrigel:4℃,24h融化Matrigel(Becton Dickison Labware,USA),用不含血清的预冷培养液按1∶100稀释,然后用预冷的吸管混匀,在预冷的35mm塑料培养皿中加入Matrigel稀释液0.5ml,37℃培养箱孵育1h后,吸去多余的液体,并用无菌去离子水冲洗1次后,即刻使用。注意切勿使铺敷的Matrigel干燥。
3. 胚胎黑质神经元取材
取孕13d SD大鼠1只(北京医科大学实验动物中心,以见阴栓为第0d),心脏内直接注射气栓处死;无菌条件下取出子宫,用冰D-Hank液洗净,再经75%酒精洗浴30s,置于盛有冰D-Hank液的平皿中;沿子宫系膜对侧缘剪开子宫,取出胚胎,测量头臀距(CRL)为11mm,共15只,置于冰袋上盛有冰D-Hank液的平皿中待用。在解剖镜(Cambridge Instruments,Germany)下,暴露中脑脑曲;用显微手术剪剪下中脑脑曲腹侧部分(其吻侧界限为中脑与间脑的交界线的尾侧1mm),将取下的组织平铺在平皿中,用显微手术镊剥除脑膜及血管,用显微手术剪剪下其距吻侧端1mm中线两侧各1.5mm×1.5mm的组织(所取组织块长宽分别为1.5mm和3mm),放入盛有冰D-Hank液的平皿中,静置于冰袋上待用。整个取材时间(从取出大鼠子宫到全部取材完成)不超过45min。
, 百拇医药
4. 原代神经细胞培养
吹打液:含10mg/L的DNase Ⅰ(Sigma)的D-Hank液,pH7.4; 接种液:含胎牛血清10%(Gibco)、3T3成纤维细胞系条件培养液10%(自制,见前述)、青霉素105IU/L、链霉素100mg/L、葡萄糖4.5g/L的DMEM(Gibco),pH7.4;培养液:含胎牛血清10%(Gibco)、青霉素105IU/L、链霉素100mg/L、葡萄糖4.5g/L的DMEM(Gibco),pH7.4。
取材全部完成后,将组织移入已预温至37℃含有0.1%胰蛋白酶(Sigma)1ml的玻璃小管中,静置于37℃温箱消化20min;加入1滴胎牛血清(Gibco),混匀以终止消化,另外再加入10mg/L的DNase Ⅰ 1ml,混匀;片刻后,在室温以100×g离心60s,小心移去上清,加入预温至37℃的吹打液1ml,以口径为1mm的吸管吸打10次,然后以口径为0.5mm的吸管再吸打10次,在以上吸打过程中勿产生气泡;静置5min,将上清(约为总体积的9/10)吸至1个新的5ml玻璃小管中。取1μl细胞悬液,加入8μl缓冲液及1μl的10×台盼蓝混匀,镜下以见圆形、透亮、有光晕的细胞体作为活细胞的辨认特征(死亡细胞为蓝色),计数得细胞存活率为90%,活细胞密度为1.5×107/ml;然后按照每个35mm平皿接种1×106细胞的密度(约合1×105/cm2)用接种液稀释,混匀后,每个35mm平皿加入1ml细胞悬液,24h后将接种液全部弃去,加入不含3T3成纤维细胞系条件培养液的正常培养液1.5ml,培养第3d时半量换液,同时加入阿糖胞苷8mg/L(Sigma)。
, 百拇医药
5.酪氨酸羟化酶(TH)免疫细胞化学染色
抗体稀释液:含5%封闭用羊血清(北京中山生物技术公司)及0.1% Triton X-100(北京中山生物技术公司)的D-PBS;DAB稀释液:50mg/L Tris-HCl,pH7.4。
第5d终止培养,D-PBS冲洗5min×3;新鲜配制的1%多聚甲醛(北京化学试剂公司)溶液室温固定30min,D-PBS冲洗5min×3;1%的过氧化氢(北京化学试剂公司)溶液室温作用30min,D-PBS冲洗5min×3;加入5%封闭用羊血清室温30min,D-PBS冲洗5min×3;加入抗大鼠TH单克隆抗体(1∶1000,Sigma,以抗体稀释液稀释),37℃下作用2h,D-PBS冲洗3min×3;加入用抗体稀释液稀释的羊抗小鼠生物素化二抗(1∶100,Zymed Laboratories Inc.,USA),37℃下作用15min,D-PBS冲洗3min×3;加入以抗体稀释液稀释的Streptavidin-HRP复合物(1∶100,Zymed Laboratories Inc.,USA),37℃作用15min,D-PBS冲洗3min×3;DAB稀释液冲洗3min,进入0.05% DAB(Sigma)/0.3%过氧化氢孵育液中,在倒置显微镜下观察显色7min。
, 百拇医药
6. TH免疫反应神经元形态观察
6.1 TH免疫反应神经元占全部培养细胞的比例:在倒置相差显微镜(Leica MPS32)下,自Matrigel及PLL组中分别随机选取20个视野(250倍),计数视野中TH免疫反应神经元及全部培养细胞,计算TH免疫反应神经元占全部培养细胞的比例。
6.2 突起长度的测量:在上述视野中,以目镜上的标尺为工具,测量TH免疫反应神经元突起的长度。对于双极及多极TH免疫反应神经元,测量其最长的突起,而对于单极TH免疫反应神经元,测量其唯一的突起。分别将Matrigel及PLL组中所选取的20个视野内的所有TH免疫反应神经元的突起长度相加,除以所有20个视野中TH免疫反应神经元数目之和,分别得到每组TH免疫反应神经元突起的平均长度。
7. 统计学处理
使用SYSTAT统计学软件包,对Matrigel及PLL两实验组(n=10)中得到的TH免疫反应神经元比例及突起长度数据进行t检验分析。
, 百拇医药
结果
1. TH免疫反应神经元表现出多种形态
在TH免疫反应神经元中50%为双极卵圆形,这些细胞的特征是胞体呈卵圆形,其两极发出较长的突起;20%为单极卵圆形;剩余的为多极细胞、锥形细胞及其他形态的细胞(图1,3,4)。
2.不同生长基质上TH免疫反应神经元的生长状况
培养第24h,在倒置相差显微镜下观察。Matrige 1组的贴壁细胞倾向于相互聚集成团生长,形成直径为150~450μm的细胞团,中等大小的细胞团(直径为250~350μm)占60%,大细胞团及小细胞团各约占20%,符合正态分布规律;视野中所有细胞团开始向周围放射状伸出突起,在细胞团之间的散在细胞数目减少,形态与细胞团内的细胞相似,大多数呈椭圆形,并长出突起;通过对同一视野的24h动态观察发现,所形成的细胞团大多数是由相邻的贴壁细胞迁移聚集而成,但也不排除少数细胞团由单个干细胞或前体细胞分裂形成的可能性。在PLL上,细胞分散较为均匀,聚集成团生长的现象较为少见,胞体由接种时的圆形开始变为椭圆形,并发出突起,细胞形态与Matrigel上生长的细胞类似。
, http://www.100md.com
培养第3d,在倒置相差显微镜下观察。在Matrigel上,细胞团的数量及大小与培养第24h差别不大,但向周围发出的放射状突起明显较第24h密集,并与相邻的细胞团及散在细胞形成网状纤维联系,且常形成较大的纤维束与相邻的细胞团相联系;细胞团之间的散在细胞,绝大多数长出突起,并与相邻的散在细胞或细胞团形成纤维联系;细胞团与细胞团,细胞团与散在细胞及散在细胞与散在细胞之间形成密集的纤维联系,相互交织呈网状。在PLL上,细胞依然分散较均匀,少有成团生长的现象,绝大部分长出突起,并与相邻的细胞形成纤维联系,纤维相互交织呈网状,细胞形态与Matrigel上生长的细胞类似。
培养第5d,固定,进行TH免疫细胞化学染色。在倒置相差显微镜下观察。大体形态与第3d相似。在Matriagel上,TH免疫反应性神经元胞体大多数位于细胞团内,而细胞团间的TH免疫反应神经元胞体较少(图1,3),但相邻细胞团之间的纤维束中可见TH免疫反应神经元胞体,这些神经元常发出2个较长的突起,沿纤维束的纵轴分别伸向相邻的细胞团(图2);有些TH免疫反应神经元发出的轴突上尚可见较明显的串珠样的膨体及突起分支形成(图1)。在PLL上,TH免疫反应神经元胞体分布较为分散,其突起比较短,且没有明显的纤维成束现象,少见膨体及突起的分支形成(图4)。
, 百拇医药
图1 以Matrigel为生长基质培养第5d,可见大多数多巴胺能神经元生长在细胞岛内,少数在细胞岛外。在神经元突起上尚可见串珠状膨体(箭头)和分支(空箭头)形成。TH免疫组织化学染色 ×125
Fig.1 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).Most dopaminergic nerons existed in cell islands with few out of these islands.Note the beaded varicosities(arrow head) and branches(open arrow) on primary neurites. ×125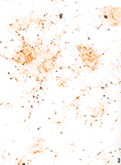
图2 以Matrigel为生长基质培养第5d,在1条连接2个相邻细胞岛的纤维束中,可以看见3个纺锤形的双极多巴胺能神经元。从这些神经元的两极各发出1条长的突起,走行于纤维束中,分别伸向2个细胞岛。纤维束主要由非多巴胺能神经元及其突起组成。TH免疫组织化学染色 ×250
, 百拇医药
Fig.2 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).In one of fiber fascicles linking two neighboring cell islands,three spindle-shaped bipolar dopaminergic neurons extended their two long processes along the fiber fascicle,which consisted of many other non-dopaminergic fibers. ×250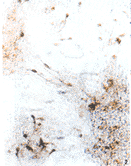
图3 以Matrigel为生长基质培养第5d,多巴胺能神经元表现为多种形态:纺锤形双极神经元(50%)、纺锤形单极神经元(20%)、其他(30%)。TH免疫组织化学染色 ×50
, 百拇医药
Fig.3 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).Dopaminergic neurons have several different shapes,namely,spindle-shaped bipolar(50%),spindle-shaped monopolar(20%),others(30%).×50
图4 以PLL为生长基质培养第5d,培养细胞没有形成明显的细胞岛。多巴胺能神经元分散较均匀,少有成团生长的现象,突起长度明显短于以Matrigel为生长基质的神经元。TH免疫组织化学染色 ×250
Fig.4 TH immunoreactive staining of dopaminergic neuron cultured on PLL(DIV 5).No obvious cell islands were observed.Dopaminergic neurons were dispersed.The processes were apparently shorter than that of on Matrigel and also were not arranged in fascicles.×250
, http://www.100md.com
3. 不同生长基质上TH免疫反应突起的长度差异明显
在Matrigel上TH免疫反应突起(182±12μm)明显长于PLL(116±7μm)(P<0.05)(图5)。
图5 以Matrigel和PLL为生长基质,TH免疫反应细胞突起的长度比较
Fig.5 Comparison between length of THir neurites on
Matrigel and PLL.
4. 不同生长基质上TH免疫反应神经元占所有培养细胞的比例无明显差异
在Matrigel上,包括TH免疫反应神经元在内的所有中脑细胞均生长良好,而就TH免疫反应神经元占所有中脑细胞的比例(15%±1%)而言,与PLL(12%±0.9%)无明显差异(P>0.05)(图6)。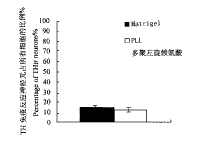
, 百拇医药
图6 以Matrigel和PLL为生长基质,TH免疫反应神经元占
全部神经元百分比的比较
Fig.6 Comparison between the percentage of THir neurons on
Matrigel and PLL.
讨论
高纯度、高质量、稳定地进行原代黑质多巴胺能神经元培养,对于帕金森综合症、早老性痴呆、药物依赖及精神分裂症的细胞生物学、电生理学、药理毒理学研究具有关键作用。
以往大多数实验者是取下整个胚胎中脑或中脑腹侧,导致多巴胺能神经元占神经元总数的比例过低。Commissiong[9]通过测定黑质的多巴胺的含量,指出胚胎14~16d大鼠多巴胺能神经元中的90%集中在1~2mm3的小块组织内,并随后成功地获得了高达17%的多巴胺能神经元纯度。这一报道与Linda[10]的报道相吻合。Linda发现,在大鼠胚胎第12.5d,多巴胺能神经元的胞体大多数位于中脑脑曲吻腹侧部分的中线两旁;第13.5d,多巴胺能神经元的胞体已经跨过中线,并向尾侧延伸至后脑水平;在第14.5d,多巴胺能神经元的胞体完全越过中线并相互汇合,同时向尾侧、吻侧及内侧扩展。
, 百拇医药
但是,Commissiong的取材方法难度较大,要求有很好的手术技巧,并且在实际操作中,经常难以达到精确定位,有时甚至会因为过分追求取材精度(1~2mm3)而错失多巴胺能神经元最富集的区域,反而导致培养物中多巴胺能神经元的比例大为下降,实验成功率不高。虽然通过扩大取材范围能够在一定程度上提高实验成功率,但是由于不可避免地取下了较多的非多巴胺能神经元富集区,得到的多巴胺能神经元的纯度依然不令人满意。
有研究表明,黑质多巴胺能神经元从分散为单细胞到接种24h以内特别容易死亡,并常表现出凋亡的特征;而且,胚胎期的神经前体细胞具有多种分化潜能。因此,如果在这段时间内采取措施抑制黑质多巴胺能神经元凋亡,并诱导神经前体细胞向多巴胺能神经元分化,应有利于改善培养效果,并可能在一定程度上补偿由于扩大取材范围而导致的多巴胺能神经元比例的下降。已有证明,多种营养因子不仅能够抑制凋亡,而且能够诱导多巴胺能表型出现。3T3成纤维细胞系可以分泌许多营养因子,其中包括bFGF[5],它们可以抑制凋亡,提高多巴胺能神经元的存活能力,并诱导多巴胺能神经元的分化[9]。因此,我们在本实验的接种液中添加了10%的3T3成纤维细胞系条件培养液,应能起到为培养初期的黑质多巴胺能神经元提供各种生长因子的作用,在第24h,再换以正常的培养液,似不影响随后的实验。从理论上讲,也可以在接种液中加入纯化的营养因子以替代3T3成纤维细胞系条件培养液,但是这样势必导致实验费用的增加。另外,通过与3T3成纤维细胞系条件培养液的联合使用,可以降低对取材精度的要求,增大了成功率,提高了培养的稳定性。也就是说,我们用较为简便的方法得到较纯的多巴胺能神经元,这对提高原代培养黑质神经元的纯度似起到了关键作用。
, http://www.100md.com
有实验表明,将细胞接种密度提高40%,可以增强营养因子的旁分泌作用,能特异地提高多巴胺能神经元的存活率达90%[11]。在本实验中我们也采用较高的细胞接种密度(1×105/cm2),这也可能对提高原代培养多巴胺能神经元的纯度起到一定作用。另外,在基本操作中,我们将每个胚胎的取材时间缩短到3min以内,以求减小细胞暴露于体外恶劣环境的时间;注意将胚胎及取下的组织置于冰上,以降低细胞的代谢率;尽量缩短胰蛋白酶作用时间,以减少对细胞的损伤(0.1%胰蛋白酶,37℃静置消化20min已经能够保证胰蛋白酶消化效果);针对细胞聚团现象,我们加用DNaseⅠ以降解因细胞破碎释放的基因组DNA;在吸打时注意正确的手法,以减少机械剪切力的损伤,等等。这些措施对提高培养质量都应该起一定作用。
Matrigel是来自EHS小鼠肉瘤基膜的可溶性提取物,其主要成分是层粘连蛋白(laminin)、IV型胶原(collagen Ⅳ)、少量entactin及多种神经营养因子(NTFs)。层粘连蛋白、IV型胶原及entactin均能促进神经元突起的生长,其中层粘连蛋白-1通过膜上受体β1与整合素结合,不仅可以直接增强生长锥与基质的粘附,而且还可以通过β1整合素引发细胞内事件,从而加速细胞器从生长锥的中央区(central region)进入板状伪足(lamellipodium),改变微管分布,促进并稳定突起的形成[12]。本实验显示,在Matrigel上,黑质神经元不仅能较好地贴附生长于培养皿表面,而且可以定向迁移并相互聚集成团,发出较长的突起形成明显的纤维束,这些特征与神经系统发育过程中的神经元所具备的行为相类似,可能提示,在Matrigel形成的细胞外基质上,易化了轴突定向生长,并有相互集结成纤维束的趋势。这可能与层粘连蛋白的作用有关[13,14]。在PLL上,黑质神经元虽能够较好地贴附生长于培养皿表面,但没有迁移及聚集成团现象,且突起较短,不能形成明显的纤维束,说明细胞外基质的重要性。另外,由于Matrigel及PLL对于多巴胺能神经元生长的数量比例没有影响,说明Matrigel中的细胞外基质成分与PLL一样,都不能特异地改善黑质神经元的存活;而黑质多巴胺能神经元在PLL上仍可长出较短突起,说明其突起的生长可能并不完全依赖于细胞外基质的作用。因此,我们认为,黑质神经元胞体的迁移及突起的生长,可能依赖细胞表面的受体组合及其引发的细胞内信号传导机制。但无论如何,在Matrigel上培养的黑质神经元比在PLL上培养的神经元似乎更接近于体内的生长状况。
, 百拇医药
在本研究中,TH免疫反应神经元表现出多种细胞形态,与前人的报道相吻合[15]。主要表现为双极的卵圆形神经元,其次为单极的卵圆形神经元,另有少量的多极和锥体形神经元。这提示,在高纯度的黑质神经元原代培养条件下,这些形态特征可以作为电生理实验中选择多巴胺能神经元的部分依据。但是如需要准确区分A8、A10及A10区的不同多巴胺能神经元,则采用新生鼠多巴胺能神经元原代培养的方法可能更为适宜[15]。
本文图1~4见插图第6页
【作者简介】 陈立南(1971—),男(汉族),山东济南人,博士
参考文献
[1]Di Porzil U,Rougon G,Novotny E A.Dopaminergic neurons from Embryonic mouse mesencephalon are enriched in culture through immunoreaction with monoclonal antibody to specific protein 4 and flow cytometry[J].Proc Natl Acad Sci U S A,1987,84(2):7334-7338.
, 百拇医药
[2]Heyer E J.Electrophysiological study of mammalian neurons from ventral mesencephalon grown in primary dissociated cell culture[J].Brain Res,1984,310(1):142-148.
[3]Shimoda K,Sauve Y,Marini A.A high percentage yield of tyrosie hydroxylase-positive cells from rat E14 mesencephalic cell culture[J].Brain Res,1992,586(2):319-331.
[4]Brewer GJ.Serum-free B27/neurobasal medium suports differentiated growth of neurons from the striatum,substantia nigra,septum,cerebral cortex,cerebellum,and dentate gyrus[J].J Neurosci Res,1995,42(5):674-683.
, 百拇医药
[5]Fawcett JW,Barker RA,Dunnett SB.Dopaminergic neuronal survival and the effects of bFGF in explant,three dimensional and monolayer cultures of embryonic rat ventral mesencephalon[J].Exp Brain Res,1995,106(2):275-282.
[6]Cohen J,Wilkin GP.Neural Cell Culture-A Practical Approach[M].London:Oxford University Press,1995:25-40.
[7]Hyman C,Hofer M,Barde YA.BDNF is a neurotrophic factor for dopaminergic neurons of the substantia nigra[J].Nature,1991,350(6315):230-232.
, http://www.100md.com
[8]Gary B,Kimberly G.Culturing Nerve Cells[M].2nd ed.Massachusetts:MIT Press,1998:37-78.
[9]Commissiong JW,Toffano G.The Effect of GM1 ganglioside on coerulospinal,noradrenergic,adult neurons and on fetal monoaminergic neurons transolanted into the transsected spinal cord of the adult rat[J].Brain Res,1986,380(2):205-215.
[10]Linda AS.Virginia MP,Tong HJ.Light-microscopic immunocytochemical localization of tyrosine hydroxylase in prenatal rat brain.I.early ontology[J].J Comp Neurol,1981,199(2):233-253.
, http://www.100md.com
[11]Mayer E,Dunnet SB,Pellitteri R.Basic Fibroblast growth factor promotes the survival of embryonic ventral mesencephalic dopaminergic neurons I.Effects in vitro[J].Neuroscience,1997,56(2):379-388.
[12]Davies RW,Morris BJ.Molecular Biology of the Neuron[M].New York:Bios Scientific Publishers Ltd,1997:269-389.
[13]Honig MG,Petersen GG,Rutishauser US.In vitro studies of growth cone behavior support a role for fasciculation mediated by cell adhesion molecules in sensory axon guidance during development[J].Dev Biol,1998,204(2):317-326.
, http://www.100md.com
[14]Fernandez-de-Miguel F. Outgrowth patterna and directed growth of identified neurons induced by native substrates in culture[J].J Comp Neurol,1997,380(1):1-15.
[15]Masuko S,Nakajima S,Nakajima Y.Dissociated high-purity dopaminergic neuron culture from the substantia nigra and the ventral tegmental aera of the postnatal rat[J].Neuroscience,1992,49(2):347-364.
【收稿日期】 1999-10-19
【修回日期】 2000-03-02, 百拇医药
单位:陈立南(北京医科大学解剖学系,北京 100083);徐群渊(首都医科大学北京神经科学研究所,北京 100054);吕捷(首都医科大学北京神经科学研究所,北京 100054);张进禄(首都医科大学北京神经科学研究所,北京 100054)
关键词:原代神经细胞培养;多巴胺能神经元;多聚左旋赖氨酸;免疫组织化学;Matrigel
解剖学报000405 【摘要】 目的 试图通过方法改进获得高纯度原代多巴胺能神经元,并研究Matrigel及多聚左旋赖氨酸(poly-l-lysine,PLL)等不同基质对于大鼠胚胎13d中脑黑质神经元突起生长的不同作用。 方法 无菌技术取得孕13d SD大鼠胚胎,采用改进的取材方法,得到胎鼠腹侧中脑细胞,以较高密度(1×105/cm2)分别种入由Matrigel及PLL作为基质的塑料培养皿中。体外培养5d后,对培养物进行TH免疫细胞化学染色,测量TH免疫反应突起的长度并计算TH免疫反应神经元占细胞总数的比例。 结果和结论 1.采用改进的方法,能够得到高纯度的多巴胺能神经元(多巴胺神经元占培养细胞总数的比例为15%);2.与PLL相比,Matrigel能有效地促进多巴胺能神经元突起的生长,但不能特异地促进中脑培养细胞的存活。
, 百拇医药
【中图分类号】 Q421;Q8134.1+1 【文献标识码】 A 【文章编号】 0529-1356(2000)04-307
STUDY OF FACTORS AFFECTING PRIMARY CULTURE
OF DOPAMINERGIC NEURONS IN RAT FETUS
CHEN Li-nan
(Department of Anatomy,Beijing Medical University,Beijing 100083,China)
XU Qun-yuan Lü Jie ZHANG Jin-lu
(Beijing Institute for Neuroscience,Capital University of Medical Sciences,Beijing 100054,China)
, 百拇医药
【Abstract】 Objective
In order to obtain high purity of primary culture of dopaminergic neurons in rat fetus,we tried to modify the culture procedure.Using improved techniques,we compared the growth status of dopaminergic neurons cultured on Matrigel and PLL(Poly-L-Lysine)substrates. Methods The DA neurons were obtained from the ventral mesencephalon of SD rat embryos(E13) by using a different dissecting method and then plated in plastic dishes coated with Matrigel and PLL substrates in high density (1×105/cm2).After cultured for 5 days in vitro,TH immunocytochemical staining was performed and length of TH immunoreactive neurites was measured. Results and Conclusions 1.Cultured dopaminergic neurons in high-purity(dopaminergic neuron/all neuron=15%) could be got by using this improved culture method.2. Matrigel substrate promoted neurites outgrowth of cultured neurons more potently than PLL substrate,but did not increase the survival of the neurons.
, 百拇医药
【Key words】 Primary neural cell culture; Dopaminergic neuron; Poly-L-lysine; Immunocytochemistry; Matrigel
为探讨帕金森病的发病机理及治疗方法,常需在单细胞水平了解黑质多巴胺能神经元的生理生化特性及其对各种毒物、药物的反应。因此,高纯度、高质量、稳定地进行原代黑质多巴胺能神经元培养,是进行这一领域研究的关键技术。
大鼠胚胎黑质多巴胺能神经元的原代培养有相当难度。据报道,在胚胎中脑原代细胞培养中所得到的多巴胺能神经元所占的比例一般较低,多为0.5%~2%[1,2](仅有一个实验室报道达到了17%[3]);另外,这些体外培养神经元的形态和功能与体内有较大差异。这些都会影响体外实验结果的准确性。
产生上述现象可能与多种原因有关。首先,大多数作者使用的取材方法是取下整个胚胎中脑或中脑腹侧,从而不可避免地混有大量不含多巴胺能神经元的组织。其次,原代培养黑质多巴胺能神经元与培养的海马、大脑皮质神经元不同,较容易死亡[4]。有报告说,胚胎黑质细胞在分散过程中即可造成30%的多巴胺能神经元死亡,接种后24h内死亡最多,为接种时存活的多巴胺神经元的60%,其后死亡进程延缓,第3d为87%[5]。尽管不同作者所报告的数字略有差异,但第3d死亡数至少要达50%以上[6],第8d则超过75%[7]。另外,多聚左旋赖氨酸虽然常被用作体外培养的基质,但并不是细胞外基质的成分,其作用仅仅是通过改善培养皿的电荷状况及吸附培养液中的某些血清成分,以促进细胞贴附[8],从而造成神经元的生长形态及功能的不稳定性。
, 百拇医药
为此,我们在本实验中,拟从取材部位、细胞接种液和培养基质3方面对黑质多巴胺能神经元的技术进行改进,旨在能够获得较高纯度及较高质量的原代黑质多巴胺能神经元培养物。
材料和方法
1. 收集3T3成纤维细胞系条件培养液
在玻璃培养瓶中,以含胎牛血清10%(Gibco),青霉素105IU/L,链霉素100mg/L,葡萄糖4.5g/L的DMEM(Gibco)培养3T3成纤维细胞系。换液时,收集旧培养液,2 000×g离心5min。取上清,储存于4℃,用作黑质神经元原代培养接种液中的添加剂。
2. 铺敷生长基质
2.1 Poly-L-Lysine:在35mm塑料培养皿(Nunc,USA)中加入50mg/L的PLL 0.5ml(Sigma,MW=70~150kD),室温作用12~24h后,吸去多余液体,用无菌去离子水彻底冲洗3次,置于37℃培养箱(Heraeus,Germany)中待用。
, 百拇医药
2.2 Matrigel:4℃,24h融化Matrigel(Becton Dickison Labware,USA),用不含血清的预冷培养液按1∶100稀释,然后用预冷的吸管混匀,在预冷的35mm塑料培养皿中加入Matrigel稀释液0.5ml,37℃培养箱孵育1h后,吸去多余的液体,并用无菌去离子水冲洗1次后,即刻使用。注意切勿使铺敷的Matrigel干燥。
3. 胚胎黑质神经元取材
取孕13d SD大鼠1只(北京医科大学实验动物中心,以见阴栓为第0d),心脏内直接注射气栓处死;无菌条件下取出子宫,用冰D-Hank液洗净,再经75%酒精洗浴30s,置于盛有冰D-Hank液的平皿中;沿子宫系膜对侧缘剪开子宫,取出胚胎,测量头臀距(CRL)为11mm,共15只,置于冰袋上盛有冰D-Hank液的平皿中待用。在解剖镜(Cambridge Instruments,Germany)下,暴露中脑脑曲;用显微手术剪剪下中脑脑曲腹侧部分(其吻侧界限为中脑与间脑的交界线的尾侧1mm),将取下的组织平铺在平皿中,用显微手术镊剥除脑膜及血管,用显微手术剪剪下其距吻侧端1mm中线两侧各1.5mm×1.5mm的组织(所取组织块长宽分别为1.5mm和3mm),放入盛有冰D-Hank液的平皿中,静置于冰袋上待用。整个取材时间(从取出大鼠子宫到全部取材完成)不超过45min。
, 百拇医药
4. 原代神经细胞培养
吹打液:含10mg/L的DNase Ⅰ(Sigma)的D-Hank液,pH7.4; 接种液:含胎牛血清10%(Gibco)、3T3成纤维细胞系条件培养液10%(自制,见前述)、青霉素105IU/L、链霉素100mg/L、葡萄糖4.5g/L的DMEM(Gibco),pH7.4;培养液:含胎牛血清10%(Gibco)、青霉素105IU/L、链霉素100mg/L、葡萄糖4.5g/L的DMEM(Gibco),pH7.4。
取材全部完成后,将组织移入已预温至37℃含有0.1%胰蛋白酶(Sigma)1ml的玻璃小管中,静置于37℃温箱消化20min;加入1滴胎牛血清(Gibco),混匀以终止消化,另外再加入10mg/L的DNase Ⅰ 1ml,混匀;片刻后,在室温以100×g离心60s,小心移去上清,加入预温至37℃的吹打液1ml,以口径为1mm的吸管吸打10次,然后以口径为0.5mm的吸管再吸打10次,在以上吸打过程中勿产生气泡;静置5min,将上清(约为总体积的9/10)吸至1个新的5ml玻璃小管中。取1μl细胞悬液,加入8μl缓冲液及1μl的10×台盼蓝混匀,镜下以见圆形、透亮、有光晕的细胞体作为活细胞的辨认特征(死亡细胞为蓝色),计数得细胞存活率为90%,活细胞密度为1.5×107/ml;然后按照每个35mm平皿接种1×106细胞的密度(约合1×105/cm2)用接种液稀释,混匀后,每个35mm平皿加入1ml细胞悬液,24h后将接种液全部弃去,加入不含3T3成纤维细胞系条件培养液的正常培养液1.5ml,培养第3d时半量换液,同时加入阿糖胞苷8mg/L(Sigma)。
, 百拇医药
5.酪氨酸羟化酶(TH)免疫细胞化学染色
抗体稀释液:含5%封闭用羊血清(北京中山生物技术公司)及0.1% Triton X-100(北京中山生物技术公司)的D-PBS;DAB稀释液:50mg/L Tris-HCl,pH7.4。
第5d终止培养,D-PBS冲洗5min×3;新鲜配制的1%多聚甲醛(北京化学试剂公司)溶液室温固定30min,D-PBS冲洗5min×3;1%的过氧化氢(北京化学试剂公司)溶液室温作用30min,D-PBS冲洗5min×3;加入5%封闭用羊血清室温30min,D-PBS冲洗5min×3;加入抗大鼠TH单克隆抗体(1∶1000,Sigma,以抗体稀释液稀释),37℃下作用2h,D-PBS冲洗3min×3;加入用抗体稀释液稀释的羊抗小鼠生物素化二抗(1∶100,Zymed Laboratories Inc.,USA),37℃下作用15min,D-PBS冲洗3min×3;加入以抗体稀释液稀释的Streptavidin-HRP复合物(1∶100,Zymed Laboratories Inc.,USA),37℃作用15min,D-PBS冲洗3min×3;DAB稀释液冲洗3min,进入0.05% DAB(Sigma)/0.3%过氧化氢孵育液中,在倒置显微镜下观察显色7min。
, 百拇医药
6. TH免疫反应神经元形态观察
6.1 TH免疫反应神经元占全部培养细胞的比例:在倒置相差显微镜(Leica MPS32)下,自Matrigel及PLL组中分别随机选取20个视野(250倍),计数视野中TH免疫反应神经元及全部培养细胞,计算TH免疫反应神经元占全部培养细胞的比例。
6.2 突起长度的测量:在上述视野中,以目镜上的标尺为工具,测量TH免疫反应神经元突起的长度。对于双极及多极TH免疫反应神经元,测量其最长的突起,而对于单极TH免疫反应神经元,测量其唯一的突起。分别将Matrigel及PLL组中所选取的20个视野内的所有TH免疫反应神经元的突起长度相加,除以所有20个视野中TH免疫反应神经元数目之和,分别得到每组TH免疫反应神经元突起的平均长度。
7. 统计学处理
使用SYSTAT统计学软件包,对Matrigel及PLL两实验组(n=10)中得到的TH免疫反应神经元比例及突起长度数据进行t检验分析。
, 百拇医药
结果
1. TH免疫反应神经元表现出多种形态
在TH免疫反应神经元中50%为双极卵圆形,这些细胞的特征是胞体呈卵圆形,其两极发出较长的突起;20%为单极卵圆形;剩余的为多极细胞、锥形细胞及其他形态的细胞(图1,3,4)。
2.不同生长基质上TH免疫反应神经元的生长状况
培养第24h,在倒置相差显微镜下观察。Matrige 1组的贴壁细胞倾向于相互聚集成团生长,形成直径为150~450μm的细胞团,中等大小的细胞团(直径为250~350μm)占60%,大细胞团及小细胞团各约占20%,符合正态分布规律;视野中所有细胞团开始向周围放射状伸出突起,在细胞团之间的散在细胞数目减少,形态与细胞团内的细胞相似,大多数呈椭圆形,并长出突起;通过对同一视野的24h动态观察发现,所形成的细胞团大多数是由相邻的贴壁细胞迁移聚集而成,但也不排除少数细胞团由单个干细胞或前体细胞分裂形成的可能性。在PLL上,细胞分散较为均匀,聚集成团生长的现象较为少见,胞体由接种时的圆形开始变为椭圆形,并发出突起,细胞形态与Matrigel上生长的细胞类似。
, http://www.100md.com
培养第3d,在倒置相差显微镜下观察。在Matrigel上,细胞团的数量及大小与培养第24h差别不大,但向周围发出的放射状突起明显较第24h密集,并与相邻的细胞团及散在细胞形成网状纤维联系,且常形成较大的纤维束与相邻的细胞团相联系;细胞团之间的散在细胞,绝大多数长出突起,并与相邻的散在细胞或细胞团形成纤维联系;细胞团与细胞团,细胞团与散在细胞及散在细胞与散在细胞之间形成密集的纤维联系,相互交织呈网状。在PLL上,细胞依然分散较均匀,少有成团生长的现象,绝大部分长出突起,并与相邻的细胞形成纤维联系,纤维相互交织呈网状,细胞形态与Matrigel上生长的细胞类似。
培养第5d,固定,进行TH免疫细胞化学染色。在倒置相差显微镜下观察。大体形态与第3d相似。在Matriagel上,TH免疫反应性神经元胞体大多数位于细胞团内,而细胞团间的TH免疫反应神经元胞体较少(图1,3),但相邻细胞团之间的纤维束中可见TH免疫反应神经元胞体,这些神经元常发出2个较长的突起,沿纤维束的纵轴分别伸向相邻的细胞团(图2);有些TH免疫反应神经元发出的轴突上尚可见较明显的串珠样的膨体及突起分支形成(图1)。在PLL上,TH免疫反应神经元胞体分布较为分散,其突起比较短,且没有明显的纤维成束现象,少见膨体及突起的分支形成(图4)。

, 百拇医药
图1 以Matrigel为生长基质培养第5d,可见大多数多巴胺能神经元生长在细胞岛内,少数在细胞岛外。在神经元突起上尚可见串珠状膨体(箭头)和分支(空箭头)形成。TH免疫组织化学染色 ×125
Fig.1 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).Most dopaminergic nerons existed in cell islands with few out of these islands.Note the beaded varicosities(arrow head) and branches(open arrow) on primary neurites. ×125

图2 以Matrigel为生长基质培养第5d,在1条连接2个相邻细胞岛的纤维束中,可以看见3个纺锤形的双极多巴胺能神经元。从这些神经元的两极各发出1条长的突起,走行于纤维束中,分别伸向2个细胞岛。纤维束主要由非多巴胺能神经元及其突起组成。TH免疫组织化学染色 ×250
, 百拇医药
Fig.2 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).In one of fiber fascicles linking two neighboring cell islands,three spindle-shaped bipolar dopaminergic neurons extended their two long processes along the fiber fascicle,which consisted of many other non-dopaminergic fibers. ×250

图3 以Matrigel为生长基质培养第5d,多巴胺能神经元表现为多种形态:纺锤形双极神经元(50%)、纺锤形单极神经元(20%)、其他(30%)。TH免疫组织化学染色 ×50
, 百拇医药
Fig.3 TH immunoreactive staining of dopaminergic neuron cultured on Matrigel(DIV 5).Dopaminergic neurons have several different shapes,namely,spindle-shaped bipolar(50%),spindle-shaped monopolar(20%),others(30%).×50

图4 以PLL为生长基质培养第5d,培养细胞没有形成明显的细胞岛。多巴胺能神经元分散较均匀,少有成团生长的现象,突起长度明显短于以Matrigel为生长基质的神经元。TH免疫组织化学染色 ×250
Fig.4 TH immunoreactive staining of dopaminergic neuron cultured on PLL(DIV 5).No obvious cell islands were observed.Dopaminergic neurons were dispersed.The processes were apparently shorter than that of on Matrigel and also were not arranged in fascicles.×250
, http://www.100md.com
3. 不同生长基质上TH免疫反应突起的长度差异明显
在Matrigel上TH免疫反应突起(182±12μm)明显长于PLL(116±7μm)(P<0.05)(图5)。

图5 以Matrigel和PLL为生长基质,TH免疫反应细胞突起的长度比较
Fig.5 Comparison between length of THir neurites on
Matrigel and PLL.
4. 不同生长基质上TH免疫反应神经元占所有培养细胞的比例无明显差异
在Matrigel上,包括TH免疫反应神经元在内的所有中脑细胞均生长良好,而就TH免疫反应神经元占所有中脑细胞的比例(15%±1%)而言,与PLL(12%±0.9%)无明显差异(P>0.05)(图6)。

, 百拇医药
图6 以Matrigel和PLL为生长基质,TH免疫反应神经元占
全部神经元百分比的比较
Fig.6 Comparison between the percentage of THir neurons on
Matrigel and PLL.
讨论
高纯度、高质量、稳定地进行原代黑质多巴胺能神经元培养,对于帕金森综合症、早老性痴呆、药物依赖及精神分裂症的细胞生物学、电生理学、药理毒理学研究具有关键作用。
以往大多数实验者是取下整个胚胎中脑或中脑腹侧,导致多巴胺能神经元占神经元总数的比例过低。Commissiong[9]通过测定黑质的多巴胺的含量,指出胚胎14~16d大鼠多巴胺能神经元中的90%集中在1~2mm3的小块组织内,并随后成功地获得了高达17%的多巴胺能神经元纯度。这一报道与Linda[10]的报道相吻合。Linda发现,在大鼠胚胎第12.5d,多巴胺能神经元的胞体大多数位于中脑脑曲吻腹侧部分的中线两旁;第13.5d,多巴胺能神经元的胞体已经跨过中线,并向尾侧延伸至后脑水平;在第14.5d,多巴胺能神经元的胞体完全越过中线并相互汇合,同时向尾侧、吻侧及内侧扩展。
, 百拇医药
但是,Commissiong的取材方法难度较大,要求有很好的手术技巧,并且在实际操作中,经常难以达到精确定位,有时甚至会因为过分追求取材精度(1~2mm3)而错失多巴胺能神经元最富集的区域,反而导致培养物中多巴胺能神经元的比例大为下降,实验成功率不高。虽然通过扩大取材范围能够在一定程度上提高实验成功率,但是由于不可避免地取下了较多的非多巴胺能神经元富集区,得到的多巴胺能神经元的纯度依然不令人满意。
有研究表明,黑质多巴胺能神经元从分散为单细胞到接种24h以内特别容易死亡,并常表现出凋亡的特征;而且,胚胎期的神经前体细胞具有多种分化潜能。因此,如果在这段时间内采取措施抑制黑质多巴胺能神经元凋亡,并诱导神经前体细胞向多巴胺能神经元分化,应有利于改善培养效果,并可能在一定程度上补偿由于扩大取材范围而导致的多巴胺能神经元比例的下降。已有证明,多种营养因子不仅能够抑制凋亡,而且能够诱导多巴胺能表型出现。3T3成纤维细胞系可以分泌许多营养因子,其中包括bFGF[5],它们可以抑制凋亡,提高多巴胺能神经元的存活能力,并诱导多巴胺能神经元的分化[9]。因此,我们在本实验的接种液中添加了10%的3T3成纤维细胞系条件培养液,应能起到为培养初期的黑质多巴胺能神经元提供各种生长因子的作用,在第24h,再换以正常的培养液,似不影响随后的实验。从理论上讲,也可以在接种液中加入纯化的营养因子以替代3T3成纤维细胞系条件培养液,但是这样势必导致实验费用的增加。另外,通过与3T3成纤维细胞系条件培养液的联合使用,可以降低对取材精度的要求,增大了成功率,提高了培养的稳定性。也就是说,我们用较为简便的方法得到较纯的多巴胺能神经元,这对提高原代培养黑质神经元的纯度似起到了关键作用。
, http://www.100md.com
有实验表明,将细胞接种密度提高40%,可以增强营养因子的旁分泌作用,能特异地提高多巴胺能神经元的存活率达90%[11]。在本实验中我们也采用较高的细胞接种密度(1×105/cm2),这也可能对提高原代培养多巴胺能神经元的纯度起到一定作用。另外,在基本操作中,我们将每个胚胎的取材时间缩短到3min以内,以求减小细胞暴露于体外恶劣环境的时间;注意将胚胎及取下的组织置于冰上,以降低细胞的代谢率;尽量缩短胰蛋白酶作用时间,以减少对细胞的损伤(0.1%胰蛋白酶,37℃静置消化20min已经能够保证胰蛋白酶消化效果);针对细胞聚团现象,我们加用DNaseⅠ以降解因细胞破碎释放的基因组DNA;在吸打时注意正确的手法,以减少机械剪切力的损伤,等等。这些措施对提高培养质量都应该起一定作用。
Matrigel是来自EHS小鼠肉瘤基膜的可溶性提取物,其主要成分是层粘连蛋白(laminin)、IV型胶原(collagen Ⅳ)、少量entactin及多种神经营养因子(NTFs)。层粘连蛋白、IV型胶原及entactin均能促进神经元突起的生长,其中层粘连蛋白-1通过膜上受体β1与整合素结合,不仅可以直接增强生长锥与基质的粘附,而且还可以通过β1整合素引发细胞内事件,从而加速细胞器从生长锥的中央区(central region)进入板状伪足(lamellipodium),改变微管分布,促进并稳定突起的形成[12]。本实验显示,在Matrigel上,黑质神经元不仅能较好地贴附生长于培养皿表面,而且可以定向迁移并相互聚集成团,发出较长的突起形成明显的纤维束,这些特征与神经系统发育过程中的神经元所具备的行为相类似,可能提示,在Matrigel形成的细胞外基质上,易化了轴突定向生长,并有相互集结成纤维束的趋势。这可能与层粘连蛋白的作用有关[13,14]。在PLL上,黑质神经元虽能够较好地贴附生长于培养皿表面,但没有迁移及聚集成团现象,且突起较短,不能形成明显的纤维束,说明细胞外基质的重要性。另外,由于Matrigel及PLL对于多巴胺能神经元生长的数量比例没有影响,说明Matrigel中的细胞外基质成分与PLL一样,都不能特异地改善黑质神经元的存活;而黑质多巴胺能神经元在PLL上仍可长出较短突起,说明其突起的生长可能并不完全依赖于细胞外基质的作用。因此,我们认为,黑质神经元胞体的迁移及突起的生长,可能依赖细胞表面的受体组合及其引发的细胞内信号传导机制。但无论如何,在Matrigel上培养的黑质神经元比在PLL上培养的神经元似乎更接近于体内的生长状况。
, 百拇医药
在本研究中,TH免疫反应神经元表现出多种细胞形态,与前人的报道相吻合[15]。主要表现为双极的卵圆形神经元,其次为单极的卵圆形神经元,另有少量的多极和锥体形神经元。这提示,在高纯度的黑质神经元原代培养条件下,这些形态特征可以作为电生理实验中选择多巴胺能神经元的部分依据。但是如需要准确区分A8、A10及A10区的不同多巴胺能神经元,则采用新生鼠多巴胺能神经元原代培养的方法可能更为适宜[15]。
本文图1~4见插图第6页
【作者简介】 陈立南(1971—),男(汉族),山东济南人,博士
参考文献
[1]Di Porzil U,Rougon G,Novotny E A.Dopaminergic neurons from Embryonic mouse mesencephalon are enriched in culture through immunoreaction with monoclonal antibody to specific protein 4 and flow cytometry[J].Proc Natl Acad Sci U S A,1987,84(2):7334-7338.
, 百拇医药
[2]Heyer E J.Electrophysiological study of mammalian neurons from ventral mesencephalon grown in primary dissociated cell culture[J].Brain Res,1984,310(1):142-148.
[3]Shimoda K,Sauve Y,Marini A.A high percentage yield of tyrosie hydroxylase-positive cells from rat E14 mesencephalic cell culture[J].Brain Res,1992,586(2):319-331.
[4]Brewer GJ.Serum-free B27/neurobasal medium suports differentiated growth of neurons from the striatum,substantia nigra,septum,cerebral cortex,cerebellum,and dentate gyrus[J].J Neurosci Res,1995,42(5):674-683.
, 百拇医药
[5]Fawcett JW,Barker RA,Dunnett SB.Dopaminergic neuronal survival and the effects of bFGF in explant,three dimensional and monolayer cultures of embryonic rat ventral mesencephalon[J].Exp Brain Res,1995,106(2):275-282.
[6]Cohen J,Wilkin GP.Neural Cell Culture-A Practical Approach[M].London:Oxford University Press,1995:25-40.
[7]Hyman C,Hofer M,Barde YA.BDNF is a neurotrophic factor for dopaminergic neurons of the substantia nigra[J].Nature,1991,350(6315):230-232.
, http://www.100md.com
[8]Gary B,Kimberly G.Culturing Nerve Cells[M].2nd ed.Massachusetts:MIT Press,1998:37-78.
[9]Commissiong JW,Toffano G.The Effect of GM1 ganglioside on coerulospinal,noradrenergic,adult neurons and on fetal monoaminergic neurons transolanted into the transsected spinal cord of the adult rat[J].Brain Res,1986,380(2):205-215.
[10]Linda AS.Virginia MP,Tong HJ.Light-microscopic immunocytochemical localization of tyrosine hydroxylase in prenatal rat brain.I.early ontology[J].J Comp Neurol,1981,199(2):233-253.
, http://www.100md.com
[11]Mayer E,Dunnet SB,Pellitteri R.Basic Fibroblast growth factor promotes the survival of embryonic ventral mesencephalic dopaminergic neurons I.Effects in vitro[J].Neuroscience,1997,56(2):379-388.
[12]Davies RW,Morris BJ.Molecular Biology of the Neuron[M].New York:Bios Scientific Publishers Ltd,1997:269-389.
[13]Honig MG,Petersen GG,Rutishauser US.In vitro studies of growth cone behavior support a role for fasciculation mediated by cell adhesion molecules in sensory axon guidance during development[J].Dev Biol,1998,204(2):317-326.
, http://www.100md.com
[14]Fernandez-de-Miguel F. Outgrowth patterna and directed growth of identified neurons induced by native substrates in culture[J].J Comp Neurol,1997,380(1):1-15.
[15]Masuko S,Nakajima S,Nakajima Y.Dissociated high-purity dopaminergic neuron culture from the substantia nigra and the ventral tegmental aera of the postnatal rat[J].Neuroscience,1992,49(2):347-364.
【收稿日期】 1999-10-19
【修回日期】 2000-03-02, 百拇医药