糖尿病时血清一氧化氮的变化及其与微血管病变的关系
作者:王燕燕* 汪义军* 王 晓* 王扬天* 黄 晟* 陈光辉*
单位:* 中国人民解放军南京军区总医院内分泌科, 邮政编码 南京210002
关键词:糖尿病;一氧化氮;微血管病变
目的
目的: 研究糖尿病时一氧化氮(NO)的变化及其与肾脏病变和神经病变的关系。 方法: 采用硝酸还原酶法对53例Ⅱ型糖尿病和32例对照组的血清NO水平进行了检测。 结果: 糖尿病患者血清NO浓度显著高于对照组(P<0.01); 有微血管病变(有肾脏病变和/或神经病变)组的血清NO明显高于无微血管病变组(P<0.01); 尿蛋白排泄(UAE)增高组血清NO高于UAE正常组(P<0.05)。 结论: 糖尿病时血清NO浓度增高; 高NO水平引起肾小球高滤过的同时对肾小球入球小动脉的扩张比对出球小动脉的扩张更明显, 可使肾小球滤过率增加, 蛋白尿排出增加; 过量NO的产生具有神经毒性, 可耗竭神经元内的能量储存, 使神经元死亡。 以上结果均参与糖尿病肾病和神经病变的发生。
, http://www.100md.com
一氧化氮(NO)是一种新型的生物信息传递体, 在维持机体微循环内环境恒定和保护机体非特异性免疫功能上起重要作用。 近来研究表明, NO与糖尿病及其微血管病变有一定内有联系, 但国内类似报道少见。 故本文对糖尿病时NO的变化及其与神经病变和肾脏病变的关系进行了探讨。
1 资料和方法
1.1 临床资料
对照组: 无糖尿病及慢性心、 肺、 肝、 肾病史, 血压、 血脂正常的本院健康工作人员32例(男15例、 女17例), 年龄19~59岁。
糖尿病组: 非胰岛素依赖性糖尿病(NIDDM)患者53例(男30例、 女23例), 年龄23~77岁, 平均55±13岁。 病程0.5~20年。 其中用胰岛素治疗24例, 口服降糖药治疗29例。 按有无微血管病变又分为二组: (1) DMⅠ组即无微血管病变组: 共25例(男16例、 女9例), 平均年龄为55±12岁, 平均病程5.5±4.2年, 空腹血糖9.1±3.6 mmol/L。 (2) DMⅡ组即有微血管病变组: 共28例(男女各14例), 平均年龄为56±14岁, 平均病程6.9±5.2年, 空腹血糖10.8±4.3 mmol/L。 均经临床病史、 体格检查及神经系统检查, 24 h尿白蛋白检测证实有糖尿病性肾病或神经病变(有并存)。 其中尿白蛋白排泄值(UAE)正常(<30 mg/24 h)者31例, UAE增高(>30 mg/24 h)者22例。
, 百拇医药
1.2 NO检测
NO化学性质活泼, 与分子氧反应转化为NO-3和NO-2, NO在血清中形成的NO-2亦会很快转变为NO-3(1 h内>95%)[1]。 因此血清NO-3可作为NO生成的良好指标。 血清NO-3浓度检测采用本院全军普通外科研究所建立的硝酸还原酶法[2]。
1.3 24 h尿白蛋白检测
采用改良火箭免疫电泳法, 正常值为<16 mg/24 h。
1.4 统计方法
, http://www.100md.com
结果用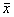 ±s表示, 应用t检验作显著性分析。
±s表示, 应用t检验作显著性分析。
2 结 果
糖尿病组和对照组血清NO含量的检测结果列于表1。 结果显示, 糖尿病患者血清NO浓度显著高于对照组(P<0.01)。
表 1 糖尿病组和对照组的NO检测结果(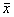 ±s)
±s)
组 别
n
, 百拇医药
NO(μmol/L)
对照组
32
82.9±17.7
糖尿病组
53
131.6±49.41)
注: 1) 二组比较: P<0.01 DMⅠ组和DMⅡ组的NO浓度检测结果见表2。DMⅡ组血清NO浓度明显高于DMⅠ组(P<0.01)。
表 2 DH Ⅰ组和DM Ⅱ组的NO检测结果(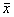 ±s)
±s)
, http://www.100md.com
组 别
n
NO(μmol/L)
DM Ⅰ组
25
106.5±29.4
DM Ⅱ组
28
154.1±52.81)
注: 1) 二组比较: P<0.01
表3显示了UAE正常组与UAE增高组的NO水平, 结果显示UAE增高时血清NO浓度高于UAE正常组(P<0.05), 提示了糖尿病肾病时的高NO产生状态。
, 百拇医药
表 3 UAE正常组和UAE增高组的NO检测结果(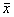 ±s)
±s)
组 别
n
NO(μmol/L)
UAE正常组
31
115.4±34.4
UAE增高组
22
154.5±57.61)
, http://www.100md.com
注: 1) 二组比较: P<0.05
3 讨 论
糖尿病时血清NO的变化文献报道不一。 多数研究认为, 胰岛素依赖型糖尿病(IDDM)发病过程中NO生成增加, 主要是由于激活的巨噬细胞合成的NO增加, T细胞和中性粒细胞亦可生成NO, 并共同发挥作用。 最近研究认为, 由非特异性免疫反应产生的干扰素-α(INF-α)、 干扰素-γ(INF-γ)和肿瘤坏死因子-α(TNF-α)等细胞因子协同作用能通过诱导胰岛β细胞一氧化氮合成酶(NOS)的mRNA表达来增加NO产生, 进而抑制葡萄糖诱导的胰岛素释放, 结果引起胰岛β细胞DNA链断裂, 使胰岛细胞发生凋亡。 而在NIDDM时由于血管内皮衍生NO的能力减弱, 使NO的释放和活性减少, 并使NO介导的血管扩张作用受损[3], 主要机制为: (1) 内皮合成NO减少; (2) 氧自由基和高级糖基化终末产物使NO灭活增加; (3) 血管平滑肌水平的NO-鸟苷酸环化酶通路的反应降低, 血管收缩物质释放增加, 抵消了NO的血管扩张作用。
, http://www.100md.com
本研究观察到, NIDDM患者血清NO明显高于对照组, 有微血管病变的患者NO水平显著高于无微血管病变者, 其机理值得探讨。 Wascher等发现将猪主动脉内皮细胞暴露于超生理浓度的D-葡萄糖中, 可增强由自体效应物质(autocoid)引起的NO合成, 而且这种变化依赖于血糖增高程度, 当血糖下降时以上变化可得到改善, 提示D-葡萄糖对于血管张力有调节作用, 这种作用是基于内皮细胞内游离钙离子浓度的升高。 高浓度的D-葡萄糖促使细胞中三磷酸肌醇生成增加, 引起内质网的钙耗竭, 导致长时间钙离子内流信号增加, 并使内质网钙离子耗竭与钙离子可渗透性质膜通路间信号转录作用直接放大, 加强了内皮细胞的NO合成。
糖尿病时高NO水平对机体是有害的, 目前已用于糖尿病微血管病变发病机理的评价。 近来关于NO代谢途径和糖尿病性肾病之间的关系, Maree[1]等报道用链脲佐菌素(STZ)引起的糖尿病鼠有高NO产生状态同时肌酐清除率增高, 而对照组和单纯饮用高糖组的肌酐清除率无变化; 并且正常鼠补充L-精氨酸(NO的底物), 可使肌酐清除率和GFR明显增高, 而投入NOs抑制剂(NOsi)后其肌酐清除率下降, GFR亦下降, 更证实了高NO和高GFR的关系。 本研究也观察到类似现象, 在糖尿病肾病患者UAE增高时亦伴有高水平的NO, UAE增高患者血清NO浓度高于UAE正常者。 Bank等[5]检测了糖尿病时肾脏NO-2+NO-3(反应NO生成的良好指标)的产生较正常肾脏高6倍以上。 这些主要来源于肾脏的高NO引起肾小球高滤过时对入球小动脉的扩张比对出球小动脉的扩张更明显, 使GFR增高、 蛋白尿增加。
, 百拇医药
已发现实验性糖尿病神经病变时神经血流明显减少, 并认为高血糖可使NOs活性受抑制, 从而引起NO降低和内皮素效应增强, 使神经外膜小动脉的血管反应性紊乱, 补充L-精氨酸可使神经血流改善, 提示NO是神经微血管系统内主要的血管扩张物质[6]。 另外, 脑血管内皮和脑血管外膜内自主神经释放的NO调节着大脑的血流量。 本组有神经病变的患者NO明显增高, 机理并不清楚。 但是过量NO的产生则具有神经毒性。 可能是由于: (1) 谷氨酸产生过量引起谷氨酸受体过度兴奋, 导致N-甲基-D-天门冬酸(NMDA)受体激活, 细胞外钙离子进入神经元内, 激活脑NOs(存在于中枢神经和周围神经内)而产生大量NO, 破坏其DNA并相继地激活ADP-核糖合成酶, 从而耗尽这些神经元内的能量储存, 使这些神经元死亡[7]; (2) NO与氧分子反应所形成的过氧亚硝酸(Peroxynitrite)可能杀伤神经元, 实验也表明了剔除了NOs的神经元对NMDA毒性的抵抗性增强。
综上所述, NO具有二重量效作用, 在正常情况下起生理调节、 参与信息传递作用; 当生成量过剩、 含量过多时, 主要是细胞毒作用, 对各种组织和细胞起无选择性的损害, 认识到这一点对临床工作是有益的。
, http://www.100md.com
参考文献
[1] Moshage H, Kok B, Huizenga JR, et al. Nitrite and Nitrate determinations in plasma: A critical evaluation. Clin Chem, 1995, 41:892.
[2] 汪义军,全竹富,吴性江,等.腹部外科患者血清一氧化氮测定及其临床意义. 江苏医药, 1997, 23:533.
[3] Williams SB, Cusco JA, Roddy MA, et al. Impaired nitric oxide-mediated vasodialation in patients with non-insulin dependent diabetes millitus. J Am Coll Cardiol, 1996, 27:567.
, 百拇医药
[4] Maree A, Peer G, Iaina A, et al. Nitric oxide in streptozotocin-indueed diabetes mellitus in rats. Clin Science, 1996, 90:379.
[5] Bank N, Aynedjian HS. Role of EDRF(nitric oxide) in diabetic renal hyperfitration. Kidney Int, 1993, 43:1 306.
[6] Kihara M, Low PA. Impaired vasoreactivity to nitric oxide in experimental diabetic neuropathy. Exp Neurol, 1995, 132:180~185.
[7] Danson TM. ADP-ribosylation as a mechanism for the action of nitric oxide in the nervous system. New Horizons, 1995, 3:86.
本文1998-06-04收到, 1998-10-18修回, 1998-12-14接受, 百拇医药(王燕燕* 汪义军* 王 晓* 王扬天* 黄 晟* 陈光辉*)
单位:* 中国人民解放军南京军区总医院内分泌科, 邮政编码 南京210002
关键词:糖尿病;一氧化氮;微血管病变
目的
目的: 研究糖尿病时一氧化氮(NO)的变化及其与肾脏病变和神经病变的关系。 方法: 采用硝酸还原酶法对53例Ⅱ型糖尿病和32例对照组的血清NO水平进行了检测。 结果: 糖尿病患者血清NO浓度显著高于对照组(P<0.01); 有微血管病变(有肾脏病变和/或神经病变)组的血清NO明显高于无微血管病变组(P<0.01); 尿蛋白排泄(UAE)增高组血清NO高于UAE正常组(P<0.05)。 结论: 糖尿病时血清NO浓度增高; 高NO水平引起肾小球高滤过的同时对肾小球入球小动脉的扩张比对出球小动脉的扩张更明显, 可使肾小球滤过率增加, 蛋白尿排出增加; 过量NO的产生具有神经毒性, 可耗竭神经元内的能量储存, 使神经元死亡。 以上结果均参与糖尿病肾病和神经病变的发生。
, http://www.100md.com
一氧化氮(NO)是一种新型的生物信息传递体, 在维持机体微循环内环境恒定和保护机体非特异性免疫功能上起重要作用。 近来研究表明, NO与糖尿病及其微血管病变有一定内有联系, 但国内类似报道少见。 故本文对糖尿病时NO的变化及其与神经病变和肾脏病变的关系进行了探讨。
1 资料和方法
1.1 临床资料
对照组: 无糖尿病及慢性心、 肺、 肝、 肾病史, 血压、 血脂正常的本院健康工作人员32例(男15例、 女17例), 年龄19~59岁。
糖尿病组: 非胰岛素依赖性糖尿病(NIDDM)患者53例(男30例、 女23例), 年龄23~77岁, 平均55±13岁。 病程0.5~20年。 其中用胰岛素治疗24例, 口服降糖药治疗29例。 按有无微血管病变又分为二组: (1) DMⅠ组即无微血管病变组: 共25例(男16例、 女9例), 平均年龄为55±12岁, 平均病程5.5±4.2年, 空腹血糖9.1±3.6 mmol/L。 (2) DMⅡ组即有微血管病变组: 共28例(男女各14例), 平均年龄为56±14岁, 平均病程6.9±5.2年, 空腹血糖10.8±4.3 mmol/L。 均经临床病史、 体格检查及神经系统检查, 24 h尿白蛋白检测证实有糖尿病性肾病或神经病变(有并存)。 其中尿白蛋白排泄值(UAE)正常(<30 mg/24 h)者31例, UAE增高(>30 mg/24 h)者22例。
, 百拇医药
1.2 NO检测
NO化学性质活泼, 与分子氧反应转化为NO-3和NO-2, NO在血清中形成的NO-2亦会很快转变为NO-3(1 h内>95%)[1]。 因此血清NO-3可作为NO生成的良好指标。 血清NO-3浓度检测采用本院全军普通外科研究所建立的硝酸还原酶法[2]。
1.3 24 h尿白蛋白检测
采用改良火箭免疫电泳法, 正常值为<16 mg/24 h。
1.4 统计方法
, http://www.100md.com
结果用
2 结 果
糖尿病组和对照组血清NO含量的检测结果列于表1。 结果显示, 糖尿病患者血清NO浓度显著高于对照组(P<0.01)。
表 1 糖尿病组和对照组的NO检测结果(
组 别
n
, 百拇医药
NO(μmol/L)
对照组
32
82.9±17.7
糖尿病组
53
131.6±49.41)
注: 1) 二组比较: P<0.01 DMⅠ组和DMⅡ组的NO浓度检测结果见表2。DMⅡ组血清NO浓度明显高于DMⅠ组(P<0.01)。
表 2 DH Ⅰ组和DM Ⅱ组的NO检测结果(
, http://www.100md.com
组 别
n
NO(μmol/L)
DM Ⅰ组
25
106.5±29.4
DM Ⅱ组
28
154.1±52.81)
注: 1) 二组比较: P<0.01
表3显示了UAE正常组与UAE增高组的NO水平, 结果显示UAE增高时血清NO浓度高于UAE正常组(P<0.05), 提示了糖尿病肾病时的高NO产生状态。
, 百拇医药
表 3 UAE正常组和UAE增高组的NO检测结果(
组 别
n
NO(μmol/L)
UAE正常组
31
115.4±34.4
UAE增高组
22
154.5±57.61)
, http://www.100md.com
注: 1) 二组比较: P<0.05
3 讨 论
糖尿病时血清NO的变化文献报道不一。 多数研究认为, 胰岛素依赖型糖尿病(IDDM)发病过程中NO生成增加, 主要是由于激活的巨噬细胞合成的NO增加, T细胞和中性粒细胞亦可生成NO, 并共同发挥作用。 最近研究认为, 由非特异性免疫反应产生的干扰素-α(INF-α)、 干扰素-γ(INF-γ)和肿瘤坏死因子-α(TNF-α)等细胞因子协同作用能通过诱导胰岛β细胞一氧化氮合成酶(NOS)的mRNA表达来增加NO产生, 进而抑制葡萄糖诱导的胰岛素释放, 结果引起胰岛β细胞DNA链断裂, 使胰岛细胞发生凋亡。 而在NIDDM时由于血管内皮衍生NO的能力减弱, 使NO的释放和活性减少, 并使NO介导的血管扩张作用受损[3], 主要机制为: (1) 内皮合成NO减少; (2) 氧自由基和高级糖基化终末产物使NO灭活增加; (3) 血管平滑肌水平的NO-鸟苷酸环化酶通路的反应降低, 血管收缩物质释放增加, 抵消了NO的血管扩张作用。
, http://www.100md.com
本研究观察到, NIDDM患者血清NO明显高于对照组, 有微血管病变的患者NO水平显著高于无微血管病变者, 其机理值得探讨。 Wascher等发现将猪主动脉内皮细胞暴露于超生理浓度的D-葡萄糖中, 可增强由自体效应物质(autocoid)引起的NO合成, 而且这种变化依赖于血糖增高程度, 当血糖下降时以上变化可得到改善, 提示D-葡萄糖对于血管张力有调节作用, 这种作用是基于内皮细胞内游离钙离子浓度的升高。 高浓度的D-葡萄糖促使细胞中三磷酸肌醇生成增加, 引起内质网的钙耗竭, 导致长时间钙离子内流信号增加, 并使内质网钙离子耗竭与钙离子可渗透性质膜通路间信号转录作用直接放大, 加强了内皮细胞的NO合成。
糖尿病时高NO水平对机体是有害的, 目前已用于糖尿病微血管病变发病机理的评价。 近来关于NO代谢途径和糖尿病性肾病之间的关系, Maree[1]等报道用链脲佐菌素(STZ)引起的糖尿病鼠有高NO产生状态同时肌酐清除率增高, 而对照组和单纯饮用高糖组的肌酐清除率无变化; 并且正常鼠补充L-精氨酸(NO的底物), 可使肌酐清除率和GFR明显增高, 而投入NOs抑制剂(NOsi)后其肌酐清除率下降, GFR亦下降, 更证实了高NO和高GFR的关系。 本研究也观察到类似现象, 在糖尿病肾病患者UAE增高时亦伴有高水平的NO, UAE增高患者血清NO浓度高于UAE正常者。 Bank等[5]检测了糖尿病时肾脏NO-2+NO-3(反应NO生成的良好指标)的产生较正常肾脏高6倍以上。 这些主要来源于肾脏的高NO引起肾小球高滤过时对入球小动脉的扩张比对出球小动脉的扩张更明显, 使GFR增高、 蛋白尿增加。
, 百拇医药
已发现实验性糖尿病神经病变时神经血流明显减少, 并认为高血糖可使NOs活性受抑制, 从而引起NO降低和内皮素效应增强, 使神经外膜小动脉的血管反应性紊乱, 补充L-精氨酸可使神经血流改善, 提示NO是神经微血管系统内主要的血管扩张物质[6]。 另外, 脑血管内皮和脑血管外膜内自主神经释放的NO调节着大脑的血流量。 本组有神经病变的患者NO明显增高, 机理并不清楚。 但是过量NO的产生则具有神经毒性。 可能是由于: (1) 谷氨酸产生过量引起谷氨酸受体过度兴奋, 导致N-甲基-D-天门冬酸(NMDA)受体激活, 细胞外钙离子进入神经元内, 激活脑NOs(存在于中枢神经和周围神经内)而产生大量NO, 破坏其DNA并相继地激活ADP-核糖合成酶, 从而耗尽这些神经元内的能量储存, 使这些神经元死亡[7]; (2) NO与氧分子反应所形成的过氧亚硝酸(Peroxynitrite)可能杀伤神经元, 实验也表明了剔除了NOs的神经元对NMDA毒性的抵抗性增强。
综上所述, NO具有二重量效作用, 在正常情况下起生理调节、 参与信息传递作用; 当生成量过剩、 含量过多时, 主要是细胞毒作用, 对各种组织和细胞起无选择性的损害, 认识到这一点对临床工作是有益的。
, http://www.100md.com
参考文献
[1] Moshage H, Kok B, Huizenga JR, et al. Nitrite and Nitrate determinations in plasma: A critical evaluation. Clin Chem, 1995, 41:892.
[2] 汪义军,全竹富,吴性江,等.腹部外科患者血清一氧化氮测定及其临床意义. 江苏医药, 1997, 23:533.
[3] Williams SB, Cusco JA, Roddy MA, et al. Impaired nitric oxide-mediated vasodialation in patients with non-insulin dependent diabetes millitus. J Am Coll Cardiol, 1996, 27:567.
, 百拇医药
[4] Maree A, Peer G, Iaina A, et al. Nitric oxide in streptozotocin-indueed diabetes mellitus in rats. Clin Science, 1996, 90:379.
[5] Bank N, Aynedjian HS. Role of EDRF(nitric oxide) in diabetic renal hyperfitration. Kidney Int, 1993, 43:1 306.
[6] Kihara M, Low PA. Impaired vasoreactivity to nitric oxide in experimental diabetic neuropathy. Exp Neurol, 1995, 132:180~185.
[7] Danson TM. ADP-ribosylation as a mechanism for the action of nitric oxide in the nervous system. New Horizons, 1995, 3:86.
本文1998-06-04收到, 1998-10-18修回, 1998-12-14接受, 百拇医药(王燕燕* 汪义军* 王 晓* 王扬天* 黄 晟* 陈光辉*)