门脉高压症患者胃粘膜微循环障碍与血清中TNF、 ET浓度变化的相关性
作者:胡虞乾 杨 镇 阮幼冰 裘法祖
单位:胡虞乾 杨 镇 裘法祖同济医科大学附属同济医院普外科, 邮政编码 武汉430030; 阮幼冰 同济医科大学超微病理研究室
关键词:门脉高压;胃粘膜;微循环;内皮素;肿瘤坏死因子
微循环学杂志990107
目的: 研究门脉高压性胃粘膜病变(PHG)的实质及其与血清中TNF、 ET的浓度变化的关系。 方法: 对30例门脉高压性胃粘膜病变患者和15例门脉高压症非胃粘膜病变(NPHG)患者的胃粘膜进行光镜、 透射电镜观察, 同时应用放免法检测二组血清中TNF、 ET的浓度。 结果: 门脉高压时胃粘膜微循环障碍是PHG形成的实质; 门脉高压病患者血清中TNF、 ET的浓度变化与PHG的发生、 发展呈正相关; 比较二组血清中TNF、 ET浓度差异有显著性(P<0.01)。 结论: 门脉高压时胃粘膜微循环变化包括有细胞机制和免疫反应二个方面的参与。
, 百拇医药
门脉高压性胃粘膜病变(portal hypertensive gastropathy, PHG)与一般胃炎不同, 其主要是继发于胃壁血管病变。 胃作为机体处于高动力循环状态的器官之一, 多数认为PHG患者胃粘膜血流增加, PHG由充血所致[1,2]。 但少数学者发现PHG患者胃粘膜血流量减少, PHG由瘀血所致[3]。 PHG的发生是多因素的, 互为因果, 但主要是胃粘膜防御机能的降低。 门脉高压时胃微循环障碍对PHG的形成有密切的关系。 已有研究表明, 肿瘤坏死因子(tumor necrosis factor, TNF)、 内皮素(endothelins, ET)等多种血管活性物质参加或介导了肝硬化血液动力学改变[4]。 本研究旨在探讨门脉高压性胃粘膜病变的实质及其与外周血中TNF、 ET的关系。
1 资料和方法
1.1 标本来源
, 百拇医药
45例患者随机取自1997年10月~1998年5月间在我院内窥镜室受检的病人。 实验分组: PHG组即Ⅰ组: 又分轻型组(Ⅰa)、 重型组(Ⅰb); 门脉高压症非胃粘膜病变组(NPHG)为Ⅱ组, 即对照组。 各组样本数均为15例。 且性别、 年龄、 社会因素等构成均相似。 取材方法: 均在电子胃镜(Olympus XQ230型)直视下取胃窦、 胃底、 胃体各一块大小约相等的组织标本, 分别按要求处理后供光镜和透射电镜观察。 外周血的抽取: 均在用药治疗前清晨空腹一次性抽取肘静脉血2 ml置于含10% EDTA-2 Na 30 μl和抑肽酶40 μl的试管中, 混匀后4 ℃、 3 000 r/min, 离心10 min, 分离血浆置入-20 ℃冰箱保存待测。
1.2 组织标品制备及观察
切取活检的胃粘膜约1 mm3大小, 用2.5%戊二醛作前固定2 h, 再以1%锇酸在4 ℃作后固定2 h, 然后用递增浓度的酒精和丙酮脱水, Epon 812包埋, 制成超薄切片, 铅铀双染, OPTON EM 10C型透射电镜观察。 同样取材作病理组织学检查: 10%福尔马林固定, 制成石蜡切片, HE染色, 光镜观察。
, 百拇医药
1.3 试剂来源及检测
ET、 TNF放免药盒由北京东亚免疫技术研究所提供。 由本院同位素室采用放射免疫法协作完成。
1.4 PHG的内镜下诊断标准
轻型PHG内镜表现: (1) 细微粉红样斑点或猩红热样疹; (2) 粘膜皱襞表面条索状发红; (3) mosaic病变, 即指红色或粉红色水肿粘膜上出现白网状间隙, 类似蛇皮状。 重型PHG内镜表现: (1) 樱桃红样斑点, 常发生在蛇皮样改变的粘膜岛上; (2) 弥漫性出血性病变。 上述病变以胃体、 胃底部多见。
1.5 统计学处理
检测结果以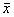 ±s表示, 组间比较采用t检验, 相关关系采用直线相关分析。
±s表示, 组间比较采用t检验, 相关关系采用直线相关分析。
, 百拇医药
2 结 果
PHG组织学表现, 通过典型病例观察, 光镜下HE染色表现为不同程度的粘膜及粘膜下血管扩张、 迂曲, 内膜呈局灶性增厚, 很少伴有炎症细胞浸润, 即使有程度也较轻, 可见粘膜毛细血管弥漫性扩张、 粘膜水肿、 红细胞渗出等。 透射电镜观察发现: 胃底与胃体部病变明显, 表现为胃粘膜毛细血管显著扩张, 不同程度的瘀血, 血管内皮小孔扩大, 与基底膜连接不紧密, 重型者可见红细胞从内皮损处外溢。 内膜呈局灶性增厚, 血管外周伴有大量的肥大细胞浸润, 很少见到中性粒细胞、 浆细胞浸润, 胞质内有较多的液性小泡, 血管周边可见大量的纤维母细胞及其崩解产物。 粘膜水肿、 粘膜上皮细胞间隙极度增宽, 细胞相互间仅靠部分细胞连接保持接触。
外周血中TNF、 ET的测定结果(见附表)显示Ⅰa、 Ⅰb与对照组比较, P<0.001, 其差异有极显著性, 且Ⅰa与Ⅰb比较, P<0.05, 其差异有显著性, 且TNF、 ET在Ⅱ、 Ⅰa、 Ⅰb三组中浓度变化与病变不同程度表现出显著的正相关(r=0.87)。
, 百拇医药
附表 外周血浆中TNF、 ET的放免测定结果(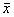 ±s) 分 组
±s) 分 组
n
TNF(ng/ml)
ET(ng/ml)
Ⅱ
15
1.30±0.03
29.26±1.35
Ⅰa
15
1.40±0.141)
, 百拇医药
34.23±1.801)
Ⅰb
15
1.54±0.131)2)
49.25±2.081)2)
注: 1) 与Ⅱ(对照)组比较: P<0.001; 2) 与Ⅰa组比较: P<0.05
3 讨 论
PHG发生与其特征性病理改变有关, 但确切机制仍不明。 但有一点可以肯定: PHG是门脉高压(PH)导致的胃粘膜病变, 而这种粘膜病变继发于胃壁血管的损伤而非炎症。 重度PHG是PH上消化道出血的重要原因, 可表现为慢性隐匿性出血和缺铁性贫血或突然大量呕血和黑便, PHG出血的意义可等同于食道曲张静脉破裂出血[5]。
, 百拇医药
本实验发现, PHG组织学特征为粘膜下血管扩张迂曲、 内膜增厚, 粘膜毛细血管弥漫性扩张, 红细胞渗出, 粘膜水肿等, 不伴或很少伴有炎症。 这可能与门静脉高压时胃静脉回流受阻, 引起粘膜水肿和微循环血流减少、 粘膜屏障受损有关。 所以根本性治疗在于降低门静脉压力, 疏通胃静脉血流, 改善胃粘膜的微循环。 有作者提出, 临床上处理具体病例时, 术前应常规作内窥镜检查, 明确食管静脉曲张与PHG的病变程度, 分析二者的临床重要性, 然后作出治疗选择[6]。
本实验通过对外周血中血管活性物质TNF、 ET的测定, 发现二者与PHG有正相关性, 对PHG的产生与发展起一定的作用。 表明TNF对肝硬化门脉高压的高动力循环起重要作用。 TNF的作用机制可能与下列因素有关: (1) 通过激活一氧化氮(NO)诱导途径发挥作用; (2) 通过促进原生型的NO合酶协同因子的合成, 增加原生型NO合酶(cNOs)的活性; (3) 通过NO依赖机制调节血管反应; (4) 通过激活平滑肌细胞的K+通道, 再通过内毒素激活对K+通道敏感的ATP而致血压下降。
, 百拇医药
另外, 关于ET升高的机制, 则可能与ET代谢酶减少, 肝脾及外周血管合成ET增加以及低氧血症、 内毒素血症等诸多因素有关。 ET是一种强烈的缩血管物质, 能增加门静脉压力、 损伤肝细胞。 提示它对门脉高压的血液动力学改变起一定作用。
PH是发生PHG的先决条件, 所有PHG病人均有较高的门脉压, 以往的研究提示, 决定PHG发生和发展可能是PH的持续时间。 门脉高压时, 胃血流量可增加80%~100%, 粘膜下存在大量的动脉静短路, 使胃粘膜血流显著减少, 从而削弱了粘膜细胞的保护作用。 另外, PH时胃静脉血流受阻, 毛细血管静压力增高, 通透性增强, 粘膜下水肿, 氧和营养物质的摄取与排泄代谢产物发生障碍, 使粘膜屏障受到破坏。 总之, 肝硬化时, 由于血管活性物质的作用, 导致门脉压力进一步增高, 必定加重胃粘膜的微循环障碍, 这可能是PHG的发病机制之一。
杨镇等曾提出了“门脉静高压性血管病变”的概念[7], 其研究证明, 肝硬变时除了肝脏结构破坏、 功能受损、 门静脉系统血流动力学紊乱外, 还伴有门静脉系统血管壁的病理性改变。 它是肝硬变所诱导的, 属于门静脉高压症病理变化的一部分。 当血管性病变逐渐形成后, 它又可能促进门静脉高压的形成与发展。 即门静脉高压性血管病变的发生机制也是PHG发生机制的补充。
, http://www.100md.com
参考文献
[1] Panes J, Bordas JM, Pique JM, et al. Increased gastric mucosal perfusion in cirrhotic patients with portal hypertensive gastropathy. Gastroenterology, 1992, 103(6):1 875~1 882.
[2] Ohta M, Hashizume M, Higashi H, et al. Portal and gastric mucosal hemodynamics in cirrhotic patients with portal hypertensive gastropathy. Hepatology, 1994, 20(6):1 432~1436.
[3] Iwao T, Toyonaga A, Ikegami M, et al. Reduced gastric mucosal blood flow in patients with portal hypertensive gastropathy. Hepatology, 1993, 18(1):36~40.
, http://www.100md.com
[4] 黄颖秋, 莫剑忠, 张德中. 血管活性物质中与肝硬化血液动力学改变. 国外医学内科学分册, 1997, 24(2):55~58.
[5] Smart HL, Triger DR. Clinical pathophysiology and relevance of portel hypertensive gastropathy. Endoscopy, 1991, 23:224.
[6] 许瑞云, 凌云彪, 邱万春, 等. 断流术与分流术对门静脉高压性胃病的不同影响. 中华外科杂志, 1997, 35(9):515~517.
[7] 杨 镇, 刘仁哲, 杨榕光, 等. 肝硬变患者胃冠状静脉内膜、 细胞外基质和平滑肌的变化. 中华外科杂志, 1996, 34(3):138~140.
本文1998-09-20收到, 1998-11-24接受, 百拇医药
单位:胡虞乾 杨 镇 裘法祖同济医科大学附属同济医院普外科, 邮政编码 武汉430030; 阮幼冰 同济医科大学超微病理研究室
关键词:门脉高压;胃粘膜;微循环;内皮素;肿瘤坏死因子
微循环学杂志990107
目的: 研究门脉高压性胃粘膜病变(PHG)的实质及其与血清中TNF、 ET的浓度变化的关系。 方法: 对30例门脉高压性胃粘膜病变患者和15例门脉高压症非胃粘膜病变(NPHG)患者的胃粘膜进行光镜、 透射电镜观察, 同时应用放免法检测二组血清中TNF、 ET的浓度。 结果: 门脉高压时胃粘膜微循环障碍是PHG形成的实质; 门脉高压病患者血清中TNF、 ET的浓度变化与PHG的发生、 发展呈正相关; 比较二组血清中TNF、 ET浓度差异有显著性(P<0.01)。 结论: 门脉高压时胃粘膜微循环变化包括有细胞机制和免疫反应二个方面的参与。
, 百拇医药
门脉高压性胃粘膜病变(portal hypertensive gastropathy, PHG)与一般胃炎不同, 其主要是继发于胃壁血管病变。 胃作为机体处于高动力循环状态的器官之一, 多数认为PHG患者胃粘膜血流增加, PHG由充血所致[1,2]。 但少数学者发现PHG患者胃粘膜血流量减少, PHG由瘀血所致[3]。 PHG的发生是多因素的, 互为因果, 但主要是胃粘膜防御机能的降低。 门脉高压时胃微循环障碍对PHG的形成有密切的关系。 已有研究表明, 肿瘤坏死因子(tumor necrosis factor, TNF)、 内皮素(endothelins, ET)等多种血管活性物质参加或介导了肝硬化血液动力学改变[4]。 本研究旨在探讨门脉高压性胃粘膜病变的实质及其与外周血中TNF、 ET的关系。
1 资料和方法
1.1 标本来源
, 百拇医药
45例患者随机取自1997年10月~1998年5月间在我院内窥镜室受检的病人。 实验分组: PHG组即Ⅰ组: 又分轻型组(Ⅰa)、 重型组(Ⅰb); 门脉高压症非胃粘膜病变组(NPHG)为Ⅱ组, 即对照组。 各组样本数均为15例。 且性别、 年龄、 社会因素等构成均相似。 取材方法: 均在电子胃镜(Olympus XQ230型)直视下取胃窦、 胃底、 胃体各一块大小约相等的组织标本, 分别按要求处理后供光镜和透射电镜观察。 外周血的抽取: 均在用药治疗前清晨空腹一次性抽取肘静脉血2 ml置于含10% EDTA-2 Na 30 μl和抑肽酶40 μl的试管中, 混匀后4 ℃、 3 000 r/min, 离心10 min, 分离血浆置入-20 ℃冰箱保存待测。
1.2 组织标品制备及观察
切取活检的胃粘膜约1 mm3大小, 用2.5%戊二醛作前固定2 h, 再以1%锇酸在4 ℃作后固定2 h, 然后用递增浓度的酒精和丙酮脱水, Epon 812包埋, 制成超薄切片, 铅铀双染, OPTON EM 10C型透射电镜观察。 同样取材作病理组织学检查: 10%福尔马林固定, 制成石蜡切片, HE染色, 光镜观察。
, 百拇医药
1.3 试剂来源及检测
ET、 TNF放免药盒由北京东亚免疫技术研究所提供。 由本院同位素室采用放射免疫法协作完成。
1.4 PHG的内镜下诊断标准
轻型PHG内镜表现: (1) 细微粉红样斑点或猩红热样疹; (2) 粘膜皱襞表面条索状发红; (3) mosaic病变, 即指红色或粉红色水肿粘膜上出现白网状间隙, 类似蛇皮状。 重型PHG内镜表现: (1) 樱桃红样斑点, 常发生在蛇皮样改变的粘膜岛上; (2) 弥漫性出血性病变。 上述病变以胃体、 胃底部多见。
1.5 统计学处理
检测结果以
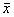 ±s表示, 组间比较采用t检验, 相关关系采用直线相关分析。
±s表示, 组间比较采用t检验, 相关关系采用直线相关分析。, 百拇医药
2 结 果
PHG组织学表现, 通过典型病例观察, 光镜下HE染色表现为不同程度的粘膜及粘膜下血管扩张、 迂曲, 内膜呈局灶性增厚, 很少伴有炎症细胞浸润, 即使有程度也较轻, 可见粘膜毛细血管弥漫性扩张、 粘膜水肿、 红细胞渗出等。 透射电镜观察发现: 胃底与胃体部病变明显, 表现为胃粘膜毛细血管显著扩张, 不同程度的瘀血, 血管内皮小孔扩大, 与基底膜连接不紧密, 重型者可见红细胞从内皮损处外溢。 内膜呈局灶性增厚, 血管外周伴有大量的肥大细胞浸润, 很少见到中性粒细胞、 浆细胞浸润, 胞质内有较多的液性小泡, 血管周边可见大量的纤维母细胞及其崩解产物。 粘膜水肿、 粘膜上皮细胞间隙极度增宽, 细胞相互间仅靠部分细胞连接保持接触。
外周血中TNF、 ET的测定结果(见附表)显示Ⅰa、 Ⅰb与对照组比较, P<0.001, 其差异有极显著性, 且Ⅰa与Ⅰb比较, P<0.05, 其差异有显著性, 且TNF、 ET在Ⅱ、 Ⅰa、 Ⅰb三组中浓度变化与病变不同程度表现出显著的正相关(r=0.87)。
, 百拇医药
附表 外周血浆中TNF、 ET的放免测定结果(
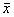 ±s) 分 组
±s) 分 组n
TNF(ng/ml)
ET(ng/ml)
Ⅱ
15
1.30±0.03
29.26±1.35
Ⅰa
15
1.40±0.141)
, 百拇医药
34.23±1.801)
Ⅰb
15
1.54±0.131)2)
49.25±2.081)2)
注: 1) 与Ⅱ(对照)组比较: P<0.001; 2) 与Ⅰa组比较: P<0.05
3 讨 论
PHG发生与其特征性病理改变有关, 但确切机制仍不明。 但有一点可以肯定: PHG是门脉高压(PH)导致的胃粘膜病变, 而这种粘膜病变继发于胃壁血管的损伤而非炎症。 重度PHG是PH上消化道出血的重要原因, 可表现为慢性隐匿性出血和缺铁性贫血或突然大量呕血和黑便, PHG出血的意义可等同于食道曲张静脉破裂出血[5]。
, 百拇医药
本实验发现, PHG组织学特征为粘膜下血管扩张迂曲、 内膜增厚, 粘膜毛细血管弥漫性扩张, 红细胞渗出, 粘膜水肿等, 不伴或很少伴有炎症。 这可能与门静脉高压时胃静脉回流受阻, 引起粘膜水肿和微循环血流减少、 粘膜屏障受损有关。 所以根本性治疗在于降低门静脉压力, 疏通胃静脉血流, 改善胃粘膜的微循环。 有作者提出, 临床上处理具体病例时, 术前应常规作内窥镜检查, 明确食管静脉曲张与PHG的病变程度, 分析二者的临床重要性, 然后作出治疗选择[6]。
本实验通过对外周血中血管活性物质TNF、 ET的测定, 发现二者与PHG有正相关性, 对PHG的产生与发展起一定的作用。 表明TNF对肝硬化门脉高压的高动力循环起重要作用。 TNF的作用机制可能与下列因素有关: (1) 通过激活一氧化氮(NO)诱导途径发挥作用; (2) 通过促进原生型的NO合酶协同因子的合成, 增加原生型NO合酶(cNOs)的活性; (3) 通过NO依赖机制调节血管反应; (4) 通过激活平滑肌细胞的K+通道, 再通过内毒素激活对K+通道敏感的ATP而致血压下降。
, 百拇医药
另外, 关于ET升高的机制, 则可能与ET代谢酶减少, 肝脾及外周血管合成ET增加以及低氧血症、 内毒素血症等诸多因素有关。 ET是一种强烈的缩血管物质, 能增加门静脉压力、 损伤肝细胞。 提示它对门脉高压的血液动力学改变起一定作用。
PH是发生PHG的先决条件, 所有PHG病人均有较高的门脉压, 以往的研究提示, 决定PHG发生和发展可能是PH的持续时间。 门脉高压时, 胃血流量可增加80%~100%, 粘膜下存在大量的动脉静短路, 使胃粘膜血流显著减少, 从而削弱了粘膜细胞的保护作用。 另外, PH时胃静脉血流受阻, 毛细血管静压力增高, 通透性增强, 粘膜下水肿, 氧和营养物质的摄取与排泄代谢产物发生障碍, 使粘膜屏障受到破坏。 总之, 肝硬化时, 由于血管活性物质的作用, 导致门脉压力进一步增高, 必定加重胃粘膜的微循环障碍, 这可能是PHG的发病机制之一。
杨镇等曾提出了“门脉静高压性血管病变”的概念[7], 其研究证明, 肝硬变时除了肝脏结构破坏、 功能受损、 门静脉系统血流动力学紊乱外, 还伴有门静脉系统血管壁的病理性改变。 它是肝硬变所诱导的, 属于门静脉高压症病理变化的一部分。 当血管性病变逐渐形成后, 它又可能促进门静脉高压的形成与发展。 即门静脉高压性血管病变的发生机制也是PHG发生机制的补充。
, http://www.100md.com
参考文献
[1] Panes J, Bordas JM, Pique JM, et al. Increased gastric mucosal perfusion in cirrhotic patients with portal hypertensive gastropathy. Gastroenterology, 1992, 103(6):1 875~1 882.
[2] Ohta M, Hashizume M, Higashi H, et al. Portal and gastric mucosal hemodynamics in cirrhotic patients with portal hypertensive gastropathy. Hepatology, 1994, 20(6):1 432~1436.
[3] Iwao T, Toyonaga A, Ikegami M, et al. Reduced gastric mucosal blood flow in patients with portal hypertensive gastropathy. Hepatology, 1993, 18(1):36~40.
, http://www.100md.com
[4] 黄颖秋, 莫剑忠, 张德中. 血管活性物质中与肝硬化血液动力学改变. 国外医学内科学分册, 1997, 24(2):55~58.
[5] Smart HL, Triger DR. Clinical pathophysiology and relevance of portel hypertensive gastropathy. Endoscopy, 1991, 23:224.
[6] 许瑞云, 凌云彪, 邱万春, 等. 断流术与分流术对门静脉高压性胃病的不同影响. 中华外科杂志, 1997, 35(9):515~517.
[7] 杨 镇, 刘仁哲, 杨榕光, 等. 肝硬变患者胃冠状静脉内膜、 细胞外基质和平滑肌的变化. 中华外科杂志, 1996, 34(3):138~140.
本文1998-09-20收到, 1998-11-24接受, 百拇医药