低温体外循环致血管内皮损伤的临床研究
作者:陈劲进 肖颖彬 王学锋 陈林
单位:陈劲进(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);肖颖彬(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);王学锋(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);陈林(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37)
关键词:体外循环;循环内皮细胞;血管性假血友病因子;肿瘤坏死因子α
微循环学杂志000204 目的: 探讨低温体外循环对血管内皮细胞损伤及其可能机制。方法:用酶联免疫法测定20例先天性心脏病患者围术期血浆中血管性假血友病因子(vWF)及肿瘤坏死因子α(TNF-α)的浓度,同时对患者血中循环内皮细胞(CEC)进行计数及形态学观察。结果:转流后各时相点vWF水平及CEC数较体外循环前显著升高。体外循环期间TNF-α浓度明显升高(P<0.05),停体外循环后TNF-α浓度下降,停机后4 h浓度与转流前无明显差别。结论:体外循环可导致血管内皮细胞激活或损伤,细胞因子TNF-α可能参与体外循环致内皮细胞激活或损伤的过程。
, 百拇医药
Study of Endothelium Injury during Cardiac Operation with Hypothermic Extracorporeal Circulation
Chen Jinjin, Xiao Yingbin, Wang Xuefeng
(Xinqiao Hospital of Third Military Medical University of Chinese PLA, Chongqing 400037)
Objective: To investigate the mechanism of endothelium injury duing cardiac operation with hypothermic extracorporeal circulation. Method: Twenty children scheduled for cardiac operation with hypothermic extracorporeal circulation (ECC) were included in the study. Venous blood was sampled at six points perioperative. the von Willebrand Factor (vWF) and tumor necrosis factor α(TNF-α) levels in the blood were measured by an enzyme-linked immunosorbent assay method. Circulating enothelial cells (CEC) were counted on the time.Results: The level of vWF and CEC increased during ECC and was remained higher than the basic values on the morning of the first postoperative day. TNF-α level increased significantly during ECC and return to basic levels by 4 hours after the end of ECC.Conclusion: The results indicated endothelial cells were injured during pediatric cadiac operations with hypothermic ECC. TNF-α may play an important role in endothelial injury.
, 百拇医药
Key words:Extracorporeal circulation; Circulating endothelial cells; von Willebrand factor; Tumor necrosis factor α
内皮细胞激活或损伤及其防护研究引起人们越来越多的关注, 对体外循环中内皮细胞激活或损 伤国内的报道尚少。 血管性假血友病因子(von Willebrand Factor, vWF)主要由血管内皮 细胞合成和分泌, 血中vWF水平增高是内皮细胞激活或损伤的标志。 循环内皮细胞(circula ting endothelial cells, CEC)是体内直接而又比较敏感反应内皮细胞损伤的标志。 我们 观察体外循环围手术期血浆vWF水平、 血中CEC数以及肿瘤坏死因子α(tumor necrosis fac tor α, TNF-α)的变化, 探讨低温体外循环对血管内皮细胞的损伤作用及其可能机制。
1 资料与方法
, http://www.100md.com
1.1一般资料
实验选择20例先天性心房、 室间隔缺损患儿, 男8例、 女12例, 年龄3~5岁, 体重11~18 kg, 所有患儿均在低温体外循环下行房、 室间隔缺损修补术, 所有患者无死亡及残余漏。
1.2 检测方法
于肝素化后体外循环前、 转流10 min、 转流30 min、 开放主动脉5 min、 停机、 停机后 4 h及术后第1日晨7个时相点, 分离静脉血血浆贮于-22℃供测vWF浓度以及TNF-α浓度, 另 采集3 ml静脉血供CEC计数。 同时测量各时相点红细胞压积。 于第1、 3、 4、 5、 6、 7 共计六个时相点测定血浆中vWF浓度, 同时对患者血中CEC进行计数及形态学观察, 于第1、 2、 3、 4、 5、 6共计六个时相点测定血浆中TNF-α的浓度。
vWF浓度测定采用苏州医学院血栓与止血研究室的vWF酶标药盒, 在美国基因公司的V-max酶 标仪上进行测定。
, 百拇医药
CEC分离及计数采用percoll密度离心法[1], 在显微镜下计数, 单位: cell/0.9 μl, 其循环内皮细胞鉴定采用间接免疫荧光法标记Ⅷ-Ag。 CEC形态特征: 镜下见CEC 体积较大, 大多数为不规则多边形细胞, 核隐约可见或无细胞核。 vWF抗体标记后的细胞胞 浆中有棕褐色颗粒, 表示为CEC。
TNF-α测定采用双抗体夹心法。 取血200 μl, 加苯甲基氟磺酸(PMSF)至1 mmol/L, 于-22 ℃保存。 操作按试剂盒进行, 在V-max酶标仪上进行比色。 单位: ng/ml。
体外循环期间血液稀释对vWF浓度、 CEC数以及TNF-α浓度的影响用以下公式校正:
校正值=测定值×转流前红细胞压积/测定时红细胞压积
1.3 统计学处理
, http://www.100md.com
结果以均值±标准差(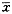 ±s)表示, 用数理统计程序包SPRM进行单因素方差分析 。
±s)表示, 用数理统计程序包SPRM进行单因素方差分析 。
2 结 果
2.1各时相点vWF浓度及CEC数
表 1 各时相点血液vWF浓度及CEC变 化(n=20,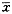 ±s) 指 标
±s) 指 标
转流前
转流
30 min
开 放
主动脉
, http://www.100md.com
5 min
停机
停机后
4 h
术后
第1天
vWF
(U/L)
0.22±
0.01
0.54±
0.021)
0.49±
, 百拇医药
0.021)
0. 60±
0.071)
1.12±
0.051)2)
1.38±
0.121)2)
CEC
(cell/0.9μl)
4.37±
0.81
, 百拇医药
11.8±
1.071)
12.94±
1.161)
13.95±
1.651)
11.50±
1.071)2)
12.54±
1.121)
注: 1) 与转流前比较: P<0.05; 2) 与转流30 min、 开放 主动脉5 min比较: P<0.05
, http://www.100md.com
表1显示, 体外循环期间各时相点vWF浓度较体外循环前均明显升高(P均<0.05) , 停机后4小时、 术后第1日晨vWF浓度较体外循环期间显著升高(P均<0.05)。
体外循环前病人的CEC数为4.37±0.81/0.9 μl, 体外循环期间各时相点CEC数 较体外循环前明显增加(P<0.05), 其中停机时达到最高值为13.95±1.65/ 0.9 μl, 体外循环结束后各时相点CEC计数与体外循环期间无显著差异(P>0.05 ), 但仍较体外循环前明显升高。
2.2 各时相点TNF-α浓度
表 2 各时相点TNF-α浓度的变化 (n=20,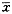 ±s)
±s)
转流前
, 百拇医药
转 流
10 min
转 流
30 min
开放主 动
脉5 min
停 机
停机后
4 h
TNF
20.89±
6.98
45.1±
, http://www.100md.com
7.41)
45.54±
5.981)
38.72±
5.031)
75.02±
10.931)
34.31±
6.64
注: 1) 与转流前比较: P<0.05
表2显示, 受试者在体外循环期间TNF-α浓度较术前明显升高(P<0.05), 停体外 循环时TNF-α浓度达最高值, 停体外循环后TNF-α浓度下降, 停机后4 h浓度与转流前无 明显差别(P<0.05)。
, 百拇医药
3 讨 论
血管内皮细胞不仅是调节血管通透性的屏障, 而且还具有其它多种复杂和活跃的生物学功能 。 低温体外循环中温度变化、 血流方式改变、 血液中各种血细胞成分的激活及组织缺血 —再灌注损伤过程均可导致内皮细胞的激活或损伤, 并认为内皮细胞激活或损伤是体外循环 致多系统脏器功能损伤的重要环节, 目前国内有关这方面的研究报道尚少。 我们对低温体 外循环过程中血浆vWF水平、 血中CEC数的动态变化以及血中TNF-α浓度进行观察, 结果表 明体外循环期间及体外循环后早期血浆中vWF水平及血中CEC数较体外循环前增高(P<0 .05), 体外循环期间TNF-α浓度明显升高(P<0.05), 停体外循环后TNF-α浓度 下降, 提示低温体外循环可导致儿童血管内皮细胞激活或损伤, 细胞因子TNF-α可能参与 体外循环致内皮细胞激活或损伤的过程。
vWF是由血管内皮细胞、 巨核细胞合成的, 其中内皮细胞是血浆vWF的主要来源[2] 。 vWF主要功能是促进血小板与血管壁的粘附。 血中vWF水平可以反应血管内皮细胞激活或 损伤的程度[3]。 我们的实验显示体外循环期间、 体外循环后4 h及术后第1日晨v WF水平比转流前升高(P<0.05)。 vWF释放增加, 促进血小板与受损血管壁的粘附, 引起血小板的聚集, 血小板聚集后可以释放其包含的α-颗粒及致密颗粒, 其中包括凝血酶 、 二磷酸腺苷等, 这些血管活性物质可以进一步激活及促使其它血小板聚集, 引起血小板 的大量消耗[4], 导致体外循环期间及体外循环后早期机体出现凝血功能紊乱。 体 外循环期间血液成分的激活, 如白细胞、 血小板及补体的激活, 花生四烯酸代谢产物及各 种血管活性物质的释放增加, 毛细血管通透性增加而诱发全身炎症反应(SIRS)。
, http://www.100md.com
内皮细胞缺失及脱落是其损伤的重要形态变化。 近年来, 在各种损伤情况下出现血管内皮 细胞脱落的报道逐渐增多, 主要检测方法是CEC计数。 Haldovec首先提出循环内皮细胞数量 变化, 可以反映许多病理状况时血管内皮细胞损伤程度。 由于分离技术的改进, 人们认为C EC的检测是目前在活体唯一可以连续而直接反映血管内皮细胞损伤的指示物[5,6] 。 本实验结果表明体外循环过程中CEC数较体外循环前明显升高(P<0.05)。 提示 体外循环能导致血管内皮细胞激活或损伤, 并介导凝血机制紊乱甚至全身炎性反应综合症(S IRS)的发生。
TNF-α是由激活的单核细胞、 淋巴细胞及枯否氏细胞所分泌的蛋白质。 C5a、 白介素 -1β、 革兰氏阴性的内毒素及革兰氏阳性的细菌产物均可刺激TNF-α合成及分泌。 本实 验表明体外循环期间TNF-α明显升高(P<0.05), 在低温体外循环过程中, 由于补 体的大量激活, 从而激活了单核细胞或巨核细胞, 使其产生众多的细胞因子, 包括TNF-α 。 TNF-α能与内皮细胞表面的特殊受体结合, 激活内皮细胞转录因子κappa基因结合核因 子(NF-κB), 使内皮细胞表达众多的粘附分子如ICAM-1、 E-选择素等, 能与中性粒细胞 上的CD18、 CD11b/CD18形成牢固的结合, 导致中性粒细胞与内皮细胞粘附, 从而介导内皮 细胞损伤[7]。
, 百拇医药
减轻体外循环对血管内皮细胞的损伤可减轻上述各种不良反应, 有助于体外循环后患者的康 复。 对体外循环致血管内皮细胞损伤的防护有待于进一步研究。
本文作者简介:陈劲进(1970~), 男, 汉族, 主治医师、 讲师, 硕士
参考文献
1,杨映波, 王正国, 朱佩芳, 等. 一种分离循环内皮细胞的新方法. 中国药理学与 毒理学杂志, 1994, 8(1):29.
2,吴庆宇, 阮长耿. vWF的分子生物学研究. 国外医学输血及血液学分册, 1989, 1 2(4):206.
3,Valen G, Blomback M, Sellei P, et al. Release of von Willebrand factor by cardiopulmonary bypass, but not by cardioplegia in open heart surgery. Throm b Res, 1994, 73(1):21~29.
, http://www.100md.com
4,Boyle EM Jr, Verrier ED, Spiess BD. Endothelial cell injury in cardiov ascular surgery: The procoagulant response. Ann Thorac Surg, 1996, 62(6):1 549 ~1 557.
5,Haldovec J. Circulating endothelial cells a a sign of vessel wall lesi ons. Physiol Bohemoslov, 1978, 27(2):140~144.
6,Takahasi H, Harker LA. Measurement of human endothelial cells in whole blood. Thromb Res, 1983, 31(1):1.
7,Boyle EM Jr, Pohlman TH, Johnson MC, et al. Endothelial cell injury in cardiovascular surgery: The systemic inflammatory response. Ann Thorac Surg, 19 97, 63(1):277~284.
本文1999-12-27收到, 2000-05-13接受, http://www.100md.com
单位:陈劲进(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);肖颖彬(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);王学锋(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37);陈林(中国人民解放军第三军医大学新桥医院心血管外科, 邮政编码 重庆4000 37)
关键词:体外循环;循环内皮细胞;血管性假血友病因子;肿瘤坏死因子α
微循环学杂志000204 目的: 探讨低温体外循环对血管内皮细胞损伤及其可能机制。方法:用酶联免疫法测定20例先天性心脏病患者围术期血浆中血管性假血友病因子(vWF)及肿瘤坏死因子α(TNF-α)的浓度,同时对患者血中循环内皮细胞(CEC)进行计数及形态学观察。结果:转流后各时相点vWF水平及CEC数较体外循环前显著升高。体外循环期间TNF-α浓度明显升高(P<0.05),停体外循环后TNF-α浓度下降,停机后4 h浓度与转流前无明显差别。结论:体外循环可导致血管内皮细胞激活或损伤,细胞因子TNF-α可能参与体外循环致内皮细胞激活或损伤的过程。
, 百拇医药
Study of Endothelium Injury during Cardiac Operation with Hypothermic Extracorporeal Circulation
Chen Jinjin, Xiao Yingbin, Wang Xuefeng
(Xinqiao Hospital of Third Military Medical University of Chinese PLA, Chongqing 400037)
Objective: To investigate the mechanism of endothelium injury duing cardiac operation with hypothermic extracorporeal circulation. Method: Twenty children scheduled for cardiac operation with hypothermic extracorporeal circulation (ECC) were included in the study. Venous blood was sampled at six points perioperative. the von Willebrand Factor (vWF) and tumor necrosis factor α(TNF-α) levels in the blood were measured by an enzyme-linked immunosorbent assay method. Circulating enothelial cells (CEC) were counted on the time.Results: The level of vWF and CEC increased during ECC and was remained higher than the basic values on the morning of the first postoperative day. TNF-α level increased significantly during ECC and return to basic levels by 4 hours after the end of ECC.Conclusion: The results indicated endothelial cells were injured during pediatric cadiac operations with hypothermic ECC. TNF-α may play an important role in endothelial injury.
, 百拇医药
Key words:Extracorporeal circulation; Circulating endothelial cells; von Willebrand factor; Tumor necrosis factor α
内皮细胞激活或损伤及其防护研究引起人们越来越多的关注, 对体外循环中内皮细胞激活或损 伤国内的报道尚少。 血管性假血友病因子(von Willebrand Factor, vWF)主要由血管内皮 细胞合成和分泌, 血中vWF水平增高是内皮细胞激活或损伤的标志。 循环内皮细胞(circula ting endothelial cells, CEC)是体内直接而又比较敏感反应内皮细胞损伤的标志。 我们 观察体外循环围手术期血浆vWF水平、 血中CEC数以及肿瘤坏死因子α(tumor necrosis fac tor α, TNF-α)的变化, 探讨低温体外循环对血管内皮细胞的损伤作用及其可能机制。
1 资料与方法
, http://www.100md.com
1.1一般资料
实验选择20例先天性心房、 室间隔缺损患儿, 男8例、 女12例, 年龄3~5岁, 体重11~18 kg, 所有患儿均在低温体外循环下行房、 室间隔缺损修补术, 所有患者无死亡及残余漏。
1.2 检测方法
于肝素化后体外循环前、 转流10 min、 转流30 min、 开放主动脉5 min、 停机、 停机后 4 h及术后第1日晨7个时相点, 分离静脉血血浆贮于-22℃供测vWF浓度以及TNF-α浓度, 另 采集3 ml静脉血供CEC计数。 同时测量各时相点红细胞压积。 于第1、 3、 4、 5、 6、 7 共计六个时相点测定血浆中vWF浓度, 同时对患者血中CEC进行计数及形态学观察, 于第1、 2、 3、 4、 5、 6共计六个时相点测定血浆中TNF-α的浓度。
vWF浓度测定采用苏州医学院血栓与止血研究室的vWF酶标药盒, 在美国基因公司的V-max酶 标仪上进行测定。
, 百拇医药
CEC分离及计数采用percoll密度离心法[1], 在显微镜下计数, 单位: cell/0.9 μl, 其循环内皮细胞鉴定采用间接免疫荧光法标记Ⅷ-Ag。 CEC形态特征: 镜下见CEC 体积较大, 大多数为不规则多边形细胞, 核隐约可见或无细胞核。 vWF抗体标记后的细胞胞 浆中有棕褐色颗粒, 表示为CEC。
TNF-α测定采用双抗体夹心法。 取血200 μl, 加苯甲基氟磺酸(PMSF)至1 mmol/L, 于-22 ℃保存。 操作按试剂盒进行, 在V-max酶标仪上进行比色。 单位: ng/ml。
体外循环期间血液稀释对vWF浓度、 CEC数以及TNF-α浓度的影响用以下公式校正:
校正值=测定值×转流前红细胞压积/测定时红细胞压积
1.3 统计学处理
, http://www.100md.com
结果以均值±标准差(
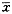 ±s)表示, 用数理统计程序包SPRM进行单因素方差分析 。
±s)表示, 用数理统计程序包SPRM进行单因素方差分析 。2 结 果
2.1各时相点vWF浓度及CEC数
表 1 各时相点血液vWF浓度及CEC变 化(n=20,
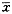 ±s) 指 标
±s) 指 标转流前
转流
30 min
开 放
主动脉
, http://www.100md.com
5 min
停机
停机后
4 h
术后
第1天
vWF
(U/L)
0.22±
0.01
0.54±
0.021)
0.49±
, 百拇医药
0.021)
0. 60±
0.071)
1.12±
0.051)2)
1.38±
0.121)2)
CEC
(cell/0.9μl)
4.37±
0.81
, 百拇医药
11.8±
1.071)
12.94±
1.161)
13.95±
1.651)
11.50±
1.071)2)
12.54±
1.121)
注: 1) 与转流前比较: P<0.05; 2) 与转流30 min、 开放 主动脉5 min比较: P<0.05
, http://www.100md.com
表1显示, 体外循环期间各时相点vWF浓度较体外循环前均明显升高(P均<0.05) , 停机后4小时、 术后第1日晨vWF浓度较体外循环期间显著升高(P均<0.05)。
体外循环前病人的CEC数为4.37±0.81/0.9 μl, 体外循环期间各时相点CEC数 较体外循环前明显增加(P<0.05), 其中停机时达到最高值为13.95±1.65/ 0.9 μl, 体外循环结束后各时相点CEC计数与体外循环期间无显著差异(P>0.05 ), 但仍较体外循环前明显升高。
2.2 各时相点TNF-α浓度
表 2 各时相点TNF-α浓度的变化 (n=20,
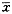 ±s)
±s)转流前
, 百拇医药
转 流
10 min
转 流
30 min
开放主 动
脉5 min
停 机
停机后
4 h
TNF
20.89±
6.98
45.1±
, http://www.100md.com
7.41)
45.54±
5.981)
38.72±
5.031)
75.02±
10.931)
34.31±
6.64
注: 1) 与转流前比较: P<0.05
表2显示, 受试者在体外循环期间TNF-α浓度较术前明显升高(P<0.05), 停体外 循环时TNF-α浓度达最高值, 停体外循环后TNF-α浓度下降, 停机后4 h浓度与转流前无 明显差别(P<0.05)。
, 百拇医药
3 讨 论
血管内皮细胞不仅是调节血管通透性的屏障, 而且还具有其它多种复杂和活跃的生物学功能 。 低温体外循环中温度变化、 血流方式改变、 血液中各种血细胞成分的激活及组织缺血 —再灌注损伤过程均可导致内皮细胞的激活或损伤, 并认为内皮细胞激活或损伤是体外循环 致多系统脏器功能损伤的重要环节, 目前国内有关这方面的研究报道尚少。 我们对低温体 外循环过程中血浆vWF水平、 血中CEC数的动态变化以及血中TNF-α浓度进行观察, 结果表 明体外循环期间及体外循环后早期血浆中vWF水平及血中CEC数较体外循环前增高(P<0 .05), 体外循环期间TNF-α浓度明显升高(P<0.05), 停体外循环后TNF-α浓度 下降, 提示低温体外循环可导致儿童血管内皮细胞激活或损伤, 细胞因子TNF-α可能参与 体外循环致内皮细胞激活或损伤的过程。
vWF是由血管内皮细胞、 巨核细胞合成的, 其中内皮细胞是血浆vWF的主要来源[2] 。 vWF主要功能是促进血小板与血管壁的粘附。 血中vWF水平可以反应血管内皮细胞激活或 损伤的程度[3]。 我们的实验显示体外循环期间、 体外循环后4 h及术后第1日晨v WF水平比转流前升高(P<0.05)。 vWF释放增加, 促进血小板与受损血管壁的粘附, 引起血小板的聚集, 血小板聚集后可以释放其包含的α-颗粒及致密颗粒, 其中包括凝血酶 、 二磷酸腺苷等, 这些血管活性物质可以进一步激活及促使其它血小板聚集, 引起血小板 的大量消耗[4], 导致体外循环期间及体外循环后早期机体出现凝血功能紊乱。 体 外循环期间血液成分的激活, 如白细胞、 血小板及补体的激活, 花生四烯酸代谢产物及各 种血管活性物质的释放增加, 毛细血管通透性增加而诱发全身炎症反应(SIRS)。
, http://www.100md.com
内皮细胞缺失及脱落是其损伤的重要形态变化。 近年来, 在各种损伤情况下出现血管内皮 细胞脱落的报道逐渐增多, 主要检测方法是CEC计数。 Haldovec首先提出循环内皮细胞数量 变化, 可以反映许多病理状况时血管内皮细胞损伤程度。 由于分离技术的改进, 人们认为C EC的检测是目前在活体唯一可以连续而直接反映血管内皮细胞损伤的指示物[5,6] 。 本实验结果表明体外循环过程中CEC数较体外循环前明显升高(P<0.05)。 提示 体外循环能导致血管内皮细胞激活或损伤, 并介导凝血机制紊乱甚至全身炎性反应综合症(S IRS)的发生。
TNF-α是由激活的单核细胞、 淋巴细胞及枯否氏细胞所分泌的蛋白质。 C5a、 白介素 -1β、 革兰氏阴性的内毒素及革兰氏阳性的细菌产物均可刺激TNF-α合成及分泌。 本实 验表明体外循环期间TNF-α明显升高(P<0.05), 在低温体外循环过程中, 由于补 体的大量激活, 从而激活了单核细胞或巨核细胞, 使其产生众多的细胞因子, 包括TNF-α 。 TNF-α能与内皮细胞表面的特殊受体结合, 激活内皮细胞转录因子κappa基因结合核因 子(NF-κB), 使内皮细胞表达众多的粘附分子如ICAM-1、 E-选择素等, 能与中性粒细胞 上的CD18、 CD11b/CD18形成牢固的结合, 导致中性粒细胞与内皮细胞粘附, 从而介导内皮 细胞损伤[7]。
, 百拇医药
减轻体外循环对血管内皮细胞的损伤可减轻上述各种不良反应, 有助于体外循环后患者的康 复。 对体外循环致血管内皮细胞损伤的防护有待于进一步研究。
本文作者简介:陈劲进(1970~), 男, 汉族, 主治医师、 讲师, 硕士
参考文献
1,杨映波, 王正国, 朱佩芳, 等. 一种分离循环内皮细胞的新方法. 中国药理学与 毒理学杂志, 1994, 8(1):29.
2,吴庆宇, 阮长耿. vWF的分子生物学研究. 国外医学输血及血液学分册, 1989, 1 2(4):206.
3,Valen G, Blomback M, Sellei P, et al. Release of von Willebrand factor by cardiopulmonary bypass, but not by cardioplegia in open heart surgery. Throm b Res, 1994, 73(1):21~29.
, http://www.100md.com
4,Boyle EM Jr, Verrier ED, Spiess BD. Endothelial cell injury in cardiov ascular surgery: The procoagulant response. Ann Thorac Surg, 1996, 62(6):1 549 ~1 557.
5,Haldovec J. Circulating endothelial cells a a sign of vessel wall lesi ons. Physiol Bohemoslov, 1978, 27(2):140~144.
6,Takahasi H, Harker LA. Measurement of human endothelial cells in whole blood. Thromb Res, 1983, 31(1):1.
7,Boyle EM Jr, Pohlman TH, Johnson MC, et al. Endothelial cell injury in cardiovascular surgery: The systemic inflammatory response. Ann Thorac Surg, 19 97, 63(1):277~284.
本文1999-12-27收到, 2000-05-13接受, http://www.100md.com