沙漠尘对大鼠肺巨噬细胞毒性机制的初步研究
作者:逄兵 周彤 吴向东 杨建明 周袁芬 金泰 蒋学之 王兰
单位:200032 上海医科大学劳动卫生学教研室
关键词:
沙漠尘对大鼠肺巨噬细胞毒性机制的初步研究 逄兵 周彤 吴向东 杨建明 周袁芬 金泰 蒋学之 王
蒋学之 王 兰
兰
接触沙漠尘后可引起实验动物肺部损伤[1,2]。我们应用大鼠肺巨噬细胞体外培养系统,对沙漠尘肺巨噬细胞离体毒性机制进行了初步研究,报告如下。
, 百拇医药
一、材料与方法
1.实验动物:200 g左右的健康成年雄性SD大鼠,上海医科大学实验动物部提供。
2.含尘培养基制备:将在塔克拉玛干沙漠采集的经风干和过筛后的沉降沙漠尘(38.3% SiO2,约95%沙尘直径<5 μm)和石英尘(99% SiO2,中国预防医学科学院劳动卫生与职业病研究所提供),高压灭菌后,用RPMI-1640将沙漠尘分别配成终浓度为100、500、2 500 μg/ml的含尘培养基,阳性对照为100 μg/ml石英尘,RPMI-1640培养基为阴性对照。
3.大鼠巨噬细胞培养:大鼠经肺灌洗后,将灌洗液离心沉淀,调整细胞浓度为106 cell/ml,接种于24孔培养板中。分别加入1 ml不同的含尘RPMI-1640培养液,染尘24 小时后回收巨噬细胞并留取培养液,将培养液离心后进行各项生化指标的测定。
, 百拇医药
4.巨噬细胞DNA损伤检测:采用单细胞电泳法检测DNA损伤程度[3]。
5.其它细胞损伤指标:细胞存活率采用苔酚蓝法;乳酸脱氢酶(LDH)测定采用2,4-二硝基苯肼比色法;
丙二醛(MDA)测定用TBA法;谷胱甘肽过氧化物酶(GSH-Px)测定用二硫代二硝基苯甲酸法。所用试剂盒由南京建成生物工程研究所提供。
6.统计处理:资料用SPSS for Windows 6.0进行t检验,并用SAS进行趋势卡方检验。
二、结果
1.沙漠尘染尘24小时后对巨噬细胞的毒性作用见表1:染尘剂量为100 μg/ml时,沙漠尘对巨噬细胞存活率无影响;随着染尘剂量的增加,巨噬细胞存活率逐渐下降,当剂量达到2 500 μg/ml时,巨噬细胞存活率明显降低。石英组巨噬细胞存活率降低更明显,低于沙漠尘2 500 μg/ml组。在剂量达到2 500 μg/ml时,培养基中LDH及GSH-Px活力明显增加。染尘2小时后,各组MDA的含量基本接近;10小时后,随着染尘剂量的增加,MDA含量有升高趋势;24小时后,高剂量沙漠尘组MDA含量明显增加,但低于100 μg/ml石英组。
, http://www.100md.com
2.沙漠尘对巨噬细胞DNA的损伤作用见表2:随着染尘剂量的增加,巨噬细胞彗星率逐渐增加,当剂量从0 μg/ml增加至2 500 μg/ml时,彗星率从20.27%增加至43.11%。DNA损伤程度分布显示:随着染尘剂量的增加,巨噬细胞DNA损伤程度逐渐加重,最高剂量组可见Ⅳ级损伤。
表1 沙漠尘染尘24小时对巨噬细胞的毒性作用(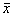 ±s)
±s)
剂量(μg/ml)
存活率(%)
LDH(U/L)
GSH-Px(U/L)
, http://www.100md.com
MDA(μmol/L)
0
0.95±0.15
3397.4±620.7
48.32±13.56
2.84±0.26
100
0.92±0.23
3409.2±379.1
43.27±4.56
2.88±0.51
500
, http://www.100md.com
0.79±0.16
4119.9±781.4
58.05±7.76
3.26±0.55
2500
0.51±0.13**
5238.1±465.0*
73.56±12.74*
4.13±1.23*
SiO2
, 百拇医药
0.29±0.11**
8242.1±815.2**
94.12±22.91**
5.76±0.59**
n=4;与对照(0)组比较,*P<0.05,**P<0.01 表2 沙漠尘染尘24小时对巨噬细胞DNA的损伤程度
剂量
(μg/ml)
细胞数
损伤程度
, 百拇医药
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
0
150
118
27
5
0
0
100
150
, http://www.100md.com
116
25
9
3
0
500
150
107
29
9
5
0
2500
150
, 百拇医药
86
40
12
6
6
n=3;趋势卡方检验,P<0.05
三、讨论
沙漠尘对体外巨噬细胞表现一定的细胞毒性。染尘24小时后,随着染尘剂量的增加,巨噬细胞存活率下降、LDH活力逐渐上升,当染尘剂量达到2 500 μg/ml时,巨噬细胞存活率及LDH活力明显改变,并表现出一定的剂量-效应关系。LDH为胞浆酶,当细胞膜受损或细胞死亡分解时,细胞外液中LDH活力升高,因此LDH及细胞存活率是体外检测细胞毒性的一种比较简便的方法。
MDA含量是脂质过氧化水平的间接反映指标。实验结果显示:随着染尘时间的增加和染尘剂量的增高,MDA水平也逐渐增加。提示:在较高剂量、较长时间作用下,沙漠尘可诱发体外巨噬细胞脂质过氧化。单细胞电泳技术(single cell gel electrophoresis)用于粉尘表面活性的研究,曾证实石英尘粒能介导DNA损伤,使DNA单链断裂[4]。本实验结果显示:随着染尘剂量的增加,巨噬细胞DNA损伤程度逐渐加重。综上所见,沙漠尘对巨噬细胞的毒性作用可能与其引发的自由基损伤有关。
, 百拇医药
GSH-Px是细胞内抗过氧化、保护肺泡巨噬细胞膜性系统的重要酶系,主要通过消除过氧化氢,保护组织细胞免受自由基的损伤[5]。本实验显示:染尘24小时后,随着染尘剂量的增加,培养基中的GSH-Px活力增高。推测可能有两个原因:一是高剂量沙漠尘引起巨噬细胞产生大量的自由基,从而诱导细胞GSH-Px活力增加;二是细胞受到损伤,导致膜的通透性增高,从而使细胞内酶漏到细胞外,使培养基中GSH-Px活力增加,但具体机制还需进一步探讨。
虽然沙漠尘中游离二氧化硅含量高达38.3%,在较高剂量下可引发体外巨噬细胞的一系列损伤。然而在染尘剂量为100 μg/ml时,沙漠尘没有对巨噬细胞存活率、MDA含量、LDH及GSH-Px活力等指标产生影响。与此相比,在此剂量下,石英尘对体外巨噬细胞的影响已非常明显,甚至比剂量高达2 500 μg/ml的沙漠尘(游离二氧化硅含量比石英尘高9.67倍)明显,说明沙漠尘的毒性较小。推测可能是与沙漠尘长期经历沙漠气候的剧烈变化,其晶体结构发生某种改变,表面活性逐渐“老化”,致使毒性降低等因素有关[6]。
, 百拇医药
参考文献
1 逄兵,邓中平,周袁芬,等.沙漠尘对大鼠肺急性损伤的研究.中国公共卫生学报,1994,13:309~310.
2 逄兵,周袁芬,张学书,等.沙漠尘致大鼠肺病理学研究.职业医学,1994,26:4~7.
3 Duthie SJ,Ma A,Ross MA,et al.Antioxidant supplementation decreases oxidative DNA damage in human lymphocytes.Cancer Res,1996,56:1291~1295.
4 Shi D,Mao Y,Daniel LN,et al.Silica radical-induced DNA damaged and lipid peroxidation.Environ Health Perspect,1994,102(Suppl 10):149~154.
5 肖国兵,马藻骅,陈志先,等.石棉作业女工血脂质过氧化与抗氧化活性的研究.中国工业医学杂志,1997,10:76~78.
6 逄兵,张学书,蒋学之.沙漠尘和沙漠肺.职业医学,1993,20:301~302.
(收稿:1997-06-17 修回:1997-12-01), http://www.100md.com
单位:200032 上海医科大学劳动卫生学教研室
关键词:
沙漠尘对大鼠肺巨噬细胞毒性机制的初步研究 逄兵 周彤 吴向东 杨建明 周袁芬 金泰
接触沙漠尘后可引起实验动物肺部损伤[1,2]。我们应用大鼠肺巨噬细胞体外培养系统,对沙漠尘肺巨噬细胞离体毒性机制进行了初步研究,报告如下。
, 百拇医药
一、材料与方法
1.实验动物:200 g左右的健康成年雄性SD大鼠,上海医科大学实验动物部提供。
2.含尘培养基制备:将在塔克拉玛干沙漠采集的经风干和过筛后的沉降沙漠尘(38.3% SiO2,约95%沙尘直径<5 μm)和石英尘(99% SiO2,中国预防医学科学院劳动卫生与职业病研究所提供),高压灭菌后,用RPMI-1640将沙漠尘分别配成终浓度为100、500、2 500 μg/ml的含尘培养基,阳性对照为100 μg/ml石英尘,RPMI-1640培养基为阴性对照。
3.大鼠巨噬细胞培养:大鼠经肺灌洗后,将灌洗液离心沉淀,调整细胞浓度为106 cell/ml,接种于24孔培养板中。分别加入1 ml不同的含尘RPMI-1640培养液,染尘24 小时后回收巨噬细胞并留取培养液,将培养液离心后进行各项生化指标的测定。
, 百拇医药
4.巨噬细胞DNA损伤检测:采用单细胞电泳法检测DNA损伤程度[3]。
5.其它细胞损伤指标:细胞存活率采用苔酚蓝法;乳酸脱氢酶(LDH)测定采用2,4-二硝基苯肼比色法;
丙二醛(MDA)测定用TBA法;谷胱甘肽过氧化物酶(GSH-Px)测定用二硫代二硝基苯甲酸法。所用试剂盒由南京建成生物工程研究所提供。
6.统计处理:资料用SPSS for Windows 6.0进行t检验,并用SAS进行趋势卡方检验。
二、结果
1.沙漠尘染尘24小时后对巨噬细胞的毒性作用见表1:染尘剂量为100 μg/ml时,沙漠尘对巨噬细胞存活率无影响;随着染尘剂量的增加,巨噬细胞存活率逐渐下降,当剂量达到2 500 μg/ml时,巨噬细胞存活率明显降低。石英组巨噬细胞存活率降低更明显,低于沙漠尘2 500 μg/ml组。在剂量达到2 500 μg/ml时,培养基中LDH及GSH-Px活力明显增加。染尘2小时后,各组MDA的含量基本接近;10小时后,随着染尘剂量的增加,MDA含量有升高趋势;24小时后,高剂量沙漠尘组MDA含量明显增加,但低于100 μg/ml石英组。
, http://www.100md.com
2.沙漠尘对巨噬细胞DNA的损伤作用见表2:随着染尘剂量的增加,巨噬细胞彗星率逐渐增加,当剂量从0 μg/ml增加至2 500 μg/ml时,彗星率从20.27%增加至43.11%。DNA损伤程度分布显示:随着染尘剂量的增加,巨噬细胞DNA损伤程度逐渐加重,最高剂量组可见Ⅳ级损伤。
表1 沙漠尘染尘24小时对巨噬细胞的毒性作用(
剂量(μg/ml)
存活率(%)
LDH(U/L)
GSH-Px(U/L)
, http://www.100md.com
MDA(μmol/L)
0
0.95±0.15
3397.4±620.7
48.32±13.56
2.84±0.26
100
0.92±0.23
3409.2±379.1
43.27±4.56
2.88±0.51
500
, http://www.100md.com
0.79±0.16
4119.9±781.4
58.05±7.76
3.26±0.55
2500
0.51±0.13**
5238.1±465.0*
73.56±12.74*
4.13±1.23*
SiO2
, 百拇医药
0.29±0.11**
8242.1±815.2**
94.12±22.91**
5.76±0.59**
n=4;与对照(0)组比较,*P<0.05,**P<0.01 表2 沙漠尘染尘24小时对巨噬细胞DNA的损伤程度
剂量
(μg/ml)
细胞数
损伤程度
, 百拇医药
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
0
150
118
27
5
0
0
100
150
, http://www.100md.com
116
25
9
3
0
500
150
107
29
9
5
0
2500
150
, 百拇医药
86
40
12
6
6
n=3;趋势卡方检验,P<0.05
三、讨论
沙漠尘对体外巨噬细胞表现一定的细胞毒性。染尘24小时后,随着染尘剂量的增加,巨噬细胞存活率下降、LDH活力逐渐上升,当染尘剂量达到2 500 μg/ml时,巨噬细胞存活率及LDH活力明显改变,并表现出一定的剂量-效应关系。LDH为胞浆酶,当细胞膜受损或细胞死亡分解时,细胞外液中LDH活力升高,因此LDH及细胞存活率是体外检测细胞毒性的一种比较简便的方法。
MDA含量是脂质过氧化水平的间接反映指标。实验结果显示:随着染尘时间的增加和染尘剂量的增高,MDA水平也逐渐增加。提示:在较高剂量、较长时间作用下,沙漠尘可诱发体外巨噬细胞脂质过氧化。单细胞电泳技术(single cell gel electrophoresis)用于粉尘表面活性的研究,曾证实石英尘粒能介导DNA损伤,使DNA单链断裂[4]。本实验结果显示:随着染尘剂量的增加,巨噬细胞DNA损伤程度逐渐加重。综上所见,沙漠尘对巨噬细胞的毒性作用可能与其引发的自由基损伤有关。
, 百拇医药
GSH-Px是细胞内抗过氧化、保护肺泡巨噬细胞膜性系统的重要酶系,主要通过消除过氧化氢,保护组织细胞免受自由基的损伤[5]。本实验显示:染尘24小时后,随着染尘剂量的增加,培养基中的GSH-Px活力增高。推测可能有两个原因:一是高剂量沙漠尘引起巨噬细胞产生大量的自由基,从而诱导细胞GSH-Px活力增加;二是细胞受到损伤,导致膜的通透性增高,从而使细胞内酶漏到细胞外,使培养基中GSH-Px活力增加,但具体机制还需进一步探讨。
虽然沙漠尘中游离二氧化硅含量高达38.3%,在较高剂量下可引发体外巨噬细胞的一系列损伤。然而在染尘剂量为100 μg/ml时,沙漠尘没有对巨噬细胞存活率、MDA含量、LDH及GSH-Px活力等指标产生影响。与此相比,在此剂量下,石英尘对体外巨噬细胞的影响已非常明显,甚至比剂量高达2 500 μg/ml的沙漠尘(游离二氧化硅含量比石英尘高9.67倍)明显,说明沙漠尘的毒性较小。推测可能是与沙漠尘长期经历沙漠气候的剧烈变化,其晶体结构发生某种改变,表面活性逐渐“老化”,致使毒性降低等因素有关[6]。
, 百拇医药
参考文献
1 逄兵,邓中平,周袁芬,等.沙漠尘对大鼠肺急性损伤的研究.中国公共卫生学报,1994,13:309~310.
2 逄兵,周袁芬,张学书,等.沙漠尘致大鼠肺病理学研究.职业医学,1994,26:4~7.
3 Duthie SJ,Ma A,Ross MA,et al.Antioxidant supplementation decreases oxidative DNA damage in human lymphocytes.Cancer Res,1996,56:1291~1295.
4 Shi D,Mao Y,Daniel LN,et al.Silica radical-induced DNA damaged and lipid peroxidation.Environ Health Perspect,1994,102(Suppl 10):149~154.
5 肖国兵,马藻骅,陈志先,等.石棉作业女工血脂质过氧化与抗氧化活性的研究.中国工业医学杂志,1997,10:76~78.
6 逄兵,张学书,蒋学之.沙漠尘和沙漠肺.职业医学,1993,20:301~302.
(收稿:1997-06-17 修回:1997-12-01), http://www.100md.com