实验性大鼠矽肺肥大细胞表型的观察
作者:唐海波 钱仲
单位:410078 长沙,湖南医科大学病理学教研室(唐海波现在湖南医科大学附属第三医院病理科)
关键词:肺;肥大细胞;矽肺;表型;纤维化
中华劳动卫生职业病杂志980511 唐海波 钱仲
【摘要】 目的 研究矽肺病灶内肥大细胞的表型。 方法 非暴露式气管内注入石英粉尘悬液复制大鼠矽肺模型。用甲苯胺蓝、阿新兰-沙红O染色及图像分析等方法,观察、分析矽肺组织中肥大细胞数量及表型的变化。 结果 (1)实验组染尘后1、4、12、24、36、48周单位面积肥大细胞数量增加,与对照组比较,差异有显著性(P<0.05)。(2)增生的肥大细胞主要是结缔组织表型肥大细胞。(3)肺实质中结缔组织型肥大细胞的增加与矽肺病程呈直线正相关。 结论 肥大细胞,特别是结缔组织型肥大细胞,在矽肺的发生发展中可能具有一定作用。
, 百拇医药
A study on the phenotype of mastcells in experimental silicosis of rats Tang Haibo,Qian Zhongfei.Department of Pathology,Hunan Medical University,Changsha 410078
【Abstract】 Objective To investigate phenotype of mast cells in rat silicotic foci.Methods Experimental silicosis were made in rats by intratracheal instilation of silica suspension,and changes of the number and phenotype of mast cells in silicotic tissues were studied using toluidin blue stain,alcian-blue safaranin 0 stain and image analysis system.Results (1)In experimental groups,1,4,12,24,36 and 48 weeks after silica treatment,the number of mast cells per unit area(mm2) increased,and there were significant difference as compared with controls.(2)Proliferative mast cells were mainly connective tissue mast cells(CTMC).(3)Increase of CTMC in parenchyma was related to the course of silicosis in linear correlation.Conclusion Mast cells,especially CTMC may play a role in the pathogenesis of silicosis.
, http://www.100md.com
【Key words】 Lung Mast cell Silicosis Phenotype Fibrosis
近年来,肥大细胞(MC)与肺纤维化的关系引起人们关注[1]。我们在实验性矽肺研究中发现:随着纤维化的发生发展,MC数量显著增加,且MC与成纤维细胞关系密切[2]。体外实验的研究结果表明:MC可促进肺成纤维细胞(LFB)增生[3]。目前有关矽肺纤维化病灶内MC异质性文献报道甚少。我们对矽肺各个阶段肥大细胞表型进行了动态观察,为探讨肥大细胞在矽肺发病中的意义提供实验资料。
材料与方法
一、矽肺模型的复制
健康Wistar雄性大鼠30只,体重180~220 g,采用非暴露式气管内注入,给每只大鼠注入石英粉尘悬液2 ml(0.3 g加300 ml生理盐水配制成0.1%悬液,高压蒸气灭菌),隔周1次,共2次(石英粉尘由湖南省职业卫生研究所馈赠)。
, http://www.100md.com
二、实验分组及处理
1.实验组:染尘结束后1、4、12、24、36、48周,分别处死5只实验动物。经右心室注入PBS溶液10 ml,冲洗肺脏,用PBS洗涤后放入Cannoy液预固定3小时。取左下肺组织1.5 cm×1.0 cm×0.6 cm,用Cannoy液继续固定8小时,常规脱水,石蜡包埋,3 μm厚连续切片备用。
2.对照组:(1)空白对照:健康雄性大鼠10只,处死后取肺,按实验组方法处理标本。(2)生理盐水对照组(盐水组):动物30只,按实验组方法处理,以生理盐水取代石英生理盐水悬液。(3)腹腔MC(PMC)作结缔组织型MC(CTMC)对照:用密度梯度离心法分离PMC[4](MC纯度达90%以上),用作CTMC阳性对照。(4)小肠粘膜MC(IMMC)作粘膜型MC(MMC)对照:实验动物剖腹,距胃幽门5cm处剪取空肠0.7 cm,PBS洗涤,Cannoy液固定3小时,脱水石蜡包埋,3μm厚连续切片,用作IMMC阳性对照。
, 百拇医药
三、方法
1.肺、肠组织切片及分离的PMC涂片分别作HE、甲苯胺蓝及阿新兰-沙红O染色(A-S)染色。
2.单位面积MC计量方法:取肺甲苯胺蓝染片(MC显异染性,胞浆呈紫红色),用图像分析仪(MIAS-300型)测量切片肺组织面积并计数全部MC数,计算单位面积MC数(cell/mm2)。
3.肥大细胞表型的计量方法:采用Ellen等[5]提出的标准MC表型分类(A-S染色[6],IMMC胞浆颗粒蓝染;CTMC则75%以上胞浆颗粒红染),按部位分别计数CTMC、IMMC细胞数,及其各占MC总数的百分率。
测定数据以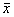 ±s表示,组内比较用t检验,实验组不同阶段MC数量及其表型变化用方差分析。
±s表示,组内比较用t检验,实验组不同阶段MC数量及其表型变化用方差分析。
, http://www.100md.com
结 果
染尘结束后1周,主要病变为肺泡炎,病灶多围绕呼吸性细支气管,病变较弥漫;随后部分肺泡炎性渗出物逐渐吸收;12周以后,肺泡炎基本消失。第4周开始出现细胞结节,随病程进展逐渐增多,并转变为细胞-纤维结节、纤维结节(矽结节),间质出现纤维结缔组织增生。
1.空白对照组肺MC(LMC)表型及分布:单位面积LMC数为1.98±0.53(cell/mm2),CTMC型占13.6%±4.79%;IMMC型占86.4%±4.79%。主要分布在胸膜下和支气管-血管旁,肺实质很少。
2.实验组、盐水对照组LMC数量的变化:染尘结束后第1周末,矽肺组单位面积LMC数明显增多,并随病变发展逐渐上升,与盐水组比较,差异有显著性(表1)。
3.LMC表型的变化:染尘结束后1周,LMC的表型发生改变,表现为CTMC比率上升,与空白对照组比较,差异有显著性;矽肺组与盐水组无明显差异。此后矽肺组CTMC率继续上升,盐水组则逐渐恢复至正常水平(表2)。IMMC的变化与CTMC相反,比率逐渐下降。
, 百拇医药
4.肺实质CTMC比率的变化:表3表明,染尘4周后,矽肺组织肺实质CTMC比率随病程进展而逐渐上升,两者呈直线正相关,直线方程Y=3.42±1.04 t(周)。
表1 矽肺组、盐水组肺肥大细胞数的变化(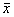 ±s)
±s)
Table 1 Changes of lung mast cell(LMC) number in silicosis and saline groups(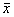 ±s) 组 别
±s) 组 别
Group
单位面积肺肥大细胞数 LMC(cell/mm2)
, 百拇医药 1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
4.55±1.29*
5.75±0.93*
5.85±1.13*
, 百拇医药
9.42±1.08**
11.42±1.03**
10.85±2.03**
盐水组
Saline
2.66±0.75
2.12±0.93
2.60±0.35
2.35±0.78
2.21±1.04
2.21±1.04
, http://www.100md.com
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=19.26,P<0.05
*P<0.05,**P<0.01 vs. saline;F=19.26,P<0.05 compared among silicosis groups表2 矽肺组、盐水组全肺结缔组织肥大细胞比率的变化(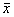 ±s)
±s)
Table 2 Changes of connective tissue mast cell(CTMC) rate in whole lung
of silicosis and saline groups(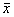 ±s) 组 别
±s) 组 别
, http://www.100md.com
Group
结缔组织肥大细胞比率 Rate of CTMC(%)
1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
52.46±12.32
62.96±9.64*
, 百拇医药
63.19±10.00*
70.01±8.34**
79.29±8.34**
81.06±7.10**
盐水组
Saline
53.69±11.85
46.12±11.29
28.38±8.74
21.83±7.80
, 百拇医药 18.37±7.80
18.37±7.80
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=30.01,P<0.01
*P<0.05,**P<0.01 vs. saline;F=30.01,P<0.01 compared among silicosis groups表3 矽肺组、盐水组肺实质结缔组织肥大细胞比率的变化(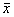 ±s)
±s)
Table 3 Changes of CTMC rate in parenchyma of lung of silicosis and saline groups(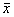 ±s) 组 别
±s) 组 别
, 百拇医药
Group
结缔组织肥大细胞比率 Rate of CTMC(%)
1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
2.65±1.85
12.15±6.18*
, 百拇医药
13.89±7.59*
32.10±10.84**
45.55±7.27**
49.57±8.75**
盐水组
Saline
3.27±1.90
4.49±3.37
1.39±1.04
1.39±1.04
1.33±1.29
, http://www.100md.com
1.33±1.29
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=64.15,P<0.01
*P<0.05,**P<0.01 vs. control;F=64.15,P<0.01 compared among silicosis groups讨 论
本实验结果表明:随着矽肺纤维化的发生发展,病灶内MC数量显著增加,与我们以前的观察结果基本一致[2]。
MC具有异质性,在啮齿类动物,按其表型不同分为MMC及CTMC两类[7]。MC的异质性也许反映了两类MC具有不同的生理功能及病理意义。
本实验的表型研究结果表明:矽肺组织中增生的MC主要为CTMC型,且肺实质中CTMC比率与矽肺病程呈直线正相关,与Tomioka[1]等用博来霉素诱发的肺纤维化病灶内的MC表型变化一致。
, http://www.100md.com
有关CTMC增生的机制还不完全清楚。一般认为MC来源于骨髓中的多能干细胞,在干细胞因子(stem cell factor,SCF)、IL3、IL4、IL9及GB-CSF等因子诱导下分化成MC[8]。有报道:在3T3成纤维细胞培养液中发现一种因子能刺激大鼠干细胞增生,并向CTMC分化[9]。在一定条件下MMC可转化为CTMC,如神经生长因子(NGF)可促进鼠IMMC转化,而成纤维细胞可产生NGF[10]。因此,有人把CTMC称为成纤维细胞依赖性细胞。有人将分离的IMMC注入腹腔,可转化为CTMC型细胞。提示微环境与MC表型有关[7]。本实验盐水对照组在实验初期,单位面积MC数量变化不大,表明MC无明显增生;但IMMC明显减少、CTMC明显增加,这一现象也许与注入盐水后导致肺组织微环境一时性变化,从而诱导IMMC向CTMC转化有关。综上所述,矽肺纤维化病灶内的
, http://www.100md.com
CTMC增加,可能是干细胞向CTMC分化的数量增加和原来肺组织中的MMC向CTMC转化的结果。
CTMC增生的病理意义还不明了,已知CTMC的组胺及肝素含量比MMC高。文献报道组胺可促进成纤维细胞增生,肝素可与一些生长因子结合,促进成纤维细胞增生,肝素(0.3~1.0 mg/ml)本身可直接刺激成纤维细胞增生[9]。此外,CTMC还可分泌肿瘤坏死因子α(TNF-α),后者又可以促进成纤维细胞增生。看来,MC对矽肺纤维化发生发展可能具有一定的作用,应予以重视。
本研究受国家自然科学基金和CMB资助
参考文献
1 Tomioka M,Goto T,Lee TDG,et al.Isolation and characterization of lung mast cells from rats with bleomycin-induced pulmonary fibrosis.Immunol,1989,66:439~444.
, 百拇医药
2 钱仲 ,戚以谟.实验性矽末沉着病肥大细胞的研究.中华病理学杂志,1992,21:346~348.
,戚以谟.实验性矽末沉着病肥大细胞的研究.中华病理学杂志,1992,21:346~348.
3 钱仲 ,尹红玲,罗俊铭.等.肥大细胞对肺成纤维细胞生长的影响.中华劳动卫生职业病杂志,1995,3:149~153.
,尹红玲,罗俊铭.等.肥大细胞对肺成纤维细胞生长的影响.中华劳动卫生职业病杂志,1995,3:149~153.
4 郑晖,钱仲 .肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15:186~187.
.肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15:186~187.
5 Jarrett EEE,Haig DM.Mucosal mast cells in vivo and vitro.Immunol Today,1984,5:115~119.
, 百拇医药
6 Van Overveld FJ,Houben LAMJ,Schmitze du Moulin FEM,et al.Mast cell heterogeneity in human lung tissue.Clin Science,1989,77:297~304.
7 Marshall JS,Bienenstock J.Mast cells.Springer Semin Immunopathol,1990,12:191~202.
8 汝小美.肥大细胞分化及调节.细胞生物学杂志,1992,14:110~114.
9 Yamashita Y,Nakagomi K,Takeda T,et al.Effect of heparin on pulmonary fibroblasts and vascular cells.Thorax,1992,47:634~639.
10 Stevens RL,Austen F.Recent advances in cellular and molecullar biology of mast cells.Immunol Today,1989,10:381~396.
(收稿:1998-01-26 修回:1998-05-19), 百拇医药
单位:410078 长沙,湖南医科大学病理学教研室(唐海波现在湖南医科大学附属第三医院病理科)
关键词:肺;肥大细胞;矽肺;表型;纤维化
中华劳动卫生职业病杂志980511 唐海波 钱仲

【摘要】 目的 研究矽肺病灶内肥大细胞的表型。 方法 非暴露式气管内注入石英粉尘悬液复制大鼠矽肺模型。用甲苯胺蓝、阿新兰-沙红O染色及图像分析等方法,观察、分析矽肺组织中肥大细胞数量及表型的变化。 结果 (1)实验组染尘后1、4、12、24、36、48周单位面积肥大细胞数量增加,与对照组比较,差异有显著性(P<0.05)。(2)增生的肥大细胞主要是结缔组织表型肥大细胞。(3)肺实质中结缔组织型肥大细胞的增加与矽肺病程呈直线正相关。 结论 肥大细胞,特别是结缔组织型肥大细胞,在矽肺的发生发展中可能具有一定作用。
, 百拇医药
A study on the phenotype of mastcells in experimental silicosis of rats Tang Haibo,Qian Zhongfei.Department of Pathology,Hunan Medical University,Changsha 410078
【Abstract】 Objective To investigate phenotype of mast cells in rat silicotic foci.Methods Experimental silicosis were made in rats by intratracheal instilation of silica suspension,and changes of the number and phenotype of mast cells in silicotic tissues were studied using toluidin blue stain,alcian-blue safaranin 0 stain and image analysis system.Results (1)In experimental groups,1,4,12,24,36 and 48 weeks after silica treatment,the number of mast cells per unit area(mm2) increased,and there were significant difference as compared with controls.(2)Proliferative mast cells were mainly connective tissue mast cells(CTMC).(3)Increase of CTMC in parenchyma was related to the course of silicosis in linear correlation.Conclusion Mast cells,especially CTMC may play a role in the pathogenesis of silicosis.
, http://www.100md.com
【Key words】 Lung Mast cell Silicosis Phenotype Fibrosis
近年来,肥大细胞(MC)与肺纤维化的关系引起人们关注[1]。我们在实验性矽肺研究中发现:随着纤维化的发生发展,MC数量显著增加,且MC与成纤维细胞关系密切[2]。体外实验的研究结果表明:MC可促进肺成纤维细胞(LFB)增生[3]。目前有关矽肺纤维化病灶内MC异质性文献报道甚少。我们对矽肺各个阶段肥大细胞表型进行了动态观察,为探讨肥大细胞在矽肺发病中的意义提供实验资料。
材料与方法
一、矽肺模型的复制
健康Wistar雄性大鼠30只,体重180~220 g,采用非暴露式气管内注入,给每只大鼠注入石英粉尘悬液2 ml(0.3 g加300 ml生理盐水配制成0.1%悬液,高压蒸气灭菌),隔周1次,共2次(石英粉尘由湖南省职业卫生研究所馈赠)。
, http://www.100md.com
二、实验分组及处理
1.实验组:染尘结束后1、4、12、24、36、48周,分别处死5只实验动物。经右心室注入PBS溶液10 ml,冲洗肺脏,用PBS洗涤后放入Cannoy液预固定3小时。取左下肺组织1.5 cm×1.0 cm×0.6 cm,用Cannoy液继续固定8小时,常规脱水,石蜡包埋,3 μm厚连续切片备用。
2.对照组:(1)空白对照:健康雄性大鼠10只,处死后取肺,按实验组方法处理标本。(2)生理盐水对照组(盐水组):动物30只,按实验组方法处理,以生理盐水取代石英生理盐水悬液。(3)腹腔MC(PMC)作结缔组织型MC(CTMC)对照:用密度梯度离心法分离PMC[4](MC纯度达90%以上),用作CTMC阳性对照。(4)小肠粘膜MC(IMMC)作粘膜型MC(MMC)对照:实验动物剖腹,距胃幽门5cm处剪取空肠0.7 cm,PBS洗涤,Cannoy液固定3小时,脱水石蜡包埋,3μm厚连续切片,用作IMMC阳性对照。
, 百拇医药
三、方法
1.肺、肠组织切片及分离的PMC涂片分别作HE、甲苯胺蓝及阿新兰-沙红O染色(A-S)染色。
2.单位面积MC计量方法:取肺甲苯胺蓝染片(MC显异染性,胞浆呈紫红色),用图像分析仪(MIAS-300型)测量切片肺组织面积并计数全部MC数,计算单位面积MC数(cell/mm2)。
3.肥大细胞表型的计量方法:采用Ellen等[5]提出的标准MC表型分类(A-S染色[6],IMMC胞浆颗粒蓝染;CTMC则75%以上胞浆颗粒红染),按部位分别计数CTMC、IMMC细胞数,及其各占MC总数的百分率。
测定数据以
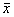 ±s表示,组内比较用t检验,实验组不同阶段MC数量及其表型变化用方差分析。
±s表示,组内比较用t检验,实验组不同阶段MC数量及其表型变化用方差分析。, http://www.100md.com
结 果
染尘结束后1周,主要病变为肺泡炎,病灶多围绕呼吸性细支气管,病变较弥漫;随后部分肺泡炎性渗出物逐渐吸收;12周以后,肺泡炎基本消失。第4周开始出现细胞结节,随病程进展逐渐增多,并转变为细胞-纤维结节、纤维结节(矽结节),间质出现纤维结缔组织增生。
1.空白对照组肺MC(LMC)表型及分布:单位面积LMC数为1.98±0.53(cell/mm2),CTMC型占13.6%±4.79%;IMMC型占86.4%±4.79%。主要分布在胸膜下和支气管-血管旁,肺实质很少。
2.实验组、盐水对照组LMC数量的变化:染尘结束后第1周末,矽肺组单位面积LMC数明显增多,并随病变发展逐渐上升,与盐水组比较,差异有显著性(表1)。
3.LMC表型的变化:染尘结束后1周,LMC的表型发生改变,表现为CTMC比率上升,与空白对照组比较,差异有显著性;矽肺组与盐水组无明显差异。此后矽肺组CTMC率继续上升,盐水组则逐渐恢复至正常水平(表2)。IMMC的变化与CTMC相反,比率逐渐下降。
, 百拇医药
4.肺实质CTMC比率的变化:表3表明,染尘4周后,矽肺组织肺实质CTMC比率随病程进展而逐渐上升,两者呈直线正相关,直线方程Y=3.42±1.04 t(周)。
表1 矽肺组、盐水组肺肥大细胞数的变化(
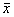 ±s)
±s)Table 1 Changes of lung mast cell(LMC) number in silicosis and saline groups(
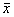 ±s) 组 别
±s) 组 别Group
单位面积肺肥大细胞数 LMC(cell/mm2)
, 百拇医药 1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
4.55±1.29*
5.75±0.93*
5.85±1.13*
, 百拇医药
9.42±1.08**
11.42±1.03**
10.85±2.03**
盐水组
Saline
2.66±0.75
2.12±0.93
2.60±0.35
2.35±0.78
2.21±1.04
2.21±1.04
, http://www.100md.com
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=19.26,P<0.05
*P<0.05,**P<0.01 vs. saline;F=19.26,P<0.05 compared among silicosis groups表2 矽肺组、盐水组全肺结缔组织肥大细胞比率的变化(
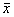 ±s)
±s)Table 2 Changes of connective tissue mast cell(CTMC) rate in whole lung
of silicosis and saline groups(
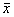 ±s) 组 别
±s) 组 别, http://www.100md.com
Group
结缔组织肥大细胞比率 Rate of CTMC(%)
1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
52.46±12.32
62.96±9.64*
, 百拇医药
63.19±10.00*
70.01±8.34**
79.29±8.34**
81.06±7.10**
盐水组
Saline
53.69±11.85
46.12±11.29
28.38±8.74
21.83±7.80
, 百拇医药 18.37±7.80
18.37±7.80
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=30.01,P<0.01
*P<0.05,**P<0.01 vs. saline;F=30.01,P<0.01 compared among silicosis groups表3 矽肺组、盐水组肺实质结缔组织肥大细胞比率的变化(
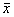 ±s)
±s)Table 3 Changes of CTMC rate in parenchyma of lung of silicosis and saline groups(
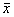 ±s) 组 别
±s) 组 别, 百拇医药
Group
结缔组织肥大细胞比率 Rate of CTMC(%)
1 week
4 weeks
12 weeks
24 weeks
36 weeks
48 weeks
矽肺组
Silicosis
2.65±1.85
12.15±6.18*
, 百拇医药
13.89±7.59*
32.10±10.84**
45.55±7.27**
49.57±8.75**
盐水组
Saline
3.27±1.90
4.49±3.37
1.39±1.04
1.39±1.04
1.33±1.29
, http://www.100md.com
1.33±1.29
与盐水组比较,*P<0.05,**P<0.01;矽肺组组间比较,F=64.15,P<0.01
*P<0.05,**P<0.01 vs. control;F=64.15,P<0.01 compared among silicosis groups讨 论
本实验结果表明:随着矽肺纤维化的发生发展,病灶内MC数量显著增加,与我们以前的观察结果基本一致[2]。
MC具有异质性,在啮齿类动物,按其表型不同分为MMC及CTMC两类[7]。MC的异质性也许反映了两类MC具有不同的生理功能及病理意义。
本实验的表型研究结果表明:矽肺组织中增生的MC主要为CTMC型,且肺实质中CTMC比率与矽肺病程呈直线正相关,与Tomioka[1]等用博来霉素诱发的肺纤维化病灶内的MC表型变化一致。
, http://www.100md.com
有关CTMC增生的机制还不完全清楚。一般认为MC来源于骨髓中的多能干细胞,在干细胞因子(stem cell factor,SCF)、IL3、IL4、IL9及GB-CSF等因子诱导下分化成MC[8]。有报道:在3T3成纤维细胞培养液中发现一种因子能刺激大鼠干细胞增生,并向CTMC分化[9]。在一定条件下MMC可转化为CTMC,如神经生长因子(NGF)可促进鼠IMMC转化,而成纤维细胞可产生NGF[10]。因此,有人把CTMC称为成纤维细胞依赖性细胞。有人将分离的IMMC注入腹腔,可转化为CTMC型细胞。提示微环境与MC表型有关[7]。本实验盐水对照组在实验初期,单位面积MC数量变化不大,表明MC无明显增生;但IMMC明显减少、CTMC明显增加,这一现象也许与注入盐水后导致肺组织微环境一时性变化,从而诱导IMMC向CTMC转化有关。综上所述,矽肺纤维化病灶内的
, http://www.100md.com
CTMC增加,可能是干细胞向CTMC分化的数量增加和原来肺组织中的MMC向CTMC转化的结果。
CTMC增生的病理意义还不明了,已知CTMC的组胺及肝素含量比MMC高。文献报道组胺可促进成纤维细胞增生,肝素可与一些生长因子结合,促进成纤维细胞增生,肝素(0.3~1.0 mg/ml)本身可直接刺激成纤维细胞增生[9]。此外,CTMC还可分泌肿瘤坏死因子α(TNF-α),后者又可以促进成纤维细胞增生。看来,MC对矽肺纤维化发生发展可能具有一定的作用,应予以重视。
本研究受国家自然科学基金和CMB资助
参考文献
1 Tomioka M,Goto T,Lee TDG,et al.Isolation and characterization of lung mast cells from rats with bleomycin-induced pulmonary fibrosis.Immunol,1989,66:439~444.
, 百拇医药
2 钱仲
 ,戚以谟.实验性矽末沉着病肥大细胞的研究.中华病理学杂志,1992,21:346~348.
,戚以谟.实验性矽末沉着病肥大细胞的研究.中华病理学杂志,1992,21:346~348.3 钱仲
 ,尹红玲,罗俊铭.等.肥大细胞对肺成纤维细胞生长的影响.中华劳动卫生职业病杂志,1995,3:149~153.
,尹红玲,罗俊铭.等.肥大细胞对肺成纤维细胞生长的影响.中华劳动卫生职业病杂志,1995,3:149~153.4 郑晖,钱仲
 .肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15:186~187.
.肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15:186~187.5 Jarrett EEE,Haig DM.Mucosal mast cells in vivo and vitro.Immunol Today,1984,5:115~119.
, 百拇医药
6 Van Overveld FJ,Houben LAMJ,Schmitze du Moulin FEM,et al.Mast cell heterogeneity in human lung tissue.Clin Science,1989,77:297~304.
7 Marshall JS,Bienenstock J.Mast cells.Springer Semin Immunopathol,1990,12:191~202.
8 汝小美.肥大细胞分化及调节.细胞生物学杂志,1992,14:110~114.
9 Yamashita Y,Nakagomi K,Takeda T,et al.Effect of heparin on pulmonary fibroblasts and vascular cells.Thorax,1992,47:634~639.
10 Stevens RL,Austen F.Recent advances in cellular and molecullar biology of mast cells.Immunol Today,1989,10:381~396.
(收稿:1998-01-26 修回:1998-05-19), 百拇医药