葡多酚对小鼠DNA与染色体放射性损伤的防护作用
作者:钟进义 栗世如
单位:266021 青岛大学医学院
关键词:DNA损伤;辐射防护;葡多酚
中华劳动卫生职业病杂志/990406 摘要 目的 探讨葡多酚对辐照诱发的DNA与染色体损伤的防护作用。方法 将小鼠经口灌胃给予不同剂量葡多酚,采用60Co γ射线全身照射1次,照射后第2天检测各组动物的脾细胞DNA损伤、骨髓嗜多染红细胞微核率和肝脏丙二醛(MDA)含量3项指标。结果 同阳性对照组比较,各试验组的DNA损伤程度、微核率和MDA水平均有不同程度降低。经t(或χ2)检验,差异均有显著性意义(P<0.05)。 结论 葡多酚对放射线照射引发的DNA和染色体损伤有良好的防护作用。
Study on the protective effect of grape polyphenol on DNA and chromosome damage induced by irradiation in mice
, 百拇医药
Zhong Jinyi,Li Shiru.Medical College of Qingdao university,Qingdao 266021
Abstract Objective To study the protective effect of grape polyphenol(GPP) on DNA and chromosome damage induced by irradiation. Method Three indices including spleen cell DNA damage,bone marrow on PCEs and liver MDA content were examined in the mice given different dose of GPP by mouth were radiated by 60 Co γ-ray once. Results Compared with that in positive control group,the degrees of DNA damage,rate of micronucleus and MDA content of mice reduced differently in the protected groups.All the differences above are signifcantly in statistic(P<0.05). Conclusion The present experiment proves that GPP has dominant protective effect on DNA and chromosome damage induced by irradiation.
, 百拇医药
Key words DNA damage Irradiation protection Grape polyphenol
由于原子能在生活和生产领域中的应用日益广泛,人类接触放射性物质及受辐射损伤的机会也随之增加。因而,加强对放射性损伤防护的研究有重要意义。葡多酚(grape polyphonel,GPP)是从葡萄核中提取的一种天然植物多酚物质,国外多称为原花青素(procyanidins)[1]。据国外研究报道,GPP具有抗氧化、抗自由基损伤、抗肿瘤和血管活性等多方面生理功效,并已在药品、保健品、化妆品等领域有较多应用[2]。但国内至今未见有关GPP功效与应用的研究报道。为探讨GPP对辐射损伤的防护作用,我们进行了本次实验。
材料与方法
1.动物与分组:山东省实验动物中心提供昆明种小鼠30只,体重20~22 g。随机分为高、中、低剂量3个实验组和阳性对照组、阴性对照组共5个组,每组6只,雌雄各半。
, 百拇医药
2.葡多酚:将新鲜葡萄弃汁取核,用溶剂浸提法分离提纯所得,纯度>99.9%。标准品由日本岛田株式会社提供。
3.照射条件:60Co γ射线源(青岛大学医学院附属医院钴源室),照射距离90 cm,剂量率为93.7 cGy/min,小鼠单次全身性照射总剂量为2.0 Gy。
4.实验方法:高、中、低3个实验组动物给予GPP剂量依次为500、250、50 mg/kg。阳性对照组只给蒸馏水,0.5 ml/只。每天早晨灌胃1次,连续5天。在最后1次灌胃后的10分钟内将动物全身性照射1次。阴性对照组不照射,只按同样方法给予GPP 500 mg/kg。全部动物均于照射后的第2天处死并同时进行有关指标检测。
5.检测指标:(1)DNA损伤:取脾脏制成细胞浆,用DNA碱性解链荧光分析方法测定[3]。用RF 540荧光分光光度计(日本岛津公司产品)测定荧光强度。未受损伤DNA相对含量(D值)依照公式D=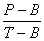 ×100%计算。式中:B为本体系中非DNA物质荧光强度,T为总荧光强度,P为除去受损伤DNA后的荧光强度。(2)骨髓嗜多染红细胞微核(MCN):取小鼠股骨,用小牛血清冲洗并收集骨髓,参照微核常规试验方法进行制片、显微镜观察和分析[4]。(3)肝脏丙二醛(MDA)含量:取肝脏约0.3 g,匀浆后用比色法测定。测试盒为南京建成生物工程研究所提供。
×100%计算。式中:B为本体系中非DNA物质荧光强度,T为总荧光强度,P为除去受损伤DNA后的荧光强度。(2)骨髓嗜多染红细胞微核(MCN):取小鼠股骨,用小牛血清冲洗并收集骨髓,参照微核常规试验方法进行制片、显微镜观察和分析[4]。(3)肝脏丙二醛(MDA)含量:取肝脏约0.3 g,匀浆后用比色法测定。测试盒为南京建成生物工程研究所提供。
, 百拇医药
结果
1.DNA损伤:阳性对照组的DNA含量(D值)平均为39.25±2.37,阴性对照组为77.12±2.19。经t检验,二者差异有非常显著意义(P<0.01)。各实验组的DNA含量均高于阳性对照组(P<0.01),3个实验组对DNA损伤的防护度为高剂量>中剂量>低剂量(经χ2 检验,P<0.05)。各组的平均D值及对DNA损伤的防护度见表1。防护度的计算公式:(实验组-阳性对照)÷(阴性对照-阳性对照)×100%。
表1 葡多酚(GPP)对DNA放射损伤的防护作用
Table 1 The protective effect of GPP on DNA damage
induced by irradiation 组别
, http://www.100md.com Group
照射剂量
Dose of
irradiation
(Gy)
GPP剂量
Dose of
GPP
(mg/kg)
D 值
D value
(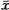 ±s)
±s)
, 百拇医药
防护度
Rate of
protection
(%)
高剂量组
Group H
2
500
53.71±2.17
38.18* *
中剂量组
Group M
, 百拇医药
2
250
49.03±2.43
25.83* *
低剂量组
Group L
2
50
42.15±2.51
7.66* *
阳性对照
Control P
, 百拇医药
2
0
39.25±2.37
0
阴性对照
Control N
0
500
77.12±2.28
100.00* *
与阳性对照组比,* * P<0.01; 每组动物数=6
* * P<0.01 vs. control P; The number of animals of each group=6
, http://www.100md.com
2.抗微核效应:阳性对照组微核细胞率为3.367%,高于阴性对照组及各实验组。经χ2检验,差异均有显著意义(P<0.05)。3个实验组的微核抑制率为高剂量>中剂量>低剂量(χ2检验,P<0.05)。各组微核抑制率按公式(阳性对照-实验组)÷阳性对照×100%计算,结果见表2。
表2 葡多酚(GPP)对辐照诱发小鼠微核的抑制作用
Table 2 The inhibitory effect of GPP on micronucleus
induced by irradiation in mice 组别
Group
微核细胞数
No. of cell
, http://www.100md.com
with MCN
微核率
MCN rate
(%)
抑制率
Inhibition rate
(%)
高剂量组
Group H
113
1.883
44.07*
, 百拇医药
中剂量组
Group M
129
2.150
36.34*
低剂量组
Group L
161
2.683
20.31*
阳性对照
Control P
, 百拇医药
202
3.367
阴性对照
Control N
93
0.155
95.39* *
与阳性对照组比,*P<0.05,* *P<0.01;每组动物数=6,观察细胞数=6 000
* P<0.05,* *P<0.01 vs. control P;The number of animals of each group=6;The number of counted cells=6 000
, 百拇医药
3.MDA含量:阳性对照组动物肝脏的MDA平均含量为(4.61±0.36) nmol/mg蛋白,较阴性对照组升高1.09 nmol/mg蛋白。经t检验,差异有非常显著意义(P<0.01)。其他各组的MDA含量见表3。同阳性对照组比较,3个实验组MDA含量的降低幅度以高剂量组最大,低剂量组最小,但均低于阴性对照组。经χ2检验,差异均有显著意义(P<0.05)。MDA降低辐度按照公式(阳性对照组-实验组)÷阳性对照组×100%计算。
表3 葡多酚(GPP)对小鼠肝脏MDA含量的影响
Table 3 The influence of GPP on MDA content
of mice liver 组别
Group
照射
, 百拇医药
Irradiation
GPP 剂量
Dose of
GPP
(mg/kg)
MDA 含量
MDA content
(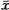 ±s)
±s)
(nmol/mg Prot.)
降低幅度
Reduction
, http://www.100md.com
rate
(%)
高剂量组
Group H
+
500
3.82±0.29
17.14*
中剂量组
Group M
+
250
3.99±0.30
, http://www.100md.com
13.45*
低剂量组
Group L
+
50
4.24±0.28
8.03*
阳性对照
Control P
+
0
4.61±0.36
, 百拇医药
0
阴性对照
Control N
-
500
3.52±0.33
23.64* *
与阳性对照组比,*P<0.05,* *P<0.01;每组动物数=6
* P<0.05,* *P<0.01 vs. control P; The number of animals of each group=6
, 百拇医药
讨论
脾脏和骨髓都是对放射线较为敏感的组织,受辐照后可在细胞、分子水平上发生形态、数量及生化等多方面病理改变[5]。小鼠骨髓嗜多染红细胞微核试验是检测染色体损伤的常用经典方法之一[4]。DNA碱性解链荧光分析方法是目前国内外较多采用的一种检测DNA损伤的灵敏方法[3,6]。由本次实验结果可见:动物经60Co γ射线照射后,阳性对照组的微核细胞率明显高于阴性对照组,但其未受损伤DNA含量却低于阴性对照组,说明其染色体和DNA均已受到辐射损伤。同阳性对照组比较,3个实验组的微核率和DNA损伤程度均有降低,但均高于阴性对照组,各实验组之间的差异均有显著性,并呈现随GPP剂量增加,微核率和DNA损伤程度则随之降低的明显剂量-反应关系。其中高剂量组对DNA损伤的防护度和对微核的抑制率分别达38.18%和44.07%,表明GPP对辐照引发的DNA和染色体损伤有良好的防护作用。
, http://www.100md.com GPP对染色体和DNA放射性损伤的防护作用,其机制可能与GPP能抑制体内自由基产生,降低脂质过氧化反应程度有关。机体受辐照损伤后产生的内源性自由基能攻击生物膜中的多不饱和脂肪酸,进而发生脂质过氧化和DNA等生物大分子损伤[5,7]。由表3可见,阳性对照组肝脏MDA含量高于阴性对照及其他各组,表明其体内过氧化反应加强,脂质过氧化物积蓄量增多。3个实验组的MDA含量虽然也高于阴性对照组,但其水平却随GPP剂量增加而逐渐降低,表明GPP对脂质过氧化有较好的抵抗作用。这同文献报道GPP有抗氧化、抗自由基损伤作用相一致[1,2,8]。
综合本次实验结果可以认为:小鼠口服GPP可降低60Co γ射线全身性照射引发的DNA与染色体损伤,呈现出良好的抗辐射损伤作用。其机制可能与GPP能降低辐照所致机体的脂质过氧化和自由基损伤有关,有待进一步实验研究。
本文为国家自然科学基金资助项目的部分内容(39870678)
, 百拇医药
参考文献
[1] 国植,徐莉.原花青素,具有广阔发展前景的植物药.国外医学植物学分册,1996,11:196-201.
[2] Maffei Facino R,Carini M,Aldini G,et al.Free radical scavenging action and anti enzyme activities of procyanidins from vitis vinifera.Arzneim-Forsch/Drug Res,1994,44:592-600.
[3] Birnboim HC.Fulrometric method for rapid detection of DNA strand break in human white blood cell produced by radiation.Cancer Res,1981,41:1889-1891.
, http://www.100md.com
[4] 李寿棋.卫生毒理学基本原理与方法.成都:四川科学技术出版社,1987.457-460.
[5] 郭鹞,王克为,王子灿,等.放射病理学.北京:人民卫生出版社,1987.136-141.
[6] 杨业鹏,徐厚恩,南新升.快速检验DNA链断裂的解螺旋荧光分析方法.卫生毒理学杂志,1994,8:118-119.
[7] 陈静,刘基芳,曲雅琴,等.β-胡萝卜素和维生素E抗辐射作用临床观察.中华放射医学与防护杂志,1997,17:117-119.
[8] Melzer R,Frickeu,Holzl J.Vasoactive properties of procyanidins from hypericum perforatum in isolated coranary arteris.Arzneim-Forsch/Drug Res,1991,41:481-483.
(收稿:1998-10-09 修回:1999-03-11), 百拇医药
单位:266021 青岛大学医学院
关键词:DNA损伤;辐射防护;葡多酚
中华劳动卫生职业病杂志/990406 摘要 目的 探讨葡多酚对辐照诱发的DNA与染色体损伤的防护作用。方法 将小鼠经口灌胃给予不同剂量葡多酚,采用60Co γ射线全身照射1次,照射后第2天检测各组动物的脾细胞DNA损伤、骨髓嗜多染红细胞微核率和肝脏丙二醛(MDA)含量3项指标。结果 同阳性对照组比较,各试验组的DNA损伤程度、微核率和MDA水平均有不同程度降低。经t(或χ2)检验,差异均有显著性意义(P<0.05)。 结论 葡多酚对放射线照射引发的DNA和染色体损伤有良好的防护作用。
Study on the protective effect of grape polyphenol on DNA and chromosome damage induced by irradiation in mice
, 百拇医药
Zhong Jinyi,Li Shiru.Medical College of Qingdao university,Qingdao 266021
Abstract Objective To study the protective effect of grape polyphenol(GPP) on DNA and chromosome damage induced by irradiation. Method Three indices including spleen cell DNA damage,bone marrow on PCEs and liver MDA content were examined in the mice given different dose of GPP by mouth were radiated by 60 Co γ-ray once. Results Compared with that in positive control group,the degrees of DNA damage,rate of micronucleus and MDA content of mice reduced differently in the protected groups.All the differences above are signifcantly in statistic(P<0.05). Conclusion The present experiment proves that GPP has dominant protective effect on DNA and chromosome damage induced by irradiation.
, 百拇医药
Key words DNA damage Irradiation protection Grape polyphenol
由于原子能在生活和生产领域中的应用日益广泛,人类接触放射性物质及受辐射损伤的机会也随之增加。因而,加强对放射性损伤防护的研究有重要意义。葡多酚(grape polyphonel,GPP)是从葡萄核中提取的一种天然植物多酚物质,国外多称为原花青素(procyanidins)[1]。据国外研究报道,GPP具有抗氧化、抗自由基损伤、抗肿瘤和血管活性等多方面生理功效,并已在药品、保健品、化妆品等领域有较多应用[2]。但国内至今未见有关GPP功效与应用的研究报道。为探讨GPP对辐射损伤的防护作用,我们进行了本次实验。
材料与方法
1.动物与分组:山东省实验动物中心提供昆明种小鼠30只,体重20~22 g。随机分为高、中、低剂量3个实验组和阳性对照组、阴性对照组共5个组,每组6只,雌雄各半。
, 百拇医药
2.葡多酚:将新鲜葡萄弃汁取核,用溶剂浸提法分离提纯所得,纯度>99.9%。标准品由日本岛田株式会社提供。
3.照射条件:60Co γ射线源(青岛大学医学院附属医院钴源室),照射距离90 cm,剂量率为93.7 cGy/min,小鼠单次全身性照射总剂量为2.0 Gy。
4.实验方法:高、中、低3个实验组动物给予GPP剂量依次为500、250、50 mg/kg。阳性对照组只给蒸馏水,0.5 ml/只。每天早晨灌胃1次,连续5天。在最后1次灌胃后的10分钟内将动物全身性照射1次。阴性对照组不照射,只按同样方法给予GPP 500 mg/kg。全部动物均于照射后的第2天处死并同时进行有关指标检测。
5.检测指标:(1)DNA损伤:取脾脏制成细胞浆,用DNA碱性解链荧光分析方法测定[3]。用RF 540荧光分光光度计(日本岛津公司产品)测定荧光强度。未受损伤DNA相对含量(D值)依照公式D=
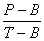 ×100%计算。式中:B为本体系中非DNA物质荧光强度,T为总荧光强度,P为除去受损伤DNA后的荧光强度。(2)骨髓嗜多染红细胞微核(MCN):取小鼠股骨,用小牛血清冲洗并收集骨髓,参照微核常规试验方法进行制片、显微镜观察和分析[4]。(3)肝脏丙二醛(MDA)含量:取肝脏约0.3 g,匀浆后用比色法测定。测试盒为南京建成生物工程研究所提供。
×100%计算。式中:B为本体系中非DNA物质荧光强度,T为总荧光强度,P为除去受损伤DNA后的荧光强度。(2)骨髓嗜多染红细胞微核(MCN):取小鼠股骨,用小牛血清冲洗并收集骨髓,参照微核常规试验方法进行制片、显微镜观察和分析[4]。(3)肝脏丙二醛(MDA)含量:取肝脏约0.3 g,匀浆后用比色法测定。测试盒为南京建成生物工程研究所提供。, 百拇医药
结果
1.DNA损伤:阳性对照组的DNA含量(D值)平均为39.25±2.37,阴性对照组为77.12±2.19。经t检验,二者差异有非常显著意义(P<0.01)。各实验组的DNA含量均高于阳性对照组(P<0.01),3个实验组对DNA损伤的防护度为高剂量>中剂量>低剂量(经χ2 检验,P<0.05)。各组的平均D值及对DNA损伤的防护度见表1。防护度的计算公式:(实验组-阳性对照)÷(阴性对照-阳性对照)×100%。
表1 葡多酚(GPP)对DNA放射损伤的防护作用
Table 1 The protective effect of GPP on DNA damage
induced by irradiation 组别
, http://www.100md.com Group
照射剂量
Dose of
irradiation
(Gy)
GPP剂量
Dose of
GPP
(mg/kg)
D 值
D value
(
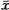 ±s)
±s), 百拇医药
防护度
Rate of
protection
(%)
高剂量组
Group H
2
500
53.71±2.17
38.18* *
中剂量组
Group M
, 百拇医药
2
250
49.03±2.43
25.83* *
低剂量组
Group L
2
50
42.15±2.51
7.66* *
阳性对照
Control P
, 百拇医药
2
0
39.25±2.37
0
阴性对照
Control N
0
500
77.12±2.28
100.00* *
与阳性对照组比,* * P<0.01; 每组动物数=6
* * P<0.01 vs. control P; The number of animals of each group=6
, http://www.100md.com
2.抗微核效应:阳性对照组微核细胞率为3.367%,高于阴性对照组及各实验组。经χ2检验,差异均有显著意义(P<0.05)。3个实验组的微核抑制率为高剂量>中剂量>低剂量(χ2检验,P<0.05)。各组微核抑制率按公式(阳性对照-实验组)÷阳性对照×100%计算,结果见表2。
表2 葡多酚(GPP)对辐照诱发小鼠微核的抑制作用
Table 2 The inhibitory effect of GPP on micronucleus
induced by irradiation in mice 组别
Group
微核细胞数
No. of cell
, http://www.100md.com
with MCN
微核率
MCN rate
(%)
抑制率
Inhibition rate
(%)
高剂量组
Group H
113
1.883
44.07*
, 百拇医药
中剂量组
Group M
129
2.150
36.34*
低剂量组
Group L
161
2.683
20.31*
阳性对照
Control P
, 百拇医药
202
3.367
阴性对照
Control N
93
0.155
95.39* *
与阳性对照组比,*P<0.05,* *P<0.01;每组动物数=6,观察细胞数=6 000
* P<0.05,* *P<0.01 vs. control P;The number of animals of each group=6;The number of counted cells=6 000
, 百拇医药
3.MDA含量:阳性对照组动物肝脏的MDA平均含量为(4.61±0.36) nmol/mg蛋白,较阴性对照组升高1.09 nmol/mg蛋白。经t检验,差异有非常显著意义(P<0.01)。其他各组的MDA含量见表3。同阳性对照组比较,3个实验组MDA含量的降低幅度以高剂量组最大,低剂量组最小,但均低于阴性对照组。经χ2检验,差异均有显著意义(P<0.05)。MDA降低辐度按照公式(阳性对照组-实验组)÷阳性对照组×100%计算。
表3 葡多酚(GPP)对小鼠肝脏MDA含量的影响
Table 3 The influence of GPP on MDA content
of mice liver 组别
Group
照射
, 百拇医药
Irradiation
GPP 剂量
Dose of
GPP
(mg/kg)
MDA 含量
MDA content
(
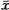 ±s)
±s)(nmol/mg Prot.)
降低幅度
Reduction
, http://www.100md.com
rate
(%)
高剂量组
Group H
+
500
3.82±0.29
17.14*
中剂量组
Group M
+
250
3.99±0.30
, http://www.100md.com
13.45*
低剂量组
Group L
+
50
4.24±0.28
8.03*
阳性对照
Control P
+
0
4.61±0.36
, 百拇医药
0
阴性对照
Control N
-
500
3.52±0.33
23.64* *
与阳性对照组比,*P<0.05,* *P<0.01;每组动物数=6
* P<0.05,* *P<0.01 vs. control P; The number of animals of each group=6
, 百拇医药
讨论
脾脏和骨髓都是对放射线较为敏感的组织,受辐照后可在细胞、分子水平上发生形态、数量及生化等多方面病理改变[5]。小鼠骨髓嗜多染红细胞微核试验是检测染色体损伤的常用经典方法之一[4]。DNA碱性解链荧光分析方法是目前国内外较多采用的一种检测DNA损伤的灵敏方法[3,6]。由本次实验结果可见:动物经60Co γ射线照射后,阳性对照组的微核细胞率明显高于阴性对照组,但其未受损伤DNA含量却低于阴性对照组,说明其染色体和DNA均已受到辐射损伤。同阳性对照组比较,3个实验组的微核率和DNA损伤程度均有降低,但均高于阴性对照组,各实验组之间的差异均有显著性,并呈现随GPP剂量增加,微核率和DNA损伤程度则随之降低的明显剂量-反应关系。其中高剂量组对DNA损伤的防护度和对微核的抑制率分别达38.18%和44.07%,表明GPP对辐照引发的DNA和染色体损伤有良好的防护作用。
, http://www.100md.com GPP对染色体和DNA放射性损伤的防护作用,其机制可能与GPP能抑制体内自由基产生,降低脂质过氧化反应程度有关。机体受辐照损伤后产生的内源性自由基能攻击生物膜中的多不饱和脂肪酸,进而发生脂质过氧化和DNA等生物大分子损伤[5,7]。由表3可见,阳性对照组肝脏MDA含量高于阴性对照及其他各组,表明其体内过氧化反应加强,脂质过氧化物积蓄量增多。3个实验组的MDA含量虽然也高于阴性对照组,但其水平却随GPP剂量增加而逐渐降低,表明GPP对脂质过氧化有较好的抵抗作用。这同文献报道GPP有抗氧化、抗自由基损伤作用相一致[1,2,8]。
综合本次实验结果可以认为:小鼠口服GPP可降低60Co γ射线全身性照射引发的DNA与染色体损伤,呈现出良好的抗辐射损伤作用。其机制可能与GPP能降低辐照所致机体的脂质过氧化和自由基损伤有关,有待进一步实验研究。
本文为国家自然科学基金资助项目的部分内容(39870678)
, 百拇医药
参考文献
[1] 国植,徐莉.原花青素,具有广阔发展前景的植物药.国外医学植物学分册,1996,11:196-201.
[2] Maffei Facino R,Carini M,Aldini G,et al.Free radical scavenging action and anti enzyme activities of procyanidins from vitis vinifera.Arzneim-Forsch/Drug Res,1994,44:592-600.
[3] Birnboim HC.Fulrometric method for rapid detection of DNA strand break in human white blood cell produced by radiation.Cancer Res,1981,41:1889-1891.
, http://www.100md.com
[4] 李寿棋.卫生毒理学基本原理与方法.成都:四川科学技术出版社,1987.457-460.
[5] 郭鹞,王克为,王子灿,等.放射病理学.北京:人民卫生出版社,1987.136-141.
[6] 杨业鹏,徐厚恩,南新升.快速检验DNA链断裂的解螺旋荧光分析方法.卫生毒理学杂志,1994,8:118-119.
[7] 陈静,刘基芳,曲雅琴,等.β-胡萝卜素和维生素E抗辐射作用临床观察.中华放射医学与防护杂志,1997,17:117-119.
[8] Melzer R,Frickeu,Holzl J.Vasoactive properties of procyanidins from hypericum perforatum in isolated coranary arteris.Arzneim-Forsch/Drug Res,1991,41:481-483.
(收稿:1998-10-09 修回:1999-03-11), 百拇医药