苯及其代谢产物在小鼠骨髓中形成DNA加合物的实验研究
作者:常平 戴宇飞 李桂兰
单位:10050 北京,中国预防医学科学院劳动卫生与职业病研究所
关键词:苯;代谢产物;32P后标记方法;DNA加合物;髓性毒性
中华劳动卫生职业病杂志/990402 摘要 目的 观察苯及其主要代谢产物苯酚、氢醌、苯醌及苯酚和氢醌联合染毒在小鼠骨髓中形成的DNA加合物及其髓性毒性。方法 改进的32P后标记方法。结果 苯及其主要代谢产物均能在小鼠骨髓细胞中形成至少1种DNA加合物,相对加合物水平从0.85×10-8~6.78×10-8不等。骨髓细胞计数结果表明:单独染苯酚或氢醌,对小鼠骨髓细胞均没有抑制作用,但二者联合染毒对小鼠却表现出增强的髓性毒作用。结论 苯及其主要代谢产物均能在小鼠骨髓细胞中形成DNA加合物,苯的代谢产物形成的DNA加合物与髓性毒性有关。
, 百拇医药
DNA adduct formation in the bone marrow of mice treated with benzene and some metabolites
Chang Ping,Dai Yufei,Li Guilan.Institute of Occupational Medicine,Chinese Academy of Preventive Medicine,Beijing 100050
Abstract Objective To investigate DNA adduct formation induced by benzene and some metabolites in the bone marrow and the myelotoxicity. Methods Female Kunming mice were treated intraperioneally with benzene and some metabolites twice daily,and nuclease P1-enhanced 32 P-postlabelling assay was used to study the effect. Results No adduct was detected in the bone marrow of control group.At least one major DNA adduct was detected in the bone marrow of mice treated with benzene,phenol,hydroquinone,benzoquinone respectively and coadministration of phenol and hydroquinone.The relative adduct levels ranged from 0.85×10-8~6.78×10-8.Administration of phenol(75mg/kg) or hydroquinone(75 mg/kg) twice daily for 12 days did not result in a suppression of bone marrow cellularity respectively.However,the concomitant administration of phenol(75 mg/kg) and hydroquinone(50 mg/kg) twice a day for 12 days produced a significant decrease in bone marrow cellularity. Conclusion Benzene and some metabolites showed myelotoxicity by forming adduct in the bone marrow.
, 百拇医药
Key words Benzene Metabolites 32P-postlabelling DNA adduct Myelotoxicity
苯能抑制骨髓细胞增殖,引起血液性疾病[1]。苯能在动物体内形成DNA加合物,苯的代谢产物在体外培养的细胞中也能与DNA发生共价结合[2-4]。但有关苯的代谢产物在动物骨髓中形成DNA加合物的研究报道甚少。我们采用改进的32P后标记法,对苯及其代谢产物苯酚、氢醌、苯醌及苯酚和氢醌联合染毒在小鼠骨髓中形成DNA加合物的情况进行了初步研究,以探讨苯及其代谢产物的髓性毒作用。
材料与方法
一、主要试剂及溶液配制
苯(分析纯,北京化学试剂厂产品)用花生油配成体积分数为10%的溶液,苯酚(分析纯,北京化学试剂厂产品)用灭菌生理盐水配成体积分数为1%的溶液,氢醌(分析纯,美国Aldrich公司产品)用灭菌生理盐水配成体积分数为1%的溶液,苯醌(分析纯,美国Aldrich公司产品)用灭菌生理盐水配成体积分数为0.05%的溶液,苯酚和氢醌用灭菌生理盐水配成体积分数为1.5%苯酚+体积分数为1%氢醌混合溶液。RNase A、蛋白酶 K、牛脾磷酸二酯酶(SPD)、微球菌内切酶(MN)、核酸酶P1、Apyrase、T4 多聚核苷酸激酶(PNK)等均购自美国Sigma公司,[γ-32P]ATP[370 MBq/ml(10 mCi/ml)]购自英国Amersham公司。PEI Cellulose薄层层析板购自德国Macherey-Nagel公司。4向层析液:D1—0.4 mol/L磷酸二氢钠,pH 6.8;D2—1.8 mol/L甲酸锂、4.5 mol/L尿素,pH 3.5;D3—0.36 mol/L氯化锂、0.22 mol/L Tris、3.8 mol/L尿素,pH 3.5;D4—1.7 mol/L磷酸二氢钠,pH 6.0。
, 百拇医药
二、方法
1.加合物检测实验动物的处理:健康雌性昆明种小鼠50只,体重18~22 g(购自中国医学科学院动物中心),随机分成5个染毒组和1个对照组。染毒方式均为腹腔注射,2次/d,间隔6小时。各染毒组的染毒剂量及时间为:(1)苯酚组:6只小鼠,75 mg/kg,共12天;(2)氢醌组:6只小鼠,75 mg/kg,共12天;(3)联合染毒组:14只小鼠,苯酚75 mg/kg、氢醌50 mg/kg,共12天;(4)苯醌组:12只小鼠,2.5 mg/kg,共7天;(5)苯组:6只小鼠,500 mg/kg,共7天;(6)对照组:6只小鼠,注射等量生理盐水,共12天。各组均在最末一次染毒后24小时处死,提取骨髓DNA。
2.骨髓细胞计数实验动物的处理:健康雌性昆明种小鼠34只,体重18~22 g(来源同前),随机分成3个染毒组(苯酚组6只、氢醌组6只、联合染毒组16只)和1个对照组(6只)。动物来源、染毒方式、剂量和时间同加合物检测实验。各组均在最末一次染毒后24小时处死,取出右侧股骨,剥去软组织,剪去股骨两端皮质,用体积分数为5%的乙酸稀释液冲出股骨内的全部细胞,按白细胞计数法计数有核细胞,算出整个股骨的有核细胞总数。
, 百拇医药
3.骨髓DNA的提取及定量:用生理盐水从骨髓腔中冲出骨髓细胞,3 000 r/min离心6分钟后,弃上清,用生理盐水清洗3遍后,按文献[5]提取DNA并定量。
4.DNA加合物的检测:向5 μg DNA中加入0.2U/μl MN 2 μl、0.02 U/μl SPD 1 μl、100 mmol/L∶50 mmol/L琥珀酸钠-氯化钙缓冲液(pH 6.0) 1 μl,补足双蒸水至总体积12 μl,37 ℃水浴2小时;水解产物加入核酸酶(5 μg/μl)1 μl、0.25 mol/L醋酸钠(pH 5.0) 2 μl、0.3 mmol/L氯化锌1.5 μl,总体积16.5 μl。37 ℃水浴40分钟后将反应物抽干,加入0.5 mol/L Tris (pH 8.0) 1.75 μl、0.75 μl激酶缓冲液(200 mmol/L Bicine、100 mmol/L氯化镁、100 mmol/L二硫苏糖醇、10 mmol/L亚精胺,pH 9.7)、[γ-32P]ATP(370 MBq/ml)2.5 μl、PNK 10 U,补足双蒸水至总体积8 μl,37 ℃标记1小时。向反应体系中加入Apyrase(0.05 U/μl) 2 μl,37 ℃保温30分钟后,在PEI薄层层析板上点样,进行4向层析:D1向带滤纸过夜,D2向约30分钟,D3向带滤纸约7小时(上滤纸16 cm),D4向带滤纸约2小时(上滤纸5 cm),每次层析后均用双蒸水洗板2次。层析温度27~29 ℃。层析结束后,-80 ℃放射自显影3天,用液闪仪对加合物斑点作定量测定。
, http://www.100md.com
5.统计学处理:实验数据采用方差分析和t检验进行统计学处理。
结果
1.小鼠骨髓细胞计数:结果表明联合染毒组小鼠骨髓有核细胞数下降(表1)。
表1 苯酚、氢醌及联合染毒小鼠骨髓细胞计数结果
Table 1 The results of bone marrow cellularity of mice treated with phenol,hydroquinone and combination 组别
Group
动物数
No.of mice
, http://www.100md.com 染毒剂量
Dose(mg/kg)
染毒时间
Time(d)
骨髓有核细胞/股骨
Bone marrow cells/femur( ±s,×107)
±s,×107)
苯酚 Phenol
6
75
12
2.27±0.53
, 百拇医药
氢醌 Hydroquinone
6
75
12
2.11±0.73
苯酚+氢醌 Phenol+Hydroquinone
7
75+50
12
1.55±0.35**
对照 Control
6
, 百拇医药
12
2.75±0.47
与对照组比较,**P<0.01 **P<0.01 vs. control
2.加合物检测各组小鼠染毒结束后存活率:苯酚组、氢醌组、苯组及对照组小鼠全部存活;联合染毒组及苯醌组各存活6只。骨髓细胞实验动物染毒结果,除联合组死亡9只小鼠外,其余各组小鼠均全部存活。
苯及其代谢产物在小鼠骨髓中的DNA加合物检出情况:苯及其代谢产物在小鼠骨髓中均可与DNA作用形成至少1种加合物,结果见表2。放射自显影图见图1~图6。
图1 苯酚组小鼠骨髓DNA加合物放射自显影图
, http://www.100md.com
Fig 1 Autoradiogram of bone marrow DNA adducts in the mice treated with 75 mg/kg phenol twice daily for 12 days
图2 氢醌组小鼠骨髓DNA加合物放射自显影图
Fig 2 Autoradiogram of bone marrow DNA adducts in the mice treated with 75 mg/kg hydroquinone twice daily for 12 days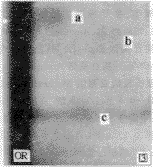
图3 苯酚+氢醌联合组小鼠骨髓DNA加合物放射自显影图
, http://www.100md.com
Fig 3 Autoradiogram of bone marrow DNA adducts in the mice treated with coadministration of 75 mg/kg phenol and 50 mg/kg hydroquinone twice daily for 12 days
图4 苯醌组小鼠骨髓DNA加合物放射自显影图
Fig 4 Autoradiogram of bone marrow DNA adducts in the mice treated with 2.5 mg/kg benzoquinone twice daily for 7 days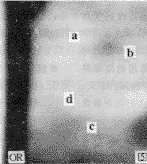
, http://www.100md.com 图5 苯组小鼠骨髓DNA加合物放射自显影图
Fig 5 Autoradiogram of bone marrow DNA adducts in the mice treated with 500 mg/kg benzene twice daily for 7 days
图6 对照组小鼠骨髓DNA加合物放射自显影图
Fig 6 Autoradiogram of bone marrow DNA adducts in negative-control mice
表2 苯及其代谢产物在小鼠骨髓中形成的DNA加合物斑点数
Table 2 The results of DNA adduct spots in bone marrow of mice treated with benzene and its metabolites 组别 Group
, 百拇医药
动物数
No.of mice
染毒剂量
Dose(mg/kg)
染毒时间
Time(d)
加合物斑点数 Adduct spots
a
b
c
d
苯酚 Phenol
, 百拇医药 6
75
12
+
氢醌 Hydroquinone
6
75
12
+
+
苯酚+氢醌 Phenol+Hydroquinone
6
75+50
, 百拇医药
12
+
+
+
苯醌 Benzoquinone
6
2.5
7
+
苯 Benzene
6
500
7
, 百拇医药
+
+
+
+
对照 Control
6
12
3.小鼠骨髓DNA加合物含量:各组小鼠骨髓中苯及其代谢产物DNA加合物斑点的放射自显影定量结果见表3,参照文献[6]换算成相对加合物标记量(RAL)。表3 小鼠骨髓中苯及其代谢产物DNA加合物含量测定结果
Table 3 Determination of radioactivity of DNA adduct spots in mice treated with benzene and its metabolites 组别 Group
, http://www.100md.com
动物数
No.of mice
放射性计数(次/min)
Radioactivity(count/min)
相对加合物标记量(×10-8)
Relative adduct labelling(×10-8)
总计
Total
(×10-8)
a
, http://www.100md.com b
c
d
a
b
c
d
苯酚 Phenol
6
280.6
0.85
0.85
氢醌 Hydroquinone
, 百拇医药
6
359.7
958.5
1.25
4.10
5.35
苯酚+氢醌 Phenol+Hydroquinone
6
793.7
408.1
365.3
3.30
, 百拇医药 1.50
1.25
6.05
苯醌 Benzoquinone
6
370.0
1.30
1.30
苯 Benzene
6
349.1
852.6
488.1
, 百拇医药
132.4
1.20
3.60
1.83
0.15
6.78
对照 Control
6
95.1
90.6
100.7
100.7
讨论
, http://www.100md.com
一般认为苯毒性的产生是多种代谢产物通过多种途径所致[2],体外细胞培养实验证明:在培养的HL-60细胞、小鼠骨髓细胞和人骨髓细胞中,氢醌联合儿茶酚或苯三醇染毒,在DNA加合物生成方面具有联合作用;但氢醌联合苯酚染毒未见到联合作用[4,5]。
在体外将苯、苯酚、氢醌、苯醌、儿茶酚及苯三醇与SD大鼠Zymbal腺体一起培养,发现暴露于不同苯代谢产物可形成不同的加合物斑点,而苯仅产生刚刚可测水平的加合物。当用苯酚或苯酚加氢醌经口染毒SD大鼠(75或150 mg/kg,1∶1,1次/d,4天),体内肝、脾、骨髓及Zymbal腺体却均无加合物出现[2]。
本实验室有关小鼠白细胞DNA加合物与苯代谢产物之间关系的研究证明[2,5-7]:苯的几种主要代谢产物均能在白细胞中形成至少1种加合物,苯及代谢产物的DNA加合物在体内的形成与染毒途径、剂量有关,并存在动物种属及性别差异。本研究结果表明:苯及其主要代谢产物均能在小鼠骨髓细胞中形成DNA加合物。从DNA加合物的相对标记量看,虽然联合染毒苯酚和氢醌组总RAL值(6.05×10-8)与苯酚和氢醌单独染毒的RAL值之和(6.20×10-8)基本相同,但加合物a在联合染毒组中的RAL值(3.30×10-8)比单独染氢醌组中加合物a的RAL值(1.25×10-8)明显增高,而加合物a是苯醌组中唯一检出的加合物斑点,该结果提示在骨髓中苯酚促进了氢醌转化为苯醌。同时,骨髓细胞计数结果表明:单独染苯酚和氢醌,对小鼠骨髓细胞没有抑制作用,但联合染苯酚和氢醌却表现出明显的骨髓抑制。Eastmond等[8]的研究证明:小鼠联合染毒(腹腔注射)苯酚(75 mg/kg)和氢醌(25~75 mg/kg),2次/d,染毒12天,苯酚能在骨髓中刺激氢醌代谢依赖的过氧化物酶,促进氢醌转化为苯醌,并明显抑制骨髓细胞的增殖,呈现出与苯类似的髓性毒效应。
, http://www.100md.com
目前已知动物染苯后,苯经肝脏细胞色素氧化酶CYP2E1代谢为苯环氧化物,进一步代谢为苯酚,其次为氢醌、粘糠醛、儿茶酚等。这些代谢产物可在骨髓中蓄积,并在骨髓细胞中的髓性过氧化物酶的作用下进一步代谢为醌、半醌或开环产物,导致髓性毒性[9]。动物染苯能形成DNA加合物,但是哪一种代谢产物形成了加合物还不清楚。本研究初步证明苯在小鼠骨髓中至少能形成4种DNA加合物a、b、c、d,从几种苯的主要代谢产物在骨髓中形成的DNA加合物层析图谱分析,可初步认为,它们可能分别来自苯醌、氢醌、苯酚以及苯的环氧化物或其它代谢产物。
参考文献
[1] 高广花.苯及其代谢产物的毒性作用.国外医学卫生学分册,1994,21:144-146.
[2] 李桂兰,常平.苯DNA加合物研究进展.卫生研究,1995,24(特缉):3-6.
, 百拇医药
[3] Levay G,Bodell WJ.Potentiation of DNA adduct formation in HL-60 cells by combination of benzene metabolites.Proc Natl Acad Sci USA,1992,89:7105-7109.
[4] Levay G,Ross D,Bodell WJ.Peroxidase activation of hydroquinone results in the formation of DNA adducts in HL-60 cells,mouse bone marrow macrophages and human bone marrow.Carcinogenesis,1993,14:2329-2334.
[5] 常平,李桂兰,郭卫红,等.苯DNA加合物的形成特征、条件和方法探讨.中华劳动卫生职业病杂志,1997,15:142-145.
, 百拇医药
[6] 李桂兰,尹午山,尹松年.苯DNA加合物的组织分布及其与细胞遗传毒性的关系.卫生研究,1995,24:260-262.
[7] 王春光,李桂兰,尹松年.苯代谢产物DNA加合物形成特性研究.中华预防医学杂志,1994,28:297-298.
[8] Eastmond DA,Smith TM,Irons RD.An interaction of benzene metabolites reproduces the myelotoxicity observed with benzene exposure.Toxicol Appl Pharmacol,1987,91:85-95.
[9] 王登中.苯DNA加合物结构研究进展.中华劳动卫生职业病杂志,1997,15:186-189.
(收稿:1999-02-01 修回:1999-05-06), 百拇医药
单位:10050 北京,中国预防医学科学院劳动卫生与职业病研究所
关键词:苯;代谢产物;32P后标记方法;DNA加合物;髓性毒性
中华劳动卫生职业病杂志/990402 摘要 目的 观察苯及其主要代谢产物苯酚、氢醌、苯醌及苯酚和氢醌联合染毒在小鼠骨髓中形成的DNA加合物及其髓性毒性。方法 改进的32P后标记方法。结果 苯及其主要代谢产物均能在小鼠骨髓细胞中形成至少1种DNA加合物,相对加合物水平从0.85×10-8~6.78×10-8不等。骨髓细胞计数结果表明:单独染苯酚或氢醌,对小鼠骨髓细胞均没有抑制作用,但二者联合染毒对小鼠却表现出增强的髓性毒作用。结论 苯及其主要代谢产物均能在小鼠骨髓细胞中形成DNA加合物,苯的代谢产物形成的DNA加合物与髓性毒性有关。
, 百拇医药
DNA adduct formation in the bone marrow of mice treated with benzene and some metabolites
Chang Ping,Dai Yufei,Li Guilan.Institute of Occupational Medicine,Chinese Academy of Preventive Medicine,Beijing 100050
Abstract Objective To investigate DNA adduct formation induced by benzene and some metabolites in the bone marrow and the myelotoxicity. Methods Female Kunming mice were treated intraperioneally with benzene and some metabolites twice daily,and nuclease P1-enhanced 32 P-postlabelling assay was used to study the effect. Results No adduct was detected in the bone marrow of control group.At least one major DNA adduct was detected in the bone marrow of mice treated with benzene,phenol,hydroquinone,benzoquinone respectively and coadministration of phenol and hydroquinone.The relative adduct levels ranged from 0.85×10-8~6.78×10-8.Administration of phenol(75mg/kg) or hydroquinone(75 mg/kg) twice daily for 12 days did not result in a suppression of bone marrow cellularity respectively.However,the concomitant administration of phenol(75 mg/kg) and hydroquinone(50 mg/kg) twice a day for 12 days produced a significant decrease in bone marrow cellularity. Conclusion Benzene and some metabolites showed myelotoxicity by forming adduct in the bone marrow.
, 百拇医药
Key words Benzene Metabolites 32P-postlabelling DNA adduct Myelotoxicity
苯能抑制骨髓细胞增殖,引起血液性疾病[1]。苯能在动物体内形成DNA加合物,苯的代谢产物在体外培养的细胞中也能与DNA发生共价结合[2-4]。但有关苯的代谢产物在动物骨髓中形成DNA加合物的研究报道甚少。我们采用改进的32P后标记法,对苯及其代谢产物苯酚、氢醌、苯醌及苯酚和氢醌联合染毒在小鼠骨髓中形成DNA加合物的情况进行了初步研究,以探讨苯及其代谢产物的髓性毒作用。
材料与方法
一、主要试剂及溶液配制
苯(分析纯,北京化学试剂厂产品)用花生油配成体积分数为10%的溶液,苯酚(分析纯,北京化学试剂厂产品)用灭菌生理盐水配成体积分数为1%的溶液,氢醌(分析纯,美国Aldrich公司产品)用灭菌生理盐水配成体积分数为1%的溶液,苯醌(分析纯,美国Aldrich公司产品)用灭菌生理盐水配成体积分数为0.05%的溶液,苯酚和氢醌用灭菌生理盐水配成体积分数为1.5%苯酚+体积分数为1%氢醌混合溶液。RNase A、蛋白酶 K、牛脾磷酸二酯酶(SPD)、微球菌内切酶(MN)、核酸酶P1、Apyrase、T4 多聚核苷酸激酶(PNK)等均购自美国Sigma公司,[γ-32P]ATP[370 MBq/ml(10 mCi/ml)]购自英国Amersham公司。PEI Cellulose薄层层析板购自德国Macherey-Nagel公司。4向层析液:D1—0.4 mol/L磷酸二氢钠,pH 6.8;D2—1.8 mol/L甲酸锂、4.5 mol/L尿素,pH 3.5;D3—0.36 mol/L氯化锂、0.22 mol/L Tris、3.8 mol/L尿素,pH 3.5;D4—1.7 mol/L磷酸二氢钠,pH 6.0。
, 百拇医药
二、方法
1.加合物检测实验动物的处理:健康雌性昆明种小鼠50只,体重18~22 g(购自中国医学科学院动物中心),随机分成5个染毒组和1个对照组。染毒方式均为腹腔注射,2次/d,间隔6小时。各染毒组的染毒剂量及时间为:(1)苯酚组:6只小鼠,75 mg/kg,共12天;(2)氢醌组:6只小鼠,75 mg/kg,共12天;(3)联合染毒组:14只小鼠,苯酚75 mg/kg、氢醌50 mg/kg,共12天;(4)苯醌组:12只小鼠,2.5 mg/kg,共7天;(5)苯组:6只小鼠,500 mg/kg,共7天;(6)对照组:6只小鼠,注射等量生理盐水,共12天。各组均在最末一次染毒后24小时处死,提取骨髓DNA。
2.骨髓细胞计数实验动物的处理:健康雌性昆明种小鼠34只,体重18~22 g(来源同前),随机分成3个染毒组(苯酚组6只、氢醌组6只、联合染毒组16只)和1个对照组(6只)。动物来源、染毒方式、剂量和时间同加合物检测实验。各组均在最末一次染毒后24小时处死,取出右侧股骨,剥去软组织,剪去股骨两端皮质,用体积分数为5%的乙酸稀释液冲出股骨内的全部细胞,按白细胞计数法计数有核细胞,算出整个股骨的有核细胞总数。
, 百拇医药
3.骨髓DNA的提取及定量:用生理盐水从骨髓腔中冲出骨髓细胞,3 000 r/min离心6分钟后,弃上清,用生理盐水清洗3遍后,按文献[5]提取DNA并定量。
4.DNA加合物的检测:向5 μg DNA中加入0.2U/μl MN 2 μl、0.02 U/μl SPD 1 μl、100 mmol/L∶50 mmol/L琥珀酸钠-氯化钙缓冲液(pH 6.0) 1 μl,补足双蒸水至总体积12 μl,37 ℃水浴2小时;水解产物加入核酸酶(5 μg/μl)1 μl、0.25 mol/L醋酸钠(pH 5.0) 2 μl、0.3 mmol/L氯化锌1.5 μl,总体积16.5 μl。37 ℃水浴40分钟后将反应物抽干,加入0.5 mol/L Tris (pH 8.0) 1.75 μl、0.75 μl激酶缓冲液(200 mmol/L Bicine、100 mmol/L氯化镁、100 mmol/L二硫苏糖醇、10 mmol/L亚精胺,pH 9.7)、[γ-32P]ATP(370 MBq/ml)2.5 μl、PNK 10 U,补足双蒸水至总体积8 μl,37 ℃标记1小时。向反应体系中加入Apyrase(0.05 U/μl) 2 μl,37 ℃保温30分钟后,在PEI薄层层析板上点样,进行4向层析:D1向带滤纸过夜,D2向约30分钟,D3向带滤纸约7小时(上滤纸16 cm),D4向带滤纸约2小时(上滤纸5 cm),每次层析后均用双蒸水洗板2次。层析温度27~29 ℃。层析结束后,-80 ℃放射自显影3天,用液闪仪对加合物斑点作定量测定。
, http://www.100md.com
5.统计学处理:实验数据采用方差分析和t检验进行统计学处理。
结果
1.小鼠骨髓细胞计数:结果表明联合染毒组小鼠骨髓有核细胞数下降(表1)。
表1 苯酚、氢醌及联合染毒小鼠骨髓细胞计数结果
Table 1 The results of bone marrow cellularity of mice treated with phenol,hydroquinone and combination 组别
Group
动物数
No.of mice
, http://www.100md.com 染毒剂量
Dose(mg/kg)
染毒时间
Time(d)
骨髓有核细胞/股骨
Bone marrow cells/femur(
 ±s,×107)
±s,×107)苯酚 Phenol
6
75
12
2.27±0.53
, 百拇医药
氢醌 Hydroquinone
6
75
12
2.11±0.73
苯酚+氢醌 Phenol+Hydroquinone
7
75+50
12
1.55±0.35**
对照 Control
6
, 百拇医药
12
2.75±0.47
与对照组比较,**P<0.01 **P<0.01 vs. control
2.加合物检测各组小鼠染毒结束后存活率:苯酚组、氢醌组、苯组及对照组小鼠全部存活;联合染毒组及苯醌组各存活6只。骨髓细胞实验动物染毒结果,除联合组死亡9只小鼠外,其余各组小鼠均全部存活。
苯及其代谢产物在小鼠骨髓中的DNA加合物检出情况:苯及其代谢产物在小鼠骨髓中均可与DNA作用形成至少1种加合物,结果见表2。放射自显影图见图1~图6。

图1 苯酚组小鼠骨髓DNA加合物放射自显影图
, http://www.100md.com
Fig 1 Autoradiogram of bone marrow DNA adducts in the mice treated with 75 mg/kg phenol twice daily for 12 days

图2 氢醌组小鼠骨髓DNA加合物放射自显影图
Fig 2 Autoradiogram of bone marrow DNA adducts in the mice treated with 75 mg/kg hydroquinone twice daily for 12 days

图3 苯酚+氢醌联合组小鼠骨髓DNA加合物放射自显影图
, http://www.100md.com
Fig 3 Autoradiogram of bone marrow DNA adducts in the mice treated with coadministration of 75 mg/kg phenol and 50 mg/kg hydroquinone twice daily for 12 days

图4 苯醌组小鼠骨髓DNA加合物放射自显影图
Fig 4 Autoradiogram of bone marrow DNA adducts in the mice treated with 2.5 mg/kg benzoquinone twice daily for 7 days

, http://www.100md.com 图5 苯组小鼠骨髓DNA加合物放射自显影图
Fig 5 Autoradiogram of bone marrow DNA adducts in the mice treated with 500 mg/kg benzene twice daily for 7 days

图6 对照组小鼠骨髓DNA加合物放射自显影图
Fig 6 Autoradiogram of bone marrow DNA adducts in negative-control mice
表2 苯及其代谢产物在小鼠骨髓中形成的DNA加合物斑点数
Table 2 The results of DNA adduct spots in bone marrow of mice treated with benzene and its metabolites 组别 Group
, 百拇医药
动物数
No.of mice
染毒剂量
Dose(mg/kg)
染毒时间
Time(d)
加合物斑点数 Adduct spots
a
b
c
d
苯酚 Phenol
, 百拇医药 6
75
12
+
氢醌 Hydroquinone
6
75
12
+
+
苯酚+氢醌 Phenol+Hydroquinone
6
75+50
, 百拇医药
12
+
+
+
苯醌 Benzoquinone
6
2.5
7
+
苯 Benzene
6
500
7
, 百拇医药
+
+
+
+
对照 Control
6
12
3.小鼠骨髓DNA加合物含量:各组小鼠骨髓中苯及其代谢产物DNA加合物斑点的放射自显影定量结果见表3,参照文献[6]换算成相对加合物标记量(RAL)。表3 小鼠骨髓中苯及其代谢产物DNA加合物含量测定结果
Table 3 Determination of radioactivity of DNA adduct spots in mice treated with benzene and its metabolites 组别 Group
, http://www.100md.com
动物数
No.of mice
放射性计数(次/min)
Radioactivity(count/min)
相对加合物标记量(×10-8)
Relative adduct labelling(×10-8)
总计
Total
(×10-8)
a
, http://www.100md.com b
c
d
a
b
c
d
苯酚 Phenol
6
280.6
0.85
0.85
氢醌 Hydroquinone
, 百拇医药
6
359.7
958.5
1.25
4.10
5.35
苯酚+氢醌 Phenol+Hydroquinone
6
793.7
408.1
365.3
3.30
, 百拇医药 1.50
1.25
6.05
苯醌 Benzoquinone
6
370.0
1.30
1.30
苯 Benzene
6
349.1
852.6
488.1
, 百拇医药
132.4
1.20
3.60
1.83
0.15
6.78
对照 Control
6
95.1
90.6
100.7
100.7
讨论
, http://www.100md.com
一般认为苯毒性的产生是多种代谢产物通过多种途径所致[2],体外细胞培养实验证明:在培养的HL-60细胞、小鼠骨髓细胞和人骨髓细胞中,氢醌联合儿茶酚或苯三醇染毒,在DNA加合物生成方面具有联合作用;但氢醌联合苯酚染毒未见到联合作用[4,5]。
在体外将苯、苯酚、氢醌、苯醌、儿茶酚及苯三醇与SD大鼠Zymbal腺体一起培养,发现暴露于不同苯代谢产物可形成不同的加合物斑点,而苯仅产生刚刚可测水平的加合物。当用苯酚或苯酚加氢醌经口染毒SD大鼠(75或150 mg/kg,1∶1,1次/d,4天),体内肝、脾、骨髓及Zymbal腺体却均无加合物出现[2]。
本实验室有关小鼠白细胞DNA加合物与苯代谢产物之间关系的研究证明[2,5-7]:苯的几种主要代谢产物均能在白细胞中形成至少1种加合物,苯及代谢产物的DNA加合物在体内的形成与染毒途径、剂量有关,并存在动物种属及性别差异。本研究结果表明:苯及其主要代谢产物均能在小鼠骨髓细胞中形成DNA加合物。从DNA加合物的相对标记量看,虽然联合染毒苯酚和氢醌组总RAL值(6.05×10-8)与苯酚和氢醌单独染毒的RAL值之和(6.20×10-8)基本相同,但加合物a在联合染毒组中的RAL值(3.30×10-8)比单独染氢醌组中加合物a的RAL值(1.25×10-8)明显增高,而加合物a是苯醌组中唯一检出的加合物斑点,该结果提示在骨髓中苯酚促进了氢醌转化为苯醌。同时,骨髓细胞计数结果表明:单独染苯酚和氢醌,对小鼠骨髓细胞没有抑制作用,但联合染苯酚和氢醌却表现出明显的骨髓抑制。Eastmond等[8]的研究证明:小鼠联合染毒(腹腔注射)苯酚(75 mg/kg)和氢醌(25~75 mg/kg),2次/d,染毒12天,苯酚能在骨髓中刺激氢醌代谢依赖的过氧化物酶,促进氢醌转化为苯醌,并明显抑制骨髓细胞的增殖,呈现出与苯类似的髓性毒效应。
, http://www.100md.com
目前已知动物染苯后,苯经肝脏细胞色素氧化酶CYP2E1代谢为苯环氧化物,进一步代谢为苯酚,其次为氢醌、粘糠醛、儿茶酚等。这些代谢产物可在骨髓中蓄积,并在骨髓细胞中的髓性过氧化物酶的作用下进一步代谢为醌、半醌或开环产物,导致髓性毒性[9]。动物染苯能形成DNA加合物,但是哪一种代谢产物形成了加合物还不清楚。本研究初步证明苯在小鼠骨髓中至少能形成4种DNA加合物a、b、c、d,从几种苯的主要代谢产物在骨髓中形成的DNA加合物层析图谱分析,可初步认为,它们可能分别来自苯醌、氢醌、苯酚以及苯的环氧化物或其它代谢产物。
参考文献
[1] 高广花.苯及其代谢产物的毒性作用.国外医学卫生学分册,1994,21:144-146.
[2] 李桂兰,常平.苯DNA加合物研究进展.卫生研究,1995,24(特缉):3-6.
, 百拇医药
[3] Levay G,Bodell WJ.Potentiation of DNA adduct formation in HL-60 cells by combination of benzene metabolites.Proc Natl Acad Sci USA,1992,89:7105-7109.
[4] Levay G,Ross D,Bodell WJ.Peroxidase activation of hydroquinone results in the formation of DNA adducts in HL-60 cells,mouse bone marrow macrophages and human bone marrow.Carcinogenesis,1993,14:2329-2334.
[5] 常平,李桂兰,郭卫红,等.苯DNA加合物的形成特征、条件和方法探讨.中华劳动卫生职业病杂志,1997,15:142-145.
, 百拇医药
[6] 李桂兰,尹午山,尹松年.苯DNA加合物的组织分布及其与细胞遗传毒性的关系.卫生研究,1995,24:260-262.
[7] 王春光,李桂兰,尹松年.苯代谢产物DNA加合物形成特性研究.中华预防医学杂志,1994,28:297-298.
[8] Eastmond DA,Smith TM,Irons RD.An interaction of benzene metabolites reproduces the myelotoxicity observed with benzene exposure.Toxicol Appl Pharmacol,1987,91:85-95.
[9] 王登中.苯DNA加合物结构研究进展.中华劳动卫生职业病杂志,1997,15:186-189.
(收稿:1999-02-01 修回:1999-05-06), 百拇医药