4-氧和4-羟-四甲基哌啶氮氧自由基及衍生物对体外鼠肝谷胱甘肽影响及铁离子的络合作用
作者:苏军华 吴勇杰 刘莉 王绪明 李等松 田喧
单位:苏军华 李等松 兰州军区联勤部军事医学研究所,兰州 730020;吴勇杰 兰州医学院;刘莉 兰州军区第二门诊部;王绪明 解放军兰州医学高等专科学校;田喧 兰州大学化学系国家重点实验室
关键词:
4 4-氧-4-羟-四甲基呱啶氮氧自由基(4—TEMPO)是一类稳定的氮氧自由基,应用于自旋标记技术及辐射化学、低毒、无致癌及致突变作用[1]。有研究发现其有抗H2O2诱导的红细胞溶血作用,对白血病细胞DNA合成具有明显的抑制作用,能抗大鼠组织脂质过氧化[1,2]。本文就4—TEMPO对大鼠肝组织GSH含量影响及对Fe2+络合作用做了进一步的探讨。
1 材料及方法
, http://www.100md.com
1.1 材料试剂 4-氧-2,2,6,6-四甲基哌啶氮氧自由基(4-oxy-2,2,6,6-tetramethyl piperidinooxy1,OTMPO)、4-氧-2,2,6,6-四甲基哌啶(4-oxy-2,2,6,6-tetramethyl piperidine,OTMP)、4-氧-2,2,6,6-四甲基羟哌啶(4-oxy-2,2,6,6-tetramethyl-1-hydroxy piperidine,OTMPOH)、4-羟-2,2,6,6-四甲基哌啶(4-hydroxy-2,2,6,6-tetramethyl piperidine,HTMP)、4-羟-2,2,6,6-四甲基哌啶氮氧自由基(4-hydroxy-2,2,6,6-tetramethyl piperidinooxyl,HTMPO)和4-羟-2,2,6,6-四甲基羟哌啶(4-hydroxy-2,2,6,6-tetramethyl-1-hydroxy piperidine,HTMPOH),由兰州大学化学系国家重点实验室合成并提供。本文4-TEMPO涉及OTMPO、HTMPO、OTMPOH、HTMPOH。
, 百拇医药
5,5-对硝基苯甲酸(DTNB),谷胱甘肽(GSH),碘基水杨酸(SSA),硫酸亚铁(FeSO4)均为国产分析纯。
1.2 方法
1.2.1 4-TEMPO对大鼠组织匀浆GSH含量的影响
(1) 大鼠组织匀浆的制备[3,4]:取大鼠肝组织用0.1mol/L磷酸缓冲液(pH7.4)制成10%的匀浆0.5ml加入等体积4%的SSA混匀,2500r/min离心10min,上清液待测。
(2) GSH标准曲线的制作[5,6]:取1.0 mmol/L的GSH溶液0,0.20,0.40,0.60,0.80,1.00ml,分别置10ml容量瓶中,各加偏磷酸沉淀液8.00ml,以双蒸水稀释至10ml刻度,即得浓度为0,20,40,60,80,100μmol/L的GSH标准。取标准液各2.0ml,加0.32mol/L Na2HPO42.5ml,比色前加DTNB显色液0.50ml。用光径1cm杯,在5min内在422nm波长下读取OD值(以蒸馏水调零)。
, 百拇医药
(3) GSH的测定:取0.5ml肝组织上清,将DTNB溶于pH8.4磷酸缓冲液(PBS),配成0.004%显色液,取其4.5ml,加入上清液中,再加入4-TEMPO 0.05ml混匀,室温置10min,于422nm波长处测OD值,根据GSH标准曲线求出GSH含量。以上操作均在4℃冰水槽中进行。
1.2.2 4-TEMPO对Fe2+的络合作用 参考Afanasev的方法[7],首先以0.1mol/L(pH7.2)的PBS作对照,在紫外分光光度计(190~450nm)上测得1.6μmol/L的4-TEMPO的吸收光谱,然后将此浓度的4-TEMPO与等体积等浓度的FeSO4混合后,摇匀,静置10min,分别以FeSO4溶液或相应4-TEMPO溶液为对照测此混合物的差示光谱,根据Fe2+-4-TEMPO复合物在差示谱图中吸收峰的强度,确定4-TEMPO对Fe2+的络合能力。
, 百拇医药
2 实验结果
2.1 4-TEMPO对大鼠肝组织匀浆GSH含量的影响
OTMPO、HTMPO、OTMPOH和HTMPOH对大鼠肝组织匀浆GSH含量有升高作用,与空白对照组比较有显著差异,P<0.05。OTMP和HTMP无升高大鼠组织匀浆GSH的作用,均为P>0.05。
2.2 4-TEMPO对Fe2+的络合作用
将FeSO4与4-TEMPO等量混合后,其差示谱图在190~450nm范围内除FeSO4、4-TEMPO本身的吸收峰外,未出现新的吸收峰,说明4-TEMPO对Fe2+没有络合作用(见附图)。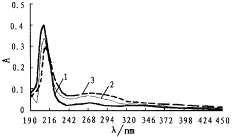
, http://www.100md.com
附图 OTMPOH、Fe2+、Fe2+-OTMPOH混合物紫外差示光谱图
1 OMPOH(以PBS为对照)曲线
2 Fe2+-OTMPOH混合物(以FeSO4为对照)曲线
3 Fe2+-OTMPOH混合物(以OTMPOH为对照)曲线
3 讨论
脂质过氧化除由活性氧自由基引发外,铁离子亦是主要的诱发因素[6,7]。机体对脂质过氧化有两类防御体系,一类是酶促防御体系,如过氧化物岐化酶(SOD);另一类是非酶促反应体系,主要包括谷胱甘肽等一些小分子物质。谷胱甘肽在酶的催化下与各种内源性和外源性亲电子化合物反应生成无毒或毒性小的硫结合物,还能保护磷脂酰胆碱脂质体和生物膜免受过氧化损伤。本实验从阻止脂质过氧化诱发和提高机体内在防御体系两个方面入手,研究4-TEMPO的抗氧化作用机理。通过对大鼠肝组织GSH含量的测定,证实4-TEMPO在≥10μmol/L时可提高细胞内小分子抗氧化剂的含量,与对照组相比相差显著,P<0.05,说明4-TEMPO可增强机体自身抗自由基损伤防御系统的功能来实现抗脂质过氧化作用。经体外紫外差示光谱法证实4-TEMPO没有络合Fe2+的能力,说明其抗氧化并非通过阻断Fe2+诱发脂质过氧化这一途径实现的。至于4-TEMPO升高大鼠肝组织匀浆GSH含量是作用于谷胱甘肽还原酶,使其由氧化型向还原型转化速率加快,还是直接促使肝细胞对GSH的生成量增加,以及对细胞内其它抗氧化物质的影响,有待于进一步探讨。
, http://www.100md.com
甘肃省卫生厅资助课题
作者简介:苏军华,女,硕士,助理研究员
参考文献
1 Zeng RL, Liu LS, Swarts HW, et al. Inhibition of nitroxide free radicals against DNA synthesis of leukemia cell. Chin Sci (B),1990,(6):592
2 Wu YJ, Li WG, Zhang ZM. Antioxidative activity of 4-oxy-and 4-hydroxy-nitroxides in tissues and erythrocytes from rats. Acta Pharm Sinica, 1997,18(2):150
, 百拇医药
3 夏弈明,朱莲珍.血和组织中谷胱甘肽过氧化物酶活力的测定方法.卫生研究,1987,16(4):29
4 陈重阳,唐祖年,梁荣感.清蒿酯对正常及肝脏毒物中毒小鼠肝脏谷胱甘肽含量的影响.中国药理学通报,1993,9(1):52
5 Afanasev IB, Dorozhko AI, Brodskii AV. Chelating and free radical scavenging mechanism of inhibitory action of rutin and quercetin in lipid peroxidation. Biochem Pharmacol, 1989,38(11):1763
6 Mskino K, Hagiwara. Cautionary note for Dmpo spin trapping in presence of iron ions. Biochem Biophys Res Commun, 1990,172(3):1073
7 Broughler JM. The involvement of iron in lipid peroxidation: Importance of ferric to ferrous in initiation. J Biochem, 1986, 261(22):10282
1998-06-30收稿, http://www.100md.com
单位:苏军华 李等松 兰州军区联勤部军事医学研究所,兰州 730020;吴勇杰 兰州医学院;刘莉 兰州军区第二门诊部;王绪明 解放军兰州医学高等专科学校;田喧 兰州大学化学系国家重点实验室
关键词:
4 4-氧-4-羟-四甲基呱啶氮氧自由基(4—TEMPO)是一类稳定的氮氧自由基,应用于自旋标记技术及辐射化学、低毒、无致癌及致突变作用[1]。有研究发现其有抗H2O2诱导的红细胞溶血作用,对白血病细胞DNA合成具有明显的抑制作用,能抗大鼠组织脂质过氧化[1,2]。本文就4—TEMPO对大鼠肝组织GSH含量影响及对Fe2+络合作用做了进一步的探讨。
1 材料及方法
, http://www.100md.com
1.1 材料试剂 4-氧-2,2,6,6-四甲基哌啶氮氧自由基(4-oxy-2,2,6,6-tetramethyl piperidinooxy1,OTMPO)、4-氧-2,2,6,6-四甲基哌啶(4-oxy-2,2,6,6-tetramethyl piperidine,OTMP)、4-氧-2,2,6,6-四甲基羟哌啶(4-oxy-2,2,6,6-tetramethyl-1-hydroxy piperidine,OTMPOH)、4-羟-2,2,6,6-四甲基哌啶(4-hydroxy-2,2,6,6-tetramethyl piperidine,HTMP)、4-羟-2,2,6,6-四甲基哌啶氮氧自由基(4-hydroxy-2,2,6,6-tetramethyl piperidinooxyl,HTMPO)和4-羟-2,2,6,6-四甲基羟哌啶(4-hydroxy-2,2,6,6-tetramethyl-1-hydroxy piperidine,HTMPOH),由兰州大学化学系国家重点实验室合成并提供。本文4-TEMPO涉及OTMPO、HTMPO、OTMPOH、HTMPOH。
, 百拇医药
5,5-对硝基苯甲酸(DTNB),谷胱甘肽(GSH),碘基水杨酸(SSA),硫酸亚铁(FeSO4)均为国产分析纯。
1.2 方法
1.2.1 4-TEMPO对大鼠组织匀浆GSH含量的影响
(1) 大鼠组织匀浆的制备[3,4]:取大鼠肝组织用0.1mol/L磷酸缓冲液(pH7.4)制成10%的匀浆0.5ml加入等体积4%的SSA混匀,2500r/min离心10min,上清液待测。
(2) GSH标准曲线的制作[5,6]:取1.0 mmol/L的GSH溶液0,0.20,0.40,0.60,0.80,1.00ml,分别置10ml容量瓶中,各加偏磷酸沉淀液8.00ml,以双蒸水稀释至10ml刻度,即得浓度为0,20,40,60,80,100μmol/L的GSH标准。取标准液各2.0ml,加0.32mol/L Na2HPO42.5ml,比色前加DTNB显色液0.50ml。用光径1cm杯,在5min内在422nm波长下读取OD值(以蒸馏水调零)。
, 百拇医药
(3) GSH的测定:取0.5ml肝组织上清,将DTNB溶于pH8.4磷酸缓冲液(PBS),配成0.004%显色液,取其4.5ml,加入上清液中,再加入4-TEMPO 0.05ml混匀,室温置10min,于422nm波长处测OD值,根据GSH标准曲线求出GSH含量。以上操作均在4℃冰水槽中进行。
1.2.2 4-TEMPO对Fe2+的络合作用 参考Afanasev的方法[7],首先以0.1mol/L(pH7.2)的PBS作对照,在紫外分光光度计(190~450nm)上测得1.6μmol/L的4-TEMPO的吸收光谱,然后将此浓度的4-TEMPO与等体积等浓度的FeSO4混合后,摇匀,静置10min,分别以FeSO4溶液或相应4-TEMPO溶液为对照测此混合物的差示光谱,根据Fe2+-4-TEMPO复合物在差示谱图中吸收峰的强度,确定4-TEMPO对Fe2+的络合能力。
, 百拇医药
2 实验结果
2.1 4-TEMPO对大鼠肝组织匀浆GSH含量的影响
OTMPO、HTMPO、OTMPOH和HTMPOH对大鼠肝组织匀浆GSH含量有升高作用,与空白对照组比较有显著差异,P<0.05。OTMP和HTMP无升高大鼠组织匀浆GSH的作用,均为P>0.05。
2.2 4-TEMPO对Fe2+的络合作用
将FeSO4与4-TEMPO等量混合后,其差示谱图在190~450nm范围内除FeSO4、4-TEMPO本身的吸收峰外,未出现新的吸收峰,说明4-TEMPO对Fe2+没有络合作用(见附图)。

, http://www.100md.com
附图 OTMPOH、Fe2+、Fe2+-OTMPOH混合物紫外差示光谱图
1 OMPOH(以PBS为对照)曲线
2 Fe2+-OTMPOH混合物(以FeSO4为对照)曲线
3 Fe2+-OTMPOH混合物(以OTMPOH为对照)曲线
3 讨论
脂质过氧化除由活性氧自由基引发外,铁离子亦是主要的诱发因素[6,7]。机体对脂质过氧化有两类防御体系,一类是酶促防御体系,如过氧化物岐化酶(SOD);另一类是非酶促反应体系,主要包括谷胱甘肽等一些小分子物质。谷胱甘肽在酶的催化下与各种内源性和外源性亲电子化合物反应生成无毒或毒性小的硫结合物,还能保护磷脂酰胆碱脂质体和生物膜免受过氧化损伤。本实验从阻止脂质过氧化诱发和提高机体内在防御体系两个方面入手,研究4-TEMPO的抗氧化作用机理。通过对大鼠肝组织GSH含量的测定,证实4-TEMPO在≥10μmol/L时可提高细胞内小分子抗氧化剂的含量,与对照组相比相差显著,P<0.05,说明4-TEMPO可增强机体自身抗自由基损伤防御系统的功能来实现抗脂质过氧化作用。经体外紫外差示光谱法证实4-TEMPO没有络合Fe2+的能力,说明其抗氧化并非通过阻断Fe2+诱发脂质过氧化这一途径实现的。至于4-TEMPO升高大鼠肝组织匀浆GSH含量是作用于谷胱甘肽还原酶,使其由氧化型向还原型转化速率加快,还是直接促使肝细胞对GSH的生成量增加,以及对细胞内其它抗氧化物质的影响,有待于进一步探讨。
, http://www.100md.com
甘肃省卫生厅资助课题
作者简介:苏军华,女,硕士,助理研究员
参考文献
1 Zeng RL, Liu LS, Swarts HW, et al. Inhibition of nitroxide free radicals against DNA synthesis of leukemia cell. Chin Sci (B),1990,(6):592
2 Wu YJ, Li WG, Zhang ZM. Antioxidative activity of 4-oxy-and 4-hydroxy-nitroxides in tissues and erythrocytes from rats. Acta Pharm Sinica, 1997,18(2):150
, 百拇医药
3 夏弈明,朱莲珍.血和组织中谷胱甘肽过氧化物酶活力的测定方法.卫生研究,1987,16(4):29
4 陈重阳,唐祖年,梁荣感.清蒿酯对正常及肝脏毒物中毒小鼠肝脏谷胱甘肽含量的影响.中国药理学通报,1993,9(1):52
5 Afanasev IB, Dorozhko AI, Brodskii AV. Chelating and free radical scavenging mechanism of inhibitory action of rutin and quercetin in lipid peroxidation. Biochem Pharmacol, 1989,38(11):1763
6 Mskino K, Hagiwara. Cautionary note for Dmpo spin trapping in presence of iron ions. Biochem Biophys Res Commun, 1990,172(3):1073
7 Broughler JM. The involvement of iron in lipid peroxidation: Importance of ferric to ferrous in initiation. J Biochem, 1986, 261(22):10282
1998-06-30收稿, http://www.100md.com