2450MHz微波诱导猪视网膜色素上皮细胞脂质过氧化损伤及锌的防护效应
作者:邓中荣 刘秀红 陈景元 杨瑞华 刘学东
单位:第四军医大学军事卫勤统计系,西安 710033
关键词:微波;视网膜色素上皮细胞;锌;脂质过氧化
卫生研究000301 摘要:为观察微波对体外培养的猪视网膜色素上皮细胞的脂质过氧化损伤作用及锌的生物防护作用,体外培养猪视网膜色素上皮细胞,微波按强度分为3组(10、20、30mW.cm-2)辐照1h。30mW.cm-2为防护组,在培养液中加入不同浓度的硫酸锌。辐照后立即测定SOD活性、MDA含量,检测细胞存活率。结果显示微波辐照后,SOD活性下降,MDA含量升高,细胞存活率明显下降,加入锌后,可减轻这种损伤。在本实验条件下,微波可引起体外培养的猪视网膜色素上皮细胞的脂质过氧化损伤,锌可提高细胞的抗氧化能力,减轻细胞的损伤。
, 百拇医药
中图分类号:R818 R897 Q581 文献标识码:A
文章编号:1000-8020(2000)03-0129-03
Zinc protective effects on pig retinal pigment epithelial cell
damage of lipid peroxide induced by 2450MHz microwave
Deng Zhongrong, Liu Xiuhong, Chen Jingyuan, Yang Ruihua, et al.
(Faculty of Military Health Service and Statistics,Fourth Military Medical University,Xi'an 710033,China)
, 百拇医药
Abstract:To observe the lipid peroxide damage in the cultured pig retinal pigment epithelial cell(RPE) induced by microwave and the protective effects by zinc (Zn).RPE cells were divided into 3 groups in terms of microwave intensity(the group of 10, 20 and 30mW.cm-2)and each group was exposed to microwave for 1 hour.After adding ZnSO4 into DMEM culture fluid,the group of 30mW.cm-2was exposed to microwave.The activity of SOD and the content of MDA were measured.The results showed that the activity of SOD decreased significantly compared with the control group(P<0.001).The content of MDA increased significantly compared with the control group(P<0.001).Administration of Zn alleviated the increase of MDA and decrease of SOD.In the experiment,2450MHz microwave induces the lipid peroxide damage in RPE cells. Zn can enhance the antioxidation ability of cells and alleviate the damage to some extent.
, 百拇医药
Key words:microwave, retinal pigment epithelial cell, zinc, lipid peroxide
微波对眼睛的影响包括对角膜、晶体、玻璃体、视网膜等的影响[1]。很多研究报道认为微波可引起晶体的损害而致白内障,微波照射可引起视网膜病变,如干扰视网膜电位等[2]。为进一步研究微波对眼的损伤及其防护,我们观察了2450MHz不同强度微波对体外培养的猪视网膜色素上皮细胞(retinal pigment epithelial cell,RPE)的脂质过氧化损伤及锌的防护效应,现将部分结果报告如下。
1 材料与方法
1.1 材料
标本取自某肉联厂商品猪,宰杀后立即摘取眼球,放入冰盐水内,30min内,用肥皂水刷洗,蒸馏水和三蒸水各冲洗3次,500U/ml庆大霉素生理盐水和1ml/L的新洁尔灭溶液各浸泡30min。方法依参考文献[3,4]。无菌状态下,用PBS液冲洗眼球3次,在高压灭菌的平皿中,沿巩膜后缘剪开,弃去眼前节,剥去视网膜层,PBS液冲洗眼杯3次,眼杯中加入0.25%的胰酶(Gibco,USA),37℃消化45min,用吸管轻轻吹打而使RPE细胞更多脱落,将含有细胞的消化液,移入含15%胎牛血清(杭州,四季青)的DMEM(GIBCO,USA,内含10mg/L氢化可的松)培养液的离心管中,终止胰酶反应,1000r/min离心8min,弃取上清液再次加入DMEM培养液,滴管吹打使细胞散开,细胞悬液接种于培养瓶内,加入适量培养液,在37℃,湿度为90%的5%CO2孵箱培养。待细胞贴壁2~3天后换培养液一次,当细胞融合,数量合适后,可进行传代。用0.25%的胰酶消化(时间根据细胞数量控制),贴壁细胞消化下来后,可进行1∶2或1∶3传代。角蛋白单克隆抗体进行RPE细胞的鉴定。
, 百拇医药
1.2 方法
波源为微波理疗仪(上海医疗器械八厂),频率2450MHz,连续波。垂直极化照射方式。采用的微波强度为30、20和10mW/cm2等3个强度级。照射距离40cm。微波强度用漏能仪测定。于微波屏蔽室内,将RPE细胞置于辐照台上辐照时间1h。RPE细胞分为4组,其中实验组3组,空白对照1组,各组内有3个平行样。选30mW/cm2组为锌(硫酸锌)防护组,硫酸锌的浓度分为0.2、0.4和0.6g/L组。测定RPE细胞内SOD活性和MDA含量。台盼蓝染色检测细胞存活率:辐照后收集细胞,制成单细胞悬液取9滴悬液与1滴4g/L台盼蓝溶液混匀,用血球计数板分别计数活细胞和死细胞,并计算细胞存活率。辐照后立即收集细胞,PBS漂洗2~3次,调细胞密度为1×105/L的细胞悬液,低温超声粉碎细胞,羟胺法测定SOD的催化活性[5](与对照组相比,抑制率50%吸光度(A)为一个酶活性单位)。改良硫代巴比妥酸荧光法测定MDA含量[6]。
, http://www.100md.com
1.3 统计方法
所有数据用t检验进行统计学分析,判断其显著性。
2 结果
2.1 细胞形态
猪原代RPE细胞未贴壁时,细胞大而圆,光镜下细胞成圆形黑色。贴壁的细胞胞浆向外伸展呈多角形,细胞核成透明状,大量的色素颗粒在细胞核周围均匀分布。随着传代次数的增加,细胞内的色素颗粒逐渐减少,一般在3~4代细胞色素颗粒基本消失。微波辐照后光镜下立即观察RPE细胞3个组均未见明显的形态学改变,继续培养24h,10mW/cm2组可见细胞的边缘模糊,少部分细胞脱壁;20mW/cm2组细胞脱壁较多,少部分细胞结构不清,并可见部分细胞的碎片。30mW/cm2组大部分脱壁,细胞结构模糊,细胞的碎片明显增多。
, 百拇医药
2.2 台盼蓝染色检测细胞存活率
对照组细胞存活率为(99.7±1.2)%,辐照各组10mW/cm2组存活率(99.4±0.6)%,与对照组无显著性差异(P>0.05);20mW/cm2组存活率(86.3±1.5%),30mW/cm2组存活率(76.4±2.6)%,均与对照组存在显著性差异(P<0.01)。
2.3 SOD活性与MDA含量测定
10mW/cm2组辐照后,SOD活性下降,MDA含量稍有上升,与对照组无显著性差异。20mW/cm2组和30mW/cm2组辐照后,SOD活性下降明显,MDA含量明显上升,两组分别与对照组存在显著性差异。而且随着微波强度的增大,SOD活性呈下降趋势,MDA含量呈上升趋势。说明随着微波强度的增加,脂质过氧化对细胞的损伤也增加,见表1。
, 百拇医药
表1 微波辐照后SOD活性和MDA含量的变化(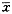 ±s,n=4) 组 别
±s,n=4) 组 别
MDA
(mol/1015 cell)
SOD
(U/104cell)
对照组
1.84±0.18
1.300±0.028
辐照组(mW.cm-2)
, 百拇医药
10
1.89±0.16
0.794±0.125
20
2.49±0.41(1)
0.567±0.172(2)
30
5.24±0.70(1)
0.464±0.155(2)
注:与对照组比较,(1)P<0.05 (2)P<0.001
, http://www.100md.com
2.4 锌防护组SOD和MDA的测定
培养液中加入ZnSO4后微波辐照,0.2g/L组就有明显的抗氧化作用,SOD活性明显升高(P<0.001),MDA含量下降(P<0.001),0.4g/L组和0.6g/L组抗氧化作用明显优于0.2g/L组(P<0.001),说明存在某种量-效关系。
3 讨论
微波对视觉系统的影响主要涉及角膜、晶体和视网膜,目前研究较多的是对晶体的损伤,而未见有关视网膜色素上皮细胞损伤的报道。本实验表明,10mW/cm2组与对照组比较,细胞存活率亦无明显改变,脂质过氧化指标有改变,20mW/cm2组与30mW/cm2组经照射后,细胞存活率下降,脂质过氧化反应更明显,上述改变随着微波辐照强度的增大而增加。加入一定浓度的锌,细胞存活率明显上升,具有明显的保护作用。
, 百拇医药
表2 ZnSO4对视网膜色素上皮细胞的保护作用(1)(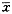 ±s,n=4) 组 别
±s,n=4) 组 别
MDA
(mol/1015 cell)
SOD
(U/104cell)
锌防护组(g/L)
0.6
0.56±0.04
0.484±0.03
, 百拇医药
0.4
0.96±0.36
0.323±0.01
0.2
2.66±0.49
0.227±0.05
对照组
4.95±0.69
0.533±0.25
注:(1)各组与对照组比较 P<0.001
微波可能影响体内的氧化和抗氧化系统使其失衡。Drygin等用功率密度为460mW/cm2的微波辐照大鼠24min,发现受照大鼠大脑皮质的脂质抗氧化系统被耗竭[7]。微波还可诱导脂质体的脂质过氧化[8]。本实验结果表明,微波辐照后,引起视网膜色素上皮细胞抗氧化物酶SOD活性降低,细胞清除自由基的能力下降,脂质过氧化产物MDA含量升高。随着微波辐照强度的增大,SOD活性下降程度越大,MDA含量升高越明显,细胞脂质过氧化损伤越严重,细胞脂质过氧化损伤程度随着微波辐照强度的增大而增加。所以,微波辐照可能一方面破坏细胞内的抗氧化系统,另一方面引起细胞内脂质过氧化反应,使细胞内产生大量的自由基,细胞内氧化与抗氧化系统失去平衡,而引起细胞损伤。
, 百拇医药
锌作为人体必需的微量元素之一,具有重要的生物学功能。视网膜是人体内含锌最高的组织,缺锌可造成视网膜的某些病理变化。锌能对抗膜的过氧化作用,抑制脂质过氧化作用,增加细胞膜和溶酶体膜的稳定性,对各种酶系统起保护作用,并稳定膜的结构和功能,使细胞对离子和自由基有较强的抵抗力。一般认为,锌的抗氧化一方面是通过SOD进行的,Zn浓度的增加,可增加CuZn.SOD的活性,从而增加了对自由基的清除,减少了脂质过氧化的发生和对细胞的损伤[9]。另一方面,Zn作为金属硫蛋白(metallothionein,TM)的诱导剂,可诱导MT的产生,而MT是迄今已知最强的自由基清除剂,但是Zn诱导MT的表达至少需3~6h达到高峰,本实验结果是微波辐照后立即测定的结果,故可不考虑MT的抗氧化
作用。本研究表明,微波可诱导视网膜色素上皮细胞的脂质过氧化损伤,Zn可以提高RPE细胞的抗氧化的能力,在一定程度上清除自由基,对微波损伤RPE细胞有一定的保护作用。
, 百拇医药
基金项目:国家自然科学基金资助项目(No.39700119)
作者简介:邓中荣,男,硕士生,讲师文章编号:1000-8020(2000)03-0129-03
参考文献
1,李昌吉.微波致角膜和视网膜损害的实验研究.眼外伤与职业性眼病杂志,1989,(3):141—143
2,叶国钦.微波低强度辐射对视网膜电位的影响.生理学报,1980,32(2):200—203
3,喻晓兵,吴景天.兔视网膜色素上皮细胞的体外培养及超微结构的研究.中国医科大学学报,1999,28(2):105—107
4,王雨生,严密,杨抚华.视网膜色素上皮细胞培养技术及其应用.中华眼底病杂志,1994,10(2):124—128
, 百拇医药
5,王成莲.羟胺法测定超氧化物歧化酶.生物化学与生物物理学报,1989,16(6):473—475
6,张秀明,严丽娟,柴建开.改良硫代巴比妥荧光法测血清过氧化脂质.生物化学与生物物理进展,1996,23(2):175—178
7,Drygin AN,Nechaeva RV,Osipovich VK,et al.The pathogenesis of central nervous system functional disordersafter exposure to microwave radiation.Vopr Med Khim,1992,38(2):38—40
8,Babhincova M.Microwave-induced lipid peroxidation in liposomes.Folia Biol Praha,1993,39(5):250—255
9,吴先诚.超氧化物歧化酶与眼病.国外医学眼科学分册,1990,14(3):139—142
(1999-12-14收稿), http://www.100md.com
单位:第四军医大学军事卫勤统计系,西安 710033
关键词:微波;视网膜色素上皮细胞;锌;脂质过氧化
卫生研究000301 摘要:为观察微波对体外培养的猪视网膜色素上皮细胞的脂质过氧化损伤作用及锌的生物防护作用,体外培养猪视网膜色素上皮细胞,微波按强度分为3组(10、20、30mW.cm-2)辐照1h。30mW.cm-2为防护组,在培养液中加入不同浓度的硫酸锌。辐照后立即测定SOD活性、MDA含量,检测细胞存活率。结果显示微波辐照后,SOD活性下降,MDA含量升高,细胞存活率明显下降,加入锌后,可减轻这种损伤。在本实验条件下,微波可引起体外培养的猪视网膜色素上皮细胞的脂质过氧化损伤,锌可提高细胞的抗氧化能力,减轻细胞的损伤。
, 百拇医药
中图分类号:R818 R897 Q581 文献标识码:A
文章编号:1000-8020(2000)03-0129-03
Zinc protective effects on pig retinal pigment epithelial cell
damage of lipid peroxide induced by 2450MHz microwave
Deng Zhongrong, Liu Xiuhong, Chen Jingyuan, Yang Ruihua, et al.
(Faculty of Military Health Service and Statistics,Fourth Military Medical University,Xi'an 710033,China)
, 百拇医药
Abstract:To observe the lipid peroxide damage in the cultured pig retinal pigment epithelial cell(RPE) induced by microwave and the protective effects by zinc (Zn).RPE cells were divided into 3 groups in terms of microwave intensity(the group of 10, 20 and 30mW.cm-2)and each group was exposed to microwave for 1 hour.After adding ZnSO4 into DMEM culture fluid,the group of 30mW.cm-2was exposed to microwave.The activity of SOD and the content of MDA were measured.The results showed that the activity of SOD decreased significantly compared with the control group(P<0.001).The content of MDA increased significantly compared with the control group(P<0.001).Administration of Zn alleviated the increase of MDA and decrease of SOD.In the experiment,2450MHz microwave induces the lipid peroxide damage in RPE cells. Zn can enhance the antioxidation ability of cells and alleviate the damage to some extent.
, 百拇医药
Key words:microwave, retinal pigment epithelial cell, zinc, lipid peroxide
微波对眼睛的影响包括对角膜、晶体、玻璃体、视网膜等的影响[1]。很多研究报道认为微波可引起晶体的损害而致白内障,微波照射可引起视网膜病变,如干扰视网膜电位等[2]。为进一步研究微波对眼的损伤及其防护,我们观察了2450MHz不同强度微波对体外培养的猪视网膜色素上皮细胞(retinal pigment epithelial cell,RPE)的脂质过氧化损伤及锌的防护效应,现将部分结果报告如下。
1 材料与方法
1.1 材料
标本取自某肉联厂商品猪,宰杀后立即摘取眼球,放入冰盐水内,30min内,用肥皂水刷洗,蒸馏水和三蒸水各冲洗3次,500U/ml庆大霉素生理盐水和1ml/L的新洁尔灭溶液各浸泡30min。方法依参考文献[3,4]。无菌状态下,用PBS液冲洗眼球3次,在高压灭菌的平皿中,沿巩膜后缘剪开,弃去眼前节,剥去视网膜层,PBS液冲洗眼杯3次,眼杯中加入0.25%的胰酶(Gibco,USA),37℃消化45min,用吸管轻轻吹打而使RPE细胞更多脱落,将含有细胞的消化液,移入含15%胎牛血清(杭州,四季青)的DMEM(GIBCO,USA,内含10mg/L氢化可的松)培养液的离心管中,终止胰酶反应,1000r/min离心8min,弃取上清液再次加入DMEM培养液,滴管吹打使细胞散开,细胞悬液接种于培养瓶内,加入适量培养液,在37℃,湿度为90%的5%CO2孵箱培养。待细胞贴壁2~3天后换培养液一次,当细胞融合,数量合适后,可进行传代。用0.25%的胰酶消化(时间根据细胞数量控制),贴壁细胞消化下来后,可进行1∶2或1∶3传代。角蛋白单克隆抗体进行RPE细胞的鉴定。
, 百拇医药
1.2 方法
波源为微波理疗仪(上海医疗器械八厂),频率2450MHz,连续波。垂直极化照射方式。采用的微波强度为30、20和10mW/cm2等3个强度级。照射距离40cm。微波强度用漏能仪测定。于微波屏蔽室内,将RPE细胞置于辐照台上辐照时间1h。RPE细胞分为4组,其中实验组3组,空白对照1组,各组内有3个平行样。选30mW/cm2组为锌(硫酸锌)防护组,硫酸锌的浓度分为0.2、0.4和0.6g/L组。测定RPE细胞内SOD活性和MDA含量。台盼蓝染色检测细胞存活率:辐照后收集细胞,制成单细胞悬液取9滴悬液与1滴4g/L台盼蓝溶液混匀,用血球计数板分别计数活细胞和死细胞,并计算细胞存活率。辐照后立即收集细胞,PBS漂洗2~3次,调细胞密度为1×105/L的细胞悬液,低温超声粉碎细胞,羟胺法测定SOD的催化活性[5](与对照组相比,抑制率50%吸光度(A)为一个酶活性单位)。改良硫代巴比妥酸荧光法测定MDA含量[6]。
, http://www.100md.com
1.3 统计方法
所有数据用t检验进行统计学分析,判断其显著性。
2 结果
2.1 细胞形态
猪原代RPE细胞未贴壁时,细胞大而圆,光镜下细胞成圆形黑色。贴壁的细胞胞浆向外伸展呈多角形,细胞核成透明状,大量的色素颗粒在细胞核周围均匀分布。随着传代次数的增加,细胞内的色素颗粒逐渐减少,一般在3~4代细胞色素颗粒基本消失。微波辐照后光镜下立即观察RPE细胞3个组均未见明显的形态学改变,继续培养24h,10mW/cm2组可见细胞的边缘模糊,少部分细胞脱壁;20mW/cm2组细胞脱壁较多,少部分细胞结构不清,并可见部分细胞的碎片。30mW/cm2组大部分脱壁,细胞结构模糊,细胞的碎片明显增多。
, 百拇医药
2.2 台盼蓝染色检测细胞存活率
对照组细胞存活率为(99.7±1.2)%,辐照各组10mW/cm2组存活率(99.4±0.6)%,与对照组无显著性差异(P>0.05);20mW/cm2组存活率(86.3±1.5%),30mW/cm2组存活率(76.4±2.6)%,均与对照组存在显著性差异(P<0.01)。
2.3 SOD活性与MDA含量测定
10mW/cm2组辐照后,SOD活性下降,MDA含量稍有上升,与对照组无显著性差异。20mW/cm2组和30mW/cm2组辐照后,SOD活性下降明显,MDA含量明显上升,两组分别与对照组存在显著性差异。而且随着微波强度的增大,SOD活性呈下降趋势,MDA含量呈上升趋势。说明随着微波强度的增加,脂质过氧化对细胞的损伤也增加,见表1。
, 百拇医药
表1 微波辐照后SOD活性和MDA含量的变化(
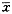 ±s,n=4) 组 别
±s,n=4) 组 别MDA
(mol/1015 cell)
SOD
(U/104cell)
对照组
1.84±0.18
1.300±0.028
辐照组(mW.cm-2)
, 百拇医药
10
1.89±0.16
0.794±0.125
20
2.49±0.41(1)
0.567±0.172(2)
30
5.24±0.70(1)
0.464±0.155(2)
注:与对照组比较,(1)P<0.05 (2)P<0.001
, http://www.100md.com
2.4 锌防护组SOD和MDA的测定
培养液中加入ZnSO4后微波辐照,0.2g/L组就有明显的抗氧化作用,SOD活性明显升高(P<0.001),MDA含量下降(P<0.001),0.4g/L组和0.6g/L组抗氧化作用明显优于0.2g/L组(P<0.001),说明存在某种量-效关系。
3 讨论
微波对视觉系统的影响主要涉及角膜、晶体和视网膜,目前研究较多的是对晶体的损伤,而未见有关视网膜色素上皮细胞损伤的报道。本实验表明,10mW/cm2组与对照组比较,细胞存活率亦无明显改变,脂质过氧化指标有改变,20mW/cm2组与30mW/cm2组经照射后,细胞存活率下降,脂质过氧化反应更明显,上述改变随着微波辐照强度的增大而增加。加入一定浓度的锌,细胞存活率明显上升,具有明显的保护作用。
, 百拇医药
表2 ZnSO4对视网膜色素上皮细胞的保护作用(1)(
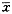 ±s,n=4) 组 别
±s,n=4) 组 别MDA
(mol/1015 cell)
SOD
(U/104cell)
锌防护组(g/L)
0.6
0.56±0.04
0.484±0.03
, 百拇医药
0.4
0.96±0.36
0.323±0.01
0.2
2.66±0.49
0.227±0.05
对照组
4.95±0.69
0.533±0.25
注:(1)各组与对照组比较 P<0.001
微波可能影响体内的氧化和抗氧化系统使其失衡。Drygin等用功率密度为460mW/cm2的微波辐照大鼠24min,发现受照大鼠大脑皮质的脂质抗氧化系统被耗竭[7]。微波还可诱导脂质体的脂质过氧化[8]。本实验结果表明,微波辐照后,引起视网膜色素上皮细胞抗氧化物酶SOD活性降低,细胞清除自由基的能力下降,脂质过氧化产物MDA含量升高。随着微波辐照强度的增大,SOD活性下降程度越大,MDA含量升高越明显,细胞脂质过氧化损伤越严重,细胞脂质过氧化损伤程度随着微波辐照强度的增大而增加。所以,微波辐照可能一方面破坏细胞内的抗氧化系统,另一方面引起细胞内脂质过氧化反应,使细胞内产生大量的自由基,细胞内氧化与抗氧化系统失去平衡,而引起细胞损伤。
, 百拇医药
锌作为人体必需的微量元素之一,具有重要的生物学功能。视网膜是人体内含锌最高的组织,缺锌可造成视网膜的某些病理变化。锌能对抗膜的过氧化作用,抑制脂质过氧化作用,增加细胞膜和溶酶体膜的稳定性,对各种酶系统起保护作用,并稳定膜的结构和功能,使细胞对离子和自由基有较强的抵抗力。一般认为,锌的抗氧化一方面是通过SOD进行的,Zn浓度的增加,可增加CuZn.SOD的活性,从而增加了对自由基的清除,减少了脂质过氧化的发生和对细胞的损伤[9]。另一方面,Zn作为金属硫蛋白(metallothionein,TM)的诱导剂,可诱导MT的产生,而MT是迄今已知最强的自由基清除剂,但是Zn诱导MT的表达至少需3~6h达到高峰,本实验结果是微波辐照后立即测定的结果,故可不考虑MT的抗氧化
作用。本研究表明,微波可诱导视网膜色素上皮细胞的脂质过氧化损伤,Zn可以提高RPE细胞的抗氧化的能力,在一定程度上清除自由基,对微波损伤RPE细胞有一定的保护作用。
, 百拇医药
基金项目:国家自然科学基金资助项目(No.39700119)
作者简介:邓中荣,男,硕士生,讲师文章编号:1000-8020(2000)03-0129-03
参考文献
1,李昌吉.微波致角膜和视网膜损害的实验研究.眼外伤与职业性眼病杂志,1989,(3):141—143
2,叶国钦.微波低强度辐射对视网膜电位的影响.生理学报,1980,32(2):200—203
3,喻晓兵,吴景天.兔视网膜色素上皮细胞的体外培养及超微结构的研究.中国医科大学学报,1999,28(2):105—107
4,王雨生,严密,杨抚华.视网膜色素上皮细胞培养技术及其应用.中华眼底病杂志,1994,10(2):124—128
, 百拇医药
5,王成莲.羟胺法测定超氧化物歧化酶.生物化学与生物物理学报,1989,16(6):473—475
6,张秀明,严丽娟,柴建开.改良硫代巴比妥荧光法测血清过氧化脂质.生物化学与生物物理进展,1996,23(2):175—178
7,Drygin AN,Nechaeva RV,Osipovich VK,et al.The pathogenesis of central nervous system functional disordersafter exposure to microwave radiation.Vopr Med Khim,1992,38(2):38—40
8,Babhincova M.Microwave-induced lipid peroxidation in liposomes.Folia Biol Praha,1993,39(5):250—255
9,吴先诚.超氧化物歧化酶与眼病.国外医学眼科学分册,1990,14(3):139—142
(1999-12-14收稿), http://www.100md.com