雌激素对小鼠骨中原癌基因c-myc蛋白的影响
作者:李灵芝 张永亮 马丽英 刘建中 陈虹
单位:马丽英(新疆医学院);李灵芝 张永亮 刘建中 陈虹(武警医学院药学教研室,天津 300162)
关键词:雌酚酮;c-myc;长骨;免疫组织化学
卫生研究000616 摘要:为初步探讨雌激素对骨的作用机制,以体外培养的小鼠胚胎长骨作为模型,通过免疫组织化学方法检测雌酚酮对骺板静止区、增殖区和肥大区c-myc蛋白表达的影响。结果显示,培养介质中雌酚酮浓度为10-9mol/L时,增殖区c- myc蛋白阳性细胞面积与对照组相比显著增加;浓度为10-8mol/L时,除增殖区外,静止区阳性细胞面积也显著增加;当浓度增至10-7mol/L时,3个区阳性细胞面积均显著增加。提示雌激素可通过促进长骨c-myc的表达促进软骨内成骨。
, 百拇医药
中图分类号:R977.1 R967 文献标识码:A
文章编号:1000-8020(2000)06-0402-03
Effect of estrogen on the expression of c-myc protein of bone in mice
Li Lingzhi Zhang Yongliang Ma Liying Liu Jianzhong et al
(Medical Collage of Chinese People's Armed Police Forces, Tianjin 300 162,China)
Abstract:In order to study the mechanism by which estrogen effects on bone, the effect of estrone on expression of c-myc protein in the epiphyseal plate of fetal mouse long bone was detected by immunohistochemistry procedure in vitro. The result showed that the concentrations of estrone areas of positively staining cells increased significantly in proliferative zone at 10-9 mol/L, in proliferative zone and resting zone at 10-8mol/L, and in resting zone, proliferative zone and hypertrophic zone at 10-7 mol/L respectively. It was considered that estrogen might enforce endochondral bone formation by enhancing expression of c-myc in long bone.
, 百拇医药
Key words:estrone, c-myc, long bone, immunohistochemistry
雌激素可影响成骨细胞和破骨细胞的功能,因而是影响骨代谢的重要因素。但雌激素对骨的作用机制迄今尚未阐明。文献表明原癌基因c-myc在软骨内成骨过程中起着重要作用 [1],本文通过观察雌激素对体外培养小鼠胚胎长骨c-myc蛋白表达的影响,初步探讨雌激素对骨的作用机制。
1 材料和方法
1.1 主要试剂
雌酚酮购自浙江仙居药厂。小鼠抗c-myc单克隆抗体(cat.sc-42,一抗)购自美国Santa Cruz公司。SPTM试剂盒(含生物素化兔抗鼠IgG,二抗)购自美国Zymed公司。
1.2 主要设备
, http://www.100md.com
隔水式恒温培养箱(上海),旋转培养装置(成都),超净工作台(蚌埠),Olympus显微镜(日本),AO型组织切片机(美国),THW-500型真彩色图像分析系统(四川联合大学)。
1.3 组织培养
1.3.1 实验分组 实验设1个正常对照组及3个雌酚酮组(Ⅰ、Ⅱ、Ⅲ),浓度分别为10-9、10-8和10-7mol/L。每组培养长骨18根,分3次,每次培养6根。
1.3.2 培养方法[2] 将16d孕龄的昆明种小鼠脱颈椎处死,取雌性胎鼠尺骨,置于含有BGJb培养基的培养瓶中,加入待测药物,通入混合气体(O2∶CO2∶N2=45∶5∶50),于(37.5±0.5)℃旋转培养,转速35 r/min,24h后补充气体1次。
, 百拇医药
1.4 c-myc蛋白免疫组织化学染色
1.4.1 骨组织固定处理 骨组织培养48h后,用4%多聚甲醛磷酸缓冲液(pH7.2)固定,7%EDTA磷酸缓冲液(pH7.2,4℃)脱钙,石蜡包埋,自中心纵切片(5μm),裱于涂有明胶的载玻片上,置37℃烤箱72h。
1.4.2 染色方法 组织切片常规脱蜡入水,在3%H2O2溶液中孵育30min阻断内源性过氧化物酶,加0.4%胃蛋白酶37℃反应15min暴露抗原,加新配2%牛血清白蛋白,37℃封闭30min,SP法染色(一抗和二抗工作浓度均为1∶200,于37℃分别孵育2h和1h),DAB显色,逐级酒精脱水,二甲苯透明,封片。
1.5 结果判定及图像分析
阳性对照用人结肠癌组织代替骨组织;阴性对照骨组织染色时以磷酸缓冲液代替一抗,其余步骤相同。光镜下观察骺板静止区(resting zone)、增殖区(proliferative zone)和肥大区(hypertrophic zone)的c-myc蛋白染色阳性的细胞分布,并在彩色图像分析系统下测定各区阳性细胞面积和阳性细胞数,所有切片均放大40倍,测量窗面积100μm2。
, 百拇医药
1.6 统计方法
所有数据均采用华西医科大学公共卫生学院研制的PEMS统计软件包进行方差分析和q检验。
2 结果
光镜下正常对照组骺板静止区、增殖区和肥大区均可见少量c-myc蛋白免疫反应阳性的软骨细胞,阳性物质位于细胞核,呈棕色颗粒状。经雌酚酮处理后,阳性物质定位未改变,但表达强度发生了变化。培养介质中雌酚酮浓度为10-9mol/L时,增殖区c-myc 蛋白阳性细胞面积与对照组相比增加;浓度为10-8mol/L时,除增殖区外,静止区阳性细胞面积也显著增加;当浓度增至10-7mol/L,3个区阳性细胞面积均显著增加(附表,图片1~6 见封4)。浓度对阳性细胞数的变化影响不大,仅当雌酚酮浓度为10-7mol/L时,静止区阳性细胞数较对照组增加(附表)。
, http://www.100md.com
附表 雌酚酮对骺板各区c-myc蛋白免疫
反应阳性细胞面积和细胞数的影响 (n=18,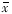 ±s) 组别
±s) 组别
浓度
(mol/L)
阳性细胞面积(μm2/100μm2)
阳性细胞数(个/100μm2)
静止区
增殖区
肥大区
, http://www.100md.com 静止区
增殖区
肥大区
对照组
7.35±1.25
6.17±2.26
7.69±2.10
60.0± 3.0
71.3±6.8
33.2±7.0
雌酚酮Ⅰ组
10-9
, http://www.100md.com
9.10±3.85
9.69±1.89(2)
8.41±2.42
58.0± 7.0
69.7±8.8
31.6±5.5
雌酚酮Ⅱ组
10-8
11.93±2.10(2)
14.65±2.54(2)
8.79±1.58
, http://www.100md.com
62.0±10.6
66.4±5.6
29.7±8.1
雌酚酮Ⅲ组
10-7
13.45±2.64(2)
15.05±2.88(2)
9.61±1.73(1)
84.6± 8.1(2)
71.0±6.1
, 百拇医药
34.8±6.0
注:与对照组相比(1)P<0.05,(2)P<0.01
图1 对照组静止区c-myc蛋白免疫组织化学染色(×400)
图2 雌酚酮Ⅲ组(10-7mol/L)静止区
c-myc蛋白免疫组织化学染色(×400)
图3 对照组增殖区c-myc蛋白免疫组织化学染色(×400)
, http://www.100md.com
图4 雌酚酮Ⅲ组(10-7mol/L)增殖区
c-myc蛋白免疫组织化学染色(×400)
图5 对照组肥大区c-myc蛋白免疫组织化学染色(×400)
图6 雌酚酮Ⅲ组(10-7mol/L)肥大区
c-myc蛋白免疫组织化学染色(×400)
3 讨论
原癌基因c-myc参与调控细胞增殖和分化。在细胞分化过程中,c-myc基因表达下调。终止分化一般都伴随着c-myc表达的突然下降[3,4]。但是,进一步的研究表明,c-myc表达的调节并不与DNA合成耦联。某些细胞系的分化并不仅仅伴随着简单的表达下降,在大鼠PC12嗜铬细胞瘤细胞和小鼠红白血病细胞的分化过程中,c-myc mRNA水平出现瞬时升高[5,6]。对心肌和骨骼肌的研究也提示在细胞肥大过程中也表达c-myc蛋白[7,8],而在软骨细胞,肥大则代表着分化。这意味着c-myc在细胞增殖和分化中所起的作用更复杂。
, 百拇医药
在骨的生长板上可清晰地观察到成熟程度不同的软骨细胞的各个区带,软骨细胞在其中沿生长方向有序排列,因而是研究c-myc在骨细胞的正常生长和分化中作用的一个极好模型。Farquharson用定位和定量的方法检测了大鼠及鸡胫骨和跖骨生长板c-myc蛋白的含量,发现在处于增殖和分化状态的细胞中c-myc蛋白含量显著高于静止和分化完全的细胞[1]。本实验采用小鼠胚胎长骨培养模型,发现在胎鼠长骨生长过程中,骺板静止区、增殖区和肥大区均不同程度地有c-myc蛋白表达,其阳性细胞面积相近,结果与Farquharson不完全相同,这可能与胚胎骨正处于细胞分裂、增殖、分化和钙化的高峰期有关,也可能由于种属差异所致。但该结果同样证实c-myc基因在软骨内成骨过程中起着重要作用。对各区的阳性细胞计数表明,除雌酚酮浓度为10-7mol/L时增殖区阳性细胞数增加外,其 它各组阳性细胞数均无明显改变,提示雌酚酮主要使细胞内c-myc阳性物质增多,对细胞的增加影响不大。
已证实软骨细胞上存在雌激素受体,这意味着雌激素可以直接作用于软骨细胞。本实验发现培养基中加入10-7mol/L雌酚酮后,静止区、增殖区和肥大区c-myc 表达均增强。随雌酚酮浓度下降,表达也逐 渐减弱,当雌酚酮浓度依10-8mol/L、10-9mol/L递减时,肥大区和静止区c-myc阳性面积相继降至正常对照组水平,但增殖区c-myc阳性细胞面积仍高于正常对照组。表明雌酚酮在低浓度时,仅作用于增殖期软骨细胞,浓度较高时,则对静止期和分化期的软骨细胞均有作用。同时我们的实验还证实:雌酚酮浓度为10-7mol/L时,胎鼠长骨骨干和骨总长均大于正常对照组[9]。提示雌酚酮可能通过促进软骨细胞c-myc的表达,促进软骨细胞的增殖和分化,从而促进软骨内骨形成。
, 百拇医药
Müller等的实验证实,用血清或纯化的生长因子刺激成纤维细胞会诱导c-fos mRNA及其蛋白质大量表达,随之激活c-myc[10]。我们在实验中也发现雌酚酮能够不同程度地上调各区c-fos蛋白水平,而且当雌酚酮浓度依10-9~10-7mol/L降低时,各区c-fos蛋白水平降低的特点与c-myc相似[9]。提示本实验中雌酚酮促进长骨c-myc蛋白表达有可能是通过促进c-fos表达实现的。确切证据尚需通过观察雌酚酮干预后,长骨c-fos和c-myc表达变化的时序性来提供。
作者简介:李灵芝,女,博士,副教授
4 参考文献
1,farquharson C Hesketh JE, Loveridge N. The proto-oncogene c-myc is involved in cell differentiation as well as cell proliferation:studies on growth plate chondrocytes in situ. J Cellular Phys,1992,152:135-144
, 百拇医药
2,马丽英,王瑞淑,李云,等.小鼠胚胎长骨体外培养的研究.卫生研究,1998,27:399-401
3,Campisi J, Gray HE, Pardee AB, et al. Cell-cycle control of c-myc but not c-ras expression is lost following chemical transformation. Cell,1984,36:241-247
4,Dony C, Kessel M, Gruss P. Post-transcription control of myc and P53 expression during differentiation of embryonal carcinoma cell line F9. Nature, 1985,317:636-639
5,Greenberg ME, Greene LA, Ziff EB. Nerve growth factor and epidermal growth factor induce rapid transient changes in proto-oncogene transcription in PC12 cells. J Biol Chem,1985,260:14101-14110
, http://www.100md.com
6,Lachma HM, Skoultchi AI. Expression of c-myc changes during differentiation of mouse erythroleukaemia cells. Nature, 1984,310:592-594
7,Izumo S, Nadal-Ginard B, mahdavi V. Proto-oncogene induction,and reprogramming of cardiac gene expression produced by pressure overload. Proc Acad Sci USA,1988,85:339-343
8,Whitelaw PF, Hesketh JE. Expression of c-myc and c-fos in rat skeletal muscle. Evidence for increased levels of c-myc mRNA during hypertrophy. Biochem J, 1992,281:143-147
9,Müller R, Bravo R, Burckhardt J. Induction of c-fos gene and protein by growth factors precedes activation of c-myc. Nature, 1984,312:716-720
10,李灵芝,张永亮,冯凯琳,等.雌激素上调小鼠长骨c-fos和c-jun表达水平.中国药理 学通报,2000,16(1):43-45
(2000-06-01收稿), 百拇医药
单位:马丽英(新疆医学院);李灵芝 张永亮 刘建中 陈虹(武警医学院药学教研室,天津 300162)
关键词:雌酚酮;c-myc;长骨;免疫组织化学
卫生研究000616 摘要:为初步探讨雌激素对骨的作用机制,以体外培养的小鼠胚胎长骨作为模型,通过免疫组织化学方法检测雌酚酮对骺板静止区、增殖区和肥大区c-myc蛋白表达的影响。结果显示,培养介质中雌酚酮浓度为10-9mol/L时,增殖区c- myc蛋白阳性细胞面积与对照组相比显著增加;浓度为10-8mol/L时,除增殖区外,静止区阳性细胞面积也显著增加;当浓度增至10-7mol/L时,3个区阳性细胞面积均显著增加。提示雌激素可通过促进长骨c-myc的表达促进软骨内成骨。
, 百拇医药
中图分类号:R977.1 R967 文献标识码:A
文章编号:1000-8020(2000)06-0402-03
Effect of estrogen on the expression of c-myc protein of bone in mice
Li Lingzhi Zhang Yongliang Ma Liying Liu Jianzhong et al
(Medical Collage of Chinese People's Armed Police Forces, Tianjin 300 162,China)
Abstract:In order to study the mechanism by which estrogen effects on bone, the effect of estrone on expression of c-myc protein in the epiphyseal plate of fetal mouse long bone was detected by immunohistochemistry procedure in vitro. The result showed that the concentrations of estrone areas of positively staining cells increased significantly in proliferative zone at 10-9 mol/L, in proliferative zone and resting zone at 10-8mol/L, and in resting zone, proliferative zone and hypertrophic zone at 10-7 mol/L respectively. It was considered that estrogen might enforce endochondral bone formation by enhancing expression of c-myc in long bone.
, 百拇医药
Key words:estrone, c-myc, long bone, immunohistochemistry
雌激素可影响成骨细胞和破骨细胞的功能,因而是影响骨代谢的重要因素。但雌激素对骨的作用机制迄今尚未阐明。文献表明原癌基因c-myc在软骨内成骨过程中起着重要作用 [1],本文通过观察雌激素对体外培养小鼠胚胎长骨c-myc蛋白表达的影响,初步探讨雌激素对骨的作用机制。
1 材料和方法
1.1 主要试剂
雌酚酮购自浙江仙居药厂。小鼠抗c-myc单克隆抗体(cat.sc-42,一抗)购自美国Santa Cruz公司。SPTM试剂盒(含生物素化兔抗鼠IgG,二抗)购自美国Zymed公司。
1.2 主要设备
, http://www.100md.com
隔水式恒温培养箱(上海),旋转培养装置(成都),超净工作台(蚌埠),Olympus显微镜(日本),AO型组织切片机(美国),THW-500型真彩色图像分析系统(四川联合大学)。
1.3 组织培养
1.3.1 实验分组 实验设1个正常对照组及3个雌酚酮组(Ⅰ、Ⅱ、Ⅲ),浓度分别为10-9、10-8和10-7mol/L。每组培养长骨18根,分3次,每次培养6根。
1.3.2 培养方法[2] 将16d孕龄的昆明种小鼠脱颈椎处死,取雌性胎鼠尺骨,置于含有BGJb培养基的培养瓶中,加入待测药物,通入混合气体(O2∶CO2∶N2=45∶5∶50),于(37.5±0.5)℃旋转培养,转速35 r/min,24h后补充气体1次。
, 百拇医药
1.4 c-myc蛋白免疫组织化学染色
1.4.1 骨组织固定处理 骨组织培养48h后,用4%多聚甲醛磷酸缓冲液(pH7.2)固定,7%EDTA磷酸缓冲液(pH7.2,4℃)脱钙,石蜡包埋,自中心纵切片(5μm),裱于涂有明胶的载玻片上,置37℃烤箱72h。
1.4.2 染色方法 组织切片常规脱蜡入水,在3%H2O2溶液中孵育30min阻断内源性过氧化物酶,加0.4%胃蛋白酶37℃反应15min暴露抗原,加新配2%牛血清白蛋白,37℃封闭30min,SP法染色(一抗和二抗工作浓度均为1∶200,于37℃分别孵育2h和1h),DAB显色,逐级酒精脱水,二甲苯透明,封片。
1.5 结果判定及图像分析
阳性对照用人结肠癌组织代替骨组织;阴性对照骨组织染色时以磷酸缓冲液代替一抗,其余步骤相同。光镜下观察骺板静止区(resting zone)、增殖区(proliferative zone)和肥大区(hypertrophic zone)的c-myc蛋白染色阳性的细胞分布,并在彩色图像分析系统下测定各区阳性细胞面积和阳性细胞数,所有切片均放大40倍,测量窗面积100μm2。
, 百拇医药
1.6 统计方法
所有数据均采用华西医科大学公共卫生学院研制的PEMS统计软件包进行方差分析和q检验。
2 结果
光镜下正常对照组骺板静止区、增殖区和肥大区均可见少量c-myc蛋白免疫反应阳性的软骨细胞,阳性物质位于细胞核,呈棕色颗粒状。经雌酚酮处理后,阳性物质定位未改变,但表达强度发生了变化。培养介质中雌酚酮浓度为10-9mol/L时,增殖区c-myc 蛋白阳性细胞面积与对照组相比增加;浓度为10-8mol/L时,除增殖区外,静止区阳性细胞面积也显著增加;当浓度增至10-7mol/L,3个区阳性细胞面积均显著增加(附表,图片1~6 见封4)。浓度对阳性细胞数的变化影响不大,仅当雌酚酮浓度为10-7mol/L时,静止区阳性细胞数较对照组增加(附表)。
, http://www.100md.com
附表 雌酚酮对骺板各区c-myc蛋白免疫
反应阳性细胞面积和细胞数的影响 (n=18,
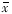 ±s) 组别
±s) 组别浓度
(mol/L)
阳性细胞面积(μm2/100μm2)
阳性细胞数(个/100μm2)
静止区
增殖区
肥大区
, http://www.100md.com 静止区
增殖区
肥大区
对照组
7.35±1.25
6.17±2.26
7.69±2.10
60.0± 3.0
71.3±6.8
33.2±7.0
雌酚酮Ⅰ组
10-9
, http://www.100md.com
9.10±3.85
9.69±1.89(2)
8.41±2.42
58.0± 7.0
69.7±8.8
31.6±5.5
雌酚酮Ⅱ组
10-8
11.93±2.10(2)
14.65±2.54(2)
8.79±1.58
, http://www.100md.com
62.0±10.6
66.4±5.6
29.7±8.1
雌酚酮Ⅲ组
10-7
13.45±2.64(2)
15.05±2.88(2)
9.61±1.73(1)
84.6± 8.1(2)
71.0±6.1
, 百拇医药
34.8±6.0
注:与对照组相比(1)P<0.05,(2)P<0.01

图1 对照组静止区c-myc蛋白免疫组织化学染色(×400)

图2 雌酚酮Ⅲ组(10-7mol/L)静止区
c-myc蛋白免疫组织化学染色(×400)

图3 对照组增殖区c-myc蛋白免疫组织化学染色(×400)

, http://www.100md.com
图4 雌酚酮Ⅲ组(10-7mol/L)增殖区
c-myc蛋白免疫组织化学染色(×400)

图5 对照组肥大区c-myc蛋白免疫组织化学染色(×400)

图6 雌酚酮Ⅲ组(10-7mol/L)肥大区
c-myc蛋白免疫组织化学染色(×400)
3 讨论
原癌基因c-myc参与调控细胞增殖和分化。在细胞分化过程中,c-myc基因表达下调。终止分化一般都伴随着c-myc表达的突然下降[3,4]。但是,进一步的研究表明,c-myc表达的调节并不与DNA合成耦联。某些细胞系的分化并不仅仅伴随着简单的表达下降,在大鼠PC12嗜铬细胞瘤细胞和小鼠红白血病细胞的分化过程中,c-myc mRNA水平出现瞬时升高[5,6]。对心肌和骨骼肌的研究也提示在细胞肥大过程中也表达c-myc蛋白[7,8],而在软骨细胞,肥大则代表着分化。这意味着c-myc在细胞增殖和分化中所起的作用更复杂。
, 百拇医药
在骨的生长板上可清晰地观察到成熟程度不同的软骨细胞的各个区带,软骨细胞在其中沿生长方向有序排列,因而是研究c-myc在骨细胞的正常生长和分化中作用的一个极好模型。Farquharson用定位和定量的方法检测了大鼠及鸡胫骨和跖骨生长板c-myc蛋白的含量,发现在处于增殖和分化状态的细胞中c-myc蛋白含量显著高于静止和分化完全的细胞[1]。本实验采用小鼠胚胎长骨培养模型,发现在胎鼠长骨生长过程中,骺板静止区、增殖区和肥大区均不同程度地有c-myc蛋白表达,其阳性细胞面积相近,结果与Farquharson不完全相同,这可能与胚胎骨正处于细胞分裂、增殖、分化和钙化的高峰期有关,也可能由于种属差异所致。但该结果同样证实c-myc基因在软骨内成骨过程中起着重要作用。对各区的阳性细胞计数表明,除雌酚酮浓度为10-7mol/L时增殖区阳性细胞数增加外,其 它各组阳性细胞数均无明显改变,提示雌酚酮主要使细胞内c-myc阳性物质增多,对细胞的增加影响不大。
已证实软骨细胞上存在雌激素受体,这意味着雌激素可以直接作用于软骨细胞。本实验发现培养基中加入10-7mol/L雌酚酮后,静止区、增殖区和肥大区c-myc 表达均增强。随雌酚酮浓度下降,表达也逐 渐减弱,当雌酚酮浓度依10-8mol/L、10-9mol/L递减时,肥大区和静止区c-myc阳性面积相继降至正常对照组水平,但增殖区c-myc阳性细胞面积仍高于正常对照组。表明雌酚酮在低浓度时,仅作用于增殖期软骨细胞,浓度较高时,则对静止期和分化期的软骨细胞均有作用。同时我们的实验还证实:雌酚酮浓度为10-7mol/L时,胎鼠长骨骨干和骨总长均大于正常对照组[9]。提示雌酚酮可能通过促进软骨细胞c-myc的表达,促进软骨细胞的增殖和分化,从而促进软骨内骨形成。
, 百拇医药
Müller等的实验证实,用血清或纯化的生长因子刺激成纤维细胞会诱导c-fos mRNA及其蛋白质大量表达,随之激活c-myc[10]。我们在实验中也发现雌酚酮能够不同程度地上调各区c-fos蛋白水平,而且当雌酚酮浓度依10-9~10-7mol/L降低时,各区c-fos蛋白水平降低的特点与c-myc相似[9]。提示本实验中雌酚酮促进长骨c-myc蛋白表达有可能是通过促进c-fos表达实现的。确切证据尚需通过观察雌酚酮干预后,长骨c-fos和c-myc表达变化的时序性来提供。
作者简介:李灵芝,女,博士,副教授
4 参考文献
1,farquharson C Hesketh JE, Loveridge N. The proto-oncogene c-myc is involved in cell differentiation as well as cell proliferation:studies on growth plate chondrocytes in situ. J Cellular Phys,1992,152:135-144
, 百拇医药
2,马丽英,王瑞淑,李云,等.小鼠胚胎长骨体外培养的研究.卫生研究,1998,27:399-401
3,Campisi J, Gray HE, Pardee AB, et al. Cell-cycle control of c-myc but not c-ras expression is lost following chemical transformation. Cell,1984,36:241-247
4,Dony C, Kessel M, Gruss P. Post-transcription control of myc and P53 expression during differentiation of embryonal carcinoma cell line F9. Nature, 1985,317:636-639
5,Greenberg ME, Greene LA, Ziff EB. Nerve growth factor and epidermal growth factor induce rapid transient changes in proto-oncogene transcription in PC12 cells. J Biol Chem,1985,260:14101-14110
, http://www.100md.com
6,Lachma HM, Skoultchi AI. Expression of c-myc changes during differentiation of mouse erythroleukaemia cells. Nature, 1984,310:592-594
7,Izumo S, Nadal-Ginard B, mahdavi V. Proto-oncogene induction,and reprogramming of cardiac gene expression produced by pressure overload. Proc Acad Sci USA,1988,85:339-343
8,Whitelaw PF, Hesketh JE. Expression of c-myc and c-fos in rat skeletal muscle. Evidence for increased levels of c-myc mRNA during hypertrophy. Biochem J, 1992,281:143-147
9,Müller R, Bravo R, Burckhardt J. Induction of c-fos gene and protein by growth factors precedes activation of c-myc. Nature, 1984,312:716-720
10,李灵芝,张永亮,冯凯琳,等.雌激素上调小鼠长骨c-fos和c-jun表达水平.中国药理 学通报,2000,16(1):43-45
(2000-06-01收稿), 百拇医药