镉对大鼠肝细胞原癌基因c-fos、c-jun表达的影响
作者:余日安 陈学敏 鲁文清
单位:同济医科大学公共卫生学院,武汉 430030
关键词:镉;c-fos;c-jun;癌基因
卫生研究000606 摘要:应用Northern斑点杂交方法研究氯化镉对大鼠肝细胞原癌基因c-fos、c-jun表达的影响。结果表明,5、10和20μmol/kg氯化镉腹腔一次注射后,大鼠肝细胞c-fos、c-jun mRNA较对照组明显增多。结果提示,氯化镉可以引起大鼠在体肝细胞原癌基因c-fos、c-jun表达增强。
中图分类号:R599.9 Q523 R730.21 文献标识码:A
文章编号:1000-8020(2000)06-0364-02
Effects of cadmium on the expression of proto-oncogene c-fos
, 百拇医药
and c-jun of liver cell in rats
Yu Ri-an Chen Xuemin Lu Wenqing
(School of Public Health, Tongji Medical University, Wuhan 430030, China)
Abstract:The effects of cadmium chloride on the expression of proto-oncogene c-fos and c-jun of rat liver cells were studied with Northern dot hybridization. The results showed that at the dose of 5, 10 or 20μmol/kg of cadmium chloride, the expression of proto-oncogene c-fos and c-jun could be induced obviously.
, 百拇医药
Key words:cadmium, c-fos, c-jun, oncogene
镉的污染问题一直受到世界各国高度重视,我国是重金属丰产的国家,许多矿区附近也受到严重镉污染[1]。近一、二十年来,关于镉对机体健康的影响展开了广泛的研究。研究表明,镉具有致癌、致畸和致突变作用[2]。1993年国际肿瘤研究中心(IARC)明确指出,镉是人类和实验动物肺癌的肯定致癌物,镉也能诱发实验动物前列腺和睾丸肿瘤。镉已被IARC归类为第一类致癌物[3]。作者曾应用单细胞凝胶电泳研究发现8.75、17.50和35.00μmol/L的CdCl2可以引起离体大鼠肝细胞DNA单链断裂,出现拖尾的慧星细胞[4]。为了进一步研究镉的致癌作用机理,本研究采用Northern斑点杂交方法,研究了CdCl2在体作用时对原癌基因c-fos、c-jun表达的影响。
, http://www.100md.com
1 材料与方法
1.1 动物分组及染毒
健康雄性SD大鼠,体重(200±50)g,由同济医科大学实验动物中心提供,常规喂养。将实验动物随机分组,每组5只。腹腔注射染毒1次,染毒后48h处死动物,取出肝脏。各染毒组CdCl2剂量为:低剂量镉组5μmol/kg,中剂量镉组10μmol/kg,高剂量镉组20μmol/kg。对照组 腹脏注射等量PBS。
1.2 Northern斑点杂交
采用TRIzol Reagent试剂盒(美国Gibco BRL公司产品),一步法提取肝细胞总RNA。用紫外分光光度计(日本岛津)比色测定OD260nm和OD280nm值,控制OD260/OD280在1.7~2.0之间,按OD260nm值计算RNA总含量。调整RNA浓度至1μg/μl。
, 百拇医药
用地高辛-DNA标记检测试剂盒(DIG high prime labeling and detection starter kit I, Boehringer Mannheim公司产品)标记c-fos、 c-jun探针(购自武汉博士德公司);在NC膜上将RNA样品液按设计点样(因多孔过滤加样器为每排4孔,故取4份样品点样,后改手工点样,仍取4份样品);按地高辛-DNA标记检测试剂盒提供的方法进行预杂交、杂交、洗膜、显色等操作;杂交斑点用MPIAS-500多媒体图文分析系统测定积分光密度。
2 结果
5、10和20μmol/kg CdCl2腹腔染毒均可使大鼠肝细胞c-fos、c-jun mRNA含量较对照组增多(附表),CdCl2的3个剂量组之间差异无显著性意义(P>0.05),杂交斑 点见图1、2。
附表 CdCl2对大鼠细胞c-fos、c-jun mRNA的影响(n=5,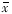 ±s)
±s)
, 百拇医药
积分光密度(IOD) 组 别
c-fos
c-jun
对照组
6.99±0.40
7.42±1.05
CdCl2组(μmol/kg)
5
13.85±5.19
22.42±3.45(1)
10
, http://www.100md.com 18.79±3.13(1)
14.51±3.59
20
19.64±4.52(1)
20.03±3.91(1)
注:与对照组比较(1)P<0.01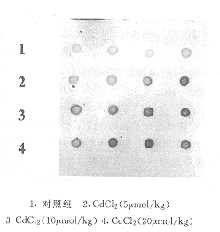
图1 Northern斑点杂交(CdCl2与c-fos)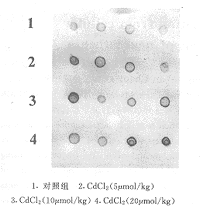
图2 Northern斑点杂交(CdCl2与c-jun)
, 百拇医药
3 讨论
c-fos、c-jun均为即刻早期基因,其表达产物均为核内转录因子,c-fos和c-jun还可构成二聚体活性蛋白AP-1(activation protein 1),参与细胞信息传递和调节某些基因的表达[5]。
本文应用Northern斑点杂交研究CdCl2对原癌基因c-fos和c-jun表达的影响。结果表明,5、10和20μmol/kg的CdCl2可使大鼠肝细胞c-fos、c-jun表达增强。
研究发现,c-fos、c-jun表达增强以及AP-1结合活性提高是由于氧化应激所造成的,如活性氧自由基、羟自由基、紫外照射等[6,7]。研究证实,镉能引起脂质过氧化,造成氧化应激[8],因此,CdCl2使c-fos、c-jun表达增强可能与镉造成氧化应激有关。
, 百拇医药
有人认为DNA损伤会引起癌基因的激活[9]。作者曾应用单细胞凝胶电泳研究发现8.75、17.50和35.00μmol/L的CdCl2可以引起离体大鼠肝细胞DNA单链断裂,出现拖尾的慧星细胞[4]。本文的结果进一步支持这一假设。
镉能影响细胞钙稳态,使细胞内Ca2+浓度增高[10],Nicotera研究发现,细胞浆和细胞核内游离钙水平的紊乱可以改变基因表达的模式[11]。Matsuoka研究了镉对LLC-PK1细胞c-fos表达的作用,认为钙离子浓度增加和蛋白激酶活性增加均参与了转录,BAPTA/AM是细胞内钙的螯合剂,用BAPTA/AM处理的细胞,镉对c-fos mRNA的诱导显著下降[12]。镉还可以改变细胞的胞浆蛋白和胞核蛋白的磷酸化模式,如镉可以结合并影响蛋白激酶C和钙调蛋白的活性,引起转录因子磷酸化的增加,从而使它们反应的基因增加转录[13~15]。
, http://www.100md.com
总之,镉通过造成氧化应激,引起DNA损伤,增加细胞内钙浓度,并激活蛋白激酶C,使c-fos、c-jun等即早基因表达增加。
基金项目:国家自然科学基金资助项目 (No.39670626)
作者简介:余日安,男,博士生
4 参考文献
1,王夔主编.生命科学中的微量元素.第2版.北京:中国计量出版社,1 996
2,Degraeve N. Carcinogenic, teratogenic and mutagenic effects of cadm ium. Mut Res, 1981,86:115
3,IARC. Beryllium, cadmium, mercury and exposures in the glass manufa cturing industry. In:IARC monographs on the evaluation of carcinogenic risks to humans. Lyon: Intern Agency Res Cancer, 1993,58:41
, 百拇医药
4,余日安,陈学敏.镉对大鼠肝细胞DNA损伤作用的研究.中国公共卫生学报,19 98,17(2):106
5,Liebermann DA, Gregory B, Hoffman B. AP-1(Fos/Jun), transcription factors in hematopoietic differentiation and apoptosis. Int J Oncol, 1998,12(3):685
6,Nose K, Shibanuma K, Kageyama H. Transcriptional activation of earl y-response genes by hydrogen peroxide in a mouse osteoblast cell line. Eur J Biochem, 1991,201:99
7,Amstad PA, Krupitza G, Cerutti PA. Mechanism of c-fos induction by active oxygen. Cancer Res, 1992,52:3952
, http://www.100md.com
8,Muller L. Consequences of cadmium toxicity in rat hepatocytes mitoc hondrial dysfunction and lipid peroxidation. Toxicology,1991,40:285
9,张铣,刘毓谷主编.毒理学.北京:北京医科大学中国协和医科大学联合出版 社,1997
10,Smith JB, Dwyer SD, Smith L, et al. Cadmium evokes inositol polyphosphate formation and calcium mobilization. J Biol Chem,1989,264:7115
11,Nicotera P, Zhivotosky B, Orrenius S, et al. Nuclear calcium transport and the role of calcium in apoptosis. Cell Calcium,1994,16:279
, 百拇医药
12,Matsuoka M, Call KM. Cadmium-induced expression of immediate early genes in LLC-PK1 cells. Kidney Int,1995,48:383
13,Akerman KEO, Honkaniemi J, Scott IG. Interaction of Cd2+with the calmodulin-activated (Ca2++Mg2+)-ATPase activity of human erythrocyte ghosts. Biochim Biophys Acta,1985,845:48
14,Suzuki Y, Chao SH, Zysk J. Stimulation of calmodulin by cadmium ion. Arch Toxicol, 1985,57:205
15,Speizer LA, Watson MJ, Kanter JR, et al. Inhibition of phorbol ester binding and protein kinase c activity by heavy metals. J Biol Chem, 1989,264:5581
(2000-04-03收稿), http://www.100md.com
单位:同济医科大学公共卫生学院,武汉 430030
关键词:镉;c-fos;c-jun;癌基因
卫生研究000606 摘要:应用Northern斑点杂交方法研究氯化镉对大鼠肝细胞原癌基因c-fos、c-jun表达的影响。结果表明,5、10和20μmol/kg氯化镉腹腔一次注射后,大鼠肝细胞c-fos、c-jun mRNA较对照组明显增多。结果提示,氯化镉可以引起大鼠在体肝细胞原癌基因c-fos、c-jun表达增强。
中图分类号:R599.9 Q523 R730.21 文献标识码:A
文章编号:1000-8020(2000)06-0364-02
Effects of cadmium on the expression of proto-oncogene c-fos
, 百拇医药
and c-jun of liver cell in rats
Yu Ri-an Chen Xuemin Lu Wenqing
(School of Public Health, Tongji Medical University, Wuhan 430030, China)
Abstract:The effects of cadmium chloride on the expression of proto-oncogene c-fos and c-jun of rat liver cells were studied with Northern dot hybridization. The results showed that at the dose of 5, 10 or 20μmol/kg of cadmium chloride, the expression of proto-oncogene c-fos and c-jun could be induced obviously.
, 百拇医药
Key words:cadmium, c-fos, c-jun, oncogene
镉的污染问题一直受到世界各国高度重视,我国是重金属丰产的国家,许多矿区附近也受到严重镉污染[1]。近一、二十年来,关于镉对机体健康的影响展开了广泛的研究。研究表明,镉具有致癌、致畸和致突变作用[2]。1993年国际肿瘤研究中心(IARC)明确指出,镉是人类和实验动物肺癌的肯定致癌物,镉也能诱发实验动物前列腺和睾丸肿瘤。镉已被IARC归类为第一类致癌物[3]。作者曾应用单细胞凝胶电泳研究发现8.75、17.50和35.00μmol/L的CdCl2可以引起离体大鼠肝细胞DNA单链断裂,出现拖尾的慧星细胞[4]。为了进一步研究镉的致癌作用机理,本研究采用Northern斑点杂交方法,研究了CdCl2在体作用时对原癌基因c-fos、c-jun表达的影响。
, http://www.100md.com
1 材料与方法
1.1 动物分组及染毒
健康雄性SD大鼠,体重(200±50)g,由同济医科大学实验动物中心提供,常规喂养。将实验动物随机分组,每组5只。腹腔注射染毒1次,染毒后48h处死动物,取出肝脏。各染毒组CdCl2剂量为:低剂量镉组5μmol/kg,中剂量镉组10μmol/kg,高剂量镉组20μmol/kg。对照组 腹脏注射等量PBS。
1.2 Northern斑点杂交
采用TRIzol Reagent试剂盒(美国Gibco BRL公司产品),一步法提取肝细胞总RNA。用紫外分光光度计(日本岛津)比色测定OD260nm和OD280nm值,控制OD260/OD280在1.7~2.0之间,按OD260nm值计算RNA总含量。调整RNA浓度至1μg/μl。
, 百拇医药
用地高辛-DNA标记检测试剂盒(DIG high prime labeling and detection starter kit I, Boehringer Mannheim公司产品)标记c-fos、 c-jun探针(购自武汉博士德公司);在NC膜上将RNA样品液按设计点样(因多孔过滤加样器为每排4孔,故取4份样品点样,后改手工点样,仍取4份样品);按地高辛-DNA标记检测试剂盒提供的方法进行预杂交、杂交、洗膜、显色等操作;杂交斑点用MPIAS-500多媒体图文分析系统测定积分光密度。
2 结果
5、10和20μmol/kg CdCl2腹腔染毒均可使大鼠肝细胞c-fos、c-jun mRNA含量较对照组增多(附表),CdCl2的3个剂量组之间差异无显著性意义(P>0.05),杂交斑 点见图1、2。
附表 CdCl2对大鼠细胞c-fos、c-jun mRNA的影响(n=5,
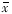 ±s)
±s), 百拇医药
积分光密度(IOD) 组 别
c-fos
c-jun
对照组
6.99±0.40
7.42±1.05
CdCl2组(μmol/kg)
5
13.85±5.19
22.42±3.45(1)
10
, http://www.100md.com 18.79±3.13(1)
14.51±3.59
20
19.64±4.52(1)
20.03±3.91(1)
注:与对照组比较(1)P<0.01

图1 Northern斑点杂交(CdCl2与c-fos)

图2 Northern斑点杂交(CdCl2与c-jun)
, 百拇医药
3 讨论
c-fos、c-jun均为即刻早期基因,其表达产物均为核内转录因子,c-fos和c-jun还可构成二聚体活性蛋白AP-1(activation protein 1),参与细胞信息传递和调节某些基因的表达[5]。
本文应用Northern斑点杂交研究CdCl2对原癌基因c-fos和c-jun表达的影响。结果表明,5、10和20μmol/kg的CdCl2可使大鼠肝细胞c-fos、c-jun表达增强。
研究发现,c-fos、c-jun表达增强以及AP-1结合活性提高是由于氧化应激所造成的,如活性氧自由基、羟自由基、紫外照射等[6,7]。研究证实,镉能引起脂质过氧化,造成氧化应激[8],因此,CdCl2使c-fos、c-jun表达增强可能与镉造成氧化应激有关。
, 百拇医药
有人认为DNA损伤会引起癌基因的激活[9]。作者曾应用单细胞凝胶电泳研究发现8.75、17.50和35.00μmol/L的CdCl2可以引起离体大鼠肝细胞DNA单链断裂,出现拖尾的慧星细胞[4]。本文的结果进一步支持这一假设。
镉能影响细胞钙稳态,使细胞内Ca2+浓度增高[10],Nicotera研究发现,细胞浆和细胞核内游离钙水平的紊乱可以改变基因表达的模式[11]。Matsuoka研究了镉对LLC-PK1细胞c-fos表达的作用,认为钙离子浓度增加和蛋白激酶活性增加均参与了转录,BAPTA/AM是细胞内钙的螯合剂,用BAPTA/AM处理的细胞,镉对c-fos mRNA的诱导显著下降[12]。镉还可以改变细胞的胞浆蛋白和胞核蛋白的磷酸化模式,如镉可以结合并影响蛋白激酶C和钙调蛋白的活性,引起转录因子磷酸化的增加,从而使它们反应的基因增加转录[13~15]。
, http://www.100md.com
总之,镉通过造成氧化应激,引起DNA损伤,增加细胞内钙浓度,并激活蛋白激酶C,使c-fos、c-jun等即早基因表达增加。
基金项目:国家自然科学基金资助项目 (No.39670626)
作者简介:余日安,男,博士生
4 参考文献
1,王夔主编.生命科学中的微量元素.第2版.北京:中国计量出版社,1 996
2,Degraeve N. Carcinogenic, teratogenic and mutagenic effects of cadm ium. Mut Res, 1981,86:115
3,IARC. Beryllium, cadmium, mercury and exposures in the glass manufa cturing industry. In:IARC monographs on the evaluation of carcinogenic risks to humans. Lyon: Intern Agency Res Cancer, 1993,58:41
, 百拇医药
4,余日安,陈学敏.镉对大鼠肝细胞DNA损伤作用的研究.中国公共卫生学报,19 98,17(2):106
5,Liebermann DA, Gregory B, Hoffman B. AP-1(Fos/Jun), transcription factors in hematopoietic differentiation and apoptosis. Int J Oncol, 1998,12(3):685
6,Nose K, Shibanuma K, Kageyama H. Transcriptional activation of earl y-response genes by hydrogen peroxide in a mouse osteoblast cell line. Eur J Biochem, 1991,201:99
7,Amstad PA, Krupitza G, Cerutti PA. Mechanism of c-fos induction by active oxygen. Cancer Res, 1992,52:3952
, http://www.100md.com
8,Muller L. Consequences of cadmium toxicity in rat hepatocytes mitoc hondrial dysfunction and lipid peroxidation. Toxicology,1991,40:285
9,张铣,刘毓谷主编.毒理学.北京:北京医科大学中国协和医科大学联合出版 社,1997
10,Smith JB, Dwyer SD, Smith L, et al. Cadmium evokes inositol polyphosphate formation and calcium mobilization. J Biol Chem,1989,264:7115
11,Nicotera P, Zhivotosky B, Orrenius S, et al. Nuclear calcium transport and the role of calcium in apoptosis. Cell Calcium,1994,16:279
, 百拇医药
12,Matsuoka M, Call KM. Cadmium-induced expression of immediate early genes in LLC-PK1 cells. Kidney Int,1995,48:383
13,Akerman KEO, Honkaniemi J, Scott IG. Interaction of Cd2+with the calmodulin-activated (Ca2++Mg2+)-ATPase activity of human erythrocyte ghosts. Biochim Biophys Acta,1985,845:48
14,Suzuki Y, Chao SH, Zysk J. Stimulation of calmodulin by cadmium ion. Arch Toxicol, 1985,57:205
15,Speizer LA, Watson MJ, Kanter JR, et al. Inhibition of phorbol ester binding and protein kinase c activity by heavy metals. J Biol Chem, 1989,264:5581
(2000-04-03收稿), http://www.100md.com