葡激酶在变铅青链霉菌中的克隆和分泌表达
作者:程 泳 李 元 刘伯英 郭连宏
单位:中国医学科学院 中国协和医科大学 医药生物技术研究所, 北京 100050
关键词:葡激酶;链霉菌;克隆;表达
葡激酶在变铅青链霉菌中的克隆和分泌表达
摘要 目的 构建可分泌表达葡激酶的基因工程链霉菌。方法 通过PCR方法扩增得到包括葡激酶结构基因和分泌信号肽基因在内的 730 bp的DNA片段,将该片段插入变铅青链霉菌质粒 pIJ459的erm强启动子下游,构建重组质粒pIJ459SAK,转化变铅青链霉菌TK54。结果 获得含有该重组质粒的基因工程菌株,经发酵培养基培养72 h后,发酵液离心取上清用变性聚丙烯酰胺凝胶电泳分析,可见相对分子量约为16 000的特异性蛋白条带;用溶纤平皿法可测得溶纤活性。结论 葡激酶已在所构建的基因工程菌中分泌表达且具有溶纤活性。
, 百拇医药
中图号 Q510 Q784
来源于金黄色葡萄球菌(Staphylococcus aureus)的葡激酶(staphylokinase,SAK)是由163个氨基酸组成的具有溶纤作用的蛋白质,相对分子量为15 500~18 000[1]。它首先与血纤蛋白溶酶原(plasminogen, PLG)按1∶1比例结合形成复合物,此复合物可激活PLG形成有溶纤活性的血纤蛋白溶酶(plasmin, PLI)。当血浆中存在血栓时,PLI可与血栓特异性结合,溶解血栓;当血浆中不存在血栓时,PLI则被血浆中的α-antiplasmin (α-AP)中和[2]。葡激酶具有良好的血纤特异性,不降低凝血系统中的纤维蛋白原水平,不易引起全身性溶血,副作用小;并且由于其相对分子量小,渗透性好,可迅速发挥溶栓作用。体外实验表明,葡激酶对富含血小板的动脉血栓具有明显强于其它溶栓剂的溶栓作用[3]。本研究采用PCR方法直接从临床来源的S.aureus总DNA扩增获得包括葡激酶结构基因和分泌信号肽基因的730 bp DNA片段,插入质粒pIJ459的erm强启动子下游,构建重组质粒pIJ459SAK,转化变铅青链霉菌(Streptomyces lividans)TK54,得到的基因工程重组菌可将葡激酶直接分泌到发酵液中,且具有溶纤活性。
, 百拇医药
1 材料和方法
材料
质粒、菌株和培养基:大肠杆菌(E.coli)质粒pUC19,链霉菌质粒pIJ459均由本实验室保存。临床分离的S.aureus菌株由本所药理室提供。S.lividans TK54, E.coli HB101由本实验室保存。S.aureus采用加富肉汤培养基,E.coli采用LB培养基,链霉菌种子培养基为YEME培养基[4],发酵培养基为酶解酪蛋白培养基。
工具酶和试剂:限制性内切酶、Taq DNA聚合酶及T4DNA连接酶等工具酶均购自GIBCO/BRL、友谊公司、上海生工公司,DNA荧光标记杂交试剂盒为Amersham公司产品,人血纤维蛋白原及凝血酶购自中国药品生物制品检定所,链激酶标准品由北京汇思特公司赠送,其它试剂均为分析纯。
方法
, 百拇医药
总DNA及质粒DNA提取:S.aureus总DNA及E.coli质粒DNA提取采用碱裂解法,参照Sambrook等[5]方法进行。S.lividans质粒DNA提取按照改进的Hopwood等[4]方法,小量提取采用酸性酚法,大量提取采用碱变性法。
DNA的酶切及连接:DNA的限制性内切酶酶切及T4DNA连接酶连接均按照厂家推荐的条件进行。
PCR扩增葡激酶基因:根据文献报道的葡激酶基因核苷酸序列及表达质粒pIJ459的多克隆位点设计引物[6]:
上游引物: 5′CGTCTAGAGTGGATATGGCATGAG 3′ 引入XbaⅠ酶切位点。
下游引物:5′GCGCGGAAGCTTTCATTTCTTTTCTATAAC 3′ 引入HindⅢ酶切位点和终止密码子TCA。
, 百拇医药
PCR扩增条件:在50 μl反应体系中采用2.5 mmol/L MgCl2, 0.2 mmol/L dNTP, 94℃变性3 min后,进入循环程序,包括94℃变性 1 min,52℃复性 1 min, 72℃延伸2 min。循环30次后再延伸10 min,终止反应。
大肠杆菌感受态细胞的制备和DNA转化:按改进的Sambrook等[5]方法用E. coli HB101氯化钙法制备感受态细胞并进行DNA转化。
链霉菌原生质体的制备及DNA转化:S.lividans TK54原生质体的制备及DNA转化按照改进的Hopwood等[4]方法进行。将S.lividansTK54新鲜斜面接种于25 ml YEME液体培养基,28℃振荡培养24 h,转种到25 ml含0.5%甘氨酸的YEME液体培养基继续培养24~48 h,离心并洗涤菌体,加入5 ml含2 mg/ml溶菌酶的P缓冲液(Tris 0.31%;CaCl2*2H2O 0.386%,MgCl2*6H2O 0.204%,Sucrose 10.3%,Glucose 0.1%,pH7.6)28℃保温30~60 min至原生质体形成率达90%以上,离心收集原生质体洗涤后悬于P缓冲液。取50 μl原生质体加入10 μl DNA (可多至1 μg),混匀后立即加入200 μl 25%的PEG1000,涂布于R2平板,28℃培养20 h后,覆盖含硫链丝菌素(100 μg/μl)的软琼脂(0.65%),28℃继续培养5~10 d,挑取转化子。
, 百拇医药
核苷酸序列分析:按照ABI公司提供的碱裂解法提取质粒DNA并纯化,ABI 373A型自动测序仪测序。
Southern杂交:以测序确证的PCR扩增片段为探针,按Amersham公司Gene Images random labeling module和Gene Images CDP-Star detection module试剂盒说明书对所获得的重组质粒进行荧光标记与检测。
聚丙烯酰胺凝胶电泳(SDS-PAGE)分析:聚丙烯酰胺凝胶电泳按Ornstein & Davis 系统。分离胶浓度为15%,电压在堆积胶部分为8V/cm,进入分离胶后升为12V/cm,银染显色[5]。
表达产物溶纤活性测定:采用溶纤平皿法测定发酵液上清中表达产物的溶纤活性。含有人血纤溶酶原的人纤维蛋白原用0.1 mol/L pH 7.4的磷酸盐缓冲液溶解(终质量浓度为0.36 mg/ml),与等体积15%琼脂糖溶液混合,加入8 U(B.P)凝血酶,混匀后迅速倒入平皿,37℃放置1 h后待用。链霉菌重组菌株经发酵培养基28℃振荡培养72 h,发酵液4 000r/min离心 15min,上清液80%硫酸铵沉淀后溶于少量水中,取10 μl 加在溶纤平皿上,以溶纤机理相似的链激酶为标准,37℃保温16~20 h,测定溶纤活性。
, 百拇医药
图 1 PCR产物的琼脂糖凝胶电泳
Fig 1 Agrose gel electrophoresis of PCR produc 1. DNA marker:λDNA (HindⅢ/EcoRⅠ);
2. PCR product
2 结果
葡激酶基因的获得 以临床来源的金黄色葡萄球菌总DNA为模板,经PCR扩增获得包括葡激酶结构基因和分泌信号肽基因在内的全长为730 bp的DNA片段(图1)。将该片段和大肠杆菌质粒pUC19用XbaⅠ和HindⅢ双酶切,T4DNA连接酶连接,构建重组质粒pUCSAK(图2),经ABI 373A型自动测序仪测序,证实所扩增的片段与已知葡激酶基因序列完全一致。
重组质粒的构建 重组质粒pUCSAK和链霉菌质粒pIJ459经XbaⅠ和HindⅢ双酶切,低熔点胶回收所需DNA片段,T4DNA酶连接,转化S.lividansTK54, 在含有20 μg/ml硫链丝菌素的R2平板上挑选重组子。经酶切分析和Southern杂交分析均证实所构建的重组质粒pIJ459SAK中确含葡激酶基因(图3)。
, 百拇医药
图 2 重组质粒pIJ459SAK的构建过程
Fig 2 Construction of recombinant plasmid of pIJ459SAK
图 3 重组质粒pIJ459SAK的酶切分析(A)和Southern杂交分析(B)
Fig 3 Restriction enzymic analysis (A) and result of Southern blot analysis (B) of recombinant plasmid pIJ459SAK 1.pIJ459/HindⅢ(negative control); 2. pIJ459SAK/HindⅢ; 3. pIJ459SAK/(HindⅢ+XbaⅠ); 4. λDNA/(HindⅢ+EcoRⅠ); 5. PCR product; 6. pUC19SAK (positive control)
, 百拇医药
表达产物的聚丙烯酰胺凝胶电泳(SDS-PAGE)分析结果 链霉菌重组菌株72 h发酵液上清经15%SDS-PAGE分析,上样量20 μl,可见相对分子质量约为16 000的特异性蛋白条带,证实葡激酶确被分泌到发酵液上清中(图4)。
表达产物的溶纤活性测定 链霉菌重组菌株72 h发酵液经80%硫酸铵沉淀后溶于少量水中,取30 μl加在溶纤平皿上,测得具有溶纤活性(图5)。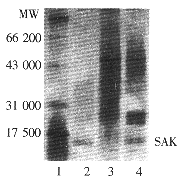
图 4 重组菌株发酵液上清的SDS-PAGE(15%)分析结果
Fig 4 15% SDS-PAGE analysis of recombinant strain culture supernatant
1. Standard protein molecular weight; 2&4.S.lividans [pIJ459SAK] 72 hours culture supernatant;
, 百拇医药
3. S.lividans [pIJ459] 72 hours culture supernatant (control)
SAK: staphylokinase; MW: molecular weight
图 5 重组菌株发酵液上清溶纤活性的测定结果
Fig 5 Fibrin-plate analysis of activation of recombinant strain culture supernatant
1. S.lividans [pIJ459SAK]72 hours culture supernatant (ammonium sulfate precipitated);
, http://www.100md.com
2. streptokinase (1 000U/ml);3.S.lividans [pIJ459] 72 hours culture supernatant (control)
3 讨论
溶栓剂的使用是治疗急性心肌梗塞(acute myocardial infarction)等心血管疾病的有效方法,可显著降低患者的死亡率。目前临床使用的尿激酶(urokinase)和链激酶(streptokinase),缺乏血纤特异性,在溶栓同时也引起凝血系统中血纤蛋白原水平的急剧降低,易导致全身性溶血,故大大限制了临床的使用范围。组织型纤溶酶原激活剂(t-PA)特异性好,但半衰期短,使用剂量大,且价格昂贵,故难以推广。Lijnen等[3]体外实验表明,葡激酶溶解血栓的专一性强,达到同样溶纤效果所需剂量仅为链激酶的1/4。因此,葡激酶有良好的开发和应用前景。
以链霉菌为宿主通过基因重组技术表达的葡激酶可被直接分泌到发酵液中,省去基因工程大肠杆菌中包含体变性、复性等降低活性成分回收率的工序,简化了分离纯化工艺。此外,链霉菌对人、畜安全,可避免基因工程技术中抗生素抗性质粒的使用对环境的潜在危害。
, 百拇医药
本研究利用葡激酶自身信号肽基因实现了葡激酶在链霉菌中的分泌表达,证明葡激酶自身信号肽可被同属革兰氏阳性菌的链霉菌转录和蛋白质翻译、运输系统识别。Collen等[7]报道,由基因工程大肠杆菌表达的葡激酶相对分子质量在16 000~18 000左右,这是由葡激酶N-末端氨基酸序列存在0、6或10个氨基酸缺失所造成的。而基因工程链霉菌所分泌表达的葡激酶经SDS-PAGE分析,仅为单一条带,便于分离纯化工作。其N-末端氨基酸序列待纯化测定蛋白质序列后即能确定。
参 考 文 献
1 Collen D, Zhao ZA, Holvoet P, et al. Primary structure and gene structure of staphylokinase. Fibrinolysis, 1992, 6:226~231
2 Lijnen HR, Van Hoef B, De Cock F, et al. On the mechanismof fibrin-specific plasminogen activation by staphylokinase. J Biol Chem, 1991,266: 11826~11831
, 百拇医药
3 Lijnen HR, De Cock F, Matsuo O, et al. Comparative fibrinolytic and fibrinogenolytic properties of staphylokinase and streptokinase in plasma of different species in vitro. Fibrinolysis, 1992, 6:33~37
4 Hopwood DA. Genetic manipulation of Streptomyces:a laboratory mannual. Norwich: John Innes Foundation, 1988
5 Sambrook J, Fritsch EF, Maniatis T, et al. Molecular cloning: a laboratory mannual. 2nd ed. New York: Cold Spring Harbour Laboratory Press, 1989. 64~70
, 百拇医药
6 Behnke D, Gerlach D. Cloning and expression in Escherichia coli, Bacillus subtilis, and Streptococcus sanguis of a gene for staphylokinase-a bacterial plasminogen activator. Mol Gen Genet, 1987, 210:528~534
7 Collen D, Silence K, Demarsin E, et al. Isolation and characterisation of natural and recombinant staphylokinase. Fibrinolysis, 1992, 6:203~213
Cloning and Secretory Expression of Staphylokinase in Streptomyces lividans
, http://www.100md.com
Cheng Yong Li Yuan Liu Boying Guo Lianhong
(Institute of Medicinal Biotechnology, CAMS and PUMC, Beijing 100050)
Objective Construct a recombinant Streptomyces strain by which staphylokinase can be secretory expressed. Methods With the total DNA extracted from strains of Staphylococcus aureus isolated in clinic as template DNA, one 730 bp DNA fragment including secretory signal peptide sequence and structure gene of staphylokinase was amplified by PCR. After cloning into plasmid pUC19 and sequencing, this fragment was confirmed to have the same nucleotide sequence as that of staphylokinase gene reported before. Then the fragment was inserted into Streptomyces plasmid pIJ459 following strong promoter. Recombinant plasmid pIJ459SAK was transformed into S. lividans TK54. Results The 72 hours culture supernatant of the secretory-type genetic engineering strain that harbored pIJ459SAK was analyzed by 15% SDS-PAGE. One specific protein band with molecular weight about 16 000 can be seen after staining the gel with silver nitrate. The fibrinolytic activity of Staphylokinase can be also detected in the 72 hours culture supernatant in the fibrin-plate assay. Conclusions Staphylokinase can be successfully secreted into fermentation culture by the recombinant Streptomyces strain.
Key words staphylokinase; Streptomyces lividans; clone; expression
(1998-01-22 收稿), 百拇医药
单位:中国医学科学院 中国协和医科大学 医药生物技术研究所, 北京 100050
关键词:葡激酶;链霉菌;克隆;表达
葡激酶在变铅青链霉菌中的克隆和分泌表达
摘要 目的 构建可分泌表达葡激酶的基因工程链霉菌。方法 通过PCR方法扩增得到包括葡激酶结构基因和分泌信号肽基因在内的 730 bp的DNA片段,将该片段插入变铅青链霉菌质粒 pIJ459的erm强启动子下游,构建重组质粒pIJ459SAK,转化变铅青链霉菌TK54。结果 获得含有该重组质粒的基因工程菌株,经发酵培养基培养72 h后,发酵液离心取上清用变性聚丙烯酰胺凝胶电泳分析,可见相对分子量约为16 000的特异性蛋白条带;用溶纤平皿法可测得溶纤活性。结论 葡激酶已在所构建的基因工程菌中分泌表达且具有溶纤活性。
, 百拇医药
中图号 Q510 Q784
来源于金黄色葡萄球菌(Staphylococcus aureus)的葡激酶(staphylokinase,SAK)是由163个氨基酸组成的具有溶纤作用的蛋白质,相对分子量为15 500~18 000[1]。它首先与血纤蛋白溶酶原(plasminogen, PLG)按1∶1比例结合形成复合物,此复合物可激活PLG形成有溶纤活性的血纤蛋白溶酶(plasmin, PLI)。当血浆中存在血栓时,PLI可与血栓特异性结合,溶解血栓;当血浆中不存在血栓时,PLI则被血浆中的α-antiplasmin (α-AP)中和[2]。葡激酶具有良好的血纤特异性,不降低凝血系统中的纤维蛋白原水平,不易引起全身性溶血,副作用小;并且由于其相对分子量小,渗透性好,可迅速发挥溶栓作用。体外实验表明,葡激酶对富含血小板的动脉血栓具有明显强于其它溶栓剂的溶栓作用[3]。本研究采用PCR方法直接从临床来源的S.aureus总DNA扩增获得包括葡激酶结构基因和分泌信号肽基因的730 bp DNA片段,插入质粒pIJ459的erm强启动子下游,构建重组质粒pIJ459SAK,转化变铅青链霉菌(Streptomyces lividans)TK54,得到的基因工程重组菌可将葡激酶直接分泌到发酵液中,且具有溶纤活性。
, 百拇医药
1 材料和方法
材料
质粒、菌株和培养基:大肠杆菌(E.coli)质粒pUC19,链霉菌质粒pIJ459均由本实验室保存。临床分离的S.aureus菌株由本所药理室提供。S.lividans TK54, E.coli HB101由本实验室保存。S.aureus采用加富肉汤培养基,E.coli采用LB培养基,链霉菌种子培养基为YEME培养基[4],发酵培养基为酶解酪蛋白培养基。
工具酶和试剂:限制性内切酶、Taq DNA聚合酶及T4DNA连接酶等工具酶均购自GIBCO/BRL、友谊公司、上海生工公司,DNA荧光标记杂交试剂盒为Amersham公司产品,人血纤维蛋白原及凝血酶购自中国药品生物制品检定所,链激酶标准品由北京汇思特公司赠送,其它试剂均为分析纯。
方法
, 百拇医药
总DNA及质粒DNA提取:S.aureus总DNA及E.coli质粒DNA提取采用碱裂解法,参照Sambrook等[5]方法进行。S.lividans质粒DNA提取按照改进的Hopwood等[4]方法,小量提取采用酸性酚法,大量提取采用碱变性法。
DNA的酶切及连接:DNA的限制性内切酶酶切及T4DNA连接酶连接均按照厂家推荐的条件进行。
PCR扩增葡激酶基因:根据文献报道的葡激酶基因核苷酸序列及表达质粒pIJ459的多克隆位点设计引物[6]:
上游引物: 5′CGTCTAGAGTGGATATGGCATGAG 3′ 引入XbaⅠ酶切位点。
下游引物:5′GCGCGGAAGCTTTCATTTCTTTTCTATAAC 3′ 引入HindⅢ酶切位点和终止密码子TCA。
, 百拇医药
PCR扩增条件:在50 μl反应体系中采用2.5 mmol/L MgCl2, 0.2 mmol/L dNTP, 94℃变性3 min后,进入循环程序,包括94℃变性 1 min,52℃复性 1 min, 72℃延伸2 min。循环30次后再延伸10 min,终止反应。
大肠杆菌感受态细胞的制备和DNA转化:按改进的Sambrook等[5]方法用E. coli HB101氯化钙法制备感受态细胞并进行DNA转化。
链霉菌原生质体的制备及DNA转化:S.lividans TK54原生质体的制备及DNA转化按照改进的Hopwood等[4]方法进行。将S.lividansTK54新鲜斜面接种于25 ml YEME液体培养基,28℃振荡培养24 h,转种到25 ml含0.5%甘氨酸的YEME液体培养基继续培养24~48 h,离心并洗涤菌体,加入5 ml含2 mg/ml溶菌酶的P缓冲液(Tris 0.31%;CaCl2*2H2O 0.386%,MgCl2*6H2O 0.204%,Sucrose 10.3%,Glucose 0.1%,pH7.6)28℃保温30~60 min至原生质体形成率达90%以上,离心收集原生质体洗涤后悬于P缓冲液。取50 μl原生质体加入10 μl DNA (可多至1 μg),混匀后立即加入200 μl 25%的PEG1000,涂布于R2平板,28℃培养20 h后,覆盖含硫链丝菌素(100 μg/μl)的软琼脂(0.65%),28℃继续培养5~10 d,挑取转化子。
, 百拇医药
核苷酸序列分析:按照ABI公司提供的碱裂解法提取质粒DNA并纯化,ABI 373A型自动测序仪测序。
Southern杂交:以测序确证的PCR扩增片段为探针,按Amersham公司Gene Images random labeling module和Gene Images CDP-Star detection module试剂盒说明书对所获得的重组质粒进行荧光标记与检测。
聚丙烯酰胺凝胶电泳(SDS-PAGE)分析:聚丙烯酰胺凝胶电泳按Ornstein & Davis 系统。分离胶浓度为15%,电压在堆积胶部分为8V/cm,进入分离胶后升为12V/cm,银染显色[5]。
表达产物溶纤活性测定:采用溶纤平皿法测定发酵液上清中表达产物的溶纤活性。含有人血纤溶酶原的人纤维蛋白原用0.1 mol/L pH 7.4的磷酸盐缓冲液溶解(终质量浓度为0.36 mg/ml),与等体积15%琼脂糖溶液混合,加入8 U(B.P)凝血酶,混匀后迅速倒入平皿,37℃放置1 h后待用。链霉菌重组菌株经发酵培养基28℃振荡培养72 h,发酵液4 000r/min离心 15min,上清液80%硫酸铵沉淀后溶于少量水中,取10 μl 加在溶纤平皿上,以溶纤机理相似的链激酶为标准,37℃保温16~20 h,测定溶纤活性。

, 百拇医药
图 1 PCR产物的琼脂糖凝胶电泳
Fig 1 Agrose gel electrophoresis of PCR produc 1. DNA marker:λDNA (HindⅢ/EcoRⅠ);
2. PCR product
2 结果
葡激酶基因的获得 以临床来源的金黄色葡萄球菌总DNA为模板,经PCR扩增获得包括葡激酶结构基因和分泌信号肽基因在内的全长为730 bp的DNA片段(图1)。将该片段和大肠杆菌质粒pUC19用XbaⅠ和HindⅢ双酶切,T4DNA连接酶连接,构建重组质粒pUCSAK(图2),经ABI 373A型自动测序仪测序,证实所扩增的片段与已知葡激酶基因序列完全一致。
重组质粒的构建 重组质粒pUCSAK和链霉菌质粒pIJ459经XbaⅠ和HindⅢ双酶切,低熔点胶回收所需DNA片段,T4DNA酶连接,转化S.lividansTK54, 在含有20 μg/ml硫链丝菌素的R2平板上挑选重组子。经酶切分析和Southern杂交分析均证实所构建的重组质粒pIJ459SAK中确含葡激酶基因(图3)。

, 百拇医药
图 2 重组质粒pIJ459SAK的构建过程
Fig 2 Construction of recombinant plasmid of pIJ459SAK

图 3 重组质粒pIJ459SAK的酶切分析(A)和Southern杂交分析(B)
Fig 3 Restriction enzymic analysis (A) and result of Southern blot analysis (B) of recombinant plasmid pIJ459SAK 1.pIJ459/HindⅢ(negative control); 2. pIJ459SAK/HindⅢ; 3. pIJ459SAK/(HindⅢ+XbaⅠ); 4. λDNA/(HindⅢ+EcoRⅠ); 5. PCR product; 6. pUC19SAK (positive control)
, 百拇医药
表达产物的聚丙烯酰胺凝胶电泳(SDS-PAGE)分析结果 链霉菌重组菌株72 h发酵液上清经15%SDS-PAGE分析,上样量20 μl,可见相对分子质量约为16 000的特异性蛋白条带,证实葡激酶确被分泌到发酵液上清中(图4)。
表达产物的溶纤活性测定 链霉菌重组菌株72 h发酵液经80%硫酸铵沉淀后溶于少量水中,取30 μl加在溶纤平皿上,测得具有溶纤活性(图5)。

图 4 重组菌株发酵液上清的SDS-PAGE(15%)分析结果
Fig 4 15% SDS-PAGE analysis of recombinant strain culture supernatant
1. Standard protein molecular weight; 2&4.S.lividans [pIJ459SAK] 72 hours culture supernatant;
, 百拇医药
3. S.lividans [pIJ459] 72 hours culture supernatant (control)
SAK: staphylokinase; MW: molecular weight

图 5 重组菌株发酵液上清溶纤活性的测定结果
Fig 5 Fibrin-plate analysis of activation of recombinant strain culture supernatant
1. S.lividans [pIJ459SAK]72 hours culture supernatant (ammonium sulfate precipitated);
, http://www.100md.com
2. streptokinase (1 000U/ml);3.S.lividans [pIJ459] 72 hours culture supernatant (control)
3 讨论
溶栓剂的使用是治疗急性心肌梗塞(acute myocardial infarction)等心血管疾病的有效方法,可显著降低患者的死亡率。目前临床使用的尿激酶(urokinase)和链激酶(streptokinase),缺乏血纤特异性,在溶栓同时也引起凝血系统中血纤蛋白原水平的急剧降低,易导致全身性溶血,故大大限制了临床的使用范围。组织型纤溶酶原激活剂(t-PA)特异性好,但半衰期短,使用剂量大,且价格昂贵,故难以推广。Lijnen等[3]体外实验表明,葡激酶溶解血栓的专一性强,达到同样溶纤效果所需剂量仅为链激酶的1/4。因此,葡激酶有良好的开发和应用前景。
以链霉菌为宿主通过基因重组技术表达的葡激酶可被直接分泌到发酵液中,省去基因工程大肠杆菌中包含体变性、复性等降低活性成分回收率的工序,简化了分离纯化工艺。此外,链霉菌对人、畜安全,可避免基因工程技术中抗生素抗性质粒的使用对环境的潜在危害。
, 百拇医药
本研究利用葡激酶自身信号肽基因实现了葡激酶在链霉菌中的分泌表达,证明葡激酶自身信号肽可被同属革兰氏阳性菌的链霉菌转录和蛋白质翻译、运输系统识别。Collen等[7]报道,由基因工程大肠杆菌表达的葡激酶相对分子质量在16 000~18 000左右,这是由葡激酶N-末端氨基酸序列存在0、6或10个氨基酸缺失所造成的。而基因工程链霉菌所分泌表达的葡激酶经SDS-PAGE分析,仅为单一条带,便于分离纯化工作。其N-末端氨基酸序列待纯化测定蛋白质序列后即能确定。
参 考 文 献
1 Collen D, Zhao ZA, Holvoet P, et al. Primary structure and gene structure of staphylokinase. Fibrinolysis, 1992, 6:226~231
2 Lijnen HR, Van Hoef B, De Cock F, et al. On the mechanismof fibrin-specific plasminogen activation by staphylokinase. J Biol Chem, 1991,266: 11826~11831
, 百拇医药
3 Lijnen HR, De Cock F, Matsuo O, et al. Comparative fibrinolytic and fibrinogenolytic properties of staphylokinase and streptokinase in plasma of different species in vitro. Fibrinolysis, 1992, 6:33~37
4 Hopwood DA. Genetic manipulation of Streptomyces:a laboratory mannual. Norwich: John Innes Foundation, 1988
5 Sambrook J, Fritsch EF, Maniatis T, et al. Molecular cloning: a laboratory mannual. 2nd ed. New York: Cold Spring Harbour Laboratory Press, 1989. 64~70
, 百拇医药
6 Behnke D, Gerlach D. Cloning and expression in Escherichia coli, Bacillus subtilis, and Streptococcus sanguis of a gene for staphylokinase-a bacterial plasminogen activator. Mol Gen Genet, 1987, 210:528~534
7 Collen D, Silence K, Demarsin E, et al. Isolation and characterisation of natural and recombinant staphylokinase. Fibrinolysis, 1992, 6:203~213
Cloning and Secretory Expression of Staphylokinase in Streptomyces lividans
, http://www.100md.com
Cheng Yong Li Yuan Liu Boying Guo Lianhong
(Institute of Medicinal Biotechnology, CAMS and PUMC, Beijing 100050)
Objective Construct a recombinant Streptomyces strain by which staphylokinase can be secretory expressed. Methods With the total DNA extracted from strains of Staphylococcus aureus isolated in clinic as template DNA, one 730 bp DNA fragment including secretory signal peptide sequence and structure gene of staphylokinase was amplified by PCR. After cloning into plasmid pUC19 and sequencing, this fragment was confirmed to have the same nucleotide sequence as that of staphylokinase gene reported before. Then the fragment was inserted into Streptomyces plasmid pIJ459 following strong promoter. Recombinant plasmid pIJ459SAK was transformed into S. lividans TK54. Results The 72 hours culture supernatant of the secretory-type genetic engineering strain that harbored pIJ459SAK was analyzed by 15% SDS-PAGE. One specific protein band with molecular weight about 16 000 can be seen after staining the gel with silver nitrate. The fibrinolytic activity of Staphylokinase can be also detected in the 72 hours culture supernatant in the fibrin-plate assay. Conclusions Staphylokinase can be successfully secreted into fermentation culture by the recombinant Streptomyces strain.
Key words staphylokinase; Streptomyces lividans; clone; expression
(1998-01-22 收稿), 百拇医药