多聚酶链反应检测结核杆菌复合群方法的建立及临床应用
作者:张卫东 李福平 张坚 陈秀珠
单位:张卫东、张坚、陈秀珠:同济医科大学基础医学院微生物学教研室, 武汉 430030;李福平:湖南省岳阳市第一人民医院内科, 岳阳 414000
关键词:多聚酶链反应;结核杆菌
同济医科大学学报990504 摘要 采用多聚酶链反应(PCR)对结核杆菌复合群基因组进行扩增,得到一285 bp DNA条带。经Southern 印迹证实为特异性扩增。用PCR方法对临床40份待测标本进行检测,并与结核杆菌常规培养以及高渗培养等方法进行比较,其阳性率分别为60.0%、7.5% 和0%,差异均有显著性意义(均为P<0.01)。
中图法分类号 R378.91
Polymerase Chain Reaction Technique for Detection of Mycobacteriun Tuberculosis Complex in Clinical Specimens and Clinical Application
, http://www.100md.com
Zhang Weidong, Li Fuping, Zhang Jian et al.
Department of Microbiology, School of Basic Medical Sciences,Tongji Medical University, Wuhan 430030
Abstract A polymerase chain reaction (PCR) assay for the rapid detection of M.tuberculosis complex was developed. The PCR system was used in the identification of members of the M.tuberculosis complex and the specific product of amplification is a 285 bp DNA fragment confirmed with southern blot. The 40 clinical specimens were detected with the methods of PCR, M.tuberculosis culture, L-form of M.tuberculosis culture and acid-fast staining, at the same time, with the positive rate being 60.0 %, 7.5 %, 0 %, respectively.
, http://www.100md.com
Key words polymerase chain reaction; mycobacterium tuberculosis
结核菌感染目前在我国仍相当流行。其病原体主要包括人、牛两型结核杆菌。临床常规检测方法均因灵敏度低、特异性差或鉴定费时长等诸多原因难以满足早期诊断需要。针对上述情况我们建立了一种结核杆菌复合群PCR检测方法,初步临床试验,效果满意。
1 材料与方法
1.1 引物及实验用标准菌株
引物根据文献[1]于中科院上海细胞所合成。所用菌种包括:Staphy. Aureus,Strep.hemolyticus, M.simiae, M.smegmatis, M.terrae, M.marinum, M.furtuitum, M.paratuberculosis, M.kansassi, M.xenopi, M.chelorae, M.tuberculosis, M.bovis, M.avium, E.coli, K.pneumoniea, Candida,sp.等,分别从卫生部生物制品检定所、中科院微生物所以及加拿大British Columbia 大学Altamirano博士处引进。
, http://www.100md.com
1.2 其它主要试剂和材料
质粒工程菌MN522(含探针ASK58-4片段)系Altamirano博士惠赠。随机引物标记盒(Promega),〔α-32p〕dCTP (北京福瑞公司),TB-PCR Kit, FD-聚合酶(上海复华公司), 结核杆菌L型培养基(蚌埠医学院微生物室),Bam HI、EcoRI(GIBCO BRL), 硝酸纤维素膜 (NC)(Schleicher & Schuell)。
1.3 临床标本
62份临床标本中22份为既往确诊的结核性脑膜炎和胸膜炎的冻存标本;另40份为同济医院门诊或住院患者,其中脑脊液2份,胸水14份以及痰标本24份。
1.4 探针ASK58-4特异性鉴定
实验用标准菌株DNA按文献[2]方法提取后分别取5 ng变性,以一定间距点样于NC膜上行常规杂交。所用探针由质粒工程菌MN522中提取、酶切及回收,方法见文献[3]。探针标记按公司说明书进行。
, 百拇医药
1.5 引物特异性鉴定
30 μl反应液中含25 mmol/L MgCl2, 50 mmol/L KCl, 10 mmol/L Tris . Cl(pH 8.3),1 g/L明胶,dNTP各200 μmol/L,引物各0.8 μmol/L,人型及牛型结核杆菌及其它对照菌DNA各10 μl(6 ng),FD-DNA聚合酶0.4 U。循环采用94 ℃ 30 s、72 ℃ 90 s双温控点共35次,最后72 ℃保温5 min。取产物10 μl电泳并于紫外灯下观察,反应中设置空白对照。上述电泳结果按常规Southern转印置NC膜上,同前行杂交鉴定。
1.6 临床标本PCR与培养、抗酸染色检测比较
痰标本先经40 g/L NaOH处理,离心后部分用于细菌培养及抗酸染色镜检,余之加入裂解液(本室研制)置100 ℃水浴作用10 min,取上清10 μl行PCR反应。脑脊液及胸水则直接离心,勿需NaOH前处理。同时上述62份临床标本以及人、牛型结核杆菌标准株一并用复华公司TB-PCR Kit检测。
, 百拇医药
2 结果
2.1 探针特异性分析
回收探针仅与人、牛型结核杆菌DNA杂交,与其它菌株DNA无杂交信号,见图1。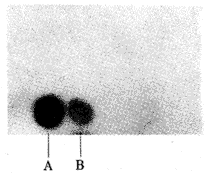
图1 探针ASK 58-4与实验用标准菌株DNA斑点杂交
A:人型结核杆菌 B:牛型结核杆菌
2.2 PCR特异性鉴定
人、牛型结核杆菌DNA经本系统扩增后电泳可见一285 bp条带以及前沿的引物二聚体带(图2)。经Southern转印后杂交只见285 bp处有杂交信号,且强度与扩增片段的点样量呈正比。但其它对照菌DNA同样扩增后无肉眼可见条带,转印后杂交亦未见阳性信号。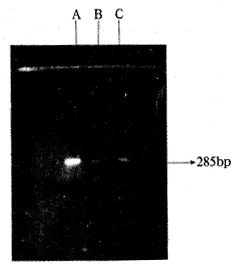
, 百拇医药
图2 人、牛型结核杆菌标准株DNA PCR扩增
A:人型结核杆菌(30 μl) B:人型结核杆菌(5 μl)
C:牛型结核杆菌(20 μl)
2.3 两种PCR系统检测结核杆菌复合群
同等条件下,本系统能同时检测到人、牛两型结核杆菌,而复华试剂盒仅对人型结核杆菌有一扩增带。同时,我们还对22份已确诊标本进行对比检测,结果复华试剂盒19例阳性,而本系统22例均为阳性。
2.4 不同方法检测40例临床标本比较
本文采用了4种方法进行检测比较,结果见附表。
附表 40例临床标本不同检测方法结果的比较
, http://www.100md.com
检测方法
标本例数
阳性例数
阳性率(%)
抗酸染色镜检
40
0
0#
改良罗氏培养基培养
40
3*
7.5#
, 百拇医药
结核杆菌L型培养
40
0
0#
本系统PCR
40
24
60.0
复华PCR试剂盒
40
19
47.5
*菌落裂解后用本系统进行PCR鉴定;
, http://www.100md.com
与本系统PCR法比较 #P<0.01。
3 讨论
探针鉴定表明ASK58-4片段仅与人、牛型结核杆菌有杂交信号,其中前者信号强于后者,考虑可能系该片段与牛型结核杆菌DNA同源性较人型低。说明ASK58-4对结核杆菌复合群有高度特异性。根据该片段序列分析设计的引物对人、牛型结核杆菌DNA进行扩增,得到285 bp条带,经Southern印迹示为特异性扩增片段,且该系统对其它实验对照菌DNA均无条带扩增,证实为特异性引物。同时我们将本系统与复华试剂盒对22份已确诊标本进行了对照检测,结果阳性数分别为22和19。推测其差异可能与复华试剂盒只针对人型结核杆菌有关。
应用本系统我们对临床40例待测标本进行了检测,阳性24例(60%),其中脑脊液阳性1例(1/2),胸水阳性8例(8/14),痰标本15例(15/24)。其中4例阴性胸水标本送检癌细胞阳性,9例阴性痰标本中有5例胸片示支气管扩张表现。同样40份标本中经抗酸染色及结核L型细菌高渗培养均为阴性,但其中3例经改良罗氏培养基培养为阳性。说明本系统检测结核杆菌灵敏度较常规方法高(P<0.01)。为了监控PCR可能出现的假阴性,我们行PCR操作时有意不采用热启动方式,即结果判断均以有引物二聚体出现为前提条件。若标本中存在有酶抑制物,则引物二聚体消失,标本经适当稀释后重做,直至二聚体出现。实验证明,在不严重影响扩增片段产量前提下,保留二聚体不失为监控扩增假阴性的有效手段之一。
, http://www.100md.com
本法中由于扩增片段经DNA序列分析发现(G+C)含量高达69%,我们将反应温控点由Altamirano的3个改为2个,既提高了反应特异性,又节省了运行时间,临床应用效果满意。
作者简介:张卫东, 男, 1964年生, 讲师。
参考文献
1 Altamirano M, Kelly M T, Wong A et al. Characterization of a DNA probe for detection of mycobacterium tuberculosis complex in clinical samples by polymerase chain reaction. J Clin Microbiol, 1992, 30:2173
2 Buck G E, O'hara L C, Summersgill J T. Rapid simple method for treating clinical specimens containing mycobacterium tuberculosis to remove DNA for polymerase chain reaction. J Clin Microbiol, 1992, 30:1331
3 Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning. A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. 1.29~1.30, 5.31, 6.30~6.31, 1.101~1.104, 9.32~9.58
收稿日期:1997-07-08, 百拇医药
单位:张卫东、张坚、陈秀珠:同济医科大学基础医学院微生物学教研室, 武汉 430030;李福平:湖南省岳阳市第一人民医院内科, 岳阳 414000
关键词:多聚酶链反应;结核杆菌
同济医科大学学报990504 摘要 采用多聚酶链反应(PCR)对结核杆菌复合群基因组进行扩增,得到一285 bp DNA条带。经Southern 印迹证实为特异性扩增。用PCR方法对临床40份待测标本进行检测,并与结核杆菌常规培养以及高渗培养等方法进行比较,其阳性率分别为60.0%、7.5% 和0%,差异均有显著性意义(均为P<0.01)。
中图法分类号 R378.91
Polymerase Chain Reaction Technique for Detection of Mycobacteriun Tuberculosis Complex in Clinical Specimens and Clinical Application
, http://www.100md.com
Zhang Weidong, Li Fuping, Zhang Jian et al.
Department of Microbiology, School of Basic Medical Sciences,Tongji Medical University, Wuhan 430030
Abstract A polymerase chain reaction (PCR) assay for the rapid detection of M.tuberculosis complex was developed. The PCR system was used in the identification of members of the M.tuberculosis complex and the specific product of amplification is a 285 bp DNA fragment confirmed with southern blot. The 40 clinical specimens were detected with the methods of PCR, M.tuberculosis culture, L-form of M.tuberculosis culture and acid-fast staining, at the same time, with the positive rate being 60.0 %, 7.5 %, 0 %, respectively.
, http://www.100md.com
Key words polymerase chain reaction; mycobacterium tuberculosis
结核菌感染目前在我国仍相当流行。其病原体主要包括人、牛两型结核杆菌。临床常规检测方法均因灵敏度低、特异性差或鉴定费时长等诸多原因难以满足早期诊断需要。针对上述情况我们建立了一种结核杆菌复合群PCR检测方法,初步临床试验,效果满意。
1 材料与方法
1.1 引物及实验用标准菌株
引物根据文献[1]于中科院上海细胞所合成。所用菌种包括:Staphy. Aureus,Strep.hemolyticus, M.simiae, M.smegmatis, M.terrae, M.marinum, M.furtuitum, M.paratuberculosis, M.kansassi, M.xenopi, M.chelorae, M.tuberculosis, M.bovis, M.avium, E.coli, K.pneumoniea, Candida,sp.等,分别从卫生部生物制品检定所、中科院微生物所以及加拿大British Columbia 大学Altamirano博士处引进。
, http://www.100md.com
1.2 其它主要试剂和材料
质粒工程菌MN522(含探针ASK58-4片段)系Altamirano博士惠赠。随机引物标记盒(Promega),〔α-32p〕dCTP (北京福瑞公司),TB-PCR Kit, FD-聚合酶(上海复华公司), 结核杆菌L型培养基(蚌埠医学院微生物室),Bam HI、EcoRI(GIBCO BRL), 硝酸纤维素膜 (NC)(Schleicher & Schuell)。
1.3 临床标本
62份临床标本中22份为既往确诊的结核性脑膜炎和胸膜炎的冻存标本;另40份为同济医院门诊或住院患者,其中脑脊液2份,胸水14份以及痰标本24份。
1.4 探针ASK58-4特异性鉴定
实验用标准菌株DNA按文献[2]方法提取后分别取5 ng变性,以一定间距点样于NC膜上行常规杂交。所用探针由质粒工程菌MN522中提取、酶切及回收,方法见文献[3]。探针标记按公司说明书进行。
, 百拇医药
1.5 引物特异性鉴定
30 μl反应液中含25 mmol/L MgCl2, 50 mmol/L KCl, 10 mmol/L Tris . Cl(pH 8.3),1 g/L明胶,dNTP各200 μmol/L,引物各0.8 μmol/L,人型及牛型结核杆菌及其它对照菌DNA各10 μl(6 ng),FD-DNA聚合酶0.4 U。循环采用94 ℃ 30 s、72 ℃ 90 s双温控点共35次,最后72 ℃保温5 min。取产物10 μl电泳并于紫外灯下观察,反应中设置空白对照。上述电泳结果按常规Southern转印置NC膜上,同前行杂交鉴定。
1.6 临床标本PCR与培养、抗酸染色检测比较
痰标本先经40 g/L NaOH处理,离心后部分用于细菌培养及抗酸染色镜检,余之加入裂解液(本室研制)置100 ℃水浴作用10 min,取上清10 μl行PCR反应。脑脊液及胸水则直接离心,勿需NaOH前处理。同时上述62份临床标本以及人、牛型结核杆菌标准株一并用复华公司TB-PCR Kit检测。
, 百拇医药
2 结果
2.1 探针特异性分析
回收探针仅与人、牛型结核杆菌DNA杂交,与其它菌株DNA无杂交信号,见图1。

图1 探针ASK 58-4与实验用标准菌株DNA斑点杂交
A:人型结核杆菌 B:牛型结核杆菌
2.2 PCR特异性鉴定
人、牛型结核杆菌DNA经本系统扩增后电泳可见一285 bp条带以及前沿的引物二聚体带(图2)。经Southern转印后杂交只见285 bp处有杂交信号,且强度与扩增片段的点样量呈正比。但其它对照菌DNA同样扩增后无肉眼可见条带,转印后杂交亦未见阳性信号。

, 百拇医药
图2 人、牛型结核杆菌标准株DNA PCR扩增
A:人型结核杆菌(30 μl) B:人型结核杆菌(5 μl)
C:牛型结核杆菌(20 μl)
2.3 两种PCR系统检测结核杆菌复合群
同等条件下,本系统能同时检测到人、牛两型结核杆菌,而复华试剂盒仅对人型结核杆菌有一扩增带。同时,我们还对22份已确诊标本进行对比检测,结果复华试剂盒19例阳性,而本系统22例均为阳性。
2.4 不同方法检测40例临床标本比较
本文采用了4种方法进行检测比较,结果见附表。
附表 40例临床标本不同检测方法结果的比较
, http://www.100md.com
检测方法
标本例数
阳性例数
阳性率(%)
抗酸染色镜检
40
0
0#
改良罗氏培养基培养
40
3*
7.5#
, 百拇医药
结核杆菌L型培养
40
0
0#
本系统PCR
40
24
60.0
复华PCR试剂盒
40
19
47.5
*菌落裂解后用本系统进行PCR鉴定;
, http://www.100md.com
与本系统PCR法比较 #P<0.01。
3 讨论
探针鉴定表明ASK58-4片段仅与人、牛型结核杆菌有杂交信号,其中前者信号强于后者,考虑可能系该片段与牛型结核杆菌DNA同源性较人型低。说明ASK58-4对结核杆菌复合群有高度特异性。根据该片段序列分析设计的引物对人、牛型结核杆菌DNA进行扩增,得到285 bp条带,经Southern印迹示为特异性扩增片段,且该系统对其它实验对照菌DNA均无条带扩增,证实为特异性引物。同时我们将本系统与复华试剂盒对22份已确诊标本进行了对照检测,结果阳性数分别为22和19。推测其差异可能与复华试剂盒只针对人型结核杆菌有关。
应用本系统我们对临床40例待测标本进行了检测,阳性24例(60%),其中脑脊液阳性1例(1/2),胸水阳性8例(8/14),痰标本15例(15/24)。其中4例阴性胸水标本送检癌细胞阳性,9例阴性痰标本中有5例胸片示支气管扩张表现。同样40份标本中经抗酸染色及结核L型细菌高渗培养均为阴性,但其中3例经改良罗氏培养基培养为阳性。说明本系统检测结核杆菌灵敏度较常规方法高(P<0.01)。为了监控PCR可能出现的假阴性,我们行PCR操作时有意不采用热启动方式,即结果判断均以有引物二聚体出现为前提条件。若标本中存在有酶抑制物,则引物二聚体消失,标本经适当稀释后重做,直至二聚体出现。实验证明,在不严重影响扩增片段产量前提下,保留二聚体不失为监控扩增假阴性的有效手段之一。
, http://www.100md.com
本法中由于扩增片段经DNA序列分析发现(G+C)含量高达69%,我们将反应温控点由Altamirano的3个改为2个,既提高了反应特异性,又节省了运行时间,临床应用效果满意。
作者简介:张卫东, 男, 1964年生, 讲师。
参考文献
1 Altamirano M, Kelly M T, Wong A et al. Characterization of a DNA probe for detection of mycobacterium tuberculosis complex in clinical samples by polymerase chain reaction. J Clin Microbiol, 1992, 30:2173
2 Buck G E, O'hara L C, Summersgill J T. Rapid simple method for treating clinical specimens containing mycobacterium tuberculosis to remove DNA for polymerase chain reaction. J Clin Microbiol, 1992, 30:1331
3 Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning. A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. 1.29~1.30, 5.31, 6.30~6.31, 1.101~1.104, 9.32~9.58
收稿日期:1997-07-08, 百拇医药