电离辐射对淋巴细胞DNA合成的影响及适应性反应*
作者:赵雨杰△ 苏燎原△△ 邹华伟 孔向蓉
单位:苏州医学院放射生物学教研室,215007
关键词:电离辐射;淋巴细胞;DNA合成
苏州医学院学报991103 摘要 目的:探讨淋巴细胞预先接受低剂量电离辐射后,对大剂量照射的适应性反应。方法:用0.048Gy γ-射线照射后接受0.5~8.0Gy攻击剂量照射,以3H-TdR掺入法观察淋巴细胞DNA合成能力的变化。结果:淋巴细胞接受低剂量照射时能提高被大剂量照射的DNA合成能力,4.0Gy的照射时适应性反应最充分。结论:低剂量辐射能诱导淋巴细胞对大剂量辐射的适应性反应。
中图法分类 R811.5
Radiation Effect and Response of DNA Synthesis in Lymphocytes
, http://www.100md.com
Induced by Low Dose Irradiation
Zhao Yujie, Su Liaoyuan, Zou Huawei, et al
(Department of Radiobiology, Suzhou Medical College,Suzhou, 215007)
Abstract The ability of DNA synthesis in lymphocytes were measured by using 3 H-TdR incorporation method. This method was used to observe the damage of lymphocytes irradiated by several challenge doses (0.5~0.8Gy) and adaptive response iuduced by previous low dose irradiation. The results show that DNA synthesis was inhibited by challenge dose of radiation and was adapted by previous 0.048 Gy irradiation.
, http://www.100md.com
Key words ionizing radiation; lymphocyte; DNA synthesis
DNA是细胞生长、发育、繁殖、遗传的重要物质基础,它蕴藏着丰富的遗传信息,通过转录和翻译,指导着蛋白质和酶的生物合成,主宰着细胞的生理功能。电离辐射作用于机体后能够引起细胞DNA不同程度的损伤,特别是淋巴细胞具有较高的辐射敏感性,照射后导致DNA生物合成抑制。利用放射性同位素标记的DNA前体3 H-TdR掺入率可以测定新的DNA合成速率。本实验采用3H-TdR掺入法观察了体外培养人外周血淋巴细胞的辐射效应及预先低剂量照射(Adaptive dose,D1)后产生的对相继大剂量辐射(Challenge dose, D2)所致损伤的抗性—适应性反应[1]和不同剂量D2(0.5~8.0Gy)对淋巴细胞适应性反应的影响。
, http://www.100md.com 1 材料和方法
1.1 实验分组:6名健康献血员静脉血各2ml,肝素抗凝。
1.2 实验分组:将每个人的静脉血各0.1ml,分别装入培养瓶,共10份。其中5份为对照实验组,5份为低剂量照射组。
1.3 照射条件及照射方法:低剂量照射组采用226Ra γ—射线照射,强度为38.9×107Bq,辐射源置37℃培养箱中。培养瓶按同心圆排列在木制支架上,距辐射源50cm,剂量率为0.48cGy/h,照射10h,吸收剂量为4.8cGy。照射后继续培养14h,给予攻击剂量照射。攻击剂量照射组用60Co—γ射线,强度为2.22PBq,样品距放射源3.0m,剂量率为1.0Gy/min,分别照射0.5、1.0、4.0、8.0Gy。
1.4 细胞培养条件:对照组与低剂量照射组共60份全血样品,分别加入2ml含有100mg/L、PHA(广州)和15%人AB型血清的RPMI 1640培养液,照射后,37℃温箱内培养48h后,每只培养瓶加入20μl 3H-TdR(3.7×104Bq北京原子能研究所),24h后,用负压细胞收集器收获淋巴细胞于49型玻璃纤维滤膜上,烘干后用液体闪烁计数仪(Beckman LS—6800,USA)测量CPM值。
, http://www.100md.com
附表 攻击剂量对淋巴细胞适应性反应的影响(cpm,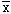 ±s)
±s)
n
0.0
0.5Gy
1.0Gy
4.0Gy
8.0Gy
D2
6
60822±2675
53728±2600
, 百拇医药
45069±3889
31175±2813
24455±2666
D1+2
6
63223±3761
58884±2943*
51783±1446**
39546±1119**
29115±2645*
, 百拇医药
RP
6
103.9±6.2
109.6±5.5
114.9±3.2
126.9±3.6
119.1±10.8
与D2组比较,*P<0.05;**P<0.01,RP=CPMD1+2/CPMD2×100%
2 结果
2.1 D2的剂量对3H—TdR掺入率的影响:见附表。0.5Gy照射使DNA合成速率下降到对照组的88.3%;1.0Gy照射下降到对照组的74.1%;照射剂量增加0.5Gy使DNA合成速率变化了14.2%。4.0Gy照射组DNA合成速率下降到51.3%;而8.0Gy照射下降到40.2%;照射剂量从4.0到8.0Gy变化了4.0Gy,引起DNA合成速率的变化仅是11.1%。在剂量较小时,DNA合成速率的变化较大;当剂量较大时,DNA合成速率的变化较小。
, 百拇医药
2.2 D2的剂量对D1的照射诱导的适应性反应的影响:体外培养的淋巴细胞预先接受D1(0.048Gy)照射后,经培养14h后,再分别照射D2剂量为0.5、1.0、4.0、8.0Gy。附表中的第三行数据表明,适应性反应的强弱与D2的剂量有关,攻击剂量为0.5、1.0Gy,适应性反应未能得到充分表达(RP分别为109.6和114.9,与4.0Gy点比较,P<0.05);当攻击剂量为4.0Gy时,适应性反应得以充分表达(RP=126.9),而8.0Gy照射又相对超过了诱导的细胞所能适应的程度(RP和4.0Gy点比,P<0.05);存在适应性反应的最适攻击剂量;对于0.048Gy的预照射,体外培养的淋巴细胞DNA合成适应性反应的表达,4.0Gy的照射剂量是最适剂量。
3 讨论
机体对环境中物理、化学和生物因子的作用可发生适应性反应(Cytogenetic adaptive response)。适应性反应原表现形式是多种多样的,在整体水平、细胞水平[2]、亚细胞水平和分子水平[3]均有其表现,而且不同水平的适应又是相互关联的,低水平辐射诱导的细胞遗传学适应性反应,首先报道于1984年[4]。后来的报道证实,第一次低剂量(诱导剂量)照射淋巴细胞,经一段时间培养后,再给予大剂量(攻击剂量)照射,同样可以诱导淋巴细胞产生适应性反应[5]。
, http://www.100md.com
在正常的DNA生物合成过程中需要dATP、dGTP、dCTP和dTTP 4种脱氧核苷三磷酸为原料,以DNA为模板,在Mg2+存在的条件下由DNA聚合酶催化,复制出新的DNA子代分子,细胞的DNA合成对辐射比较敏感,主要是由于电离辐射的直接作用和间接作用导致DNA合成过程中各种酶类活性的抑制和能量供应不足,与DNA合成有关的酶催化反应受抑制,尤其是催化四种脱氧核苷三磷酸合成DNA链的DNA聚合酶α对放射线敏感。另外,DNA合成是个耗能过程,需要ATP供给能量,而核和线粒体氧化磷酸化易受电离辐射影响,在较大剂量照射后DNA模板亦可发生损伤,引起DNA合成抑制。但是,电离辐射作为有害因子的同时,在一定剂量范围内,也可导致受照射细胞表现出适应性反应[6],体外培养的淋巴细胞在一定剂量范围内也表现出适应性反应[7]。
关于低剂量辐射诱导适应性反应的机制,国内外学者作了大量的研究,Wolff报道[8],放线菌酮(CHM)抑制蛋白的合成能抑制适应性反应,说明适应性反应与细胞内蛋白的合成密切相关。有人认为多聚(ADP—核糖)转移酶(ADPRT)的激活在适应性反应的发生机制中起重要作用,因为用ADPRT抑制剂3—氨苯甲酰胺(3—AB)可以使适应性反应消失[9]。低剂量辐射可以刺激DNA的切除修复,使淋巴细胞程序外DNA合成(Unscheduled DNA Synthesis, UDS)增高;同时使淋巴细胞程序外DNA聚合酶的活性增加。Boothman[10]提出低剂量辐射诱导的适应性反应是调控基因表达的结果,通过特定基因的表达产生新的功能蛋白,增强了细胞的辐射抗性。也有资料[11]表明,低剂量辐射可以诱导细胞抗氧化机制功能增强,促进自由基的清除,因而可以减轻或防止自由基和活性氧等对生物大分子的损伤作用。可见,对适应性反应的研究具有重要的意义。对生物大分子的适应有待深入研究,以揭示其规律及抗辐射机制。
, 百拇医药
* 核工业总公司资助课题(6920062-17);
△ 博士生,现在南京东南大学吴健雄实验室工作 △△导师
参考文献
1 蔡 露,刘树铮.低剂量辐射诱导的细胞遗传学适应性反应.中华放射医学与防护杂志,1990,70∶624
2 Holliday R. A re-examination of the effects of ionizing radiation on lifespan and transformation of human doploid fibroblasts. Mutat Res, 1991,256(2)∶295
3 James SJ, makinodan T. T cell proliferation in normal and autoimmune-prone mice after extended exposure to low doses of ionizing radiation and/or caloric restriction. Int J Radiat Biol, 1988,53∶137
, 百拇医药
4 Olivieri G, et al. Adaptive response of human lymphocytes to low concentrations of radioactive thymidine. Science,1984,223∶594
5 Cai L, Liu SZ,Imduction of cytogenetic adaptive respose of somatic and germ cells in vivo and in vitro by low dose irradiation. Int J Radiat Biol,1990,58∶187
6 Zhou PK, et al. Cultured mouse SR-1 cells exposed to low dose of gamma rays becomes less susceptible to the induction of mutagenesis by radiation as well as bleomycin. Mutagenesis, 1993,8∶109
, http://www.100md.com
7 杜泽吉,苏燎原.小剂量辐射对淋巴细胞亚群刺激效应的研究.辐射研究与辐射工艺学报,1994,12(1)∶59
8 Wolff S, et al. The adaptive response of human lymphocytes to very low doses of ionizing radiation: a case of induced chromosomal repair with the induction of specific proteins. In: Baverstock KF, Stather JW, ed. Low Dose Radiation: Biological Basis of Risk Asessment. London:Taylor &Francis, 1989∶446
9 Ikushima T. Chromosomal response to ionizing radiation of an adaptive response in cultured Chinese hamster cells. Mutat Res, 1987,180∶215
, 百拇医药
10 Boothman DA, et al. Identification and characterization of X-ray induced proteins in human cells. Cancer Res, 1989,49∶2871
11 Yamaoka K, et al. Effects of low dose X-ray irradiation of old rats-SOD activity, lipid peroxide level and memebrane fluidity. In: Suahara T, Sagan LA, Aoyama T, ed. Low Dose Irradiation and Biological Defense Mechanisms. Elsevier:Science publishers, 1992∶418
(1999年7月15日收稿), http://www.100md.com(赵雨杰△ 苏燎原△△ 邹华伟 孔向蓉)
单位:苏州医学院放射生物学教研室,215007
关键词:电离辐射;淋巴细胞;DNA合成
苏州医学院学报991103 摘要 目的:探讨淋巴细胞预先接受低剂量电离辐射后,对大剂量照射的适应性反应。方法:用0.048Gy γ-射线照射后接受0.5~8.0Gy攻击剂量照射,以3H-TdR掺入法观察淋巴细胞DNA合成能力的变化。结果:淋巴细胞接受低剂量照射时能提高被大剂量照射的DNA合成能力,4.0Gy的照射时适应性反应最充分。结论:低剂量辐射能诱导淋巴细胞对大剂量辐射的适应性反应。
中图法分类 R811.5
Radiation Effect and Response of DNA Synthesis in Lymphocytes
, http://www.100md.com
Induced by Low Dose Irradiation
Zhao Yujie, Su Liaoyuan, Zou Huawei, et al
(Department of Radiobiology, Suzhou Medical College,Suzhou, 215007)
Abstract The ability of DNA synthesis in lymphocytes were measured by using 3 H-TdR incorporation method. This method was used to observe the damage of lymphocytes irradiated by several challenge doses (0.5~0.8Gy) and adaptive response iuduced by previous low dose irradiation. The results show that DNA synthesis was inhibited by challenge dose of radiation and was adapted by previous 0.048 Gy irradiation.
, http://www.100md.com
Key words ionizing radiation; lymphocyte; DNA synthesis
DNA是细胞生长、发育、繁殖、遗传的重要物质基础,它蕴藏着丰富的遗传信息,通过转录和翻译,指导着蛋白质和酶的生物合成,主宰着细胞的生理功能。电离辐射作用于机体后能够引起细胞DNA不同程度的损伤,特别是淋巴细胞具有较高的辐射敏感性,照射后导致DNA生物合成抑制。利用放射性同位素标记的DNA前体3 H-TdR掺入率可以测定新的DNA合成速率。本实验采用3H-TdR掺入法观察了体外培养人外周血淋巴细胞的辐射效应及预先低剂量照射(Adaptive dose,D1)后产生的对相继大剂量辐射(Challenge dose, D2)所致损伤的抗性—适应性反应[1]和不同剂量D2(0.5~8.0Gy)对淋巴细胞适应性反应的影响。
, http://www.100md.com 1 材料和方法
1.1 实验分组:6名健康献血员静脉血各2ml,肝素抗凝。
1.2 实验分组:将每个人的静脉血各0.1ml,分别装入培养瓶,共10份。其中5份为对照实验组,5份为低剂量照射组。
1.3 照射条件及照射方法:低剂量照射组采用226Ra γ—射线照射,强度为38.9×107Bq,辐射源置37℃培养箱中。培养瓶按同心圆排列在木制支架上,距辐射源50cm,剂量率为0.48cGy/h,照射10h,吸收剂量为4.8cGy。照射后继续培养14h,给予攻击剂量照射。攻击剂量照射组用60Co—γ射线,强度为2.22PBq,样品距放射源3.0m,剂量率为1.0Gy/min,分别照射0.5、1.0、4.0、8.0Gy。
1.4 细胞培养条件:对照组与低剂量照射组共60份全血样品,分别加入2ml含有100mg/L、PHA(广州)和15%人AB型血清的RPMI 1640培养液,照射后,37℃温箱内培养48h后,每只培养瓶加入20μl 3H-TdR(3.7×104Bq北京原子能研究所),24h后,用负压细胞收集器收获淋巴细胞于49型玻璃纤维滤膜上,烘干后用液体闪烁计数仪(Beckman LS—6800,USA)测量CPM值。
, http://www.100md.com
附表 攻击剂量对淋巴细胞适应性反应的影响(cpm,
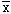 ±s)
±s)n
0.0
0.5Gy
1.0Gy
4.0Gy
8.0Gy
D2
6
60822±2675
53728±2600
, 百拇医药
45069±3889
31175±2813
24455±2666
D1+2
6
63223±3761
58884±2943*
51783±1446**
39546±1119**
29115±2645*
, 百拇医药
RP
6
103.9±6.2
109.6±5.5
114.9±3.2
126.9±3.6
119.1±10.8
与D2组比较,*P<0.05;**P<0.01,RP=CPMD1+2/CPMD2×100%
2 结果
2.1 D2的剂量对3H—TdR掺入率的影响:见附表。0.5Gy照射使DNA合成速率下降到对照组的88.3%;1.0Gy照射下降到对照组的74.1%;照射剂量增加0.5Gy使DNA合成速率变化了14.2%。4.0Gy照射组DNA合成速率下降到51.3%;而8.0Gy照射下降到40.2%;照射剂量从4.0到8.0Gy变化了4.0Gy,引起DNA合成速率的变化仅是11.1%。在剂量较小时,DNA合成速率的变化较大;当剂量较大时,DNA合成速率的变化较小。
, 百拇医药
2.2 D2的剂量对D1的照射诱导的适应性反应的影响:体外培养的淋巴细胞预先接受D1(0.048Gy)照射后,经培养14h后,再分别照射D2剂量为0.5、1.0、4.0、8.0Gy。附表中的第三行数据表明,适应性反应的强弱与D2的剂量有关,攻击剂量为0.5、1.0Gy,适应性反应未能得到充分表达(RP分别为109.6和114.9,与4.0Gy点比较,P<0.05);当攻击剂量为4.0Gy时,适应性反应得以充分表达(RP=126.9),而8.0Gy照射又相对超过了诱导的细胞所能适应的程度(RP和4.0Gy点比,P<0.05);存在适应性反应的最适攻击剂量;对于0.048Gy的预照射,体外培养的淋巴细胞DNA合成适应性反应的表达,4.0Gy的照射剂量是最适剂量。
3 讨论
机体对环境中物理、化学和生物因子的作用可发生适应性反应(Cytogenetic adaptive response)。适应性反应原表现形式是多种多样的,在整体水平、细胞水平[2]、亚细胞水平和分子水平[3]均有其表现,而且不同水平的适应又是相互关联的,低水平辐射诱导的细胞遗传学适应性反应,首先报道于1984年[4]。后来的报道证实,第一次低剂量(诱导剂量)照射淋巴细胞,经一段时间培养后,再给予大剂量(攻击剂量)照射,同样可以诱导淋巴细胞产生适应性反应[5]。
, http://www.100md.com
在正常的DNA生物合成过程中需要dATP、dGTP、dCTP和dTTP 4种脱氧核苷三磷酸为原料,以DNA为模板,在Mg2+存在的条件下由DNA聚合酶催化,复制出新的DNA子代分子,细胞的DNA合成对辐射比较敏感,主要是由于电离辐射的直接作用和间接作用导致DNA合成过程中各种酶类活性的抑制和能量供应不足,与DNA合成有关的酶催化反应受抑制,尤其是催化四种脱氧核苷三磷酸合成DNA链的DNA聚合酶α对放射线敏感。另外,DNA合成是个耗能过程,需要ATP供给能量,而核和线粒体氧化磷酸化易受电离辐射影响,在较大剂量照射后DNA模板亦可发生损伤,引起DNA合成抑制。但是,电离辐射作为有害因子的同时,在一定剂量范围内,也可导致受照射细胞表现出适应性反应[6],体外培养的淋巴细胞在一定剂量范围内也表现出适应性反应[7]。
关于低剂量辐射诱导适应性反应的机制,国内外学者作了大量的研究,Wolff报道[8],放线菌酮(CHM)抑制蛋白的合成能抑制适应性反应,说明适应性反应与细胞内蛋白的合成密切相关。有人认为多聚(ADP—核糖)转移酶(ADPRT)的激活在适应性反应的发生机制中起重要作用,因为用ADPRT抑制剂3—氨苯甲酰胺(3—AB)可以使适应性反应消失[9]。低剂量辐射可以刺激DNA的切除修复,使淋巴细胞程序外DNA合成(Unscheduled DNA Synthesis, UDS)增高;同时使淋巴细胞程序外DNA聚合酶的活性增加。Boothman[10]提出低剂量辐射诱导的适应性反应是调控基因表达的结果,通过特定基因的表达产生新的功能蛋白,增强了细胞的辐射抗性。也有资料[11]表明,低剂量辐射可以诱导细胞抗氧化机制功能增强,促进自由基的清除,因而可以减轻或防止自由基和活性氧等对生物大分子的损伤作用。可见,对适应性反应的研究具有重要的意义。对生物大分子的适应有待深入研究,以揭示其规律及抗辐射机制。
, 百拇医药
* 核工业总公司资助课题(6920062-17);
△ 博士生,现在南京东南大学吴健雄实验室工作 △△导师
参考文献
1 蔡 露,刘树铮.低剂量辐射诱导的细胞遗传学适应性反应.中华放射医学与防护杂志,1990,70∶624
2 Holliday R. A re-examination of the effects of ionizing radiation on lifespan and transformation of human doploid fibroblasts. Mutat Res, 1991,256(2)∶295
3 James SJ, makinodan T. T cell proliferation in normal and autoimmune-prone mice after extended exposure to low doses of ionizing radiation and/or caloric restriction. Int J Radiat Biol, 1988,53∶137
, 百拇医药
4 Olivieri G, et al. Adaptive response of human lymphocytes to low concentrations of radioactive thymidine. Science,1984,223∶594
5 Cai L, Liu SZ,Imduction of cytogenetic adaptive respose of somatic and germ cells in vivo and in vitro by low dose irradiation. Int J Radiat Biol,1990,58∶187
6 Zhou PK, et al. Cultured mouse SR-1 cells exposed to low dose of gamma rays becomes less susceptible to the induction of mutagenesis by radiation as well as bleomycin. Mutagenesis, 1993,8∶109
, http://www.100md.com
7 杜泽吉,苏燎原.小剂量辐射对淋巴细胞亚群刺激效应的研究.辐射研究与辐射工艺学报,1994,12(1)∶59
8 Wolff S, et al. The adaptive response of human lymphocytes to very low doses of ionizing radiation: a case of induced chromosomal repair with the induction of specific proteins. In: Baverstock KF, Stather JW, ed. Low Dose Radiation: Biological Basis of Risk Asessment. London:Taylor &Francis, 1989∶446
9 Ikushima T. Chromosomal response to ionizing radiation of an adaptive response in cultured Chinese hamster cells. Mutat Res, 1987,180∶215
, 百拇医药
10 Boothman DA, et al. Identification and characterization of X-ray induced proteins in human cells. Cancer Res, 1989,49∶2871
11 Yamaoka K, et al. Effects of low dose X-ray irradiation of old rats-SOD activity, lipid peroxide level and memebrane fluidity. In: Suahara T, Sagan LA, Aoyama T, ed. Low Dose Irradiation and Biological Defense Mechanisms. Elsevier:Science publishers, 1992∶418
(1999年7月15日收稿), http://www.100md.com(赵雨杰△ 苏燎原△△ 邹华伟 孔向蓉)