人血小板TGF β的提取纯化及鉴定
作者:唐康来 杨柳 卢卫忠 吴梅英 成小玲 倪兵 曹佳
单位:唐康来 杨柳 卢卫忠 吴梅英:第三军医大学:1附属西南医院骨科;成小玲:附属西南医院输血科;倪兵:基础医学部生物化学教研室;曹佳:预防医学系分子毒理教研室,重庆 400038
关键词:转化生长因子β;提取与纯化;血小板;人
提要 目的
提要 目的:建立一种快速、简单、实用的从人血小板提纯转化生长因子β(TGF β)的方法。方法:改良的白膜回浆法提取人血小板,酸醇抽提裂解法提取血小板中的TGF β及2次凝胶过柱法纯化TGF β。所有提取及纯化步骤均在酸性条件下进行以防止管壁对TGF β的吸附和生物活性的影响;使用了易挥发的溶媒和缓冲液便于冻干时去除。结果:SDS-PAGE电泳及薄层分析显示纯化后的TGF β纯度达到89.38%,在EGF参与下10ng/ml浓度的TGF β可刺激NRK细胞在软琼脂培养中呈多克隆样生长。结论:运用本方法提取的TGF β纯度高,生物活性强;与以前方法相比具有成本低廉、提取工艺简单、快速实用的特点。
, 百拇医药
中图法分类号 R446.1 文献标识码 A
Isolation and purification of transforming growth factor β from human blood platelet
TANG Kang-lai, YANG Liu, LU Wei-zhong, WU Mei-ying, CHENG Xiao-ling, NI Bing, CAO Jia
(Department of Orthopedics, Southwest Hospital, Third Military Medical University, Chongqing 400038)
Abstract Objective: To establish a rapid, economic and convenient method for isolation and purification of transforming growth factor ( (TGF-β) from human blood. Methods: 1) The platelet concentrates prepared from buffy coats without plasma was used to isolate platelet from human blood. 2) The platelet protein was extracted with acid-ethanol. 3) The TGF-β was extracted from the platelet protein with sequential gelfiltration on Bio-Gel P60 columns, first in the absence and then in the presence of altra-pure urea. All the these steps were performed under acidic condition to prevent adsorption of TGF-β to the vial walls. In addition, volutile solvents and buffers allowing easy removal of solvent and salt by hyphilization were used. Results: SDS-PAGE electrophoresis and auto-scanning by computer showed that the homogeneity of the growth factor obtained with this method could be up to 89.38%. In the presence of EGF, it could stimulate the NRK cells to grow as multi-clone in soft agar culture at a concentration of 10 ng/ml. Conclusion: The purified TGF-β has high homogeneity and bioactivity. The method for its preparation is easier, faster and more convenient as compared with those previously used by other researchers.
, 百拇医药
Key words TGF-β; isolation; purification; blood; platelet; human
转化生长因子β(Transforming growth factor β,TGF β)可能是目前所知的作用最为复杂和多样的生长因子,在骨折愈合、软组织创伤修复、器官移植和肿瘤治疗等多学科领域具有广阔的临床应用前景[1~6]。而影响TGF β临床应用的最大障碍之一是TGF β来源有限,且价格非常昂贵。目前TGF β的制备主要有2种方法:①从生物组织细胞中直接提取纯化;②利用转基因技术在部分真核细胞中高效表达,然后分离纯化;而转基因技术难度大,其产品稳定性差,仅限于实验室探索阶段,暂无法运用推广[7];因此直接从生物组织细胞中提取纯化TGF β仍是目前最为有效的方法。如何降低制备成本,提高TGF β产率,建立一种快速稳定的并能规模化生产的方法意义特别重大。本实验通过摸索成功地建立了一种快速简单的从人血小板中提取纯化TGF β的方法。
, 百拇医药
1 材料与方法
1.1 主要试剂与仪器
Pepstatin 胃酶抑素(Sigma公司),苯*****PMSF (Sigma公司), 表皮生长因子(Epidermal growth factor,EGF)(由西南医院烧伤研究所惠赠),超纯脲(Sigma公司), 正常鼠肾细胞(Normalrat kidney,fibroblasts,NRK)(中科院上海细胞生物所),标准分子量蛋白(华美公司),Bio-GelP60生物凝胶(Bio-Rad公司),色谱柱(上海华美实验仪器厂),细胞破碎仪(上海华美实验仪器厂),紫外检测记录仪(Bio-Rad公司),2132型蠕动泵 ,垂直电泳仪(大连高新技术开发公司),CO2孵箱,高速冷冻离心机(Beckman),冻干机,人TGF β-ILISA试剂盒(美国Gezyml公司),CS-9000全自动薄层分析仪(Beckman),人血(由西南医院输血科提供)。
, 百拇医药
1.2 人血小板分离
取新鲜ACD-B抗凝人全血200 ml×30袋,室温下离心(2500×g)12 min,分层后回收血浆,将血袋中间约20~30 ml白膜层和约10~20 ml上层红细胞一并挤入100 ml空血浆袋;充分混匀后,进行第2次离心(500×g,6 min),分出上层浓缩血小板血浆。再进行重离心(3200×g,4℃,30 min),回收上部血浆进行再利用。收集的血小板用PBS缓冲液洗脱两次(3200×g,4℃,30 min),收集纯的血小板进行下面的实验。
1.3 人血小板TGF β粗提
按每克血小板加入4ml已配制好的酸醇抽提裂解液(其组成成分为375 ml 95%乙醇和7.5 ml浓盐酸加入33 mg PMSF和1.9 mg Pepstin),振摇3~5min后立即用匀浆器匀浆,4℃隔夜孵育。离心(3200×g,4℃,30 min)去除杂质,收集上悬液,加入氨水(NH4OH)调PH到3,再加2倍体积乙醇(4℃)和4倍体积乙醚(4℃) 于上悬液中予以萃取,4℃隔夜孵育。血小板蛋白沉淀后,予以离心(3 200×g,4℃,30 min)收集沉淀,并用1 mol/L乙酸溶液溶解,4℃隔夜孵育。再次离心去除未溶解的杂质,得到粗提产品溶液,予以冻干(-20℃)保存。
, http://www.100md.com
1.4 TGF β的纯化
用1mol/L乙酸溶液溶解粗提物,低压液相色谱柱(3.0 cm×120 cm)层析,充填物为Bio-GelP60,平衡液及洗脱液为1mol/L乙酸,流速16.8 ml/h,收集部分为每管4.2ml;用凝胶电泳(SDS-PAGE)确定TGF β活性峰,收集TGF β活性峰高的部分,冷冻干燥,电泳及薄层分析测其含量。将冻干的活性峰部分溶于1mol/L的乙酸溶液(含8mol/L超纯脲),再一次行低压液相色谱柱(2.6 cm×100 cm)层析,充填物仍为Bio-Gel P60,洗脱液为1mol/L乙酸(含8mol/L超纯脲),流速为10 ml/h,收集部分为每管2.5 ml;同样用凝胶电泳确定TGF β活性峰,收集TGF β活性峰高的部分,用1mol/L乙酸溶液透析去脲,冷冻干燥。
1.5 检测方法及生物活性测定
1.5.1 SDS-PAGE凝胶电泳 取粗提物、第1、2次纯化层析曲线蛋白峰部分及2次冻干产品行SDS-PAGE电泳;浓缩胶为5%,分离胶为15%,按文献的方法[8]进行电泳,电泳结束后用考马斯亮蓝法染色,电泳用标准蛋白Marker的分子量分别为97.4×103u,66.2×103u,43×103u,31×103u,20.1×103u,14.4×103u以及25×103u的TGF β标准蛋白。
, http://www.100md.com
1.5.2 薄层分析 将上述SDS-PAGE结果在CS-9000 全自动薄层扫描仪上进行薄层分析,测定粗提物、初步纯化及第2次纯化的样品中蛋白组成及TGF β含量。
1.5.3 ELISE法定量 按美国Genzyme公司提供的人TGF β的ELISA试剂盒所标说明书进行测定,测出待测样品和标准品OD值,绘制标准曲线。根据OD值算出其样品的浓度,再根据其浓度和体积算出样品的TGF β总量。
1.5.4 生物活性鉴定方法 将3%软琼脂17 ml加热至45℃让其融化,混入83 ml 37℃的PRMI 1640培养液(含15%胎牛血清)配成A液,按每孔1 ml加入6孔培养板。用0.25%胰蛋白酶消化贴壁的NRK细胞,再用PRMI 1640培养液洗脱2次(不含胎牛血清),将NRK细胞混悬于含有15%胎牛血清的PRMI 1640培养液配成B液并予计数。将B液接种于含有A液的6孔培养板内,使NRK细胞的含量为5 000/孔,容积为2.5 ml,置于4%CO2孵箱孵育(37℃)5 d。实验共分4个组:①TGF β组(TGF β的终浓度为10ng/ml);②TGF β+EGF组(TGF β终浓度为10 ng/ml,EGF终含量为2.5 ng/ml);③EGF组(EGF组终含量为2.5 ng/ml);④空白对照组。
, 百拇医药
2 结果
2.1 人血小板提取率及纯度
随机对其中8个200 ml ACD-B抗凝人全血提取前后对比测定,血小板提取率均在70%以上,红细胞和白细胞混入量均小于2.0×108/袋和1.4×108/袋。
2.2 TGF β粗提物的分析结果
SDS-PAGE电泳和薄层分析显示,见图1。TGF β粗提物成分复杂,至少有13种以上不同分子量的蛋白成分,以25×103u成分和低分子量的蛋白最多,其中25×103u的TGF β含量为33.05%;超过25×103u成分约占18%以上。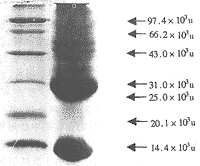
, 百拇医药
图1 TGF β粗提物SDS-PAGE凝胶电泳结果
左:标准蛋白;右:TGF β粗提物
Fig 1 SDS-PAGE of crude TGF β
Left: Protein markers; Right: Crude TGF β
2.3 TGF β 2次纯化分析结果
2.3.1 第1次纯化分析结果 TGF β粗提物经Bio-Gel P60(洗脱液为1mol/L乙酸)柱层析曲线;SDS-PAGE显示第75~96管部分中含有25×103u成分。SDS-PAGE凝胶电泳及薄层分析结果:第1次纯化收集的TGF β,以25×103u和小分子量的蛋白为主,其中25×103u的TGF β含量为67.34%;大分子量的蛋白含量低。
, http://www.100md.com
2.3.2 第2次纯化分析结果 第1次纯化的TGF β再次经Bio-Gel P60柱层析(洗脱液为1 mol/L乙酸,8 mol/L超纯脲)曲线,仅见一个吸收峰;SDS-PAGE显示第105-114管部分中含有25×103u成分。SDS-PAGE凝胶电泳及薄层分析结果:第2次纯化收集的TGF β以25×103u的TGF β为主,其中仍见少许的低分子量蛋白成分,其纯度为89.38%,见图2。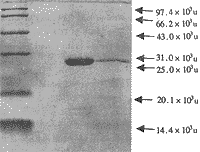
图2 TGF β纯化物SDS-PAGE凝胶电泳结果
左:标准蛋白;中:TGF β纯化物;右:TGF β标准品
Fig 2 SDS-PAGE of purified TGF β
, 百拇医药
Left: Protein markers; Middle: purified TGF β;
Right: TGF β marker
2.4 ELISE定量结果
从200 ml×30袋全血中可纯化325 μg的TGF β。
2.5 纯化后TGF β生物活性鉴定结果见表1
表1 纯化后的TGF β生物活性
Tab 1 Biological activity of purified platelet-derived TGF β
Sample
, 百拇医药 Number of soft agar colonies
TGF β+EGF
256.3±1.67
EGF
27.7±1.33
TGF β
0.5±0.33
Control
0±0.00
空白对照组NRK细胞呈贴壁生长,见图3;单纯TGF β几乎不能刺激NRK细胞呈克隆生长;单纯EGF可刺激NRK细胞呈克隆样生长但不明显;加入TGF β大量NRK细胞呈克隆生长,见图4。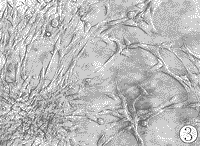
, 百拇医药
图3 空白对照组:NRK细胞在软琼脂培养中无克隆生长 (10×20)
Fig 3 Control group: No colony in soft agar culture of normal rat kidney fibroblasts (10×20)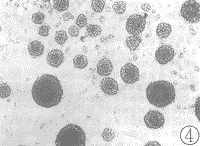
图4 EGF加TGF β组:NRK细胞在软琼脂培养中呈多克隆生长 (10×20)
Fig 4 EGF+TGF β group: Multi-colony growth in soft agar culture of normal rat kidney fibroblasts (10×20)
, 百拇医药
3 讨论
3.1 关于人血小板的提取与再利用
传统的血小板制备方法为2次离心浓缩法,首先是轻离心分离富含血小板血浆,然后重离心使血小板聚合沉淀,分出上清乏血小板血浆,使聚合成片或絮状的血小板留于袋内;这种方法制出的血小板数量少,得率一般在60%左右,红细胞和白细胞含量高;并耗损一定量的血浆,造成部分血浆丢失[9,10]。我们通过探索改良了白膜回浆法制备浓缩血小板,这种方法简单方便,白细胞及红细胞混入量少;血小板提取率明显提高,一般均在70%以上,且血浆得到了回收。目前,国内外实行的是成分输血,血小板的利用率-般在10%以下;用本方法分离血小板并不影响其他成分输血,是对血小板的较好再利用。根据我们的实验,要保证血小板的提取率及纯度需注意以下几点:①血小板具粘附及降解性,所有容器应硅化处理,转移次数尽量少;洗脱后的纯血小板应立即进行下面的实验,防止其自身降解。②第1次离心以后分离血浆时流速不可过快,以免形成漩涡,使血浆底层及白膜层的血小板卷入血浆被分出影响得率。③第2次离心时血袋一定要竖直并使血浆上部分尽量饱满,可避免血浆两层紧贴或折叠,使红细胞粘附上层下沉,影响血小板纯度;第2次离心转速小,时间短,细胞层面较疏松,分离时应轻拿轻放。
, 百拇医药
3.2 关于TGF β粗提
自从Robert等[11]开创用酸醇从肿瘤细胞中提取转化多肽以来,人们已从廿余种组织细胞中提取了TGF β[12,13],其中血小板为TGF β最佳的组织来源,要从血小板中提取TGF β,必须对血小板进行破碎。实验中我们运用超声破碎法、SDS裂解法、渗透压法和匀浆器匀浆法来破碎血小板,均达到了目的。 通过筛选,酸醇裂解加匀浆器匀浆法破碎效果明显,其他方法有待进一步探索。另外,利用血小板蛋白包括TGF β不溶于乙醇和乙醚的特点,选用乙醚和乙醇萃取分离出血小板蛋白(包括TGF β)。与以往研究相比[12],本方法具有操作简单、成本低廉等优点。粗提物电泳发现,血小板蛋白分子量主要为25×103u和低分子量成分,其中25×103u的成分含量为33.05%, 进一步证实血小板是TGF β的最佳组织来源。
3.3 关于TGF β纯化方法
, http://www.100md.com
蛋白分离纯化是生物工程下游技术中最关键的步聚,常用方法有:离子交换层析、疏水作用层析、凝胶过滤层析、亲和层析、色谱聚焦以及羟基磷灰石柱层析等。目前用于TGF β分离纯化的方法主要有:凝胶层析、离子交换层析、逆相色谱层析等[11]。最近Werz[12]将3种方法同时运用于TGF β的分离纯化,其得率及纯度均有突飞猛进的进步。我们在实验中选用了2次凝胶层析法分离纯化TGF β,凝胶介质为Bio-Gel P60,其分离范围在(3~60)×103u;第1次柱层析后收集TGF β活性峰高的部分,冻干后电泳表明:TGF β的纯度为67.34%;除了有25×103u的成分外还有低分子量的蛋白混杂,为了除去低分子量的蛋白,在第2次过柱时我们在溶媒中加入8 mol/L的超纯脲,使小分子量的蛋白分离开,终产品的纯度达到89.38%,基本达到了纯化蛋白的要求。本方法较Werz等人提供的方法简单、适用,但纯度及得率存在一定差距,有待进一步探讨。
3.4 TGF β的提取率、生物活性维持
, http://www.100md.com
影响TGF β提取率主要因素有:①TGF β自身的降解,为了克服这个矛盾,在血小板破碎裂解过程中,我们加入了酶保护剂PMSF和Pepstin;2次分离纯化过程均运用1mol/L乙酸溶液维持其活性。②TGF β对容器壁和层析介质的粘附,在分离纯化的大部分操作均是在溶液中进行;利用TGF β易溶于乙酸的特点,在柱层析的平衡、过柱及洗脱过程均用1mol/L乙酸溶液。③血小板的裂解方法,本实验采用的是酸醇裂解加匀浆器匀浆破碎法破裂血小板效果令人满意,其他方法有待进一步研究及验证。维持TGF β的生物活性我们采用了以下措施:①绝大多数操作均在低温下进行。②在粗提过程中使用蛋白水解酶保护剂抑制蛋白水解酶对TGF β的降解作用。③TGF β在pH<3.5状况下易被激活,1 mol/L乙酸的pH在3.0左右,对维持其生物活性至关重要。④用冷冻干燥的方法对粗提物及纯化产品进行保存。
3.5 TGF β的生物活性鉴定
目前用于TGTβ生物活性检测方法很多,主要有:①刺激NRK细胞呈非静止性生长[11]。②抑制肿瘤或非肿瘤细胞系的生长。③诱导软骨形成。④刺激骨干骨膜下成骨。⑤诱导人骨髓细胞系Mono Mac-6中5-脂氧合酶表达和酶活性[12]。本实验选用的是刺激NRK细胞呈非静止性生长的方法;用10 ng/ml浓度的人血小板TGF β纯化物,在EGF(2.5 ng/ml)参与下可明显促进NRK细胞在软琼脂中呈克隆样生长,从而证实TGF β纯化物具有高度的生物活性作用。
, http://www.100md.com
本实验在借鉴前人的经验基础上,成功地建立了一种适合于国内的实验条件下能提取TGF β的方法,具有成本低廉、方法简单的特点,具有一定的应用价值。TGF β提取纯化今后面临的主要问题有:①如何进一步降低成本,提高产率和纯度;②如何将实验室生产变为规模化生产,这也是我们正在和将要解决的问题。
基金项目:重庆市重点科技攻关项目
作者简介:唐康来,男,30岁,主治医师,讲师,硕士
参考文献
[1] Lind M. Growth factors: Possible new clinical tools[J]. Acta Orthop Scand,1996,67(4):407-417.
[2] Lind M. Growth factor stimulation of bone healing. Effects on osteoblasts, osteomies,and implants fixation[J].Acta Orthop Scand Suppl,1998,283(2):2-37.
, 百拇医药
[3] Tripple S B, Coutts R D, Einhorm T A,et al. Growth factors as therapeutic agents[J]. J Bone Joint Surg(Amer),1996,8(3):1272-1283.
[4] O'kane S, Ferguson M W. Transforming growth factor beta's and wound healing[J]. Int J Biochem Cell Biol,1997,29(1):63-78.
[5] Yang L, Qiu C X, Ludlow A, et al. Active transforming growth factor beta in wound repair: Determination using a new assay[J]. Am J Pathol,1999,154(1):105-111.
, http://www.100md.com
[6] 龙建银,王会信. 转化生长因子β的临床应用前景[J]. 军事医学科学院院刊,1997,21(2):135-140.
[7] Bottinger E P,Kopp J O. Lessons from TGF-β transgenic mice[J]. Miner Eletrolyte Metab,1998,24:154-160.
[8] J.萨姆布鲁克, E.F弗里奇, T.曼尼阿蒂斯.分子克隆实验指导[M].北京:科学技术出版社,1992.880-888.
[9] 陈方祥,林武存.血小板制备与输注研究近况[J]. 国外医学:输血及血液学分册,1996,19(5):304-307.
[10] Hogman C F. New trends in the preparation and storage of platelets[J]. Transfusion,1992,32(1):3-6.
, 百拇医药
[11] Roberts A B, Lamb L C, Newton D L, et al. Isolation of polypeptides from virally and chemically transformed cells by acid/ethanol extraction[J]. Proc Natl Sci USA,1980,77(5):3494-3498.
[12] Werz O, Brungs M, Steinhiber D. Purification of transforming growth factor beta 1 from human platelets[J]. Pharmazie, 1996,51(11):893-896.
[13] Taniguchi Y, Tanaka T, Gotoh K, et al. Transforming growth factor-β1-induced cellular hetergeneity in the periosterm of rat parietal bone[J]. Calcif Tissue Int,1993,52(2):122-126.
收稿日期:1999-05-10;修回日期:1999-07-19, http://www.100md.com
单位:唐康来 杨柳 卢卫忠 吴梅英:第三军医大学:1附属西南医院骨科;成小玲:附属西南医院输血科;倪兵:基础医学部生物化学教研室;曹佳:预防医学系分子毒理教研室,重庆 400038
关键词:转化生长因子β;提取与纯化;血小板;人
提要 目的
提要 目的:建立一种快速、简单、实用的从人血小板提纯转化生长因子β(TGF β)的方法。方法:改良的白膜回浆法提取人血小板,酸醇抽提裂解法提取血小板中的TGF β及2次凝胶过柱法纯化TGF β。所有提取及纯化步骤均在酸性条件下进行以防止管壁对TGF β的吸附和生物活性的影响;使用了易挥发的溶媒和缓冲液便于冻干时去除。结果:SDS-PAGE电泳及薄层分析显示纯化后的TGF β纯度达到89.38%,在EGF参与下10ng/ml浓度的TGF β可刺激NRK细胞在软琼脂培养中呈多克隆样生长。结论:运用本方法提取的TGF β纯度高,生物活性强;与以前方法相比具有成本低廉、提取工艺简单、快速实用的特点。
, 百拇医药
中图法分类号 R446.1 文献标识码 A
Isolation and purification of transforming growth factor β from human blood platelet
TANG Kang-lai, YANG Liu, LU Wei-zhong, WU Mei-ying, CHENG Xiao-ling, NI Bing, CAO Jia
(Department of Orthopedics, Southwest Hospital, Third Military Medical University, Chongqing 400038)
Abstract Objective: To establish a rapid, economic and convenient method for isolation and purification of transforming growth factor ( (TGF-β) from human blood. Methods: 1) The platelet concentrates prepared from buffy coats without plasma was used to isolate platelet from human blood. 2) The platelet protein was extracted with acid-ethanol. 3) The TGF-β was extracted from the platelet protein with sequential gelfiltration on Bio-Gel P60 columns, first in the absence and then in the presence of altra-pure urea. All the these steps were performed under acidic condition to prevent adsorption of TGF-β to the vial walls. In addition, volutile solvents and buffers allowing easy removal of solvent and salt by hyphilization were used. Results: SDS-PAGE electrophoresis and auto-scanning by computer showed that the homogeneity of the growth factor obtained with this method could be up to 89.38%. In the presence of EGF, it could stimulate the NRK cells to grow as multi-clone in soft agar culture at a concentration of 10 ng/ml. Conclusion: The purified TGF-β has high homogeneity and bioactivity. The method for its preparation is easier, faster and more convenient as compared with those previously used by other researchers.
, 百拇医药
Key words TGF-β; isolation; purification; blood; platelet; human
转化生长因子β(Transforming growth factor β,TGF β)可能是目前所知的作用最为复杂和多样的生长因子,在骨折愈合、软组织创伤修复、器官移植和肿瘤治疗等多学科领域具有广阔的临床应用前景[1~6]。而影响TGF β临床应用的最大障碍之一是TGF β来源有限,且价格非常昂贵。目前TGF β的制备主要有2种方法:①从生物组织细胞中直接提取纯化;②利用转基因技术在部分真核细胞中高效表达,然后分离纯化;而转基因技术难度大,其产品稳定性差,仅限于实验室探索阶段,暂无法运用推广[7];因此直接从生物组织细胞中提取纯化TGF β仍是目前最为有效的方法。如何降低制备成本,提高TGF β产率,建立一种快速稳定的并能规模化生产的方法意义特别重大。本实验通过摸索成功地建立了一种快速简单的从人血小板中提取纯化TGF β的方法。
, 百拇医药
1 材料与方法
1.1 主要试剂与仪器
Pepstatin 胃酶抑素(Sigma公司),苯*****PMSF (Sigma公司), 表皮生长因子(Epidermal growth factor,EGF)(由西南医院烧伤研究所惠赠),超纯脲(Sigma公司), 正常鼠肾细胞(Normalrat kidney,fibroblasts,NRK)(中科院上海细胞生物所),标准分子量蛋白(华美公司),Bio-GelP60生物凝胶(Bio-Rad公司),色谱柱(上海华美实验仪器厂),细胞破碎仪(上海华美实验仪器厂),紫外检测记录仪(Bio-Rad公司),2132型蠕动泵 ,垂直电泳仪(大连高新技术开发公司),CO2孵箱,高速冷冻离心机(Beckman),冻干机,人TGF β-ILISA试剂盒(美国Gezyml公司),CS-9000全自动薄层分析仪(Beckman),人血(由西南医院输血科提供)。
, 百拇医药
1.2 人血小板分离
取新鲜ACD-B抗凝人全血200 ml×30袋,室温下离心(2500×g)12 min,分层后回收血浆,将血袋中间约20~30 ml白膜层和约10~20 ml上层红细胞一并挤入100 ml空血浆袋;充分混匀后,进行第2次离心(500×g,6 min),分出上层浓缩血小板血浆。再进行重离心(3200×g,4℃,30 min),回收上部血浆进行再利用。收集的血小板用PBS缓冲液洗脱两次(3200×g,4℃,30 min),收集纯的血小板进行下面的实验。
1.3 人血小板TGF β粗提
按每克血小板加入4ml已配制好的酸醇抽提裂解液(其组成成分为375 ml 95%乙醇和7.5 ml浓盐酸加入33 mg PMSF和1.9 mg Pepstin),振摇3~5min后立即用匀浆器匀浆,4℃隔夜孵育。离心(3200×g,4℃,30 min)去除杂质,收集上悬液,加入氨水(NH4OH)调PH到3,再加2倍体积乙醇(4℃)和4倍体积乙醚(4℃) 于上悬液中予以萃取,4℃隔夜孵育。血小板蛋白沉淀后,予以离心(3 200×g,4℃,30 min)收集沉淀,并用1 mol/L乙酸溶液溶解,4℃隔夜孵育。再次离心去除未溶解的杂质,得到粗提产品溶液,予以冻干(-20℃)保存。
, http://www.100md.com
1.4 TGF β的纯化
用1mol/L乙酸溶液溶解粗提物,低压液相色谱柱(3.0 cm×120 cm)层析,充填物为Bio-GelP60,平衡液及洗脱液为1mol/L乙酸,流速16.8 ml/h,收集部分为每管4.2ml;用凝胶电泳(SDS-PAGE)确定TGF β活性峰,收集TGF β活性峰高的部分,冷冻干燥,电泳及薄层分析测其含量。将冻干的活性峰部分溶于1mol/L的乙酸溶液(含8mol/L超纯脲),再一次行低压液相色谱柱(2.6 cm×100 cm)层析,充填物仍为Bio-Gel P60,洗脱液为1mol/L乙酸(含8mol/L超纯脲),流速为10 ml/h,收集部分为每管2.5 ml;同样用凝胶电泳确定TGF β活性峰,收集TGF β活性峰高的部分,用1mol/L乙酸溶液透析去脲,冷冻干燥。
1.5 检测方法及生物活性测定
1.5.1 SDS-PAGE凝胶电泳 取粗提物、第1、2次纯化层析曲线蛋白峰部分及2次冻干产品行SDS-PAGE电泳;浓缩胶为5%,分离胶为15%,按文献的方法[8]进行电泳,电泳结束后用考马斯亮蓝法染色,电泳用标准蛋白Marker的分子量分别为97.4×103u,66.2×103u,43×103u,31×103u,20.1×103u,14.4×103u以及25×103u的TGF β标准蛋白。
, http://www.100md.com
1.5.2 薄层分析 将上述SDS-PAGE结果在CS-9000 全自动薄层扫描仪上进行薄层分析,测定粗提物、初步纯化及第2次纯化的样品中蛋白组成及TGF β含量。
1.5.3 ELISE法定量 按美国Genzyme公司提供的人TGF β的ELISA试剂盒所标说明书进行测定,测出待测样品和标准品OD值,绘制标准曲线。根据OD值算出其样品的浓度,再根据其浓度和体积算出样品的TGF β总量。
1.5.4 生物活性鉴定方法 将3%软琼脂17 ml加热至45℃让其融化,混入83 ml 37℃的PRMI 1640培养液(含15%胎牛血清)配成A液,按每孔1 ml加入6孔培养板。用0.25%胰蛋白酶消化贴壁的NRK细胞,再用PRMI 1640培养液洗脱2次(不含胎牛血清),将NRK细胞混悬于含有15%胎牛血清的PRMI 1640培养液配成B液并予计数。将B液接种于含有A液的6孔培养板内,使NRK细胞的含量为5 000/孔,容积为2.5 ml,置于4%CO2孵箱孵育(37℃)5 d。实验共分4个组:①TGF β组(TGF β的终浓度为10ng/ml);②TGF β+EGF组(TGF β终浓度为10 ng/ml,EGF终含量为2.5 ng/ml);③EGF组(EGF组终含量为2.5 ng/ml);④空白对照组。
, 百拇医药
2 结果
2.1 人血小板提取率及纯度
随机对其中8个200 ml ACD-B抗凝人全血提取前后对比测定,血小板提取率均在70%以上,红细胞和白细胞混入量均小于2.0×108/袋和1.4×108/袋。
2.2 TGF β粗提物的分析结果
SDS-PAGE电泳和薄层分析显示,见图1。TGF β粗提物成分复杂,至少有13种以上不同分子量的蛋白成分,以25×103u成分和低分子量的蛋白最多,其中25×103u的TGF β含量为33.05%;超过25×103u成分约占18%以上。

, 百拇医药
图1 TGF β粗提物SDS-PAGE凝胶电泳结果
左:标准蛋白;右:TGF β粗提物
Fig 1 SDS-PAGE of crude TGF β
Left: Protein markers; Right: Crude TGF β
2.3 TGF β 2次纯化分析结果
2.3.1 第1次纯化分析结果 TGF β粗提物经Bio-Gel P60(洗脱液为1mol/L乙酸)柱层析曲线;SDS-PAGE显示第75~96管部分中含有25×103u成分。SDS-PAGE凝胶电泳及薄层分析结果:第1次纯化收集的TGF β,以25×103u和小分子量的蛋白为主,其中25×103u的TGF β含量为67.34%;大分子量的蛋白含量低。
, http://www.100md.com
2.3.2 第2次纯化分析结果 第1次纯化的TGF β再次经Bio-Gel P60柱层析(洗脱液为1 mol/L乙酸,8 mol/L超纯脲)曲线,仅见一个吸收峰;SDS-PAGE显示第105-114管部分中含有25×103u成分。SDS-PAGE凝胶电泳及薄层分析结果:第2次纯化收集的TGF β以25×103u的TGF β为主,其中仍见少许的低分子量蛋白成分,其纯度为89.38%,见图2。

图2 TGF β纯化物SDS-PAGE凝胶电泳结果
左:标准蛋白;中:TGF β纯化物;右:TGF β标准品
Fig 2 SDS-PAGE of purified TGF β
, 百拇医药
Left: Protein markers; Middle: purified TGF β;
Right: TGF β marker
2.4 ELISE定量结果
从200 ml×30袋全血中可纯化325 μg的TGF β。
2.5 纯化后TGF β生物活性鉴定结果见表1
表1 纯化后的TGF β生物活性
Tab 1 Biological activity of purified platelet-derived TGF β
Sample
, 百拇医药 Number of soft agar colonies
TGF β+EGF
256.3±1.67
EGF
27.7±1.33
TGF β
0.5±0.33
Control
0±0.00
空白对照组NRK细胞呈贴壁生长,见图3;单纯TGF β几乎不能刺激NRK细胞呈克隆生长;单纯EGF可刺激NRK细胞呈克隆样生长但不明显;加入TGF β大量NRK细胞呈克隆生长,见图4。

, 百拇医药
图3 空白对照组:NRK细胞在软琼脂培养中无克隆生长 (10×20)
Fig 3 Control group: No colony in soft agar culture of normal rat kidney fibroblasts (10×20)

图4 EGF加TGF β组:NRK细胞在软琼脂培养中呈多克隆生长 (10×20)
Fig 4 EGF+TGF β group: Multi-colony growth in soft agar culture of normal rat kidney fibroblasts (10×20)
, 百拇医药
3 讨论
3.1 关于人血小板的提取与再利用
传统的血小板制备方法为2次离心浓缩法,首先是轻离心分离富含血小板血浆,然后重离心使血小板聚合沉淀,分出上清乏血小板血浆,使聚合成片或絮状的血小板留于袋内;这种方法制出的血小板数量少,得率一般在60%左右,红细胞和白细胞含量高;并耗损一定量的血浆,造成部分血浆丢失[9,10]。我们通过探索改良了白膜回浆法制备浓缩血小板,这种方法简单方便,白细胞及红细胞混入量少;血小板提取率明显提高,一般均在70%以上,且血浆得到了回收。目前,国内外实行的是成分输血,血小板的利用率-般在10%以下;用本方法分离血小板并不影响其他成分输血,是对血小板的较好再利用。根据我们的实验,要保证血小板的提取率及纯度需注意以下几点:①血小板具粘附及降解性,所有容器应硅化处理,转移次数尽量少;洗脱后的纯血小板应立即进行下面的实验,防止其自身降解。②第1次离心以后分离血浆时流速不可过快,以免形成漩涡,使血浆底层及白膜层的血小板卷入血浆被分出影响得率。③第2次离心时血袋一定要竖直并使血浆上部分尽量饱满,可避免血浆两层紧贴或折叠,使红细胞粘附上层下沉,影响血小板纯度;第2次离心转速小,时间短,细胞层面较疏松,分离时应轻拿轻放。
, 百拇医药
3.2 关于TGF β粗提
自从Robert等[11]开创用酸醇从肿瘤细胞中提取转化多肽以来,人们已从廿余种组织细胞中提取了TGF β[12,13],其中血小板为TGF β最佳的组织来源,要从血小板中提取TGF β,必须对血小板进行破碎。实验中我们运用超声破碎法、SDS裂解法、渗透压法和匀浆器匀浆法来破碎血小板,均达到了目的。 通过筛选,酸醇裂解加匀浆器匀浆法破碎效果明显,其他方法有待进一步探索。另外,利用血小板蛋白包括TGF β不溶于乙醇和乙醚的特点,选用乙醚和乙醇萃取分离出血小板蛋白(包括TGF β)。与以往研究相比[12],本方法具有操作简单、成本低廉等优点。粗提物电泳发现,血小板蛋白分子量主要为25×103u和低分子量成分,其中25×103u的成分含量为33.05%, 进一步证实血小板是TGF β的最佳组织来源。
3.3 关于TGF β纯化方法
, http://www.100md.com
蛋白分离纯化是生物工程下游技术中最关键的步聚,常用方法有:离子交换层析、疏水作用层析、凝胶过滤层析、亲和层析、色谱聚焦以及羟基磷灰石柱层析等。目前用于TGF β分离纯化的方法主要有:凝胶层析、离子交换层析、逆相色谱层析等[11]。最近Werz[12]将3种方法同时运用于TGF β的分离纯化,其得率及纯度均有突飞猛进的进步。我们在实验中选用了2次凝胶层析法分离纯化TGF β,凝胶介质为Bio-Gel P60,其分离范围在(3~60)×103u;第1次柱层析后收集TGF β活性峰高的部分,冻干后电泳表明:TGF β的纯度为67.34%;除了有25×103u的成分外还有低分子量的蛋白混杂,为了除去低分子量的蛋白,在第2次过柱时我们在溶媒中加入8 mol/L的超纯脲,使小分子量的蛋白分离开,终产品的纯度达到89.38%,基本达到了纯化蛋白的要求。本方法较Werz等人提供的方法简单、适用,但纯度及得率存在一定差距,有待进一步探讨。
3.4 TGF β的提取率、生物活性维持
, http://www.100md.com
影响TGF β提取率主要因素有:①TGF β自身的降解,为了克服这个矛盾,在血小板破碎裂解过程中,我们加入了酶保护剂PMSF和Pepstin;2次分离纯化过程均运用1mol/L乙酸溶液维持其活性。②TGF β对容器壁和层析介质的粘附,在分离纯化的大部分操作均是在溶液中进行;利用TGF β易溶于乙酸的特点,在柱层析的平衡、过柱及洗脱过程均用1mol/L乙酸溶液。③血小板的裂解方法,本实验采用的是酸醇裂解加匀浆器匀浆破碎法破裂血小板效果令人满意,其他方法有待进一步研究及验证。维持TGF β的生物活性我们采用了以下措施:①绝大多数操作均在低温下进行。②在粗提过程中使用蛋白水解酶保护剂抑制蛋白水解酶对TGF β的降解作用。③TGF β在pH<3.5状况下易被激活,1 mol/L乙酸的pH在3.0左右,对维持其生物活性至关重要。④用冷冻干燥的方法对粗提物及纯化产品进行保存。
3.5 TGF β的生物活性鉴定
目前用于TGTβ生物活性检测方法很多,主要有:①刺激NRK细胞呈非静止性生长[11]。②抑制肿瘤或非肿瘤细胞系的生长。③诱导软骨形成。④刺激骨干骨膜下成骨。⑤诱导人骨髓细胞系Mono Mac-6中5-脂氧合酶表达和酶活性[12]。本实验选用的是刺激NRK细胞呈非静止性生长的方法;用10 ng/ml浓度的人血小板TGF β纯化物,在EGF(2.5 ng/ml)参与下可明显促进NRK细胞在软琼脂中呈克隆样生长,从而证实TGF β纯化物具有高度的生物活性作用。
, http://www.100md.com
本实验在借鉴前人的经验基础上,成功地建立了一种适合于国内的实验条件下能提取TGF β的方法,具有成本低廉、方法简单的特点,具有一定的应用价值。TGF β提取纯化今后面临的主要问题有:①如何进一步降低成本,提高产率和纯度;②如何将实验室生产变为规模化生产,这也是我们正在和将要解决的问题。
基金项目:重庆市重点科技攻关项目
作者简介:唐康来,男,30岁,主治医师,讲师,硕士
参考文献
[1] Lind M. Growth factors: Possible new clinical tools[J]. Acta Orthop Scand,1996,67(4):407-417.
[2] Lind M. Growth factor stimulation of bone healing. Effects on osteoblasts, osteomies,and implants fixation[J].Acta Orthop Scand Suppl,1998,283(2):2-37.
, 百拇医药
[3] Tripple S B, Coutts R D, Einhorm T A,et al. Growth factors as therapeutic agents[J]. J Bone Joint Surg(Amer),1996,8(3):1272-1283.
[4] O'kane S, Ferguson M W. Transforming growth factor beta's and wound healing[J]. Int J Biochem Cell Biol,1997,29(1):63-78.
[5] Yang L, Qiu C X, Ludlow A, et al. Active transforming growth factor beta in wound repair: Determination using a new assay[J]. Am J Pathol,1999,154(1):105-111.
, http://www.100md.com
[6] 龙建银,王会信. 转化生长因子β的临床应用前景[J]. 军事医学科学院院刊,1997,21(2):135-140.
[7] Bottinger E P,Kopp J O. Lessons from TGF-β transgenic mice[J]. Miner Eletrolyte Metab,1998,24:154-160.
[8] J.萨姆布鲁克, E.F弗里奇, T.曼尼阿蒂斯.分子克隆实验指导[M].北京:科学技术出版社,1992.880-888.
[9] 陈方祥,林武存.血小板制备与输注研究近况[J]. 国外医学:输血及血液学分册,1996,19(5):304-307.
[10] Hogman C F. New trends in the preparation and storage of platelets[J]. Transfusion,1992,32(1):3-6.
, 百拇医药
[11] Roberts A B, Lamb L C, Newton D L, et al. Isolation of polypeptides from virally and chemically transformed cells by acid/ethanol extraction[J]. Proc Natl Sci USA,1980,77(5):3494-3498.
[12] Werz O, Brungs M, Steinhiber D. Purification of transforming growth factor beta 1 from human platelets[J]. Pharmazie, 1996,51(11):893-896.
[13] Taniguchi Y, Tanaka T, Gotoh K, et al. Transforming growth factor-β1-induced cellular hetergeneity in the periosterm of rat parietal bone[J]. Calcif Tissue Int,1993,52(2):122-126.
收稿日期:1999-05-10;修回日期:1999-07-19, http://www.100md.com