二阶导数紫外分光光度法测定黄体酮注射液的含量
作者:徐静 李峰 程亦农
单位:安徽省合肥市药品检验所化学室,合肥 230022
关键词:孕酮;分光光度法;紫外线
安徽医科大学学报990227 中国图书资料分类法分类号 R977.12
用紫外分光光度法测定黄体酮的含量〔1〕,其注射液是油剂,油溶剂对测定有干扰,因而药典一直采用HPLC法。本研究对茶油为溶剂的黄体酮注射液,直接用无水乙醇溶解并稀释至一定浓度,采用二阶导数零交截距法〔2〕测含量,可消除茶油的干扰。
1 仪器与药品
岛津UV-2401 PC分光光度计;无水乙醇:上海振兴化工一厂,批号9610355;黄体酮对照品:中国药品生物制品检定所,批号027-8004;茶油:由上海第九制药厂提供;岛津LC-10AD高效液相色谱仪(包括LC-10AT泵,SPD-10A紫外检测器,PC-6A数据处理器);甲醇,上海溶剂厂。
, 百拇医药
2 测定依据与参数的选定
2.1 测定依据 配制黄体酮无水乙醇溶液(6 μg.L-1):精密称取黄体酮对照品60 mg置100 ml量瓶中,加无水乙醇适量使溶解并稀释至刻度,摇匀,为贮备液。准确吸取上述贮备液1 ml置100 ml量瓶中,加无水乙醇稀释至刻度。
配制茶油无水乙醇溶液(6 μl.L-1):准确吸取茶油6 ml置100 ml量瓶中,加无水乙醇稀释至刻度,摇匀,为贮备液。准确吸取上述贮备液1 ml置100 ml量瓶中,加无水乙醇稀释至刻度、摇匀。
配制两种无水乙醇混合液:分别准确吸取上述两种贮备液各1 ml,置100 ml量瓶中,加无水乙醇稀释至刻度,摇匀。
用上述3种溶液在200~300 nm波长范围内分别绘制吸收光谱(图1)与二阶导数光谱(图2)。
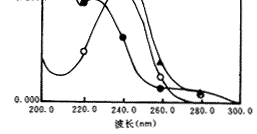 图1 吸收光谱
图1 吸收光谱
, 百拇医药
○—○黄体酮;●—●茶油;▲—▲二者混合液
由二阶导数光谱图2看,茶油在242.5 nm波长处的零交点可作为黄体酮的测定波长,过此点对基线作垂线与混合液的光谱相交,量取交点O'与零交点O截距D值,可作为黄体酮的定量信息。D值与茶油的浓度无关,而与黄体酮的浓度成正比例,因而消除了茶油的干扰。

图2 二阶导数光谱
○—○黄体酮;●—●茶油;▲—▲二者混合液
2.2 测定参数 狭缝:2 nm;扫描速度:中速;Δλ:4 nm(2 nd);扫描因素:20;纵轴:±0.1。
, 百拇医药
3 标准曲线制备
精密称取105℃干燥至恒重的黄体酮对照品10 mg,置100 ml量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,作为对照液。准确量取对照液1.0,1.5,2.0,2.5 ml分别置25 ml量瓶中,加无水乙醇稀释至刻度,摇匀,置1 cm石英吸收池中,以无水乙醇作参比,按选定参数,在200~300 nm波长绘制二阶导数光谱,量取零交截距D值,结果见表1。
表1 黄体酮浓度C与D值的关系(n=4) C(μg.L-1)
4.12
6.18
8.24
10.3
, 百拇医药 D(mm)
28.0
41.5
55.8
70.0
回归方程与相关系数 D=-0.28+6.8C r=0.999 9
4 回收率试验
精密量取黄体酮对照液1.0,1.5,2.0,2.5,3.0 ml分别置25 ml量瓶中,按黄体酮注射液1 ml含10 mg黄体酮的比例分别加茶油无水乙醇溶液适量,再加无水乙醇稀释至刻度,摇匀,按标准曲线制备项下方法绘制二阶导数光谱,量取D值,由回归方程计算回收率(%),结果见表2。
表2 回收率试验结果(%,n=5) 加入量(μg)
, http://www.100md.com
测得量
(μg)
回收率
RSD
4.12
4.13
100.2
6.18
6.22
100.6
8.24
8.22
, http://www.100md.com
99.8
100.2
0.60
10.30
10.40
101.0
12.36
12.30
99.5
5 样品测定
用内容量移液管精密量取本品1 ml,置100 ml量瓶中,用无水乙醇分数次洗涤移液管内壁,洗液并入量瓶中,加无水乙醇适量稀释,振摇使油混溶后再加至刻度,摇匀。准确量取2 ml,规格1 ml∶10 mg者置25 ml量瓶中,1 ml∶20 mg者置50 ml量瓶中,加无水乙醇稀释至刻度,摇匀。按标准曲线制备项下方法绘制二阶导数光谱。量取D值,由回归方程计算黄体酮含量。另外,按药典方法(HPLC法)测得黄体酮含量。两结果比较,基本一致,具体结果见表3。
, 百拇医药
表3 UV法与HPLC法含量测定比较(%,n=3) 批号
规格
UV法
HPLC法
941204-11
1 ml∶10 mg
98.0(0.4)
98.1
951003-111
1 ml∶20 mg
96.0(0.5)
95.7
, http://www.100md.com
970311
1 ml∶10 mg
100.3(0.4)
99.4
括号内为RSD(%)6 小结
6.1 本法不需分离可直接测定以茶油为溶剂的黄体酮注射液的含量。操作简便、快速,与药典HPLC法比较,测定结果基本一致。
6.2 黄体酮注射液1 ml在50 ml无水乙醇中不能完全混溶,因而两种规格均以量取1 ml,加无水乙醇至100 ml为宜。
6.3 由于零交截距相交于谷的陡坡处,零交点所在波长的选择以及仪器波长准确与否对测定结果影响较大,测定时可用干扰组分(茶油)选定零交点波长,以便得到较准确的结果。
6.4 样品的含量测定,采用外标一点法更为简便。
作者简介:徐 静,女,33岁,主管药师
参考文献
1 中华人民共和国卫生新药典委员会.中国药典.二部,北京:化学工业出版社,1985:474~475
2 刘艳春.一阶导数紫外光谱法检查阿斯匹林及其片剂中的游离水杨酸.药物分析杂志,1994;14(2):46
1998-03-18收稿,1998-12-16修回, 百拇医药
单位:安徽省合肥市药品检验所化学室,合肥 230022
关键词:孕酮;分光光度法;紫外线
安徽医科大学学报990227 中国图书资料分类法分类号 R977.12
用紫外分光光度法测定黄体酮的含量〔1〕,其注射液是油剂,油溶剂对测定有干扰,因而药典一直采用HPLC法。本研究对茶油为溶剂的黄体酮注射液,直接用无水乙醇溶解并稀释至一定浓度,采用二阶导数零交截距法〔2〕测含量,可消除茶油的干扰。
1 仪器与药品
岛津UV-2401 PC分光光度计;无水乙醇:上海振兴化工一厂,批号9610355;黄体酮对照品:中国药品生物制品检定所,批号027-8004;茶油:由上海第九制药厂提供;岛津LC-10AD高效液相色谱仪(包括LC-10AT泵,SPD-10A紫外检测器,PC-6A数据处理器);甲醇,上海溶剂厂。
, 百拇医药
2 测定依据与参数的选定
2.1 测定依据 配制黄体酮无水乙醇溶液(6 μg.L-1):精密称取黄体酮对照品60 mg置100 ml量瓶中,加无水乙醇适量使溶解并稀释至刻度,摇匀,为贮备液。准确吸取上述贮备液1 ml置100 ml量瓶中,加无水乙醇稀释至刻度。
配制茶油无水乙醇溶液(6 μl.L-1):准确吸取茶油6 ml置100 ml量瓶中,加无水乙醇稀释至刻度,摇匀,为贮备液。准确吸取上述贮备液1 ml置100 ml量瓶中,加无水乙醇稀释至刻度、摇匀。
配制两种无水乙醇混合液:分别准确吸取上述两种贮备液各1 ml,置100 ml量瓶中,加无水乙醇稀释至刻度,摇匀。
用上述3种溶液在200~300 nm波长范围内分别绘制吸收光谱(图1)与二阶导数光谱(图2)。

 图1 吸收光谱
图1 吸收光谱, 百拇医药
○—○黄体酮;●—●茶油;▲—▲二者混合液
由二阶导数光谱图2看,茶油在242.5 nm波长处的零交点可作为黄体酮的测定波长,过此点对基线作垂线与混合液的光谱相交,量取交点O'与零交点O截距D值,可作为黄体酮的定量信息。D值与茶油的浓度无关,而与黄体酮的浓度成正比例,因而消除了茶油的干扰。


图2 二阶导数光谱
○—○黄体酮;●—●茶油;▲—▲二者混合液
2.2 测定参数 狭缝:2 nm;扫描速度:中速;Δλ:4 nm(2 nd);扫描因素:20;纵轴:±0.1。
, 百拇医药
3 标准曲线制备
精密称取105℃干燥至恒重的黄体酮对照品10 mg,置100 ml量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,作为对照液。准确量取对照液1.0,1.5,2.0,2.5 ml分别置25 ml量瓶中,加无水乙醇稀释至刻度,摇匀,置1 cm石英吸收池中,以无水乙醇作参比,按选定参数,在200~300 nm波长绘制二阶导数光谱,量取零交截距D值,结果见表1。
表1 黄体酮浓度C与D值的关系(n=4) C(μg.L-1)
4.12
6.18
8.24
10.3
, 百拇医药 D(mm)
28.0
41.5
55.8
70.0
回归方程与相关系数 D=-0.28+6.8C r=0.999 9
4 回收率试验
精密量取黄体酮对照液1.0,1.5,2.0,2.5,3.0 ml分别置25 ml量瓶中,按黄体酮注射液1 ml含10 mg黄体酮的比例分别加茶油无水乙醇溶液适量,再加无水乙醇稀释至刻度,摇匀,按标准曲线制备项下方法绘制二阶导数光谱,量取D值,由回归方程计算回收率(%),结果见表2。
表2 回收率试验结果(%,n=5) 加入量(μg)
, http://www.100md.com
测得量
(μg)
回收率

RSD
4.12
4.13
100.2
6.18
6.22
100.6
8.24
8.22
, http://www.100md.com
99.8
100.2
0.60
10.30
10.40
101.0
12.36
12.30
99.5
5 样品测定
用内容量移液管精密量取本品1 ml,置100 ml量瓶中,用无水乙醇分数次洗涤移液管内壁,洗液并入量瓶中,加无水乙醇适量稀释,振摇使油混溶后再加至刻度,摇匀。准确量取2 ml,规格1 ml∶10 mg者置25 ml量瓶中,1 ml∶20 mg者置50 ml量瓶中,加无水乙醇稀释至刻度,摇匀。按标准曲线制备项下方法绘制二阶导数光谱。量取D值,由回归方程计算黄体酮含量。另外,按药典方法(HPLC法)测得黄体酮含量。两结果比较,基本一致,具体结果见表3。
, 百拇医药
表3 UV法与HPLC法含量测定比较(%,n=3) 批号
规格
UV法
HPLC法
941204-11
1 ml∶10 mg
98.0(0.4)
98.1
951003-111
1 ml∶20 mg
96.0(0.5)
95.7
, http://www.100md.com
970311
1 ml∶10 mg
100.3(0.4)
99.4
括号内为RSD(%)6 小结
6.1 本法不需分离可直接测定以茶油为溶剂的黄体酮注射液的含量。操作简便、快速,与药典HPLC法比较,测定结果基本一致。
6.2 黄体酮注射液1 ml在50 ml无水乙醇中不能完全混溶,因而两种规格均以量取1 ml,加无水乙醇至100 ml为宜。
6.3 由于零交截距相交于谷的陡坡处,零交点所在波长的选择以及仪器波长准确与否对测定结果影响较大,测定时可用干扰组分(茶油)选定零交点波长,以便得到较准确的结果。
6.4 样品的含量测定,采用外标一点法更为简便。
作者简介:徐 静,女,33岁,主管药师
参考文献
1 中华人民共和国卫生新药典委员会.中国药典.二部,北京:化学工业出版社,1985:474~475
2 刘艳春.一阶导数紫外光谱法检查阿斯匹林及其片剂中的游离水杨酸.药物分析杂志,1994;14(2):46
1998-03-18收稿,1998-12-16修回, 百拇医药