聚合酶链反应—微孔板杂交技术检测人乳头瘤病毒
作者:龚蕴贞 肖尚喜 俞慕华 林维芬 胡涛
单位:安徽医科大学微生物学教研室,合肥 230032
关键词:乳头状瘤病毒;人;聚合酶链反应
安徽医科大学学报000302 摘要 目的 建立HPV诊断及分型技术。方法 用HPV通用型引物和型特异性探针作PCR-微孔板杂交检测法(PCR-ELISA)。结果 特异性探针只与HPV阳性标本显色,A值为0.327±0.029;阴性标本均不显色,A值为0.003±0.001,与性传播性疾病相关的病原微生物(淋球菌、解脲支原体、沙眼衣原体、人巨细胞病毒、单纯疱疹病毒)均不显色。该法能检出3.6个HeLa细胞含HPV-18型144个拷贝,A值0.237~0.206;空白对照A值为0.005~0.015。结论 PCR-ELISA方法快速、敏感、特异且可用自动化酶标仪多量标本检测,适合临床实验使用。
, 百拇医药
中图分类号 R446.9
文献标识码 A 文章编号 1000-1492(2000)03-0168-03
Detection of human papillo-mavirus by polymerase
chain reaction and microtiter plate hybridization
Gong Yunzhen,Xiao Shangxi,Yu Muhua et al
(Dept of Microbiology ,Anhui Medical University,Hefei 230032)
Abstract Objective A technique for the diagnosis and typing of human papillomaviruses (HPV). Methods Based on PCR-ELISA with HPV consensus primers and type-specific probes was developed. Results Specific test showed that the method could HPV-positive samples and A value of 0.327±0.024 was determined.All HPV-negative samples could not be detected with the method and A value of 0.003±0.001 was determined.At the same time,the method could not detect some pathogens of STD,such as gonococcus,ureaplasma,chlamydia trachomatis,human cytomegalovirus and herpes simplex virus.Sensitive test showed that the method could detect 3.6 HeLa cells containing 144 copies of HPV18. A value of 0.237~0.206,whereas as control value was 0.005~0.015. Conclusion The PCR-ELISA provides the potential for an automated,simple,rapid and accurate test for detection and typing of HPV and accurate test for detection and typing of HPV in diagnostic virological laboratories.
, 百拇医药
MeSH papillomaviruses, human; polymerase chain reaction
人乳头瘤病毒(Human papillomaviruses, HPV)引起皮肤上的疣状物或泌尿生殖道粘膜上的尖锐湿疣,某些型别(如HPV-16、18)还可导致恶变。该病毒的复制高度依赖于皮肤角质细胞的分化,至今无法在体外细胞培养,因此在研究和临床检测上受到很大限制,血清学方法不能发挥重要作用。传统的病理诊断常见有凹空细胞(Koilocytosis),阳性率较低;核酸杂交试验的实验条件和技术要求较高;聚合酶链反应(PCR)是诊断HPV最敏感的方法,但易受到假阳性的干扰,另外HPV型别多,不同型别所致病变的转归亦是不同。建立快速、特异、敏感的核酸检测及分型的方法十分重要,本研究为HPV引物1 MY09和引物2 MY11的PCR产物与通用型探针和型特异型探针作PCR-微孔板杂交检测法,建立了HPV诊断及分型技术。
1 材料和方法
, http://www.100md.com
1.1 细胞系和临床标本 HeLa细胞由本室提供,每个HeLa细胞含HPV-18型核酸40拷贝〔1〕。细胞株以DMEM含10%(体积分数,下同)牛血清培养液常规传代。HPV-DNA阳性标本3份,阴性标本2份。
1.2 PCR引物和探针的设计〔2〕 引物为Ting和Manos(1990年)设计,由本室Oligo-1000型DNA合成仪合成。以HPVL1区为靶序列,引物1为MY09 5′-CGTCC(AC)A(AG)(AG)GGA(AT)ACTGATC,引物2为MY11 5′-GC(AC)CAGGG(AT)CATAA(CT)AATGG,该对引物与各型HPVL1区高度互补,扩增-450 bp的DNA片段。生物素化的HPV探针由美国赛百盛公司合成,通用探针1、2序列分别为:Bio-5′-CTGTTGTTGATACTACACGCA-3′和Bio-5′-CTGTGGTAGATACCAC(AT)CGCA-3′HPV18型探针的序列为:Bio-5′GGATGCTGCACCGGCTGA-3′。
, http://www.100md.com
1.3 PCR条件 20 μl反应体系中含10 mmol*L-1 Tris-HCl(pH 8.4)、50 mmol*L-1 KCl、2.0 mmol*L-1 MgCl2、100 mg*L-1明胶、200 μmol*L-1 dNTPs、10 μmol*L-1 Dig-11dUTP、浓度各为50 pmol*L-1的两条引物、1 U Tap酶(dNTP和Tap酶购自Promega公司,Dig-11-dUTP购自BOEHRINGER MANNHEIM公司)、5 μl标本提取液。在Bio-Rad热循环仪(美国伯乐公司产品)上进行扩增,94℃变性4 min,循环参数为94℃ 30 s,55℃ 30 s,72℃ 45 s。30次循环后,72℃延伸5 min。为避免污染而出现假阳性,试验过程中每一步在实验室不同区域进行。
1.4 特异性试验 与性传播性疾病相关的病原微生物(淋球菌、解脲支原体、沙眼衣原体、人巨细胞病毒、单纯庖疹病毒)与HPV进行同样扩增,杂交,显色。
, http://www.100md.com
1.5 敏感性试验 将HeLa细胞胰酶消化,吹打成单个细胞,并计数后,进行对倍稀释,分别进行同条件的PCR扩增,电泳,杂交,显色。
1.6 核酸杂交及ELISA检测 5 μl PCR产物加400 μl 4×SSC(含20 mmol*L-1 HEPES,4 mmol*L-1 EDTA),95℃ 5 min后立即冰浴,取100 μl混合液加入预先包被了链亲和素和生物素化的核酸探针的微孔板中(每孔1、2、4、8、16 μg链亲和素于100 μl 0.5 mol*L-1碳酸盐缓冲液pH 9.6,4℃过夜。用PBST洗涤,分别加入5 g*L-1明胶PBS;10%牛血清PBS封板和不加封板液,分别加入100 μl含5 ng生物素化的2个通用型探针混合物或18型单一的生物素化探针,4℃过夜)。含有Dig-11dUTP的PCR产物分别与微孔中通用型探针或18型探针杂交,分别于45℃、50℃、55℃、60℃水浴0.5 h、1 h、2 h、3 h,PBST洗涤3次,每孔加入HRP-抗Dig抗体100 μl(含300 mU的酶):37℃作用45 min,PBST洗涤3次,加TMB A液50 μl,TMB B液50 μl,10 min内显色,2 mol*L-1 H2SO4终止,DV 900B4型全自动酶标仪测A值。
, 百拇医药
2 结果
2.1 PCR的特异性 在特异性试验中,本方法除与HPV DNA阳性3份标本和3.6个HeLa细胞数以上标本显示阳性结果外,其它与性传播疾病相关的病原微生物均为阴性。
2.2 PCR的敏感性 敏感性试验显示该方法能检出3.6个HeLa细胞含144个拷贝(即lg2.158),A值范围0.237~0.206,空白对照A值范围为0.005~0.015。反应散点见图1。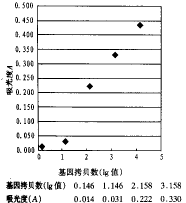
图1 不同基因拷贝数的PCR产物显色反应散点图
(基因拷贝数以lg值表示)
2.3 微孔板包被及洗涤条件的优化 在杂交体系优化实验中。使用2 μg链亲和素结合于不同的微孔板,结果国产软板和丹麦NUMC Maxisorp单条可拆微孔板效果一样好,国产硬板不能吸附链亲和素;应用5 g*L-1明胶PBS、10%牛血清PBS封板和不加封板液进行比较,结果以不封板为好,3份阳性标本均显色,A均值为0.327±0.029,2份阴性标本均不显色,A均值为0.003±0.001。试用两种不同洗涤液:10 mmol*L-1 Tris-HCl(pH 7.5,含0.15 mol*L-1 NaCl和0.05% Tween 20,简称TBST)、0.01 mol*L-1 PBS(pH 7.4含0.05% Tween 20,简称PBST),结果两种洗涤液效果一样。
, 百拇医药
2.4 微孔板杂交体系的优化 PCR产物5 μl,用50 mmol*L-1 NaOH变性和用4×SSC杂交液95℃变性5 min,立即冰浴,然后将PCR产物加入预先包被了探针的微孔板中杂交,结果显示用95℃变性后立即冰浴效果最佳,杂交时间采用0.5 h、1 h、2 h、3 h,杂交温度选用45℃、50℃、55℃、60℃,结果以杂交时间1 h、温度55℃为最佳。
3 讨论
至今,HPV至少有77个型别〔3〕,其中一些(如HPV-6、11型)只引起皮肤粘膜增生病变(如疣体或尖锐湿疣),称为良性组;另一些(如HPV-16、18型)可导致皮肤粘膜的恶性转化(如宫颈癌,阴茎癌),称为恶性组。HPV各型别的临床转归不同,分型在临床标本检出中十分必要。该病毒DNA的拷贝整合于癌细胞,一般不整合于非癌细胞和恶性前细胞〔4〕,每个SiHa细胞系含HPV-16 DNA 1~2拷贝,每个HeLa细胞含HPV-18 DNA 40拷贝。本实验应用HeLa细胞裂解液,用HPV通用引物MY09和MY11引物作PCR扩增,其产物与HPV通用探针和HPV18型探针作微孔板杂交试验结果表明在一定细胞数范围内与A值成正比。通过克隆基因的DNA杂交试验及酶谱分析来HPV型别,条件要求高,不适于临床大量标本检测。PCR是诊断HPV感染的敏感方法,但HPV型别繁多,运用型特异性引物显然是不可取,而利用同源引物PCR同时扩增多型HPV,随后必须对PCR产物进行分型。以往的分型方法是用型特异性探针作点杂交,利用限制性内切酶作限制性片段长度多态性分析分型〔5〕,直接DNA序列分析〔6〕,或用非放射性方法标记的型特异性探针作反向点杂交〔7〕。所有这些方法都受到一定的限制,不适合临床大量标本的常规检测。本方法将PCR技术、核酸杂交技术及酶联免疫技术结合起来,较简便,结果客观,而且酶联方法在临床实验室已比较成熟,也排除了化学试剂(如溴化乙啶)污染和同位素杂交的放射性污染,因此本方法适合于大量标本的检测,有利于自动化且可根据A值对PCR产物定量。
, http://www.100md.com
微孔板杂交法中,DNA固定于微孔板的技术是关键,有直接包被DNA或用蛋白质固定〔8〕,包被和洗涤是比较重要的环节。我们没有采用寡核苷酸探针直接包被,而是引入链亲和素-生物素系统的帮助,这样使包被更容易结合、更牢固。洗涤液的pH值及Tween 20的浓度较重要,否则会导致孔间差异较大。在杂交过程中我们按文献〔2〕的方法作了部分改进(如PCR产物的变性法、杂交时间的缩短、取消了杂交后的封板步骤),使实验更加简便。从我们初步应用看来,建立的PCR-ELISA法与一般PCR电泳法同样敏感,但通过杂交,提高了特异性,并可用型特异性探针分型。重复试验7次,结果一致。本法有望推广作为临床实验使用,但还需进一步应用多型特异性探针,增加临床标本的数量加以评估,降低试剂盒的成本。
基金项目:安徽省“九五”攻关项目课题(9613004-2)
作者简介:龚蕴贞,女,59岁,副教授
, http://www.100md.com
参考文献
1,Coutlee F, Provencher D, Vorer H. Detection of human papillomavirus DNA in cervical La-vage specimens by a nonisotopic consensus PCR assay. J Clinical Microbiol, 1995;33(8):1 973~1 978
2,Poljak M, Seme K. Rapid detection and typing of human papillomaviruses by consensus polymerase chain reaction and enzyme-linked immunosor-bent assay. J Virol Methods,1996;56(2):231~238
3,Hausen HZ. Papillomavirus infections-a major cause of human cacers. Biochimca et Biophysica Acta, 1996;1 288:F55~F78
, 百拇医药
4,侯云德. 分子病毒学. 第1版,北京:学苑出版社,1990:206
5,Bernard HU, Chan SY,Manos MM et al. Identification and assessment of known and novel human papillomaviruses by polymerase chain reaction amplification,restriction fragment length polymorphisms. Nucleotide sequence, and phylogenetic algorithms. J Infect Dis, 1994;170(5):1 077~1 085
6,Rady PL,Chin R,Arany I et al. Direct sequencing of consensus primer generated PCR fragments of human papillomaviruses. J Virol Methods, 1993;43(3):335~350
7,Forslund O,Hansson BG, Bjerre B. Typing of human papillomaviruses by consensus polymerase chain reaction and a non-radioactive reverse dot blot hybridization. J Virol Methods, 1994;49(2):129~140
8,魏 军,张 征. 聚合酶链反应产物微孔板杂交技术. 中华医学检验杂志, 1997;20(4):252~253
1999-10-29收稿,2000-04-20修回, http://www.100md.com
单位:安徽医科大学微生物学教研室,合肥 230032
关键词:乳头状瘤病毒;人;聚合酶链反应
安徽医科大学学报000302 摘要 目的 建立HPV诊断及分型技术。方法 用HPV通用型引物和型特异性探针作PCR-微孔板杂交检测法(PCR-ELISA)。结果 特异性探针只与HPV阳性标本显色,A值为0.327±0.029;阴性标本均不显色,A值为0.003±0.001,与性传播性疾病相关的病原微生物(淋球菌、解脲支原体、沙眼衣原体、人巨细胞病毒、单纯疱疹病毒)均不显色。该法能检出3.6个HeLa细胞含HPV-18型144个拷贝,A值0.237~0.206;空白对照A值为0.005~0.015。结论 PCR-ELISA方法快速、敏感、特异且可用自动化酶标仪多量标本检测,适合临床实验使用。
, 百拇医药
中图分类号 R446.9
文献标识码 A 文章编号 1000-1492(2000)03-0168-03
Detection of human papillo-mavirus by polymerase
chain reaction and microtiter plate hybridization
Gong Yunzhen,Xiao Shangxi,Yu Muhua et al
(Dept of Microbiology ,Anhui Medical University,Hefei 230032)
Abstract Objective A technique for the diagnosis and typing of human papillomaviruses (HPV). Methods Based on PCR-ELISA with HPV consensus primers and type-specific probes was developed. Results Specific test showed that the method could HPV-positive samples and A value of 0.327±0.024 was determined.All HPV-negative samples could not be detected with the method and A value of 0.003±0.001 was determined.At the same time,the method could not detect some pathogens of STD,such as gonococcus,ureaplasma,chlamydia trachomatis,human cytomegalovirus and herpes simplex virus.Sensitive test showed that the method could detect 3.6 HeLa cells containing 144 copies of HPV18. A value of 0.237~0.206,whereas as control value was 0.005~0.015. Conclusion The PCR-ELISA provides the potential for an automated,simple,rapid and accurate test for detection and typing of HPV and accurate test for detection and typing of HPV in diagnostic virological laboratories.
, 百拇医药
MeSH papillomaviruses, human; polymerase chain reaction
人乳头瘤病毒(Human papillomaviruses, HPV)引起皮肤上的疣状物或泌尿生殖道粘膜上的尖锐湿疣,某些型别(如HPV-16、18)还可导致恶变。该病毒的复制高度依赖于皮肤角质细胞的分化,至今无法在体外细胞培养,因此在研究和临床检测上受到很大限制,血清学方法不能发挥重要作用。传统的病理诊断常见有凹空细胞(Koilocytosis),阳性率较低;核酸杂交试验的实验条件和技术要求较高;聚合酶链反应(PCR)是诊断HPV最敏感的方法,但易受到假阳性的干扰,另外HPV型别多,不同型别所致病变的转归亦是不同。建立快速、特异、敏感的核酸检测及分型的方法十分重要,本研究为HPV引物1 MY09和引物2 MY11的PCR产物与通用型探针和型特异型探针作PCR-微孔板杂交检测法,建立了HPV诊断及分型技术。
1 材料和方法
, http://www.100md.com
1.1 细胞系和临床标本 HeLa细胞由本室提供,每个HeLa细胞含HPV-18型核酸40拷贝〔1〕。细胞株以DMEM含10%(体积分数,下同)牛血清培养液常规传代。HPV-DNA阳性标本3份,阴性标本2份。
1.2 PCR引物和探针的设计〔2〕 引物为Ting和Manos(1990年)设计,由本室Oligo-1000型DNA合成仪合成。以HPVL1区为靶序列,引物1为MY09 5′-CGTCC(AC)A(AG)(AG)GGA(AT)ACTGATC,引物2为MY11 5′-GC(AC)CAGGG(AT)CATAA(CT)AATGG,该对引物与各型HPVL1区高度互补,扩增-450 bp的DNA片段。生物素化的HPV探针由美国赛百盛公司合成,通用探针1、2序列分别为:Bio-5′-CTGTTGTTGATACTACACGCA-3′和Bio-5′-CTGTGGTAGATACCAC(AT)CGCA-3′HPV18型探针的序列为:Bio-5′GGATGCTGCACCGGCTGA-3′。
, http://www.100md.com
1.3 PCR条件 20 μl反应体系中含10 mmol*L-1 Tris-HCl(pH 8.4)、50 mmol*L-1 KCl、2.0 mmol*L-1 MgCl2、100 mg*L-1明胶、200 μmol*L-1 dNTPs、10 μmol*L-1 Dig-11dUTP、浓度各为50 pmol*L-1的两条引物、1 U Tap酶(dNTP和Tap酶购自Promega公司,Dig-11-dUTP购自BOEHRINGER MANNHEIM公司)、5 μl标本提取液。在Bio-Rad热循环仪(美国伯乐公司产品)上进行扩增,94℃变性4 min,循环参数为94℃ 30 s,55℃ 30 s,72℃ 45 s。30次循环后,72℃延伸5 min。为避免污染而出现假阳性,试验过程中每一步在实验室不同区域进行。
1.4 特异性试验 与性传播性疾病相关的病原微生物(淋球菌、解脲支原体、沙眼衣原体、人巨细胞病毒、单纯庖疹病毒)与HPV进行同样扩增,杂交,显色。
, http://www.100md.com
1.5 敏感性试验 将HeLa细胞胰酶消化,吹打成单个细胞,并计数后,进行对倍稀释,分别进行同条件的PCR扩增,电泳,杂交,显色。
1.6 核酸杂交及ELISA检测 5 μl PCR产物加400 μl 4×SSC(含20 mmol*L-1 HEPES,4 mmol*L-1 EDTA),95℃ 5 min后立即冰浴,取100 μl混合液加入预先包被了链亲和素和生物素化的核酸探针的微孔板中(每孔1、2、4、8、16 μg链亲和素于100 μl 0.5 mol*L-1碳酸盐缓冲液pH 9.6,4℃过夜。用PBST洗涤,分别加入5 g*L-1明胶PBS;10%牛血清PBS封板和不加封板液,分别加入100 μl含5 ng生物素化的2个通用型探针混合物或18型单一的生物素化探针,4℃过夜)。含有Dig-11dUTP的PCR产物分别与微孔中通用型探针或18型探针杂交,分别于45℃、50℃、55℃、60℃水浴0.5 h、1 h、2 h、3 h,PBST洗涤3次,每孔加入HRP-抗Dig抗体100 μl(含300 mU的酶):37℃作用45 min,PBST洗涤3次,加TMB A液50 μl,TMB B液50 μl,10 min内显色,2 mol*L-1 H2SO4终止,DV 900B4型全自动酶标仪测A值。
, 百拇医药
2 结果
2.1 PCR的特异性 在特异性试验中,本方法除与HPV DNA阳性3份标本和3.6个HeLa细胞数以上标本显示阳性结果外,其它与性传播疾病相关的病原微生物均为阴性。
2.2 PCR的敏感性 敏感性试验显示该方法能检出3.6个HeLa细胞含144个拷贝(即lg2.158),A值范围0.237~0.206,空白对照A值范围为0.005~0.015。反应散点见图1。

图1 不同基因拷贝数的PCR产物显色反应散点图
(基因拷贝数以lg值表示)
2.3 微孔板包被及洗涤条件的优化 在杂交体系优化实验中。使用2 μg链亲和素结合于不同的微孔板,结果国产软板和丹麦NUMC Maxisorp单条可拆微孔板效果一样好,国产硬板不能吸附链亲和素;应用5 g*L-1明胶PBS、10%牛血清PBS封板和不加封板液进行比较,结果以不封板为好,3份阳性标本均显色,A均值为0.327±0.029,2份阴性标本均不显色,A均值为0.003±0.001。试用两种不同洗涤液:10 mmol*L-1 Tris-HCl(pH 7.5,含0.15 mol*L-1 NaCl和0.05% Tween 20,简称TBST)、0.01 mol*L-1 PBS(pH 7.4含0.05% Tween 20,简称PBST),结果两种洗涤液效果一样。
, 百拇医药
2.4 微孔板杂交体系的优化 PCR产物5 μl,用50 mmol*L-1 NaOH变性和用4×SSC杂交液95℃变性5 min,立即冰浴,然后将PCR产物加入预先包被了探针的微孔板中杂交,结果显示用95℃变性后立即冰浴效果最佳,杂交时间采用0.5 h、1 h、2 h、3 h,杂交温度选用45℃、50℃、55℃、60℃,结果以杂交时间1 h、温度55℃为最佳。
3 讨论
至今,HPV至少有77个型别〔3〕,其中一些(如HPV-6、11型)只引起皮肤粘膜增生病变(如疣体或尖锐湿疣),称为良性组;另一些(如HPV-16、18型)可导致皮肤粘膜的恶性转化(如宫颈癌,阴茎癌),称为恶性组。HPV各型别的临床转归不同,分型在临床标本检出中十分必要。该病毒DNA的拷贝整合于癌细胞,一般不整合于非癌细胞和恶性前细胞〔4〕,每个SiHa细胞系含HPV-16 DNA 1~2拷贝,每个HeLa细胞含HPV-18 DNA 40拷贝。本实验应用HeLa细胞裂解液,用HPV通用引物MY09和MY11引物作PCR扩增,其产物与HPV通用探针和HPV18型探针作微孔板杂交试验结果表明在一定细胞数范围内与A值成正比。通过克隆基因的DNA杂交试验及酶谱分析来HPV型别,条件要求高,不适于临床大量标本检测。PCR是诊断HPV感染的敏感方法,但HPV型别繁多,运用型特异性引物显然是不可取,而利用同源引物PCR同时扩增多型HPV,随后必须对PCR产物进行分型。以往的分型方法是用型特异性探针作点杂交,利用限制性内切酶作限制性片段长度多态性分析分型〔5〕,直接DNA序列分析〔6〕,或用非放射性方法标记的型特异性探针作反向点杂交〔7〕。所有这些方法都受到一定的限制,不适合临床大量标本的常规检测。本方法将PCR技术、核酸杂交技术及酶联免疫技术结合起来,较简便,结果客观,而且酶联方法在临床实验室已比较成熟,也排除了化学试剂(如溴化乙啶)污染和同位素杂交的放射性污染,因此本方法适合于大量标本的检测,有利于自动化且可根据A值对PCR产物定量。
, http://www.100md.com
微孔板杂交法中,DNA固定于微孔板的技术是关键,有直接包被DNA或用蛋白质固定〔8〕,包被和洗涤是比较重要的环节。我们没有采用寡核苷酸探针直接包被,而是引入链亲和素-生物素系统的帮助,这样使包被更容易结合、更牢固。洗涤液的pH值及Tween 20的浓度较重要,否则会导致孔间差异较大。在杂交过程中我们按文献〔2〕的方法作了部分改进(如PCR产物的变性法、杂交时间的缩短、取消了杂交后的封板步骤),使实验更加简便。从我们初步应用看来,建立的PCR-ELISA法与一般PCR电泳法同样敏感,但通过杂交,提高了特异性,并可用型特异性探针分型。重复试验7次,结果一致。本法有望推广作为临床实验使用,但还需进一步应用多型特异性探针,增加临床标本的数量加以评估,降低试剂盒的成本。
基金项目:安徽省“九五”攻关项目课题(9613004-2)
作者简介:龚蕴贞,女,59岁,副教授
, http://www.100md.com
参考文献
1,Coutlee F, Provencher D, Vorer H. Detection of human papillomavirus DNA in cervical La-vage specimens by a nonisotopic consensus PCR assay. J Clinical Microbiol, 1995;33(8):1 973~1 978
2,Poljak M, Seme K. Rapid detection and typing of human papillomaviruses by consensus polymerase chain reaction and enzyme-linked immunosor-bent assay. J Virol Methods,1996;56(2):231~238
3,Hausen HZ. Papillomavirus infections-a major cause of human cacers. Biochimca et Biophysica Acta, 1996;1 288:F55~F78
, 百拇医药
4,侯云德. 分子病毒学. 第1版,北京:学苑出版社,1990:206
5,Bernard HU, Chan SY,Manos MM et al. Identification and assessment of known and novel human papillomaviruses by polymerase chain reaction amplification,restriction fragment length polymorphisms. Nucleotide sequence, and phylogenetic algorithms. J Infect Dis, 1994;170(5):1 077~1 085
6,Rady PL,Chin R,Arany I et al. Direct sequencing of consensus primer generated PCR fragments of human papillomaviruses. J Virol Methods, 1993;43(3):335~350
7,Forslund O,Hansson BG, Bjerre B. Typing of human papillomaviruses by consensus polymerase chain reaction and a non-radioactive reverse dot blot hybridization. J Virol Methods, 1994;49(2):129~140
8,魏 军,张 征. 聚合酶链反应产物微孔板杂交技术. 中华医学检验杂志, 1997;20(4):252~253
1999-10-29收稿,2000-04-20修回, http://www.100md.com