中药抗癌制剂对HL-60细胞的分化诱导研究
作者:杨新中 张建军 晏雪生 李瀚 肖琳
单位:湖北中医学院附属医院 430061
关键词:中药抗癌制剂;分化诱导;HL-60细胞;肿瘤;白血病
湖北中医学院学报990309 摘要 以人早幼粒白血病细胞株(HL-60)为靶细胞,运用中药抗癌制剂对其进行体外培养和诱导分化,发现剂量在20ul/ml时,可显著地抑制HL-60细胞增殖,使原始细胞分化为中幼以下的成熟细胞,分化后的细胞具有NBT还原能力和吞噬功能。其形态的改变和吞噬能力与对照组维甲酸和中药苦参相似(P>0.05);其NBT还原能力与苦参相当(P>0.05),但稍低于维甲酸(P<0.05)。上述结果表明该制剂对HL-60细胞具有较好的分化作用。
中国图书分类号 R285.6
根据中医理论和全息生物学癌胚滞育论[1],笔者结合临床经验及近年来国内外文献资料,筛选了大量的中草药,设计组成了中药抗癌制剂[2]。以人早幼粒白血病细胞株为靶细胞,对其进行体外分化诱导实验,结果如下。
, http://www.100md.com
1 材料与方法
1.1 试剂与仪器 全反式维甲酸(RA)、佛波酯(TPA)、硝基蓝四氮唑(NBT)及RPMI1640培养剂均为美国Sigma化学试剂公司产品。小牛血清购于湖北省医科院。二氧化碳培养箱为美国的HEL-LAB型。
1.2 中药及提取液的制备 所用中药均购于湖北中医学院附属医院及湖北中医学院附属专家门诊部中药房。中药复方抗癌制剂由黄芪、当归、苦参、雄黄等药物组成。提取液由湖北中医学院附属医院药剂科制备。方法:取生药一份,加10倍双蒸水浸泡2小时后煎煮1小时,收集上清液。共提取2次,合并提取液,用60%酒精醇沉,置4°C过夜沉淀。以3000r/min离心30分钟,滤过上清液,蒸发浓缩至1.0g/ml的浓度,分装于安瓿内,常压下消毒灭菌1小时,置冰箱内冷藏备用。单味中药苦参提取液制法同上,未用醇沉,浓度为0.5g/ml。
1.3 瘤株与细胞培养及分组 HL-60细胞由中国医科院药物研究所供给,细胞培养方法按照该所韩锐教授介绍的癌细胞分化诱导剂的实验研究方法进行[3]。将HL-60细胞悬浮于含15%小牛血清的RPMI1640培养基中,置于39°C、5% CO2、100%湿度恒温箱内培养,每周传代2次。收集对数生长期细胞,以1×105/ml细胞浓度接种于24孔塑料培养板(costar,USA产)内培养,1ml/孔。实验观察共设4组:空白对照组(R组),不加任何药物,只加等体积培养液;阳性对照组又分为西药及中药两组,其中西药对照组(RA组),加全反式维甲酸[7],浓度为10-6mol,2ul/孔;中药对照组(B组)加单味苦参水提液[5],浓度为10ul/孔;实验组(A组)先后分别加入不同浓度的中药复方抗癌制剂,经多次预试验,观察细胞生长情况调整浓度,最后发现药物浓度在20ul/孔时为最佳分化浓度。实验中每组各药浓度均设3~4个平行孔,取平均值计算。
, 百拇医药
1.4 细胞生长曲线测定 各组培养后第2、4、6天分别取少量细胞,用0.2%台盼兰拒染法染色,光镜下计数活细胞,同时计算出细胞总数及死亡率,描绘出生长曲线。
1.5 细胞形态观察 细胞培养第6天后,低速离心,取沉淀细胞涂片,用Wright-Giemsa染色,置油镜下观察细胞形态,算出各组分化率。
1.6 NBT还原能力测定 细胞培养第6天后,收集细胞悬液,用Hanks液洗涤、离心,沉淀去上清液。在剩余的0.5ml/管中,各组分别加入新鲜配制的0.5ml的0.1% NBT溶液(内含有TPA 100ng),于37°C温育30分钟,取出离心终止反应。取沉淀细胞涂片,用Wright-Giemsa染色,置油镜下观察,胞浆内有蓝紫色颗粒者为NBT阳性。计数200个以上细胞,算出阳性率。
1.7 吞噬能力测定 细胞培养第6天后,收集细胞悬液,加入Hanks液洗涤离心后,向各管沉淀物中加入印度墨汁2ul/ml,充分摇匀后,置5% CO2、37°C温箱内温育4小时,然后用Hamks液反复洗涤3次,1000r/min离心5分钟。取浓集后细胞悬液1滴于载玻片上,加1滴0.5%伊红染液,加盖玻片后立即油镜下计数200个以上活细胞。凡细胞内含有5个以上墨汁颗粒者判定为阳性细胞。分别计算出各组阳性率。
, 百拇医药
2 结果
2.1 细胞生长曲线 空白对照组中HL-60细胞从第2天开始呈对数增殖,第3~4天为增殖高峰。各药物组对HL-60细胞均有明显抑制作用,其中中药复方组(A组)最为明显,西药维甲酸组次之,中药苦参组更次之。各组生长曲线图见图1。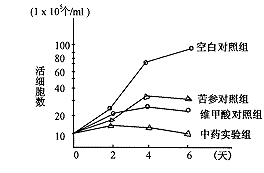
图1 各组细胞生长曲线图
2.2 细胞形态变化 空白对照组中的HL-60细胞呈原始未分化状态,细胞大而园,胞浆少,胞核大,核/浆比例大,核染色质细腻,可见核仁。而经药物处理后的各药物组大部分细胞分化为中、晚幼粒细胞,胞体变小,核/浆比例下降,核染色质变粗,核仁减少或消失,胞浆中出现特异性颗粒。其中维甲酸组形态呈粒系样改变。中药复方组及苦参组的细胞核呈扭曲状,形态为单核样改变。提示中药能诱使HL-60细胞向单核细胞方向分化[4]。参见表1。
, 百拇医药
表1 各组细胞分化率及比较 组 别
计数
分化数
未分化数
分化率%
空白对照组
200
15
185
7.5
维甲酸对照组
200
176
, http://www.100md.com
24
88.0*△
苦参对照组
200
161
39
80.5*△
中药复方实验组
200
167
33
83.5*
注:统计学处理采用x2检验,下表均同此。各药物组与空白对照组比较*为P<0.01;中药复方组与中西药阳性对照组比较△为P>0.05。
, http://www.100md.com
2.3 NBT还原能力 空白对照组还原能力<10%,各药物组均>50%,其中维甲酸组最高,中药复方组及苦参组依次减少。结果见表2。表2 各组NBT还原能力阳性率及比较 组 别
计数
阳性数
阴性数
阳性率%
空白对照组
200
14
186
7.0
维甲酸对照组
, 百拇医药
200
148
52
74.0*△△
苦参对照组
200
113
87
56.5*△
中药复方实验组
200
126
74
, http://www.100md.com
63.0*
注:各药物组与空白对照组比较*为P<0.01;中药复方实验组与中西药阳性对照组比较△为P>0.05;△△为P<0.05。
2.4 吞噬功能 空白对照组吞噬功能仅7.5%,各药物组的吞噬功能均明显高于空白对照组。结果参见表3。表3 各组吞噬功能阳性率及比较 组 别
计数
阳性数
阴性数
阳性率%
空白对照组
400
30
, http://www.100md.com
370
7.5
维甲酸对照组
400
214
186
53.5*△
苦参对照组
400
169
231
42.3*△
中药复方实验组
, 百拇医药
400
200
200
50*
注:各药物组与空白对照组比较*为P<0.01;中药复方实验组与中西药阳性对照组比较△为P>0.05。
3 讨论
肿瘤细胞的分化诱导及肿瘤的分化治疗,是当今肿瘤基础理论研究的新发展和肿瘤治疗的新途径。HL-60细胞株由于在体外较易培养繁殖,被药物诱导分化后又有明确可识别的特征,故已是目前研究肿瘤分化治疗的最常用细胞模型之一。
运用中药诱导分化癌细胞,近年来国内外仅有少许实验研究报道,且主要是应用单味中药及中药有效成分提取液[5~6]。而直接运用中药复方制剂对肿瘤细胞进行分化诱导实验及进行临床分化治疗的报道尚未见到。笔者从肿瘤患者整体考虑,根据中医对肿瘤的发病机理和临床特征的认识,以及全息生物学理论,设计的中药复方抗癌制剂在诱导分化的同时还具有扶正固本、益气养血、活血化瘀、凉血止血及抗癌解毒等多种作用。该方通过临床初步观察,发现它可使部分白血病及骨髓增生异常综合征患者骨髓中的原始细胞数量减少,达到部分或完全缓解,还可以改变部分患者的细胞质量,使病态造血得到改善和消失。
, 百拇医药
在临床观察的基础上,笔者运用HL-60细胞株做体外分化诱导实验,并以维甲酸和中药苦参作对照。结果发现该方能较好地分化HL-60细胞,其细胞的分化率和吞噬功能与维甲酸和苦参相当
(P>0.05);其NBT还原能力与苦参相似(P>0.05),但低于维甲酸(P<0.05),这可能与复方中所含的具有分化诱导作用的活性物质较少有关。
中药抗癌制剂由于成分较复杂,研究难度更大,其确切的分化诱导癌细胞的机理还需要进一步深入研究。
致谢:该实验曾得到中国医科院药物研究所夏丽娟老师的帮助与指导;统计学处理得到湖北中医学院统计教研室黄先敬老师审核,特此致谢。
基金项目:本研究为国家中医药管理局重点资助课题(No.92B068)
参考文献
, 百拇医药
1 张颖清.生物全息诊疗法.济南.山东大学出版社,1991.149~164
2 杨新中.运用全息生物学理论开发中药肿瘤分化剂设想.中国中医药科技,1994,1(5):39
3 韩 锐主编.肿瘤化学预防及药物治疗.北京:北京医科大学联合出版社,1991.241~244
4 徐建国.302种传统治癌中草药水提液对HL-60细胞的诱导分化及细胞毒作用.山西医药杂志,1991,20(2):82
5 徐建国.苦参煎液对人早幼粒白血病细胞的诱导分化研究.中国中药杂志,1990,15(10):49
6 焦 鹭.葛根有效成分S86019对HL-60细胞的分化诱导及细胞周期移行作用的研究.中华血液学杂志,1990,11(2):83
7 韩 锐.癌细胞的分化诱导及癌的分化治疗.实用肿瘤杂志,1988,3(增刊):5
收稿日期:1999-02-10, http://www.100md.com
单位:湖北中医学院附属医院 430061
关键词:中药抗癌制剂;分化诱导;HL-60细胞;肿瘤;白血病
湖北中医学院学报990309 摘要 以人早幼粒白血病细胞株(HL-60)为靶细胞,运用中药抗癌制剂对其进行体外培养和诱导分化,发现剂量在20ul/ml时,可显著地抑制HL-60细胞增殖,使原始细胞分化为中幼以下的成熟细胞,分化后的细胞具有NBT还原能力和吞噬功能。其形态的改变和吞噬能力与对照组维甲酸和中药苦参相似(P>0.05);其NBT还原能力与苦参相当(P>0.05),但稍低于维甲酸(P<0.05)。上述结果表明该制剂对HL-60细胞具有较好的分化作用。
中国图书分类号 R285.6
根据中医理论和全息生物学癌胚滞育论[1],笔者结合临床经验及近年来国内外文献资料,筛选了大量的中草药,设计组成了中药抗癌制剂[2]。以人早幼粒白血病细胞株为靶细胞,对其进行体外分化诱导实验,结果如下。
, http://www.100md.com
1 材料与方法
1.1 试剂与仪器 全反式维甲酸(RA)、佛波酯(TPA)、硝基蓝四氮唑(NBT)及RPMI1640培养剂均为美国Sigma化学试剂公司产品。小牛血清购于湖北省医科院。二氧化碳培养箱为美国的HEL-LAB型。
1.2 中药及提取液的制备 所用中药均购于湖北中医学院附属医院及湖北中医学院附属专家门诊部中药房。中药复方抗癌制剂由黄芪、当归、苦参、雄黄等药物组成。提取液由湖北中医学院附属医院药剂科制备。方法:取生药一份,加10倍双蒸水浸泡2小时后煎煮1小时,收集上清液。共提取2次,合并提取液,用60%酒精醇沉,置4°C过夜沉淀。以3000r/min离心30分钟,滤过上清液,蒸发浓缩至1.0g/ml的浓度,分装于安瓿内,常压下消毒灭菌1小时,置冰箱内冷藏备用。单味中药苦参提取液制法同上,未用醇沉,浓度为0.5g/ml。
1.3 瘤株与细胞培养及分组 HL-60细胞由中国医科院药物研究所供给,细胞培养方法按照该所韩锐教授介绍的癌细胞分化诱导剂的实验研究方法进行[3]。将HL-60细胞悬浮于含15%小牛血清的RPMI1640培养基中,置于39°C、5% CO2、100%湿度恒温箱内培养,每周传代2次。收集对数生长期细胞,以1×105/ml细胞浓度接种于24孔塑料培养板(costar,USA产)内培养,1ml/孔。实验观察共设4组:空白对照组(R组),不加任何药物,只加等体积培养液;阳性对照组又分为西药及中药两组,其中西药对照组(RA组),加全反式维甲酸[7],浓度为10-6mol,2ul/孔;中药对照组(B组)加单味苦参水提液[5],浓度为10ul/孔;实验组(A组)先后分别加入不同浓度的中药复方抗癌制剂,经多次预试验,观察细胞生长情况调整浓度,最后发现药物浓度在20ul/孔时为最佳分化浓度。实验中每组各药浓度均设3~4个平行孔,取平均值计算。
, 百拇医药
1.4 细胞生长曲线测定 各组培养后第2、4、6天分别取少量细胞,用0.2%台盼兰拒染法染色,光镜下计数活细胞,同时计算出细胞总数及死亡率,描绘出生长曲线。
1.5 细胞形态观察 细胞培养第6天后,低速离心,取沉淀细胞涂片,用Wright-Giemsa染色,置油镜下观察细胞形态,算出各组分化率。
1.6 NBT还原能力测定 细胞培养第6天后,收集细胞悬液,用Hanks液洗涤、离心,沉淀去上清液。在剩余的0.5ml/管中,各组分别加入新鲜配制的0.5ml的0.1% NBT溶液(内含有TPA 100ng),于37°C温育30分钟,取出离心终止反应。取沉淀细胞涂片,用Wright-Giemsa染色,置油镜下观察,胞浆内有蓝紫色颗粒者为NBT阳性。计数200个以上细胞,算出阳性率。
1.7 吞噬能力测定 细胞培养第6天后,收集细胞悬液,加入Hanks液洗涤离心后,向各管沉淀物中加入印度墨汁2ul/ml,充分摇匀后,置5% CO2、37°C温箱内温育4小时,然后用Hamks液反复洗涤3次,1000r/min离心5分钟。取浓集后细胞悬液1滴于载玻片上,加1滴0.5%伊红染液,加盖玻片后立即油镜下计数200个以上活细胞。凡细胞内含有5个以上墨汁颗粒者判定为阳性细胞。分别计算出各组阳性率。
, 百拇医药
2 结果
2.1 细胞生长曲线 空白对照组中HL-60细胞从第2天开始呈对数增殖,第3~4天为增殖高峰。各药物组对HL-60细胞均有明显抑制作用,其中中药复方组(A组)最为明显,西药维甲酸组次之,中药苦参组更次之。各组生长曲线图见图1。

图1 各组细胞生长曲线图
2.2 细胞形态变化 空白对照组中的HL-60细胞呈原始未分化状态,细胞大而园,胞浆少,胞核大,核/浆比例大,核染色质细腻,可见核仁。而经药物处理后的各药物组大部分细胞分化为中、晚幼粒细胞,胞体变小,核/浆比例下降,核染色质变粗,核仁减少或消失,胞浆中出现特异性颗粒。其中维甲酸组形态呈粒系样改变。中药复方组及苦参组的细胞核呈扭曲状,形态为单核样改变。提示中药能诱使HL-60细胞向单核细胞方向分化[4]。参见表1。
, 百拇医药
表1 各组细胞分化率及比较 组 别
计数
分化数
未分化数
分化率%
空白对照组
200
15
185
7.5
维甲酸对照组
200
176
, http://www.100md.com
24
88.0*△
苦参对照组
200
161
39
80.5*△
中药复方实验组
200
167
33
83.5*
注:统计学处理采用x2检验,下表均同此。各药物组与空白对照组比较*为P<0.01;中药复方组与中西药阳性对照组比较△为P>0.05。
, http://www.100md.com
2.3 NBT还原能力 空白对照组还原能力<10%,各药物组均>50%,其中维甲酸组最高,中药复方组及苦参组依次减少。结果见表2。表2 各组NBT还原能力阳性率及比较 组 别
计数
阳性数
阴性数
阳性率%
空白对照组
200
14
186
7.0
维甲酸对照组
, 百拇医药
200
148
52
74.0*△△
苦参对照组
200
113
87
56.5*△
中药复方实验组
200
126
74
, http://www.100md.com
63.0*
注:各药物组与空白对照组比较*为P<0.01;中药复方实验组与中西药阳性对照组比较△为P>0.05;△△为P<0.05。
2.4 吞噬功能 空白对照组吞噬功能仅7.5%,各药物组的吞噬功能均明显高于空白对照组。结果参见表3。表3 各组吞噬功能阳性率及比较 组 别
计数
阳性数
阴性数
阳性率%
空白对照组
400
30
, http://www.100md.com
370
7.5
维甲酸对照组
400
214
186
53.5*△
苦参对照组
400
169
231
42.3*△
中药复方实验组
, 百拇医药
400
200
200
50*
注:各药物组与空白对照组比较*为P<0.01;中药复方实验组与中西药阳性对照组比较△为P>0.05。
3 讨论
肿瘤细胞的分化诱导及肿瘤的分化治疗,是当今肿瘤基础理论研究的新发展和肿瘤治疗的新途径。HL-60细胞株由于在体外较易培养繁殖,被药物诱导分化后又有明确可识别的特征,故已是目前研究肿瘤分化治疗的最常用细胞模型之一。
运用中药诱导分化癌细胞,近年来国内外仅有少许实验研究报道,且主要是应用单味中药及中药有效成分提取液[5~6]。而直接运用中药复方制剂对肿瘤细胞进行分化诱导实验及进行临床分化治疗的报道尚未见到。笔者从肿瘤患者整体考虑,根据中医对肿瘤的发病机理和临床特征的认识,以及全息生物学理论,设计的中药复方抗癌制剂在诱导分化的同时还具有扶正固本、益气养血、活血化瘀、凉血止血及抗癌解毒等多种作用。该方通过临床初步观察,发现它可使部分白血病及骨髓增生异常综合征患者骨髓中的原始细胞数量减少,达到部分或完全缓解,还可以改变部分患者的细胞质量,使病态造血得到改善和消失。
, 百拇医药
在临床观察的基础上,笔者运用HL-60细胞株做体外分化诱导实验,并以维甲酸和中药苦参作对照。结果发现该方能较好地分化HL-60细胞,其细胞的分化率和吞噬功能与维甲酸和苦参相当
(P>0.05);其NBT还原能力与苦参相似(P>0.05),但低于维甲酸(P<0.05),这可能与复方中所含的具有分化诱导作用的活性物质较少有关。
中药抗癌制剂由于成分较复杂,研究难度更大,其确切的分化诱导癌细胞的机理还需要进一步深入研究。
致谢:该实验曾得到中国医科院药物研究所夏丽娟老师的帮助与指导;统计学处理得到湖北中医学院统计教研室黄先敬老师审核,特此致谢。
基金项目:本研究为国家中医药管理局重点资助课题(No.92B068)
参考文献
, 百拇医药
1 张颖清.生物全息诊疗法.济南.山东大学出版社,1991.149~164
2 杨新中.运用全息生物学理论开发中药肿瘤分化剂设想.中国中医药科技,1994,1(5):39
3 韩 锐主编.肿瘤化学预防及药物治疗.北京:北京医科大学联合出版社,1991.241~244
4 徐建国.302种传统治癌中草药水提液对HL-60细胞的诱导分化及细胞毒作用.山西医药杂志,1991,20(2):82
5 徐建国.苦参煎液对人早幼粒白血病细胞的诱导分化研究.中国中药杂志,1990,15(10):49
6 焦 鹭.葛根有效成分S86019对HL-60细胞的分化诱导及细胞周期移行作用的研究.中华血液学杂志,1990,11(2):83
7 韩 锐.癌细胞的分化诱导及癌的分化治疗.实用肿瘤杂志,1988,3(增刊):5
收稿日期:1999-02-10, http://www.100md.com